金属硫蛋白3与omp19融合的重组蛋白及其应用
技术领域
1.本发明公开了一种重组蛋白及其应用,属于多肽技术领域。
背景技术:
2.布鲁氏菌病(brucellosis),简称布病,是一种由革兰氏阴性菌——布鲁氏菌(brucella)引起的一种人畜共患的传染病,严重影响人类健康和畜牧业生产安全。患者通常表现为波浪热、脊柱炎、关节炎等非特异性症状,并伴随神经、生殖、免疫系统损伤。布鲁氏菌外膜蛋白(outer membrane protein, omp)存在于布鲁氏菌表面,对细菌的黏附、侵袭、定殖以及胞内存活等多个生理功能起着关键作用,在不同种型中同源性达到90 %以上,被认为是为重组布病疫苗的重要候选组分(comp immunol microbiol infect dis 2019;65: 29-36.)。全长的omp19包含177个氨基酸,基因序列较保守,在不同感染动物的血清中均能检测到针对omp19的抗体(mol immunol 2019;114: 651-660;j med microbiol 1992; 37(2): 100-103.)。coria等(j control release 2019;293: 158-171.)报道omp19具有针对胃肠道和溶酶体蛋白酶的抑制剂活性,能帮助布鲁氏菌逃避宿主蛋白酶水解防御系统的抗菌活性。huy等(front vet sci 2020; 7: 577026.)报道由omp19、omp16等抗原制备的布鲁氏菌联合亚单位疫苗(csv)可有效诱导体液和细胞免疫反应。
3.金属硫蛋白(mts)是一个富含半胱氨酸的低分子量的金属结合蛋白家族,几乎在所有生物体中都有表达,包括原核生物、低等真核生物、无脊椎动物和哺乳动物。这些蛋白可以调节体内铜、锌离子稳态,减轻重金属中毒和超氧化物胁迫。近年来,mts被认为是免疫系统的重要组成部分,但尚未引起重视。mt 蛋白家族在小鼠中包括四种亚型 (mt1-4), 在人类中包括多种亚型/变体及相应的同种型(mt1a、mt1b、mt1e、mt1f、mt1g1、mt1g2、mt1h、mt1hl1、mt1m、mt1x、mt2a、mt3 和 mt4,以及假基因mt1dp、mt1jp、mt1l、mt2p1、mt1cp、mt1lp、mt1xp1、mt1p3、mt1p1和mtl3p)。koh 等(mol brain 2020; 13(1): 116.)报道,mt具有物种间的异质性,但是在结构上具有共同的特征。zhu等(small. 2019;15(2):e1803428.)报道mts中的mt3蛋白可作为一种化疗药物递送载体的组成部分,实现抗肿瘤药物的靶向递送。目前尚无将mt3作为疫苗佐剂的报道。
4.疫苗接种是预防人畜布病经济、有效的手段。目前在研的布病疫苗类型主要包括灭活疫苗、减毒活疫苗、重组亚单位疫苗、核酸疫苗、载体疫苗等。牛种减毒活疫苗104m是我国唯一获批的人用布病疫苗,但是由于接种方式复杂(皮上划痕)、接种剂量不可控、安全性有待提高等问题,不适宜大规模接种。重组亚单位疫苗成分简单、安全性高、易于质控,是目前新型布病疫苗研发的重要方向。本发明的目的就是提供一种金属硫蛋白与布鲁氏菌外膜蛋白omp19融合而成的重组蛋白,可以快速、高效地激发抗原特异的免疫反应,且具有较好的免疫持续性和保护效力。
技术实现要素:
5.基于上述目的,本发明提供了一种金属硫蛋白3与布鲁氏菌外膜蛋白omp19融合的
重组蛋白。本发明所述的金属硫蛋白是指富含半胱氨酸的低分子量的金属结合蛋白,其几乎在所有生物体中都有表达,包括原核生物、低等真核生物、无脊椎动物和哺乳动物。
6.在一个优选的技术方案中,所述金属硫蛋白3为人源金属硫蛋白家族蛋白3。
7.在一个更为优选的实施方案中,所述人源金属硫蛋白家族蛋白3的氨基酸序列如seq id no.1所示,所述布鲁氏菌外膜蛋白omp19的氨基酸序列如seq id no.2所示。
8.更为优选地,所述人源金属硫蛋白家族蛋白3和布鲁氏菌外膜蛋白omp19以柔性多肽连接子相连。
9.尤为优选地,所述柔性多肽连接子的氨基酸序列如seq id no.3所示,并分别与人源金属硫蛋白家族蛋白3的羧基端与布鲁氏菌外膜蛋白omp19的氨基端相连。
10.其次,本发明还提供了一种编码上述重组蛋白的多核苷酸分子,所述多核苷酸分子的序列如seq id no.4所示。
11.第三,本发明还提供了一种含有上述多核苷酸分子的表达载体。
12.第四,本发明提供了一种含有上述表达载体的宿主细胞。
13.第五,本发明提供了一种制备上述的重组蛋白的方法,所述方法包括以下步骤:(1)构建含有上述多核苷酸分子的表达载体;(2)将步骤(1)获得的表达载体转化入宿主细胞中;(3)诱导步骤(2)获得的宿主细胞中的表达载体进行蛋白表达,并收获表达的蛋白。
14.最后,本发明提供了上述重组蛋白在制备预防布鲁氏菌病疫苗中的应用。
15.本发明通过基因工程的方法将mt3融合于omp19蛋白的n端,获得融合蛋白mt3-omp19 (mo)。通过两步纯化法制备mo蛋白后,在小鼠模型上开展了相应的免疫原性研究。结果表明,本发明提供的重组蛋白具有免疫后实现快速起效、免疫持续时间长、免疫剂量低的优异技术效果。当融合蛋白mo单针免疫时,在免疫后7天,mo免疫组即可诱导高滴度的omp19特异性抗体产生,抗体滴度约为1.41
ꢀ×ꢀ
105,相较于omp19联合al(oh)3 cpg免疫组(双佐剂组),特异性抗体水平显著提高了约343倍。对抗体进行长期监测的结果表明,mo组小鼠的高滴度抗体维持至180天仍未见明显下降,具有较长的免疫持续时间。剂量研究的结果表明,5 μg mo即可有效激发较4倍剂量的omp19免疫更高的抗体水平, mt3与omp19融合能显著增强omp19特异的免疫应答。本发明提供的疫苗在balb/c小鼠模型上开展的布鲁氏菌a19株攻毒实验的结果表明,与mt3单独免疫组相比,mo免疫组的菌载量下降约24倍,omp19联合双佐剂免疫组也体现出了一定保护作用,菌载量下降约3倍。omp19单独免疫组脾脏菌载量与mt3单独免疫组相当,无显著性差异。提示mt3作为疫苗佐剂可以增强omp19的保护作用。
附图说明
16.图1.mo表达与鉴定图;图2. mo蛋白纯化图;图3 .mo免疫原性、起效速度分析图;图4. mo免疫持续性分析图;图5. mo免疫剂量研究分析图;图6. mo保护效力研究分析图。
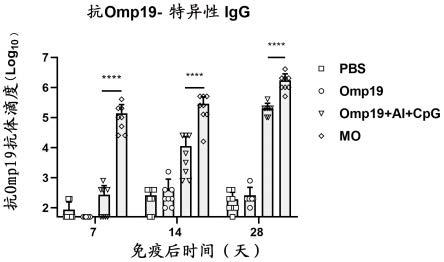
具体实施方式
17.下面结合具体实施例来进一步描述本发明,本发明的优点和特点将会随着描述而更为清楚。但这些实施例仅是范例性的,并不对本发明的权利要求所限定的保护范围构成任何限制。
18.实施例1. 人源mt3与布鲁氏菌omp19抗原融合蛋白(mo)的构建1. mt3(human)-omp19 (mo)质粒的构建将人源mt3序列(seq id no.1)通过gggs(seq id no.3)连接子连接于去除了信号肽的布鲁氏菌omp19抗原序列(seq id no.2)的n端,构成融合序列mt3-omp19(mo),将序列按照原核表达载体大肠杆菌的偏嗜性密码子优化后开展全基因合成,优化后的融合蛋白全基因序列如seq id no.4所示。将基因片段通过xhoi 和 ndei 酶切位点连接于 pet28a 载体中获得表达质粒pet28a-mo。
19.2. 诱导表达与鉴定将pet28a-mo质粒转化e.coli bl21(de3)感受态细胞,用于蛋白的诱导表达,具体步骤如下:(1)挑取单克隆菌落接种到5ml lb 培养基(含100 μg/ml 卡那霉素)中,于37℃、220 r/min条件下过夜振荡培养;(2)次日以1∶100 的比例将过夜培养物转接至5 ml lb 液体培养基,37℃、220 r/min 振摇至菌液od600 为0.6~0.8;(3)加入终浓度为1 mmol/l 的iptg 于37℃诱导表达5h;(4)8000
×
g离心10min收集1ml 菌液的菌体,加入1ml pbs(ph 7.4)重悬菌体,取50μl重悬液加入10μl 6
×
loading buffer混匀,99℃煮沸5min,用于sds-page 分析。利用超声破碎分析了蛋白的亚细胞定位。利用wb鉴定了蛋白的表达。
20.图1为mo的表达与鉴定图谱。其中,m:蛋白质相对分子质量标志物;图1中的a为mo的sds-page 分析,其中,1: 未诱导菌体,2:iptg诱导菌体;图1中的b为mo的western-blot分析,其中,1:未诱导菌体, 2:iptg诱导菌体;图1中的c为mo可溶性表达的sds-page分析,其中,1:全菌菌体,2:沉淀, 3:上清,箭头表示目的蛋白。
21.3. 蛋白的制备挑取含有目的蛋白质粒的bl21 菌株单克隆,转接于10ml卡那霉素抗性的lb 培养基,220 r/min、37℃过夜培养;吸取过夜培养所得菌液10m l 转接于1 l 新的卡那抗性的lb 培养基中,220 r/min、37℃培养至菌液od600 在0.6~0.8 之间;加入2ml 0.5mmol/l 的iptg、220 r/min、37℃培养5h;诱导培养结束后, 8000
×
g 室温离心菌液10min,弃上清;冰浴状态下超声裂解菌体30min。超声后的样品于8000
×
g、4℃ 离心10min,上清液经0.45μm 滤器过滤后用镍柱(ni
2
)亲和层析方法对蛋白进行纯化。利用endotoxin removing gel柱对ni柱收集的样品进行二次处理以减少内毒素的影响。结果如图2所示,其中,从左至右泳道1为蛋白质相对分子质量标志物,泳道2为作为对照的omp19蛋白,泳道3为经过纯化的mo蛋白。
22.实施例2. mt3的融合可提高抗原(omp19)的起效速度,增强免疫原性和免疫持续性将小鼠随机分为4组,每组8只。分别于第0、14 d对小鼠进行腿部肌肉免。免疫方案如表1所示, pbs组为阴性对照。免疫后第7、14、28、35、60、180 d采用眼眶静脉丛采血法对小鼠进行血液采集及血清抗体测定。
23.表1. mo免疫原性、起效速度及免疫持久性研究方案
注:*表示用量为μl/只。
24.结果如图3所示,初免后7d,mo免疫组即可检测到较高的omp19特异性抗体的产生,抗体滴度约为1.4
×
105, omp19 al(oh)
3 cpg免疫组激发的抗体水平约为4.1
×
102。相较omp19 al(oh)
3 cpg(双佐剂)免疫组,mo将omp19特异性抗体滴度显著提高约343倍(p 《 0.0001)。初免后14d,mo所激发的omp19特异性抗体滴度约为2.0
×
105,相较于omp19联合双佐剂免疫组(4.9
×
103)显著提高约41倍(p 《 0.0001)。二免后14d,mo所激发的抗体水平约为1.7
×
106,依然显著高于其他免疫组(p 《 0.0001)。抗体持续性研究的结果如图4所示,融合蛋白mo具有较好的免疫持续性,在观测的180d内mo组所激发的omp19特异的抗体滴度一直维持在高位,较omp19单独抗原免疫组持续提高100-1000倍。
25.实施例3. mt3的融合可显著降低抗原(omp19)的使用剂量将balb/c小鼠随机分组,每组8只,设置20μg omp19单独免疫组和mo蛋白不同免疫剂量组,通过肌肉注射的方式免疫balb/c小鼠,pbs作为阴性对照。免疫方法如表2所示。
26.表2.免疫剂量研究方案注:*表示用量为μl/只。
27.结果如图5所示,初免后7d,5μg mo免疫激发的抗体滴度即显著高于4倍剂量的omp19单独免疫组,抗体滴度提高约1000倍。初免后14d,0.1μg mo所激发的特异性抗体水平仍显著高于20μg omp19单独免疫组约10倍, 提示mt3的融合可以显著降低omp19抗原的使
用剂量。
28.实施例4. mt3的融合可增强抗原(omp19)的保护效力将balb/c小鼠随机分为4组,每组5只。分别于第0、14 d对小鼠进行腿部肌肉免疫。免疫方案如表3所示,mt3免疫组为阴性对照。
29.表3. 保护效力评价方案。
30.攻毒7天后,在无菌条件下摘取小鼠脾脏,并于pbs缓冲液充分研磨,制成组织匀浆,吸取 100
ꢀµ
l 组织匀浆进行梯度稀释,选取2 ~ 3个合适的梯度涂布于无抗性的 tsa 平板上,于 37 ℃恒温培养箱培养72 h,至有明显单克隆后,以菌落数位于30 ~ 300间的平板为准,对平板进行单克隆计数,并计算每只小鼠脾脏菌载量。
31.结果如图6所示,与mt3单独免疫组相比,mo免疫组的菌载量下降约24倍,omp19联合双佐剂免疫组也体现出了一定保护作用,菌载量下降约3倍。omp19单独免疫组脾脏菌载量与mt3单独免疫组相当,无显著性差异。提示mt3的融合可以增强omp19抗原的保护效力。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。