基于七重pcr技术的肉类检测用引物组和方法
技术领域
1.本发明属于食品质量安全检测技术领域,尤其是涉及一种基于七重pcr技术的肉类检测用引物组和方法。
背景技术:
2.肉类掺假是国内外普遍存在的食品安全问题,近年来更是成为一个重要的全球性 问题,受到了国际社会的广泛关注。如今,掺假的技术手段日新月异,掺伪制品能够在 其形态和物理特征等方面最大程度地接近纯肉,单靠肉眼观察和感官评价已很难做到区 分。频繁的肉制品掺伪事件可能危及食品安全,违反市场规则,甚至威胁公共健康,造 成严重的食品安全事故。因此,一种具有快速、灵敏、准确识别动物来源的实用技术的 开发具有重要意义。
3.近年来,随着分子生物学发展,识别肉类物种来源的技术不断发展。dna分子存在于每个细胞中,具有极高的稳定性,能够耐受高温、高压及化学方法等处理。因此,基于dna水平的技术手段结合聚合酶链式反应(pcr)的分子诊断是更为可靠的分析方法。目前,多重pcr和实时荧光定量pcr(rt-pcr)技术都被认为是具有高灵敏度和特异性的可靠方法。rt-pcr能够提供掺杂肉含量的定量分析,然而精准的定量取决于合适的内参,对于多样化肉种类的掺杂,这一要求极大限制rt-pcr分析的准确度,而且rt-pcr需要专业仪器设备和专业技能操作。相比之下,多重pcr借助简单的琼脂糖凝胶电泳实验,能够直观判断较多种类肉的掺杂。由于肉类物种具有高度的同源性,靶基因的选择对于多重pcr系统的构建至关重要。动物细胞中线粒体dna序列具有种内和种间多态性的可变区,非常适合近缘动物物种的区分。此外,线粒体dna序列在环状结构内具有多个拷贝,在肉类加工过程中更加稳定。因此,可以选择线粒体序列的多态性位点作为设计肉源中物种特异性引物的靶区。由于多重pcr法可以同时检测到多个靶点,故需要对物种特异性引物进行分析、筛选和优化,以消除动物物种间的相互,从而排除肉源间的交叉反应。因此,基于线粒体dna序列,建立快速、准确、敏感的多重pcr肉源检测技术是严格监测市场上肉制品安全的基础和关键之一。
技术实现要素:
4.本发明所要解决的技术问题是提供一种操作简单、灵敏度高和特异性好的基于七重pcr技术的肉类检测用引物组和方法。
5.本发明解决上述技术问题所采用的技术方案为:1、一种基于七重pcr技术的肉类检测用引物组,包括骆驼特异性引物对、鸽子特异性引物对、鸡特异性引物对、鸭特异性引物对、马特异性引物对、牛特异性引物对和猪特异性引物对,其中,骆驼的特异性引物对序列为:上游引物:5
’‑
gctccactttcctaaccgtgt
‑ꢀ3’
,下游引物:5
’‑
atagaggaacagccagacgaca
‑ꢀ3’
;
鸽子的特异性引物对序列为:上游引物:5
’‑
caccgcccgaatcgcaccac
‑ꢀ3’
,下游引物:5
’‑
agggatgttttctgtccggtt
‑ꢀ3’
;鸡的特异性引物对序列为:上游引物:5
’‑
ccctacttgccttccaccgta
‑ꢀ3’
,下游引物:5
’‑
cttgaatagcactccgcaccc
‑ꢀ3’
;鸭的特异性引物对序列为:上游引物:5
’‑
tcccagccctattgttcccat
‑ꢀ3’
,下游引物:5
’‑
tgttagtagggtagcaagccaca
‑ꢀ3’
;马的特异性引物对序列为:上游引物:5
’‑
tagaagccccaattgccggat
‑ꢀ3’
,下游引物:5
’‑
tattgatgatgtaaggccgtgag
‑ꢀ3’
;牛的特异性引物对序列为:上游引物:5
’‑
gctgacccatacaagcacga
‑ꢀ3’
,下游引物:5
’‑
cgtaatataagcctggacgggac
‑ꢀ3’
;猪的特异性引物对序列为:上游引物:5
’‑
gaagcctttctcctcgcacac
‑ꢀ3’
,下游引物:5
’‑
cccaaccgaaattgctagtcca
‑ꢀ3’
。
6.2、一种基于七重pcr技术的肉类检测方法,包括步骤如下:步骤一、样品dna提取:根据基因组dna试剂盒说明书,分离提取肉基因组dna,并利用nanodrop 2000分光光度计测定dna浓度;步骤二、种特异性引物设计:利用oligo 7.0软件结合生物信息学的比对分析,根据骆驼细胞色素c氧化酶亚基ⅲ序列(no.mh109991.1)、鸽子nadh脱氢酶6亚基(no.kp168712.1)、鸡d-loop (no.mk163565.1)、鸭atp酶6亚基(no.mk770342.1)、马nadh脱氢酶亚基4 (no.mn187574.1)、牛细胞色素c氧化酶亚基
ⅱꢀ
(no.mn714191915.1)和猪16srrna基因(no.kj746666.1)基因序列分别设计物种特异性引物:其中,猪的特异性引物对序列为:上游引物:5
’‑
gaagcctttctcctcgcacac
‑ꢀ3’
,下游引物:5
’‑
cccaaccgaaattgctagtcca
‑ꢀ3’
;牛的特异性引物对序列为:上游引物:5
’‑
gctgacccatacaagcacga
‑ꢀ3’
,下游引物:5
’‑
cgtaatataagcctggacgggac
‑ꢀ3’
;马的特异性引物对序列为:上游引物:5
’‑
tagaagccccaattgccggat
‑ꢀ3’
,下游引物:5
’‑
tattgatgatgtaaggccgtgag
‑ꢀ3’
;鸭的特异性引物对序列为:上游引物:5
’‑
tcccagccctattgttcccat
‑ꢀ3’
,下游引物:5
’‑
tgttagtagggtagcaagccaca
‑ꢀ3’
;
鸡的特异性引物对序列为:上游引物:5
’‑
ccctacttgccttccaccgta
‑ꢀ3’
,下游引物:5
’‑
cttgaatagcactccgcaccc
‑ꢀ3’
;鸽的特异性引物对序列为:上游引物:5
’‑
caccgcccgaatcgcaccac
‑ꢀ3’
,下游引物:5
’‑
agggatgttttctgtccggtt
‑ꢀ3’
;骆驼的特异性引物对序列为:上游引物:5
’‑
gctccactttcctaaccgtgt
‑ꢀ3’
,下游引物:5
’‑
atagaggaacagccagacgaca
‑ꢀ3’
;步骤三、七重pcr反应系统建立pcr反应体系:2.5 μl easytaq
®
缓冲液(10
×
),2 μl dntps (2.5 mm),0.5 μl easytaqdna聚合酶 (5 u μl-1
),各混合物种上下游引物各0.5 μl (10 μm),1 μl物种的基因组dna (0.01-10 ng μl-1
),并用ddh2o补充体系至25 μl。利用t100
™ꢀ
thermal cycler (bio-rad, germany),pcr反应的条件:94℃变性5 min,然后在94℃ 30s,63℃ 30s,72℃ 45s下进行34个循环,最后在72℃延伸5 min;步骤四、琼脂糖凝胶电泳进行结果分析pcr片段扩增结束,用质量浓度为4%琼脂糖凝胶分析,并利用gel doc
tm xr system凝胶成像系统拍照,根据胶图靶条带的有无即可判断样品是否有杂肉掺入。若肉样品为纯肉制品即无掺杂其他肉类,则凝胶成像中有且仅有一条与该物种相匹配的条带出现;若该肉样品非纯肉即掺杂其他肉种,则成像中除靶物种对应条带,还有其他物种的条带。
7.与现有技术相比,本发明的优点在于:1. 本发明提供了一种简洁高效、高灵敏度的技术方法,用以一次同时鉴别7种动物性食品的肉源。
8.2. 基于欧洲马肉风波及报道的牛肉掺杂种类,本发明以牛肉掺伪为主要研究对象,有针对性地利用骆驼、鸽子、鸡、鸭、马、牛和猪的线粒体dna序列设计了7对不同长度的种特异性引物。单一和多重pcr检测表明所有引物具有特异性、敏感和高效的性能,至少与14种陆地动物及3种鱼类没有交叉反应。
9.3. 对比国内外多重pcr技术,检测灵敏度集中在1 pg-0.32 ng范围;由于受到技术限制,大多数多重pcr检测物种数量少于7个,本发明七重pcr方法检测灵敏度高,对七肉类物种dna检测限为0.025~0.1ng。
10.综上所述本发明提供了一种可靠的多重pcr法,设计了多个目标线粒体dna序列的种特异性候选引物,最终确定了骆驼(128bp)、鸽子(157bp)、鸡(220bp)、鸭(272bp)、马(314bp)、牛(434bp)和猪(502bp)的7对种特异性引物,可同时鉴别骆驼、鸽、鸡、鸭、马、牛肉、猪7种动物性食品的肉源。这种多重pcr技术可以通过简单琼脂糖凝胶的分析,能够更广泛地应用于食品中肉类的物种来源的鉴定。
附图说明
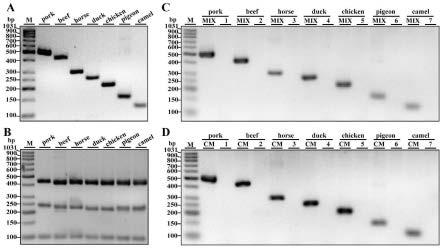
11.图1(a)为分别用骆驼(camel)、鸽子(pigeon)、鸡(chicken)、鸭(duck)、马(horse)、牛(beef)和猪(pork)来源的物种特异性引物,以相应基因组dna为模板进行pcr扩增后产物的凝胶图像;(b)为分别用真核生物12s rrna、16s rrna和18s rrna基因的预混合通用引物进行pcr扩增的所有肉类品种pcr产物的琼脂糖凝胶图像;(c)为利用骆驼、鸽子、鸡、鸭、马、牛和猪的个体模板dna进行pcr扩增后产物的琼脂糖凝胶图像;mix指包括骆驼、鸽子、鸡、鸭、马、牛肉和猪的7对引物的混合物;1-7是六个非靶物种的6对引物的混合物;(d)为以混合基因组dna作为扩增模板,使用骆驼、鸽子、鸡、鸭、马、牛、猪的特异性引物对,分别进行单一pcr扩增后产物的琼脂糖凝胶图像;cm为骆驼、鸽子、鸡、鸭、马、牛和猪七个物种基因组dna的混合物;1-7为除靶物种外的六种肉类的dna混合物。m为dna分子量标准marker(100-1031 bp)。
12.图2为以骆驼、鸽子、鸡、鸭、马、牛和猪七个物种基因组dna的混合物作为扩增模板,分别以骆驼、鸽子、鸡、鸭、马、牛、猪的单一引物对pcr扩增产物克隆至peasy
®-t5 zero载体,抽提质粒dna作模板并利用载体通用引物m13f和m13r进行pcr扩增,dna自动测序仪测序pcr产物的部分结果;图3(a)为利用骆驼、鸽子、鸡、鸭、马、牛和猪7种肉类的特异性引物对混合物,以七物种分别在20、10、5、2.5、1、0.5、0.25、0.1、0.1、0.05和0.025ng浓度下的dna混合物作模板,进行多重pcr反应扩增pcr片段的琼脂糖凝胶图像;(b) 利用伯乐公司image lab
tm
软件,绘制电泳图相对应的凝胶图像; lane1-10同(a)中横坐标标签(20、10、5、2.5、1、0.5、0.25、0.1、0.05和0.025);m为dna分子量标准marker(100-1031 bp)。
13.图4为从生肉、煮制肉和微波加热肉样品中提取的骆驼、鸽子、鸡、鸭、马、牛和猪dna扩增的单一pcr产物的凝胶图像;m为dna分子量标准marker (100-1031 bp)。
具体实施方式
14.以下结合附图实施例对本发明作进一步详细描述,但本发明不仅局限于以下实施例。
15.具体实施例一1、样品处理及dna提取新鲜的骆驼、鸽子、鸡、鸭、马、牛、猪纯肉购自本地零售商和生鲜市场,且采购完毕立即用冰运至实验室进行处理。所有样品均在-80℃保存,以抑制dna降解。使用easypure
®
基因组dna试剂盒,分离肉类样本基因组dna。并用nanodrop2000分光光度计检测dna浓度。
16.2、物种特异性引物的设计根据genbank公布的各物种线粒体基因登陆号,从国家生物技术信息中心(ncbi)数据库中分别检索骆驼细胞色素c氧化酶亚基ⅲ序列 (no.mh109991.1)、鸽子nadh脱氢酶6亚基 (no.kp168712.1)、鸡d-loop(no.mk163565.1)、鸭atp酶6亚基(no.mk770342.1)、马nadh脱氢酶亚基4(no.mn187574.1)、牛细胞色素c氧化酶亚基ⅱ(no.mn714191915.1)和猪16srrna基因(no.kj746666.1)基因序列。采用mega6软件比对分析物种间的保守区域和可变区域。结合oligo7.0与blast程序,根据熔解温度、交叉反应性、自互补性和二级结构等物理参数,设计具有物种特异性的引物。引物由上海生工生物工程有限公司合成。为了检测所
设计的物种特异性引物在非目标物种中是否存在错配现象,使用clustalw软件对14种陆地动物:骆驼、鸽子、鸡、鸭、马、牛、猪、火鸡、鹅、羊、兔、鸵鸟、狗、猫以及3种水生类鱼:小黄鱼、金枪鱼和黑鱼进行序列筛查。使用上述17物种作为模板,引物对的特异性分别采用单一pcr法进一步检测。
17.其中,骆驼的特异性引物对序列为:上游引物:5
’‑
gctccactttcctaaccgtgt
‑ꢀ3’
,下游引物:5
’‑
atagaggaacagccagacgaca
‑ꢀ3’
;鸽子的特异性引物对序列为:上游引物:5
’‑
caccgcccgaatcgcaccac
‑ꢀ3’
,下游引物:5
’‑
agggatgttttctgtccggtt
‑ꢀ3’
;鸡的特异性引物对序列为:上游引物:5
’‑
ccctacttgccttccaccgta
‑ꢀ3’
,下游引物:5
’‑
cttgaatagcactccgcaccc
‑ꢀ3’
;鸭的特异性引物对序列为:上游引物:5
’‑
tcccagccctattgttcccat
‑ꢀ3’
,下游引物:5
’‑
tgttagtagggtagcaagccaca
‑ꢀ3’
;马的特异性引物对序列为:上游引物:5
’‑
tagaagccccaattgccggat
‑ꢀ3’
,下游引物:5
’‑
tattgatgatgtaaggccgtgag
‑ꢀ3’
;牛的特异性引物对序列为:上游引物:5
’‑
gctgacccatacaagcacga
‑ꢀ3’
,下游引物:5
’‑
cgtaatataagcctggacgggac
‑ꢀ3’
;猪的特异性引物对序列为:上游引物:5
’‑
gaagcctttctcctcgcacac
‑ꢀ3’
,下游引物:5
’‑
cccaaccgaaattgctagtcca
‑ꢀ3’
。
18.3、pcr产物的琼脂糖凝胶电泳检测对于单一pcr反应体系,使用easytaq
®
dna聚合酶试剂盒进行pcr扩增。pcr反应系统由10
×
easytaq
®
缓冲液2.5μl,2.5mm dntps 2μl, easytaq dna聚合酶0.5μl,10mm上下游引物各0.5μl,每个物种的基因组dna 0.01-10 ng,并用ddh2o补充体系至25μl。pcr反应条件为:在94℃下变性5 min,然后在94℃ 30s,63℃ 30s,72℃ 45s下进行34个循环,最后在72℃下延伸5min。
19.对于多重pcr试验,在单一pcr试验后,采用7种特异性引物和相应的基因组dna作为模板,建立了七重pcr反应体系。所有pcr片段均使用t100
™
热循环仪扩增,用4wt%琼脂糖凝胶分析,并利用gel doc
tm xr system凝胶成像系统拍照。
20.4、pcr产物测序以骆驼、鸽子、鸡、鸭、马、牛和猪七个物种基因组dna的混合物作为扩增模板,以骆驼、鸽子、鸡、鸭、马、牛、猪的单一引物对分别pcr扩增,pcr扩增产物用diaspindna凝胶纯化试剂盒进行pcr片段胶回收,并连接peasy
®-t5 zero载体。使用
sanprep柱式质粒dna小量抽提试剂盒进行质粒dna提取并利用载体通用引物m13f和m13r进行单一pcr扩增,最后使用dna自动测序仪进行pcr产物测序。
21.5、结果分析依据步骤4中成像显示的电泳条带判断是否掺杂以及所掺杂的肉源种类。其产物大小分别为骆驼 (128 bp),鸽 (157 bp),鸡 (220 bp),鸭 (272 bp),马 (314 bp),牛(434 bp) 和猪 (502 bp)。当成像中出现不属于该肉制品应有纯肉条带的其他条带时,表明该制品中掺有杂肉;反之则为纯肉制品。
22.具体实施例二引物特异性分析为了验证引物的特异性,首先利用单一物种dna及其引物对,进行单一pcr扩增,经过凝胶电泳分析显示。骆驼、鸽子、鸡、鸭、马、牛和猪的扩增条带分别为128bp、157bp、220bp、272bp、314bp、434bp和502bp。为了确保七个物种基因组dna质量,同时选择三对来源于18srrna,16srrna、12srrna靶基因的通用真核引物分别作为阳性对照(图1a)。本发明中,所有的肉类样本均产生条带亮弱强度相似,与预期大小一致的99bp,240bp和456bp的目标pcr片段(图1b),表明提取肉类资源基因组dna质量相当,确保pcr等同的扩增效率。分别以单物种肉的基因组dna为模板,使用7物种的引物混合物能够获得单一pcr产物,而使用不包括目标对应物的6对非靶标引物混合物无pcr条带产生(图1c),表明只有目标引物对能够有效扩增目标物种dna。而且,以7个物种dna的混合物作模板,所有单一引物对均能有效扩增pcr条带;然而,以6个非目标物种dna混合物作模板,目标引物对不能有效扩增pcr条带 (图1d),进一步表明目标引物对能够特异性地扩增目标物种。与此同时,使用胶回收试剂盒纯化图1d中128-bp、157-bp、220-bp、272-bp、314-bp、434-bp和502-bp的扩增子,克隆至商业化载体peasy
®-t5 zero,使用sanprep柱式质粒dna小量抽提试剂盒进行质粒dna提取并利用载体通用引物m13f和m13r进行单一pcr扩增,最后使用dna自动测序仪进行pcr产物测序。将测序结果与ncbi核苷酸数据库比对分析,更加确定目标引物对能够从七物种dna混合物特异扩增目标物种。图2为上述骆驼、鸽子、鸡、鸭、马、牛、猪各物种的部分测序结果。此外,通过各目标引物对单一pcr扩增实验,证实目标引物除与靶物种结合能够有效扩增pcr条带,与14种陆地动物(骆驼、鸽子、鸡、鸭、马、牛、猪、火鸡、鹅、羊、兔、鸵鸟、狗、猫)以及3种水生类鱼(小黄鱼、金枪鱼和黑鱼)中的非目标物种结合均不能pcr扩增出条带(数据太多,未显示),表明新设计的特异性引物对与16种非靶物种均不存在交叉反应,极大降低错判可能性。基于上述实验结果,新的引物具有高度的特异性,适用于现实食品中肉类物种的鉴定。
[0023] 具体实施例三引物灵敏度分析在对每组引物进行特异性分析后,通过优化反应体系和程序,最终利用7对物种特异性引物建立了七重pcr体系。为了分析多重pcr反应的动态范围和检测限(lod),所有物种的模板dna从10 ng逐级稀释至0.01ng(10,5,2.5,1,0.5,0.25,0.1,0.05,0.025,0.01),评判七重pcr技术检测的阈值。如图3a所示,模板dna含量在10ng~0.01ng条件下,均能观察到顶端的5条清晰条带,从上至下依次为猪、牛、马、鸭和鸡。相比之下,0.025和0.01 ng 模板dna含量产生微弱的电泳条带。image lab
tm
软件依据电泳条带绘制电泳图谱。清晰条带匹配完整的峰型,弱带对应缺陷的峰型。如图3b所示,随着模板dna含量的不断降低,泳道1-10荧
光强度逐渐减弱,反映出pcr产物减少。与电泳胶图结果一致,猪、牛、马、鸭和鸡电泳图谱在泳道1-10具有完整的峰型;鸽子和骆驼图谱在泳道1-9展现完整的峰型,泳道10表现一定缺陷的峰型。综合图3a和3b鸡、鸭、马、牛和猪基因组dna的检测限为0.01 ng;而骆驼和鸽子基因组dna的检测限约为0.01-0.025 ng。
[0024] 具体实施例四引物重现性验证为了检验每组引物检测热加工肉类的效率,分别采用蒸煮(97-99℃,30 min)和微波加热(750w,10 min)处理生肉样品,提取基因组dna作模板,使用骆驼、鸽子、鸡、鸭、马、牛、猪特异性引物,进行七重pcr扩增实验。如图4a和4b所示,蒸煮样品dna经七重pcr扩增反应产生七条目标条带,同时检测七物种的检测限约为0.01 ng;微波样品dna经七重pcr扩增反应产生七条目标条带,同时检测七物种阈值约为0.05 ng。结果表明,新引物适用于现实世界肉制品物种的鉴定。
[0025]
具体实施例五商业肉品检测为验证七重pcr对于商业化肉制品鉴定的有效性,市场购买了67份猪、牛、马、鸽子和骆驼的商品肉制品。抽提基因组dna进行七重pcr扩增,并用琼脂糖凝胶电泳分析肉品种类。如下表1所示,大多数肉类样品中含有相同的标记成分,没有任何污染。然而,一些声称为100%纯肉样品被发现存在掺杂。15份猪肉样品中有5份(掺杂)(33.3%),15份牛肉样品中有6份(40.0%),12份马肉样品中有3份(25%),10份鸽子肉样品中有1份(10%),15份骆驼肉样品中有3份(20%)样品掺杂一些未注明的肉类成分。根据这项调查,廉价的鸡肉、鸭肉和猪肉仍然经常被用作红肉的替代成分。最重要的是,该调查进一步验证了本发明的七重pcr法在鉴定常见肉类品种中的有效性。
[0026]
。
[0027]
上述说明并非对本发明的限制,本发明也并不限于上述举例。本技术领域的普通技术人员在本发明的实质范围内,做出的变化、改型、添加或替换,也应属于本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。