1.本发明属于药物合成技术领域,具体涉及一种钆布醇衍生物的制备方法。
背景技术:
2.钆布醇注射液(gadobutrol injection),商品名为加乐显(gadovist),由拜耳研发,最早于1998年在瑞士上市销售,目前已在全球100多个国家获得批准。2011年3月获得美国fda批准上市,2014年7月获中国食品药品监督管理局批准上市,2015年3月在日本获准上市。
3.钆布醇注射液是一种强效核磁共振成像造影剂,用于颅脑和脊髓磁共振成像(mri)的对比增强和对比增强磁共振血管造影(ce-mra)。钆布醇是一种用三元酸布醇(butrol)作为配体的非离子型大环钆类螯合物,具有高弛豫率、高浓度、高亲水性、低渗透压、高度的动力学和热力学稳定性,更适合于快速的动态显像,在增强磁共振成像方面具有独特的优势。
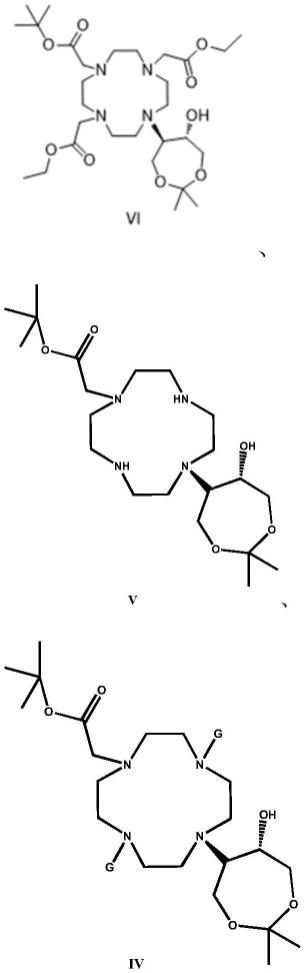
4.钆布醇注射液是1.0mol/l的高浓度钆布醇(gadobutrol)水溶液,钆布醇的化学名为钆络合10-[(1r,2s)-2,3-二羟基-1-羟甲基丙基)]-1,4,7,10-四氮杂环十二环-1,4,7-三乙酸,cas号为138071-82-6,其化学结构为及其对映异构体。
[0005]
已知,现有技术涉及通过三叔丁酯水解制备布醇,然后与钆离子源络合制备钆布醇的工艺。例如,文献inorg.chem.1997,36,6086-6093中公开了3种钆布醇的合成方案,其中方案三将式vii所示的化合物脱保护得到布醇。又如,专利wo2016/105172公开了一种高纯度钆布醇的制备方法,涉及通过将式viii所示的化合物进行酸水解制备布醇。如式vii和式viii所示的三叔丁酯取代的化
合物,在后续水解过程中易因为水解不彻底形成式x所示的钆布醇衍生物杂质。
[0006]
制备高纯度的杂质对照品,建立检测方法并确定合理的杂质限度,在钆布醇原料药中对该杂质进行有效的控制,对监控产品质量具有重要的意义。然而目前尚无关于式x所示化合物的合成方法的任何报道。
技术实现要素:
[0007]
本发明的目的是针对现有技术的缺点和不足,提供一种式x所示的钆布醇衍生物的制备方法,为钆布醇的质量控制提供高纯度的杂质对照品,保障钆布醇临床用药的安全。该制备方法可以制备得到纯度高、可作为杂质对照标准品的式x所示的钆布醇衍生物。
[0008]
为达到上述目的,本发明采用的技术方案如下:
[0009]
一种钆布醇衍生物的制备方法,所述制备方法包括:
[0010]
将式vi所示的化合物在酸性条件下进行缩酮水解反应,再在碱性条件下水解,酸化后制得式x所示的钆布醇衍生物。
[0011]
进一步地,所述酸性条件通过加入选自盐酸、三氟乙酸和硫酸中的一种或多种酸形成。
[0012]
进一步地,所述碱性条件通过加入选自氢氧化钠、氢氧化锂和氢氧化钾中的一种或多种碱形成。
[0013]
进一步地,所述酸和所述式vi所示的化合物的摩尔比为2-3:1,所述碱性条件下的ph值为12-13。
[0014]
在本发明的一个实施方案中,将式vi所示的化合物加入到水中,加入酸,进行缩酮水解反应脱除羟基保护;再加入碱调节ph至12~13,进行酯水解反应,反应过程中维持体系ph为12~13;酸化后得到式x所示的钆布醇衍生物。
[0015]
更进一步地,酸化时采用浓盐酸调节ph至6~7,减压浓缩得式x所示的钆布醇衍生
物粗品,反应式可以如下所示:
[0016][0017]
更进一步地,所述式vi所示的化合物和水的质量体积比为1:3-8。
[0018]
更进一步地,所述缩酮水解反应的温度为10-30℃,时间为1-3小时。
[0019]
更进一步地,所述酯水解反应的温度为10-30℃,时间为1-3小时。
[0020]
在本发明的一个实施方案中,酸化后得到式x所示的钆布醇衍生物的粗品,再通过高效液相色谱hplc进行纯化,得到所述式x所示的钆布醇衍生物。
[0021]
优选地,所述hplc纯化分离后得到式x所示的钆布醇衍生物的溶液,溶液冻干后得到式x所示的钆布醇衍生物。
[0022]
优选地,所述hplc的纯化条件为:流动相为a和b的混合物,其中a为0.1%tfa-h2o,即0.1%质量浓度的三氟乙酸水溶液,b为乙腈;色谱柱为waters atlantis prep t3 obd,尺寸为150*30mm,10um;流动相采用梯度流动相。
[0023]
在已报道的钆布醇制备工艺中,会因为三叔丁酯取代的中间体水解不彻底而在钆布醇原料药中产生该式x所示的钆布醇衍生物杂质。根据已报道的钆布醇制备工艺,叔丁酯基团水解反应发生在工艺路线后端,产生的杂质很可能因为后续精制工序较少、清除效果不好而残留到原料药中,需要在原料药中进行控制。本发明人通过研究发现,将式vi
[0024]
所示的化合物在酸性条件下进行缩酮水解反应,脱除羟基保护,再在碱性条件下选择性水解乙酯基团,酸化后可以制得式x所示的钆布醇衍生物。
[0025]
本发明的一些实施方案中,所述制备方法还包括:使式v所示的化合物在有机溶剂中,在碱性条件下与溴乙酸乙酯反应制得式vi所示的化合物。
[0026]
进一步地,所述有机溶剂选自乙腈、n,n-二甲基甲酰胺、n,n-二甲基乙酰胺中的一种或多种的组合。
[0027]
进一步地,所述碱性条件通过加入选自碳酸钠、碳酸钾、三乙胺、n,n-二异丙基乙胺中的一种或多种碱形成。
[0028]
进一步优选地,所述碱和式v所示的化合物的摩尔比为2-3:1。
[0029]
进一步地,所述式v所示的化合物和所述有机溶剂的质量体积比为1g:10-15ml。
[0030]
进一步地,所述溴乙酸乙酯和式v所示的化合物的摩尔比为2-3:1。
[0031]
在本发明的一些具体实施方案中,反应后往反应液中加水,用二氯甲烷萃取,有机相洗涤、干燥、浓缩,通过柱层析纯化得到式vi化合物,反应式如下所示:
[0032][0033]
优选地,所述反应的温度为50-60℃,时间为10-20小时。
[0034]
在本发明的一些实施方案中,所述制备方法还包括:使式iv所示的化合物在溶剂中,脱氨基保护制得式v所示的化合物,式iv中,g为氨基保护基。
[0035]
进一步地,所述氨基保护基为苄氧羰基,所述脱氨基保护的方法为在钯催化剂的存在下,加氢还原。
[0036]
进一步地,所述溶剂选自甲醇和乙醇中的一种或两种。
[0037]
进一步地,所述钯催化剂选自钯碳和氢氧化钯中的一种或两种。
[0038]
进一步优选地,所述式iv所示的化合物和溶剂的质量体积比为1g:5-15ml。
[0039]
进一步优选地,所述钯催化剂的质量为式iv所示的化合物质量的5%-15%。在本发明的一个具体实施方案中,反应后过滤,浓缩滤液得式v所示的化合物粗品,直接用于下一步反应,反应式可以如下所示:
[0040][0041]
进一步地,所述反应的温度为10-30℃,时间为10-20小时。
[0042]
在本发明的一些具体实施方案中,所述氨基保护基为2-(三甲基甲硅烷基)乙氧基羰基,所述溶剂为四氢呋喃,所述脱氨基保护的方法为加入四丁基氟化铵进行反应。
[0043]
进一步地,式iv所示的化合物和四氢呋喃的质量体积比为1g:5-15ml。
[0044]
进一步地,式iv所示的化合物和四丁基氟化铵的摩尔比为1:5-10。
[0045]
在本发明的一些实施方案中,所述制备方法还包括:使式iii所示的化合物在溶剂中,与4,4-二甲基-3,5,8-三氧杂双环[5,1,0]辛烷反应制得式iv所示的化合物,式iii中,g为氨基保护基。
[0046]
进一步地,使式iii所示的化合物制备式iv所示的化合物的步骤中,所述溶剂选自叔丁醇和异丙醇中的一种或两种。
[0047]
进一步地,所述4,4-二甲基-3,5,8-三氧杂双环[5,1,0]辛烷与式iii化合物的摩尔比为1-2:1。
[0048]
进一步地,所述式iii化合物和溶剂的质量体积比为1g:5-15ml。
[0049]
进一步地,反应之后浓缩反应液,通过柱层析纯化得到式iv所示的化合物,反应式如下所示:
[0050][0051]
进一步地,所述反应的温度为70-85℃,时间为48-64小时。
[0052]
在本发明的一些实施方案中,所述制备方法还包括:使式ii所示的化合物在溶剂中,在碱性条件下与溴乙酸叔丁酯反应制得式iii所示的化合物,式ii中,g为氨基保护基。
[0053]
进一步地,使式ii所示的化合物制备式iii所示的化合物的步骤中,所述溶剂选自n,n-二甲基甲酰胺和n,n-二甲基乙酰胺中的一种或两种。
[0054]
进一步优选地,所述式ii所示的化合物和溶剂的质量体积比为1g:5-15ml。
[0055]
进一步地,所述碱性条件通过加入选自醋酸钠和醋酸钾中的一种或两种碱形成。
[0056]
进一步优选地,所述碱和式ii所示的化合物的摩尔比为1:1-1.5。
[0057]
进一步地,所述溴乙酸叔丁酯和式ii所示的化合物的摩尔比为1-1.2:1。
[0058]
进一步优选地,所述反应的时间为10-20小时,温度为10-30℃。
[0059]
在本发明的一个实施方案中,将式ii所示的化合物和碱溶于溶剂中,滴加溴乙酸叔丁酯的溶液进行反应得到式iii所示的化合物,
[0060]
进一步地,反应后,浓缩除去部分溶剂,加水搅拌,用二氯甲烷萃取。有机相洗涤、干燥、浓缩。通过柱层析纯化得到式iii所示的化合物,反应式如下所示:
[0061][0062]
本发明人经过研究发现,通过控制式ii所示的化合物和溴乙酸叔丁酯的反应条件,可以实现式ii所示的化合物的选择性烷基化,得到式iii所示的化合物。
[0063]
在本发明的一些实施方案中,所述制备方法还包括:以式i所示的化合物轮环藤宁为起始原料,使其在溶剂中,氮气保护下与保护试剂反应,经过上氨基保护基反应制得所述式ii所示的化合物。
[0064]
进一步地,所述保护试剂选自苯甲氧羰酰琥珀酰亚胺、或n-[2-(三甲基硅基)乙氧羰氧基]琥珀酰亚胺。
[0065]
进一步优选地,所述式i所示的化合物和保护试剂的摩尔比为1:2-2.5。
[0066]
在本发明的一些具体实施方案中,所述式i所示的化合物溶于所述溶剂中形成溶液,所述保护试剂滴加至所述溶液中。
[0067]
进一步优选地,使式i所示的化合物制备式ii所示的化合物的步骤中,所述溶剂选自二氯甲烷、氯仿和1,2-二氯乙烷中的一种或多种的组合。
[0068]
进一步地,所述式i所示的化合物和溶剂的质量体积比为1:10-30。
[0069]
进一步地,所述反应温度为10-30℃,时间为16-24小时。
[0070]
在本发明的一个实施方案中,所述式i所示的化合物轮环藤宁在溶剂中,氮气保护下滴加苯甲氧羰酰琥珀酰亚胺进行反应,反应液用碱洗涤,干燥、浓缩有机相并纯化后得到式ii所示的化合物。
[0071]
在本发明的一个具体实施方案中,将式i所示的化合物轮环藤宁加入溶剂中,氮气保护,将反应体系降温至-10℃以下,滴加苯甲氧羰酰琥珀酰亚胺的二氯甲烷溶液,控制滴加温度在-20-0℃,滴加时间控制在5-10小时,滴加完成后进行反应。将反应液用1mol/l的氢氧化钠水溶液洗涤。干燥、浓缩有机相,通过柱层析纯化得到式ii所示的化合物,反应式如下所示:
[0072][0073]
本发明还进一步保护制备式x所示的钆布醇衍生物的中间体,所述中间体具有下式vi或者式v或者式iv所示的结构:
[0074][0075]
其中,式iv中,g为氨基保护基,具体选自苄氧羰基或2-(三甲基甲硅烷基)乙氧基羰基。
[0076]
与现有技术相比,本发明具有如下技术优势:
[0077]
(1)本发明提供的式x所示的钆布醇衍生物的制备方法,起始原料轮环藤宁易得,反应条件温和可控,能够高收率地得到纯度高的式x所示的钆布醇衍生物,从起始原料轮环滕宁到式x所示的钆布醇衍生物,最终式x所示的钆布醇衍生物的纯度可达98.4%。
[0078]
(2)本发明提供了一种高纯度、高收率的钆布醇衍生物的制备方法,弥补了现有技术关于该化合物制备方法的空白,产品可用作钆布醇杂质研究对照品,对于钆布醇的质量研究及保障临床用药安全意义重大。
具体实施方式
[0079]
下面结合实施例对本发明作进一步描述。但本发明并不限于以下实施例。实施例中采用的实施条件可以根据具体使用的不同要求做进一步调整,未注明的实施条件为本行业中的常规条件。本发明各个实施方式中所涉及到的技术特征只要彼此之间未构成冲突就可以相互组合。
[0080]
以下结合具体的实施例对本发明做进一步详细的说明。
[0081]
实施例1
[0082]
本实施例以式i所示的轮环滕宁为起始原料,制备式x所示的钆布醇衍生物,具体为:用苯甲氧羰酰琥珀酰亚胺选择性保护式i轮环滕宁对位的两个氨基,得到式ii所示的化合物。通过将式ii所示的化合物进行烷基化反应,得到式iii所示的化合物。通过将式iii所示的化合物与钆布醇环氧侧链4,4-二甲基-3,5,8-三氧杂双环[5,1,0]辛烷反应,得到式iv所示的化合物。氢气保护下,将式iv所示的化合物用钯碳催化加氢还原脱去苄氧羰基保护,得到式v所示的化合物。通过将式v所示的化合物进行烷基化反应,得到式vi所示的化合物。将式vi所示的化合物在酸性试剂中进行脱保护,然后不经纯化直接选择性水解乙酯,得到式x所示的钆布醇衍生物粗品。将上述粗品通过hplc进行制备,制备液冻干得到式x所示的钆布醇衍生物纯品。
[0083]
反应式如下所示:
[0084][0085][0086]
第一步:制备式ii化合物
[0087]
在10l反应瓶中加入4l二氯甲烷,式i化合物200.0g(1.16mol)。氮气置换,用冰盐水浴降温至-10℃以下。将苯甲氧羰酰琥珀酰亚胺636.8g(2.56mol)溶解于1.2l二氯甲烷后,滴加到反应液中,滴加过程控制温度在-20℃~-4℃。滴加完毕后,升温至室温搅拌反应16小时。反应液用2.5l l mol/l氢氧化钠水溶液洗涤。有机相干燥、减压浓缩,得到油状粗品569g。粗品经柱层析纯化得到式ii化合物341g,收率66.7%。
[0088]
式ii化合物的lc_ms:(es ):m/z 441.5[m h]。
[0089]
式ii化合物的1h nmr:δ2.82-3.09(m,8h),3.62-3.70(m,8h),5.18(s,4h),7.26-7.36(m,10h)。
[0090]
第二步:制备式iii化合物
[0091]
在500ml反应瓶中加入300ml n,n-二甲基甲酰胺dmf、式ii化合物30g(0.07mol)和醋酸钠5.66g(0.07mol)。溴乙酸叔丁酯13.51g(0.07mol)溶解在100ml dmf中,滴加入反应液中。室温搅拌16h。用油泵浓缩反应液除去部分dmf后,加入500ml水搅拌5分钟。用300ml二氯甲烷萃取2次,有机相用饱和食盐水(300ml)洗涤、干燥、减压蒸馏,得到67g粗品。粗品经柱层析纯化得到式iii化合物13.1g,收率33.8%。
[0092]
式iii化合物的lc_ms:(es
):m/z 556.0[m h]。
[0093]
第三步:制备式iv化合物
[0094]
在单口瓶中加入12.0g(21.7mmol)式iii化合物,107g叔丁醇,4,4-二甲基-3,5,8-三氧杂双环[5,1,0]辛烷6.26g(43.4mmol),80℃反应64h。反应液减压浓缩得到粗品,粗品经柱层析纯化得到式iv化合物8.44g。
[0095]
式iv化合物的lc_ms为:(es
):m/z 700.1[m h]。
[0096]
第四步:制备式v化合物
[0097]
在单口瓶中加入式iv化合物8.44g(12.1mmol),80ml甲醇,1.27g钯碳。氢气置换,室温反应16h。过滤反应液,滤液减压浓缩得到式v化合物粗品4.88g。
[0098]
式v化合物的lc_ms为:(es
):m/z 431.8[m h]。
[0099]
第五步:制备式vi化合物
[0100]
在单口瓶中加入式v化合物粗品4.88g,50ml乙腈,碳酸钾3.92g(28.3mmol),溴乙
酸乙酯4.16g(24.9mmol),52℃搅拌16h。反应液中加入100ml水,分别用80ml二氯甲烷萃取2次。有机相用饱和食盐水洗涤,干燥,减压浓缩得到粗品,粗品经柱层析纯化得到式vi化合物4.75g。
[0101]
式vi化合物的lc_ms为:(es
):m/z 603.9[m h]。
[0102]
第六步:制备式x化合物
[0103]
在单口瓶中加入式vi化合物4.75g(7.9mmol),30ml水,1.3ml 37%浓盐酸(15.8mmol),室温搅拌2小时。加入一水氢氧化锂0.91g调节反应液ph至12~13,反应1小时后补加一水氢氧化锂0.42g,继续搅拌1小时。
[0104]
用浓盐酸调节ph至6~7,减压浓缩。用hplc制备,冻干得到化合物x1.34g,纯度98.4%,收率为33%。
[0105]
其中,hplc制备条件为:流动相为a和b的混合物,其中a为0.1%tfa-h2o,即0.1%质量浓度的三氟乙酸水溶液,b为乙腈;色谱柱为waters atlantis prep t3 obd,尺寸为150*30mm,10um;流动相采用梯度流动相,流动相混合物中b组分的质量%随流动时间关系如下表1所示:
[0106]
表1
[0107]
流动时间(min)b(质量%)0521202550285030535停止
[0108]
式x化合物的lc_ms为:(es ):m/z 507.7[m h]。
[0109]
式x化合物的1h nmr(400mhz,d2o)为:δ1.45(s,9h),3.02-3.92(m,28h)。
[0110]
实施例2
[0111]
本实施例与实施例1基本相同,区别仅在于:第二步制备式iii化合物时,溴乙酸叔丁酯用量为16.21g(0.084mol)。第二步制备得到式iii化合物11.3g,收率为29.1%。
[0112]
实施例3
[0113]
本实施例与实施例1基本相同,区别仅在于:第二步制备式iii化合物时,采用0.05mol醋酸钾替换0.07mol醋酸钠。第二步制备得到式iii化合物11.7g,收率为30.1%。
[0114]
上述实施例只为说明本发明的技术构思及特点,其目的在于让熟悉此项技术的人士能够了解本发明的内容并据以实施,并不能以此限制本发明的保护范围。凡根据本发明精神实质所作的等效变化或修饰,都应涵盖在本发明的保护范围之内。
[0115]
在本文中所披露的范围的端点和任何值都不限于该精确的范围或值,这些范围或值应当理解为包含接近这些范围或值的值。对于数值范围来说,各个范围的端点值之间、各个范围的端点值和单独的点值之间,以及单独的点值之间可以彼此组合而得到一个或多个新的数值范围,这些数值范围应被视为在本文中具体公开。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。