snad稳定初期、snad稳定期和snad稳定后期各取样1次,得到六个泥样;
9.在所述步骤1)中,所述接种污泥期的取样时间为snad工艺运行的第1天,所述 亚硝化稳定期的取样时间为snad工艺运行的第24-26天,所述snad启动初期的取样 时间为snad工艺运行的第39-41天,所述snad稳定初期的取样时间为snad工艺运 行的第49-51天,所述snad稳定期的取样时间为snad工艺运行的第59-61天,所述 snad稳定后期的取样时间为snad工艺运行的第73-75天。
10.2)将步骤1)所得六个泥样静置10-15min,去除上清液,离心至少1次,用于去除 腐殖质,将离心所得固体提取总细菌dna,得到六个dna溶液;
11.在所述步骤2)中,所述离心的时间为5-6min,所述离心的转速为15000-16000rpm。
12.在所述步骤2)中,所述离心的次数为4~5次。
13.在所述步骤2)中,所述离心的温度为4-5℃。
14.3)进行pcr扩增,得到pcr扩增产物,其中,引物为
15.f341-gc(5'-cgcccgccgcgccccgcgcccgtcccgccgcccccgcccgcctacggg aggcagcag-3')和eu500(5'-gtattaccgcggctgctgg-3'),pcr扩增采用降落式 扩增程序,具体反应条件为:94℃预变性5min;94℃变性1min,65℃退火1min,72℃ 延伸1min,共进行20个循环,每个循环降低0.5℃;94℃变性1min,55℃退火1min, 72℃延伸1min,共进行3个循环;72℃延伸10min;
16.在所述步骤3)中,pcr反应体系为:将5体积份数的10
×
pcr buffer、4体积份数 的dntp、1体积份数的f341-gc、1体积份数的eu500、0.5体积份数的taq dna聚合 酶和2体积份数的dna溶液混合,加重蒸水至50体积份数。
17.4)对pcr扩增产物进行变性梯度凝胶电泳(dgge),获得dgge条带图谱,得到 snad工艺运行过程中微生物群落结构变化。
18.本发明采用pcr-dgge分子生物学技术建立了snad工艺运行过程中的微生物菌群 的检测方法,本发明的检测方法可以快速高效检测并了解实验周期中各个节点上菌群结 构的动态变化,并有针对性的对目标序列进行分析,避免了传统培养技术不能分离鉴定 的局限性,能在短时间内得出实验结果,大大减少工作量和工作实践,实验结果真实可 信。
19.研究snad反应器中微生物区系组成、微生物群落结构的演替,找出正常运行时的优 势菌种及微生物群落的变化,能为snad颗粒污泥工艺的运行提供重要的理论指导。
附图说明
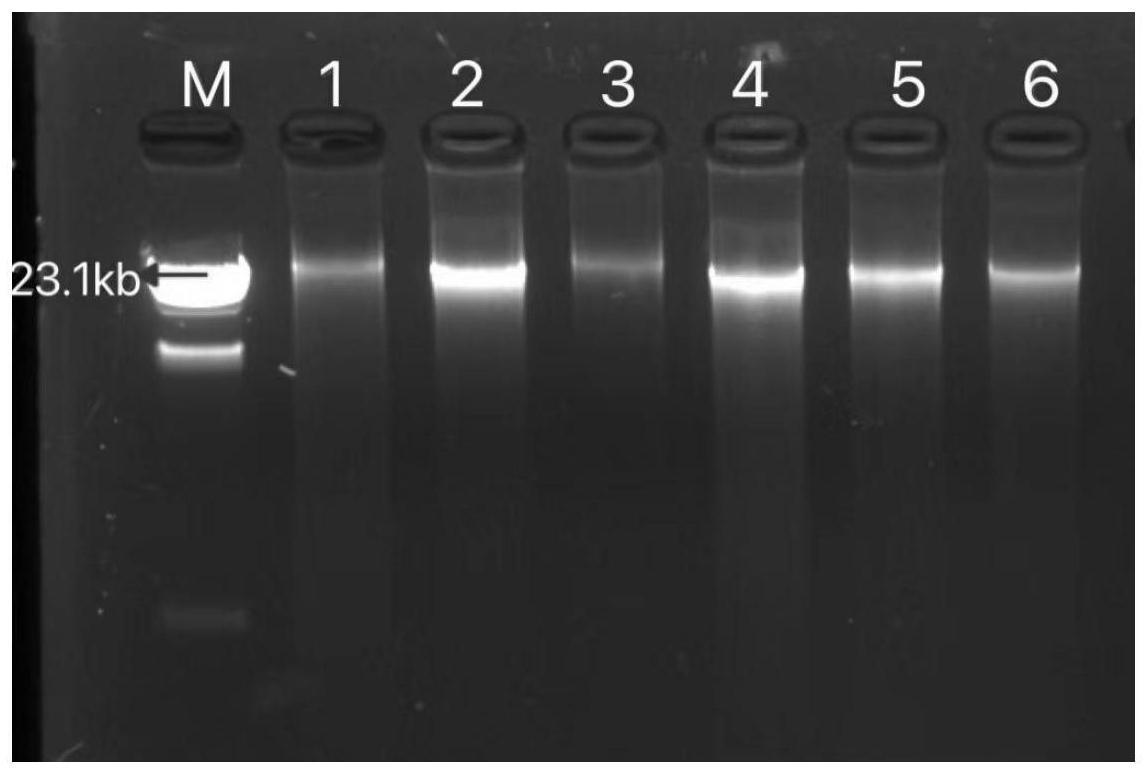
20.图1为dna溶液的琼脂糖凝胶电泳图,其中,m为marker;
21.图2为pcr扩增产物的琼脂糖凝胶电泳图,其中,0为空白对照;
22.图3为pcr扩增产物的dgge电泳图;
23.图4为总细菌电泳条带相似性比较;
24.图5为切胶回收后pcr扩增产物的凝胶电泳检测,其中,m为gm331 marker,0 为阴性对照;
25.图6为基于16s rdna序列的污泥中主要菌群的系统发育树;
26.图7为取样生活污水所在sbr反应器的氮素去除特性;
27.图8为取样生活污水所在sbr反应器的cod去除特性。
具体实施方式
28.下面结合具体实施例进一步说明本发明的技术方案。
29.下述实施例中的药品购买源:上海生工生物工程技术有限公司。
30.下述实施例中的所涉及仪器的型号和厂家:
31.超净工作台(vs-1300l-u),恒温生化培养箱(shp-250型,上海),全自动灭菌 锅(mls-3750型),超纯水仪(century,milli-q),高速离心机(1-14ed,sigama), pcr仪(myiq real-time,bio-rad),水浴恒温振荡器(dshz-300a,江苏),水平电 泳槽(dycp-31dn,北京市六一仪器厂),凝胶成像系统(gel doctm xr ,bio-rad), 分析天平(auy220岛津),-20℃低温冰箱(海尔),紫外仪(wb-9403b,北京市六 一仪器厂)。
32.实施例1
33.一种snad工艺运行过程中微生物群落结构变化的检测方法,包括以下步骤:
34.1)分别在snad工艺运行过程中的接种污泥期、亚硝化稳定期、snad启动初期、 snad稳定初期、snad稳定期和snad稳定后期各取样1次,得到六个泥样,分别依 次编号为1-6,其中,接种污泥期的取样时间为snad工艺运行的第1天,亚硝化稳定 期的取样时间为snad工艺运行的第25天,snad启动初期的取样时间为snad工艺 运行的第40天,snad稳定初期的取样时间为snad工艺运行的第50天,snad稳定 期的取样时间为snad工艺运行的第60天,snad稳定后期的取样时间为snad工艺 运行的第74天。
35.2)腐殖质是已死的生物体在土壤中经微生物分解而形成的有机物质,为了更好的去 除污泥中的腐殖质,采集1g泥样,在离心管中静沉10min后舍去上清液,用超纯水补充 至40ml处,再于4℃以15000rpm离心分离5min,弃上清液,如此重复离心5次,采用 ezup柱式基因组dna提取试剂盒(上海生工生物工程技术有限公司)将离心所得固体 提取总细菌dna,得到六个dna溶液,每个dna溶液取5μl用1.2%琼脂糖凝胶检测, 琼脂糖凝胶电泳图如图1所示,由图可知样品的dna片段大小为23kb左右,且纯度和 亮度均较好,说明dna提取较为成功,为下步进行pcr提供较好的模板。
36.其中,提取总细菌dna的方法为:称取200mg的离心所得固体,加入400μl 65℃ 预热的buffer scl,震荡混匀,置于65℃水浴5min;12000rpm室温离心3min。吸取上 清液至一个干净的1.5ml的离心管中;加入等体积buffer sp,颠倒混匀,冰浴10min; 12000rpm室温离心3min。吸取上清液至一个干净的1.5ml的离心管中;加入200μl氯 仿,充分混匀,12000rpm离心5min。吸取上层水相至一个干净的1.5ml的离心管中; 加入1.5倍体积(900μl)的buffer sb,充分混匀后用移液器将其全部加入到吸附柱中, 室温静置2min。12000rpm离心30s,倒掉收集管中废液;将吸附柱放回收集管中,加入 700μl wash solution,12000rpm离心30s,倒掉收集管中废液;将吸附柱放回收集管中, 加入300μl wash solution,12000rpm离心1min,倒掉收集管中废液;将吸附柱放回收集 管中,12000rpm离心2min;取出吸附柱,放入一个新的1.5ml离心管中,在吸附膜中 央加入75μl te buffer,静置3min,12000rpm离心2min,得到的dna溶液置于-20℃保 存或直接用于后续试验。
37.3)每个dna溶液取0.3g进行pcr扩增,得到pcr扩增产物,pcr扩增产物用1.2% 的琼脂糖凝胶电泳检测,其琼脂糖凝胶电泳图如图2所示,由图可知扩增片段大小在 240bp左右,证实为扩增的目的条带,且条带单一无非特异性扩增。其中,引物为对大多 数细菌16s rdna基因v3区具有特异性的 f341-gc(5'-cgcccgccgcgccccgcgcccgtcccgccgcccccgcccg
cctacggg aggcagcag-3')和eu500(5'-gtattaccgcggctgctgg-3'),pcr扩增采用降落式 扩增程序,具体反应条件为:94℃预变性5min;94℃变性1min,65℃退火1min,72℃ 延伸1min,共进行20个循环,每个循环降低0.5℃;94℃变性1min,55℃退火1min, 72℃延伸1min,共进行3个循环;72℃延伸10min;
38.pcr反应体系为:将5μl的10
×
pcr buffer、4μl的dntp(dntp中datp、dttp、 dctp和dgtp的浓度各2.5mmoll-1
)、1μl的f341-gc(20μmoll-1
)、1μl的eu500 (20μmoll-1
)、0.5μl的taq dna聚合酶(5u)和2μl的dna溶液混合,加重蒸水至 50μl。
39.4)采用bio-rad dcodetm dgge系统对pcr扩增产物进行变性梯度凝胶电泳 (dgge),获得dgge条带图谱,dgge电泳图如图3所示,得到snad工艺运行过程 中微生物群落结构变化。
40.对pcr扩增产物进行变性梯度凝胶电泳的方法为:用梯度混合装置制备8%的聚丙 烯酰胺凝胶,聚丙烯酰胺凝胶的变性范围为35%-55%(100%的变性剂为7mol
·
l-1
的尿素 和40%甲酰胺的混合物)。其中变性剂和聚丙烯酰胺的浓度从胶的上方向下方依次递增。 待聚丙烯酰胺凝胶完全凝固后,将胶板放入装有电泳缓冲液的电泳槽中,取20μlpcr扩 增产物和10μl的6
×
loading buffer混合后加入上样孔,然后在1
×
tae电泳缓冲液中电泳 8h(60℃、130v)。电泳结束后,用gel red核酸凝胶染料染色30min,并在凝胶成像 系统(gel doctmxr ,bio-rad)中拍照。
41.为了解总细菌群落结构在snad工艺培养驯化过程中的动态变化情况,对dgge条 带图谱中各时期总细菌种群的相似性进行了分析,见图4。由相似性的顺序分布图可以看 出,各泳道与泳道6的相似性数值基本符合培养驯化的过程,说明污泥培养驯化是一个 逐步有序的过程,微生物逐渐演变进入正常运行的状态。
42.用灭菌刀片切取dgge胶上主要的独立16s rdna条带并置于1.5ml离心管中,加 入50μl已灭菌的超纯水,将离心管于4℃下静置过夜,取2μl的浸出液作为模板,进行 pcr扩增。切胶回收后pcr扩增所用引物为:f357:5
’‑
cctacgggaggcagcag-3
’ꢀ
和r518:5
’‑
attaccgcggctgctgg-3’,扩增产物片段长约200bp。pcr反应程序为: 94℃下预变性5min;然后30个循环:94℃1min,55℃1min,72℃1min;最后在72℃ 下延伸8min。切胶回收后pcr扩增产物在1.2%琼脂糖凝胶中电泳检测如图5所示。
43.将dgge图谱的条带切胶回收后所得dna的pcr产物进行克隆,克隆子送交生物 技术公司进行测序,23个dna样品有10个样品(条带l1、l2、l3、l4、l6、l7、l9、 l14、l16和l22)测序成功,将测序所得基因序列输入到ncbi网站,利用blast程 序与数据库中已有的序列进行比对分析,同时用mega4软件构建进化树,算法为邻位 相接法(neighbor-joining-analysis),所得进化树见图6。
44.对总细菌的部分优势菌种进行切胶回收克隆测序和系统发育树分析,优势菌群主要 有β-变形菌(β-proteobacteria)、γ-变形菌(γ-proteobacteria)、厚壁菌门(firmicutes)、 拟杆菌(bacteroidetes)和未培养菌(uncultured bacterium)。微生物分布较为广泛,主 要优势菌种分布于不同的纲,已经检测出的菌种中β-变形菌略多并保持着较为稳定的优 势地位,而随着反应器的运行,厚壁菌、γ-变形菌和拟杆菌等次级种群得到强化,成为 新的优势群落,为提高snad颗粒污泥培养驯化效率和优化运行参数提供了一定的理论 依据。
45.对比例1
46.对比例1的步骤1)~3)与实施例1中检测方法的步骤1)~3)基本相同,唯一不同 之处仅在于对比例1中步骤3)中的pcr扩增程序为:94℃预变性5min;94℃变性1min, 65℃退火1min,72℃延伸1min,共进行25个循环;72℃延伸10min。
47.使用1.2%琼脂糖凝胶对对比例1的pcr扩增产物在bio-rad水平电泳仪中进行电泳 检测,pcr扩增产物跑胶无条带。
48.上述实施例和对比例步骤1)中取样的为生活污水,生活污水的水质指标如表1所示。 泥样取自于厌氧氨氧化固定床反应器下部的厌氧氨氧化颗粒污泥。
49.表1
[0050][0051]
生活污水snad颗粒污泥工艺启动驯化过程中nh
4 -n、no
3-‑
n、no
2-‑
n和cod的 进出水浓度及去除率变化情况如图7和图8所示。1-20d,颗粒污泥的亚硝化效果逐渐增 强,到第20d时,出水氨氮浓度降低为3mg/l,出水亚氮浓度上升到58mg/l,氨氮去除 率上升到93%,亚氮积累率达到95%。21-29d,颗粒污泥的亚硝化效果保持稳定,平均 氨氮去除率和亚氮积累率分别为96%和95%。30-48d,反应器的脱氮性能逐渐增强,出 水氨氮逐渐降低,从46mg/l降低到10mg/l以下,总氮去除率从22.6%上升到83.9%。 49-74d,反应器保持了较高的总氮去除能力,出水氨氮浓度在5mg/l以下,出水硝氮浓 度和亚氮浓度保持稳定,平均值分别为3mg/l和4mg/l,平均总氮去除率为85%。
[0052]
以上对本发明做了示例性的描述,应该说明的是,在不脱离本发明的核心的情况下, 任何简单的变形、修改或者其他本领域技术人员能够不花费创造性劳动的等同替换均落 入本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
