1.本发明涉及基因工程技术领域,具体涉及一种高产麦考酚酸的基因工程菌、构建方法及其应用。
背景技术:
2.麦考酚酸(mycophenolic acid,mpa)为短密青霉(penicillium brevicompactum)产生的一种抗生素,具有抗真菌、抗肿瘤和免疫抑制作用。麦考酚酸可以非竞争性地结合次黄嘌呤单核苷酸脱氢酶,以对淋巴细胞活性起到抑制作用。它的2-吗啉代乙酯类衍生物——麦考酚酸酯(morpholinoethyl ester of mycophenolic acid,mmf)是新一代免疫抑制剂。麦考酚酸酯在体内通过转化为麦考酚酸而发挥免疫抑制活性。目前在国内外器官移植中,mmf已经得到广泛的应用,这也使得麦考酚酸的生产方法及其高产菌株的构建得到业界的广泛关注。
3.麦考酚酸的药物代谢动力学特征:麦考酚酸酯(mmf)经口服吸收较完全,进入体内后很快被代谢为活性成分mpa,99.99%的mpa分布于血浆中,mpa与血浆蛋白结合率为97%~99%,在肠道、肝脏和肾脏中主要被二磷酸鸟苷-葡萄糖醛酸转移酶(uridinediphosphategluconosyltran-chemicalbooksferases,ugts)代谢为霉酚酸葡萄糖苷酸(mycophenolicacidglucuronide,mpag),另外还有少量代谢为7-o-葡萄糖苷-霉酚酸和霉酚酸酰基葡萄糖苷酸(mycophenolicacidacylglucuronide,acmpag),mpa在体内有肝肠循环,其代谢物通过肝内多药耐药相关蛋白2(multi-drugresistanceprotein2,mrp-2)转运入胆汁,随胆汁排入肠道后经细菌分解为mpa,并再次经血液循环进入肝脏,因而在用药后4~12h出现mpa的第二个峰浓度,使mpa的体内暴露量升高近40%。最终约93%mpa经尿液排出,其中以mpag形式排出的占87%,少量通过粪便排出(约6%)。
4.目前麦考酚酸的生产主要基于生物合成法,即真菌的发酵,其中高效生产麦考酚酸的有:短密青霉(penicillium brevicompactum)以及娄地青霉菌(penicillium roqueforti)等青霉菌。产物从发酵液中的提取主要是溶媒浸提之后分离的方法,目前也被广泛应用于各种生物合成产品的分离。
技术实现要素:
5.本发明的目的是为了克服上述现有技术中的至少一个缺点,提供一种高产麦考酚酸的基因工程菌、构建方法及其应用。
6.本发明提供了一种高产麦考酚酸的基因工程菌,主要特点是,以短密青霉(penicillium brevicompactum)为宿主细胞,表达由mpab基因和质粒ppk2形成的重组质粒ppkcmh,由经过截短的pgpd启动子启动mpab基因的表达,所述的重组质粒经根癌农杆菌(agrobacterium tumefaciens)gv3101介导转移。
7.其中,mpab基因(氧化裂解酶类)是原生于麦考酚酸合成基因簇的一个基因。
8.优选地,所述的截短的pgpd启动子具体为:来自于构巢曲霉3-磷酸甘油脱氢酶atg
上游2156bp的核苷酸序列为初始启动子序列,在-1046bp处截短,形成所述的截短的pgpd启动子。
9.本发明还提供了一种高产麦考酚酸的基因工程菌的构建方法,其主要特点是,所述的构建方法包括:由mpab基因与截短的pgpd启动子pgpdt和ttrpc终止子和ppk2质粒形成重组质粒,所述的重组质粒经根癌农杆菌(agrobacterium tumefaciens)gv3101介导转移至短密青霉(penicillium brevicompactum)中,增加产物合成基因簇中mpab基因的拷贝数,形成高产麦考酚酸的基因工程菌penicillium brevicompactum ppkcmh-pgpdt-mpab-ttrpc。
10.所述的mpab基因从短密青霉中扩增得到。
11.所述的pgpdt为pgpd截短的启动子,来自于构巢曲霉3-磷酸甘油脱氢酶atg上游2156bp的核苷酸序列为初始启动子序列,在-1046bp处截短,形成所述的截短的pgpd启动子。
12.所述的由mpab基因和ppk2质粒形成重组质粒,具体为:
13.将mpab基因、经过截短的3-磷酸甘油脱氢酶启动子pgpdt、巢曲霉色氨酸合成基因终止子ttrpc连在丝状真菌穿梭表达载体ppk2的多克隆位点处,得到所述的重组质粒ppkcmh。
14.接下来,将重组质粒ppk-cmh转化根癌农杆菌gv1301中,得到重组的根癌农杆菌,利用根癌农杆菌的结合转移的功能,将重组质粒中的rb和lb之间的载体片段转移进短密青霉中以得到重组的短密青霉。
15.本发明提供的构建方法具体包括以下步骤:
16.1、mpab基因,启动子pgpdt以及终止子ttrpc的克隆:
17.根据genebank公布的短密青霉麦考酚酸合成基因簇中的mpab基因序列,设计合成引物:
18.p1:gagcagacatcaccatgtctttgtctttgcctccagc
19.p2:ctaatggaagggacatttcccc
20.根据genebank公布的来自于构巢曲霉的pgpd的基因序列,经过截短之后,依据截短的启动子序列,设计并合成引物:
21.p3:cgaattcttaattaagatatcccaaatctgtccagatcatggt
22.p4:agacatggtgatgtctgctcaagcgg
23.根据genebank公布的来自于构巢曲霉的ttrpc的基因序列,设计并合成引物:
24.p5:ggaaatgtcccttccattagtgatttaatagctccatgtcaacaa
25.p6:ccgggtaccgagctcgatatcgtctagaaagaaggattacctctaa
26.在引物p1和p6的两端引入与质粒ppk2多克隆位点中的kpni酶切位点的同源重组片段,以短密青霉和质粒ppk2为模板完成pcr反应:
27.pcr的反应体系是:buffer 25μl,ddh2o 18μl,模板1μl,上下游引物各2μl,dntps 1μl,high fidelity enzyme 1μl。pcr反应条件:95℃预变性3min;进行35个循环:95℃变性20s,60℃退火20s,72℃按照1kb/min速率设置延伸时间。最后72℃保温10min,反应结束后4℃保存。反应终止后,1%琼脂糖凝胶电泳检测。
28.之后按如下方法进行融合pcr将pgpdt-mpab-ttrpc三个片段连在一起:
29.i、以上述克隆出的三个片段各取1μl作为模板,buffer 25μl,ddh2o 20μl,dntps1μl,high fidelity enzyme 1μl。
30.pcr反应条件:95℃预变性5min;进行10个循环:94℃变性20s,57℃退火20s,72℃按照1kb/min速率设置延伸时间。最后72℃保温10min,反应结束后4℃保存。
31.ii、以上述融合片段2μl作为模板,buffer 25μl,ddh2o 17μl,dntps 1μl,high fidelity enzyme 1μl,p1 2μl,p2 2μl。
32.pcr反应条件:95℃预变性5min;进行35个循环:94℃变性20s,60℃退火20s,72℃按照1kb/min速率设置延伸时间。最后72℃保温10min,反应结束后4℃保存。
33.反应终止后,1%琼脂糖凝胶电泳检测,经pcr纯化回收试剂盒纯化后,与kpni酶切之后的ppk2载体连接,并测序。
34.2、根癌农杆菌介导的结合转移:
35.制备根癌农杆菌感受态:
36.农杆菌gv3101接种于5ml lb液体培养基(含25μg/ml链霉素)中,28℃、200rpm培养过夜。取5ml培养物于lb液体培养基(50ml)(含25μg/ml链霉素)中继续培养,od600为0.5。将培养物置冰浴中30min,4℃、5000rpm、离心5min,弃去上清液。用10ml冷的10%甘油悬浮,4℃、5000rpm、离心5min,弃去上清液。用2.5ml冷的10%甘油悬浮,4℃、5000rpm、离心5min,弃去上清液。用1.0ml冷的10%甘油悬浮。分装成100μl/管,液氮冷冻1min后置-70℃保存。
37.电转法转化ppkcmh入农杆菌gv1301感受态:
38.采用bio-rad公司micro pulser电转化仪,厚度为0.2cm电转杯,将5μl重组质粒与100μl农杆菌gv1301感受态细胞相混合,全部混合液加于电转杯中。2.5kv,25μf,1000ω条件下电击转化,加入800μl lb液体培养基,30℃,150rpm振荡培养复苏10h。涂布于含25μg/ml卡那霉素和25μg/ml链霉素的lb固体培养基上,30℃倒置培养2d待菌落形成。挑取单菌落接种于含25μg/ml卡那霉素和25μg/ml链霉素的lb液体培养基,30℃、200rpm振荡培养。pcr验证阳性克隆子并传代保藏。
39.短密青霉分生孢子的培养:
40.将短密青霉孢子均匀涂布于含有pda培养基的茄子瓶中,在28℃条件下倒置培养8-10天,将孢子从pda平板上收集到装有10ml无菌的水溶液中,剧烈涡旋2-5分钟,直至孢子完全分散,用无菌的玻璃丝过滤孢子悬液除去菌丝体。将孢子悬液转移至一个新的无菌的50ml离心管中,8000rpm离心10min,收集孢子,弃上清,再用无菌水溶液悬浮孢子,血球计数板计算孢子浓度108cfu/ml,再调整到合适的浓度,存于4℃冰箱。
41.结合转移:
42.首先孢子的浓度稀释为106cfu/ml
43.将根癌农杆菌置于含有20ml lb的250ml容积的锥形瓶中,加入卡纳抗性,培养16-18h;
44.取0.5ml的根癌农杆菌培养液,取4.5ml的im培养基(含有200μm的as(乙酰丁香酮)),置于50ml的离心管中,使得终od600大约为0.2;
45.将上述混合液体在黑暗、28℃条件之下培养6h,使得od600达到0.6-0.8;
46.取100μl的诱导之后的根癌农杆菌和100μl的孢子液,相互混合,置于纤维素薄膜(whatman)上,置于im培养基固体培养基中,25℃,黑暗条件之下进行培养48h;
47.之后将纤维素薄膜转移至含有50μg/ml的潮霉素以及300μg/ml的细胞霉素的pda固体培养基上,25℃倒置培养4~5天。
48.待长出转化子之后挑取单菌落在含有50μg/ml潮霉素抗性的pda平板上进行传代至性状稳定。
49.提取上述性状稳定的转化子的基因组并进行pcr验证。待pcr验证成功的转化子长出成熟孢子之后培养于液体pda培养基中,待生长至对数生长期提取其rna并进行逆转录,使用qrt-pcr进行验证mpab基因的表达情况。
50.3、qrt-pcr验证——重组基因工程菌的获得:
51.qrt-pcr反应体系如下:
52.mix 10μl up primer 0.4μl down primer 0.4μl模板1μl ddh2o 8.2μl
53.两步法rt-pcr反应条件如下:
54.预变性:95℃,30s;
55.40个循环:变性,95℃,10s,退火延伸,60℃,30s;
56.熔解曲线:95℃,15s;60℃,60s;95℃,15s。
57.选取mpab基因相对表达量最高的菌株培养并保存,作为工程菌株,命名为penicillium brevicompactum ppkcmh-pgpdt-mpab-ttrpc。
58.本发明还提供了所述的基因工程菌在生产麦考酚酸中的应用。
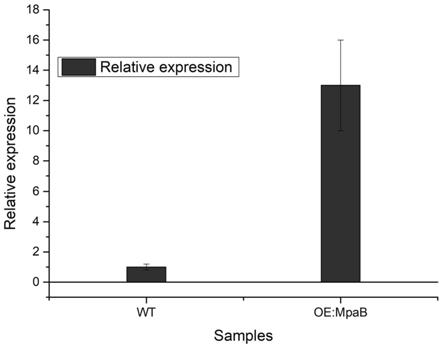
59.本发明的高产麦考酚酸的基因工程菌,可以显著提升麦考酚酸合成基因簇中mpab基因表达量,从而积极增加麦考酚酸的产量。并且,本发明提供的构建方法中,基于分子构建,无需繁琐操作,显著提升产量,具有良好的工业应用价值。
附图说明
60.图1为构建载体后,经pcr验证mpab基因的核酸图片。
61.图2为获得工程菌之后,进行rt-pcr得到的相较原始菌著mpab基因的过表达数据。
62.图3为工程菌株和原生菌株发酵产量验证数据。
63.图4为工程菌株发酵过程中生物量变化数据。
64.图5为工程菌株发酵过程发酵液中ph变化数据。
65.图6为工程菌株发酵过程发酵液中还原糖变化数据。
66.图7为构建截短pgpdt启动子示意图。
67.图8为不同位置截短的启动子的启动效率示意图。
68.图9为构建好的质粒图谱ppkcmh-pgpdt-mpab-ttrpc。
具体实施方式
69.为了能够更清楚地理解本发明的技术内容,特举以下实施例详细说明。应理解,实施例仅是用于说明本发明,而不是对本发明的限制。
70.本发明提供了一种高产麦考酚酸的基因工程菌,主要特点是,以短密青霉(penicillium brevicompactum)为宿主细胞,表达由mpab基因和质粒ppk2形成的重组质粒ppkcmh,由经过截短的pgpd启动子启动mpab基因的表达,所述的重组质粒经根癌农杆菌(agrobacterium tumefaciens)gv3101介导转移。
71.其中,所述的截短的pgpd启动子具体为:来自于构巢曲霉3-磷酸甘油脱氢酶atg上游2156bp的核苷酸序列为初始启动子序列,在-1046bp处截短,形成所述的截短的pgpd启动子。
72.如图7~8所示,本发明对完整pgpd启动子进行不同部位的截短。依据genebank查询,本发明将来自于构巢曲霉3-磷酸甘油脱氢酶atg上游2156bp的核苷酸序列作为初始启动子序列。在验证其启动效果良好之后,对其在-1946、-1646、-1346、-1046及-646bp处进行截短,分别验证其对基因的启动效率。实验结果显示,在-1046bp处截短的启动子达到了较好的启动效果,且序列长度相较初始启动子降低50%,有效降低质粒载荷。
73.本发明提供的截短的pgpd启动子,能够达到在不影响其启动效率的前体下质粒载荷更小和构建程序更加便捷的目的,将截短的3-磷酸甘油脱氢酶启动子pgpd命名为pgpdt。
74.在构建如图9所示的ppkcmh-pgpdt-mpab-ttrpc中,使用截短的启动子pgpdt。
75.本发明所述的表达载体骨架ppk2为本实验室保存。
76.实施例1:重组质粒ppkcmh的获得
77.根据genebank:km595305公布的短密青霉麦考酚酸合成基因簇中的mpab基因序列,其核酸序列如seq id no.1所示,mpab的氨基酸序列可参考uniprotkb/swiss-prot:a0a0b5lb52,设计合成引物:
78.p1:5
’‑
gagcagacatcaccatgtctttgtctttgcctccagc-3’;
79.p2:5
’‑
ctaatggaagggacatttcccc-3’;
80.根据genebank公布的来自于构巢曲霉的pgpd的基因序列,截短验证之后,依据截短的启动子序列,设计并合成引物:
81.p3:5
’‑
cgaattcttaattaagatatcccaaatctgtccagatcatggt-3’;
82.p4:5
’‑
agacatggtgatgtctgctcaagcgg-3’;
83.根据genebank公布的来自于构巢曲霉的ttrpc的基因序列,设计并合成引物:
84.p5:5
’‑
ggaaatgtcccttccattagtgatttaatagctccatgtcaacaa-3’;
85.p6:5
’‑
ccgggtaccgagctcgatatcgtctagaaagaaggattacctctaa-3’;
86.在引物p1和p6的两端引入与质粒ppk2多克隆位点中的kpni酶切位点的同源重组片段,以短密青霉和质粒ppk2为模板完成pcr反应。
87.pcr的反应体系为:buffer 25μl,ddh2o 18μl,模板1μl,上下游引物各2μl,dntps 1μl,high fidelity enzyme 1μl。pcr反应条件为:95℃预变性3min;进行35个循环:95℃变性20s,60℃退火20s,72℃按照1kb/min速率设置延伸时间。最后72℃保温10min,反应结束后4℃保存。反应终止后,1%琼脂糖凝胶电泳检测。
88.之后按如下方法进行融合pcr将pgpdt-mpab-ttrpc三个片段连在一起:
89.i、以上述克隆出的三个片段各取1μl作为模板,buffer 25μl,ddh2o 20μl,dntps1μl,high fidelity enzyme 1μl。
90.pcr反应条件:95℃预变性5min;进行10个循环:94℃变性20s,57℃退火20s,72℃按照1kb/min速率设置延伸时间。最后72℃保温10min,反应结束后4℃保存。
91.ii、以上述融合片段2μl作为模板,buffer 25μl,ddh2o 17μl,dntps 1μl,high fidelity enzyme 1μl,p1 2μl,p2 2μl。
92.pcr反应条件:95℃预变性5min;进行35个循环:94℃变性20s,60℃退火20s,72℃
按照1kb/min速率设置延伸时间。最后72℃保温10min,反应结束后4℃保存。
93.反应终止后,1%琼脂糖凝胶电泳检测,经pcr纯化回收试剂盒纯化后,与kpni酶切之后的ppk2载体连接,并测序。重组质粒的核酸图片可参考图1。
94.实施例2:制备根癌农杆菌感受
95.农杆菌gv3101接种于5ml lb液体培养基(含25μg/ml链霉素)中,28℃、200rpm培养过夜。取5ml培养物于lb液体培养基(50ml)(含25μg/ml链霉素)中继续培养,od600为0.5。将培养物置冰浴中30min,4℃、5000rpm、离心5min,弃去上清液。用10ml冷的10%甘油悬浮,4℃、5000rpm、离心5min,弃去上清液。用2.5ml冷的10%甘油悬浮,4℃、5000rpm、离心5min,弃去上清液。用1.0ml冷的10%甘油悬浮。分装成100μl/管,液氮冷冻1min后置-70℃保存。
96.实施例3:电转法转化ppkcmh入农杆菌gv1301感受态
97.采用bio-rad公司micro pulser电转化仪,厚度为0.2cm电转杯,将5μl重组质粒与100μl农杆菌gv1301感受态细胞相混合,全部混合液加于电转杯中。2.5kv,25μf,1000ω条件下电击转化,加入800μl lb液体培养基,30℃,150rpm振荡培养复苏10h。涂布于含25μg/ml卡那霉素和25μg/ml链霉素的lb固体培养基上,30℃倒置培养2d待菌落形成。挑取单菌落接种于含25μg/ml卡那霉素和25μg/ml链霉素的lb液体培养基,30℃、200rpm振荡培养。pcr验证阳性克隆子并传代保藏。
98.实施例4:短密青霉分生孢子的培养
99.将短密青霉孢子均匀涂布于含有pda培养基的茄子瓶中,在28℃条件下倒置培养8-10天,将孢子从pda平板上收集到装有10ml无菌的水溶液中,剧烈涡旋2-5分钟,直至孢子完全分散,用无菌的玻璃丝过滤孢子悬液除去菌丝体。将孢子悬液转移至一个新的无菌的50ml离心管中,8000rpm离心10min,收集孢子,弃上清,再用无菌水溶液悬浮孢子,血球计数板计算孢子浓度,再调整到108cfu/ml,存于4℃冰箱。
100.实施例5:根癌农杆菌介导的结合转移
101.首先孢子的浓度稀释为106cfu/ml
102.(1)将根癌农杆菌置于含有20ml lb的250ml容积的锥形瓶中,加入卡纳抗性,培养16~18h;
103.(2)取0.5ml的根癌农杆菌培养液,取4.5ml的im培养基(含有200μm的as(乙酰丁香酮)),置于50ml的离心管中,使得终od600大约为0.2;
104.(3)将上述混合液体在黑暗、28℃条件之下培养6h,使得od600达到0.6-0.8;
105.(4)取100μl的诱导之后的根癌农杆菌和100μl的孢子液,相互混合,置于纤维素薄膜(whatman)上,然后放在固体的im培养基中,25℃,黑暗条件之下进行培养48h;
106.(5)之后将纤维素薄膜转移至含有50μg/ml的潮霉素以及300μg/ml的细胞霉素的pda培养基上,25℃培养4~5天;
107.(6)待长出转化子之后,挑取单菌落,在含有抗性的pda平板上进行传代至性状稳定;
108.(7)提取上述性状稳定的转化子的基因组并进行pcr验证。待pcr验证成功的转化子长出成熟孢子之后培养于液体pda培养基中,待生长至对数生长期提取其rna并进行逆转录,使用qrt-pcr进行验证mpab基因的表达情况。
109.实施例6:qrt-pcr验证——重组基因工程菌的获得
110.qrt-pcr反应体系如下:
111.mix 10μl up primer 0.4μl down primer 0.4μl模板1μl ddh2o 8.2μl
112.两步法qrt-pcr反应条件如下:
113.预变性:95℃,30s;
114.40个循环:变性,95℃,10s,退火延伸,60℃,30s;
115.熔解曲线:95℃,15s;60℃,60s;95℃,15s。
116.考察结果:
117.选取mpab基因相对表达量最高的菌株培养并保存,作为工程菌株,命名为penicillium brevicompactum ppkcmh-pgpdt-mpab-ttrpc。
118.上述工程菌在生产麦考酚酸中的应用。
119.实施例7:工程菌penicillium brevicompactum ppkcmh-pgpdt-mpab-ttrpc利用葡萄糖摇瓶发酵生产麦考酚酸。
120.(1)出发菌株:penicillium brevicompactum ppkcmh-pgpdt-mpab-ttrpc
121.(2)摇瓶种子培养:
122.摇瓶种子培养基:葡萄糖100.0g/l,蛋白胨15.0g/l,黄豆粉15.0g/l,麦精1.0g/l,kh2po41.0g/l,mgso4·
7h2o 0.5g/l。使用氢氧化钠或磷酸调节ph至6.3。
123.培养条件:250ml三角瓶,装液量50ml,培养温度28℃,摇床转速220r/min,培养时间48小时。
124.(3)一级种子培养:
125.一级种子培养基:葡萄糖100.0g/l,蛋白胨15.0g/l,kh2po
4 1.0g/l,mgso4·
7h2o 1.0g/l。使用3m氢氧化钠或磷酸调节ph至6.5。
126.接种:按照1%的接种量,将摇瓶种子液接入一级种子培养基。
127.培养条件:250ml三角瓶,装液量50ml,培养温度28℃,摇床转速220r/min,培养时间48小时。
128.(4)二级种子培养:
129.二级种子培养基:葡萄糖100.0g/l,蛋白胨10.0g/l,kh2po
4 1.0g/l,mgso4·
7h2o 1.0g/l。使用3m氢氧化钠或磷酸调节ph至6.5。
130.接种:按照10%的接种量,将一级种子液接入二级种子培养基。
131.培养条件:250ml三角瓶,装液量50ml,培养温度28℃,摇床转速220r/min,培养时间30小时。
132.(5)发酵培养:
133.发酵培养基:葡萄糖108.0g/l,l-蛋氨酸0.5g/l,啤酒酵母3.3g/l,feso4·
7h2o 0.2g/l,mnso4·
h2o 0.1g/l,znso4·
7h2o 2.5g/l,caso4·
2h2o 0.3g/l。无机盐溶液配方:kh2po43.0g/l,mgso4·
7h2o 2.0g/l。无机盐溶液单独灭菌,之后和基础料培养基溶液混合。
134.接种:按照15%的接种量,将二级种子液接发酵培养基。
135.培养条件:250ml三角瓶,装液量50ml,培养温度28℃,摇床转速220r/min,培养时间180小时。
136.对比例1:原生菌株penicillium brevicompactum利用葡萄糖摇瓶发酵生产麦考酚酸。
137.(1)出发菌株:penicillium brevicompactum
138.(2)摇瓶种子培养:
139.摇瓶种子培养基:葡萄糖100.0g/l,蛋白胨15.0g/l,黄豆粉15.0g/l,麦精1.0g/l,kh2po41.0g/l,mgso4·
7h2o 0.5g/l。使用3m氢氧化钠或磷酸调节ph至6.3。
140.培养条件:250ml三角瓶,装液量50ml,培养温度28℃,摇床转速220r/min,培养时间48小时。
141.(3)一级种子培养:
142.一级种子培养基:葡萄糖100.0g/l,蛋白胨15.0g/l,kh2po
4 1.0g/l,mgso4·
7h2o 1.0g/l。使用3m氢氧化钠或磷酸调节ph至6.5。
143.接种:按照1%的接种量,将摇瓶种子液接入一级种子培养基。
144.培养条件:250ml三角瓶,装液量50ml,培养温度28℃,摇床转速220r/min,培养时间48小时。
145.(4)二级种子培养:
146.二级种子培养基:葡萄糖100.0g/l,蛋白胨10.0g/l,kh2po
4 1.0g/l,mgso4·
7h2o 1.0g/l。使用3m氢氧化钠或磷酸调节ph至6.5。
147.接种:按照10%的接种量,将一级种子液接入二级种子培养基。
148.培养条件:250ml三角瓶,装液量50ml,培养温度28℃,摇床转速220r/min,培养时间30小时。
149.(5)发酵培养:
150.发酵培养基:葡萄糖108.0g/l,l-蛋氨酸0.5g/l,啤酒酵母3.3g/l,feso4·
7h2o 0.2g/l,mnso4·
h2o 0.1g/l,znso4·
7h2o 2.5g/l,caso4·
2h2o 0.3g/l。无机盐溶液配方:kh2po43.0g/l,mgso4·
7h2o 2.0g/l。无机盐溶液单独灭菌,之后和基础料培养基溶液混合。
151.接种:按照15%的接种量,将二级种子液接发酵培养基。
152.培养条件:250ml三角瓶,装液量50ml,培养温度28℃,摇床转速220r/min,培养时间180小时。
153.实施例7和对比例1的mpab基因的过表达和发酵产量分别如图2~3所示。实施例7中工程菌株发酵过程中的生物量变化、ph变化、还原糖变化结构分别如图4~6所示。
154.本发明并不局限于上述实施例,而是覆盖在不脱离本发明的精神和范围的情况下所进行的所有改变和修改。这些改变和修改不应被认为是脱离了本发明的精神和范围,并且所有诸如对于本领域技术人员来说显而易见的修改均应被包括在所附权利要求的范围内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。