1.本发明涉及新化合物合成领域,具体涉及一种非共轭苯胺桥连四苯乙烯的供体-受体斯坦豪斯加合物及其制备方法和应用。
背景技术:
2.分子开关是构建光敏材料的重要组成部分之一。它们通常含有可以吸收光能的有机官能团。在不同波长的光的激发下,光致变色分子可以可逆地从一种状态转换为另一种状态。与温度、ph、氧化还原等其他刺激相比,光可以实现跨空间控制,具有独特的优势。donor-acceptor stenhouse adducts(dasas)化合物是一种新型的可见光光致变色化合物。这种分子在不同光照条件下可以在环形和线形之间自由切换,伴随着分子大小和极性的变化。在可见光照射下,分子会发生从有色线形到无色环形的异构化,并在黑暗中自发回到初始结构。自2014年发展至今,dasas衍生物已广泛应用于光响应开关、记忆材料、聚合物凝胶以及药物释放等领域。其中光致变色荧光材料引起了越来越多的关注,但是荧光材料的明显缺点是固态或聚集态会受到聚集荧光猝灭效应(aggregation-caused quenching,acq)的影响。为了克服这一缺点,唐本忠院士开发的聚集诱导荧光发射(aggregation-induced emission,aie)荧光分子很好地解决了荧光材料的缺陷。
3.大部分控制aie荧光基团特性是在紫外光下实现的。紫外光能量大对材料和生物系统都会产生不可逆的损伤。专利《一种具有光致变色和荧光的有机凝胶的制备方法》利用光致变色分子二噻吩乙烯和具有荧光特性的有机凝胶结合,需要254nm紫外光和可见光两个条件才能实现可逆的转变,实现了紫外光下的荧光强度控制。但其不足之处在于:
①
紫外光激发,高能量光线伤害大;
②
荧光强度弱,没有强荧光基团,控制荧光强度效果不明显;
③
应用性差,应用于信息存储效果不好。而dasas光致变色分子是在可见光区就能实现的光致变色。因此将aie基团引入dasas分子中,合成出能控制aie荧光特性的dasas衍生物具有重要的现实意义。
技术实现要素:
4.针对现有光致变色材料的上述缺陷,本发明的目的在于提供一种非共轭苯胺桥连四苯乙烯的供体-受体斯坦豪斯加合物,克服了传统荧光分子开关对紫外光的依赖,实现了可见光控制的荧光开启和关闭,同时展示了优异的光致变色性能,具有应用于信息存储领域的潜力。
5.为了实现上述目的,本发明采用如下技术方案:
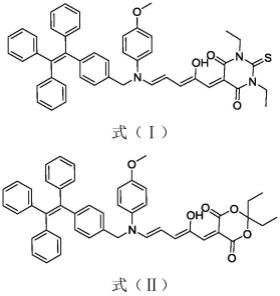
6.一种非共轭苯胺桥连四苯乙烯的供体-受体斯坦豪斯加合物(donor-acceptor stenhouse adducts,dasas),具有如下式(ⅰ)和式(ⅱ)的任意一项结构式:
[0007][0008]
一种非共轭苯胺桥连四苯乙烯的供体-受体斯坦豪斯加合物的制备方法,包括如下步骤:
[0009]
(1)3-溴苯乙烯和4-甲酰苯硼酸在弱碱性、无氧条件以及四(三苯基膦)钯的催化作用下发生suzuki偶联反应得到4-(1,2,2-三苯基乙烯基)苯甲醛;
[0010]
(2)然后4-(1,2,2-三苯基乙烯基)苯甲醛和对氨基苯甲醚发生席夫碱反应生成n-(4-甲氧基苯基)-1-(4-(1,2,2-三苯基乙烯基)苯基)甲亚胺;
[0011]
(3)接着在硼氢化钠的作用下n-(4-甲氧基苯基)-1-(4-(1,2,2-三苯基乙烯基)苯基)甲亚胺发生还原反应生成另一个中间体化合物4-甲氧基-n-(4-(1,2,2-三苯基乙烯基)苄基)苯胺;
[0012]
(4)最后在室温的条件下,4-甲氧基-n-(4-(1,2,2-三苯基乙烯基)苄基)苯胺发生缩合反应得到所述非共轭苯胺桥连四苯乙烯的供体-受体斯坦豪斯加合物。
[0013]
进一步地,4-(1,2,2-三苯基乙烯基)苯甲醛的结构式如下所示:
[0014][0015]
进一步地,n-(4-甲氧基苯基)-1-(4-(1,2,2-三苯基乙烯基)苯基)甲亚胺的结构式如下所示:
[0016][0017]
进一步地,4-甲氧基-n-(4-(1,2,2-三苯基乙烯基)苄基)苯胺的结构式如下所示:
[0018][0019]
进一步地,步骤(1)所述3-溴苯乙烯和4-甲酰苯硼酸的摩尔量之比为1:(1-2)。
[0020]
进一步地,步骤(1)所述3-溴苯乙烯和四(三苯基膦)钯的摩尔量之比为1:(0.1-0.2)。
[0021]
进一步地,步骤(1)所述suzuki偶联反应的温度为70-80℃;时间为12-24h。
[0022]
进一步地,步骤(2)所述4-(1,2,2-三苯基乙烯基)苯甲醛和对氨基苯甲醚的摩尔量之比为1:(1-1.5)。
[0023]
进一步地,步骤(2)所述席夫碱反应的温度为60-70℃;时间为8-12h。
[0024]
进一步地,步骤(3)所述硼氢化钠和n-(4-甲氧基苯基)-1-(4-(1,2,2-三苯基乙烯基)苯基)甲亚胺的摩尔量之比为1:(0.1-0.5)。
[0025]
进一步地,步骤(3)所述还原反应的温度为0-20℃;时间为8-10h。
[0026]
进一步地,步骤(4)中,4-甲氧基-n-(4-(1,2,2-三苯基乙烯基)苄基)苯胺与化合物a1或化合物a2进行缩合反应;化合物a1、a2的结构式如下:
[0027][0028]
本发明采用以下反应路线:
[0029][0030]
本发明提供上述一种非共轭苯胺桥连四苯乙烯的供体-受体斯坦豪斯加合物dasas在光致变色材料中的应用。
[0031]
本发明提供的一种非共轭苯胺桥连四苯乙烯的供体-受体斯坦豪斯加合物dasas不仅能够在溶液和薄膜状态下均能实现可逆的可见光的光致变色,而且能够实现对荧光的关闭与开启。
[0032]
本发明成功合成具有典型aie基团的dasas化合物,目标化合物具有可见光光致变色性能,以及可见光荧光调控能力,掺杂聚甲基丙烯酸甲酯薄膜(polymethyl methacrylate,pmma)的固态条件下,所制备的材料具有光致变色性能,具有成为光驱动器件、光开关和表面涂层等方面的潜能。
[0033]
与现有技术相比,本发明的优点和有益效果如下:
[0034]
(1)本发明克服了传统荧光分子开关对紫外光的依赖,是一种荧光信号在可见光调控下进行切换的新思路。
[0035]
(2)本发明提供的非共轭苯胺桥连四苯乙烯的供体-受体斯坦豪斯加合物dasas的制备方法具有合成方法简便、产率高等优势。
[0036]
(3)本发明提供的非共轭苯胺桥连四苯乙烯的供体-受体斯坦豪斯加合物dasas不仅能够在溶液和薄膜状态下实现可见光对荧光的关闭与开启,而且在固态下能够实现可见光调控的荧光信号的切换。
[0037]
(4)本发明提供的非共轭苯胺桥连四苯乙烯的供体-受体斯坦豪斯加合物dasas光响应速率快,在60秒内就可达到光稳态。
[0038]
(5)本发明提供的非共轭苯胺桥连四苯乙烯的供体-受体斯坦豪斯加合物dasas抗疲劳性能强,经过5次以上循环后仍能保证优异的光致变色性能。
[0039]
(6)本发明提供的非共轭苯胺桥连四苯乙烯的供体-受体斯坦豪斯加合物dasas在固态薄膜下,可见光可使其褪色,可应用于光信息加密等领域。
附图说明
[0040]
图1为式(ⅰ)所示化合物甲苯(20μm)溶液在620nm光照下的紫外-可见吸收图谱变化情况和式(ⅱ)所示化合物甲苯(20μm)溶液在560nm光照下的紫外-可见吸收图谱变化情况。
[0041]
图2为式(ⅰ)和式(ⅱ)所示化合物在可见光和黑暗条件下的抗疲劳性测试结果。
[0042]
图3为式(ⅰ)和式(ⅱ)所示化合物的最大吸收值随光照时间变化的归一化拟合曲线。
[0043]
图4为4-甲氧基-n-(4-(1,2,2-三苯基乙烯基)苄基)苯胺不同水含量h2o/thf混合溶液(1.0
×
10-4
m)的荧光发射光谱及其不同水含量h2o/thf混合溶液的最大发射波长荧光强度。
[0044]
图5为式(ⅱ)所示化合物60%水含量thf溶液(1.0
×
10-4
m)在560nm光照射下的紫外-可见光图谱变化情况及其相应的荧光光谱变化情况。
[0045]
图6为式(ⅰ)和式(ⅱ)所示化合物掺杂pmma的薄膜信息存储示意图。
具体实施方式
[0046]
在本文中所披露的范围的端点和任何值都不限于该精确的范围或值,这些范围或值应当理解为包含接近这些范围或值的值。对于数值范围来说,各个范围的端点值之间、各
个范围的端点值和单独的点值之间,以及单独的点值之间可以彼此组合而得到一个或多个新的数值范围,这些数值范围应被视为在本文中具体公开。
[0047]
以下示例性地提供式化合物的优选的制备方法,本领域技术人员不应理解为对本发明的限制。
[0048]
现有的已知化合物a1、a2的合成路线与制备方法如下:
[0049][0050]
制备化合物a1:
[0051]
将1,3-二乙基-2-硫代巴比妥酸(2.00g,10.0mmol)和糠醛(830μl,10.0mmol)依次添加到30ml h2o中在70℃搅拌2.5小时。在反应完成后(通过tlc监测),通过真空过滤收集形成的黄色沉淀并用冷h2o洗涤两次。将所得固体溶解在二氯甲烷(75ml)中并依次用30ml饱和氯化钠溶液、30ml饱和碳酸氢钠溶液、30ml h2o洗涤。用mgso4干燥除去水后,过滤将固体分离,取其滤液减压浓缩,得到2.50g亮黄色粉末a1,产率为90%。
[0052]1h nmr(400mhz,chloroform-d)δ8.64(d,j=3.8hz,1h),8.37(s,1h),7.82(dd,j=1.6hz,1h),6.69(ddd,j=3.8hz,1.6hz,0.8hz,1h),4.50(qd,j=7.0,3.7hz,4h),1.24(td,j=7.0,5.3hz,6h).
[0053]
制备化合物a2:
[0054]
在150ml的圆底烧瓶中,依次加入(3.000g,28.9mmol),乙酸酐(3.533g,34.6mmol)和浓硫酸(0.1ml),混合物在室温下搅拌1小时后,加入3-戊酮(2.482g,28.9mmol),继续反应3小时。萃取三次操作后,合并有机相,以石油醚为洗脱剂通过柱层析纯化,得到白色油状产物。加入上述生成物、糠醛(1.214g,12.6mmol)和水(50ml)到圆底烧瓶中,室温下搅拌3小时后,产生大量沉淀。过滤沉淀,萃取后以石油醚/乙酸乙酯(10/1,v/v)为洗脱剂经过柱层析纯化,得到1.692g黄色粉末,产率为62%。
[0055]1h nmr(400mhz,chloroform-d)δ8.48(d,j=3.8hz,1h),8.36(s,1h),7.84(d,j=1.6hz,1h),6.75(dd,j=4.0,1.7hz,1h),1.99(d,j=7.4hz,4h),1.05(t,j=7.4hz,6h).
[0056]
实施例1
[0057]
(1)制备4-(1,2,2-三苯基乙烯基)苯甲醛
[0058]
取250ml的三口烧瓶,在氮气的保护下,将3-溴苯乙烯(3.340g,10mmol),4-甲酰苯硼酸(1.500g,10mmol),碳酸钾(4.150g,30mmol),四(三苯基膦)钯(0.100g,0.1mmol)和四氢呋喃80ml依次加入到三口烧瓶中,升温到70℃,回流反应12小时,反应过程tcl监测(石油醚:乙酸乙酯=20:1,v/v)。反应完成后,停止加热,混合物冷却至室温,减压旋转蒸发除去溶剂。加入40ml二氯甲烷,依次用水(30ml)、饱和氯化钠溶液(30ml)萃取三次。合并有机层,无水硫酸镁干燥除去水。而后过滤去除硫酸镁固体后,旋转蒸发除去二氯甲烷,用硅胶柱层析纯化混合物,洗脱剂为石油醚/乙酸乙酯(25:1,v/v)。最后得到黄色固体2.640g,产率为
71.9%。
[0059]
1h nmr(400mhz,chloroform-d)δ9.90(s,1h),7.61(d,j=8.3hz,2h),7.19(d,j=8.2hz,2h),7.12(dt,j=5.7,2.9hz,9h),7.02(ddt,j=6.8,5.5,2.7hz,6h).
[0060]
(2)制备n-(4-甲氧基苯基)-1-(4-(1,2,2-三苯基乙烯基)苯基)甲亚胺
[0061]
取100ml的两口圆底烧瓶,在氮气的保护下加入4-(1,2,2-三苯基乙烯基)苯甲醛(1.808g,5mmol),对氨基苯甲醚(0.615g,5mmol)和60ml甲醇,60℃下回流反应8小时,产生大量白色沉淀。反应完成后,停止加热。混合物过滤,冷乙醇洗涤三次。真空干燥后得到白色固体粉末2.140g,产率为92%。
[0062]1h nmr(400mhz,chloroform-d)δ8.38(s,1h),7.63(d,j=8.1hz,2h),7.19(d,j=8.8hz,2h),7.17
–
7.09(m,11h),7.09
–
6.99(m,6h),6.92(d,j=8.8hz,2h),3.83(s,3h).
[0063]
(3)制备4-甲氧基-n-(4-(1,2,2-三苯基乙烯基)苄基)苯胺
[0064]
在100ml两口圆底烧瓶中,加入n-(4-甲氧基苯基)-1-(4-(1,2,2-三苯基乙烯基)苯基)甲亚胺(1.000g,2.150mmol),50ml四氢呋喃/甲醇(1/1,v/v)。常温下搅拌充分溶解后,在0℃条件下分批次加入硼氢化钠(0.713g,21.50mmol),tcl监测反应的进行,反应后8小时后停止反应。减压旋转蒸发除去溶剂,浓缩液用60ml二氯甲烷溶解,依次用60ml水、60ml饱和氯化钠萃取三次。合并有机层,无水硫酸镁干燥。过滤,旋转蒸发除去溶剂。最后得到0.954g白色固体,产率为95%。
[0065]1h nmr(400mhz,chloroform-d)δ7.14
–
7.06(m,12h),7.05
–
7.00(m,7h),6.99(s,1h),6.77(d,j=8.9hz,2h),6.58(d,j=8.9hz,2h),4.18(s,2h),3.75(s,3h).
[0066]
实施例2
[0067]
(1)制备4-(1,2,2-三苯基乙烯基)苯甲醛
[0068]
取250ml的三口烧瓶,在氮气的保护下,将3-溴苯乙烯(3.340g,10mmol),4-甲酰苯硼酸(3.000g,20mmol),碳酸钾(4.150g,30mmol),四(三苯基膦)钯(0.200g,0.2mmol)和四氢呋喃80ml依次加入到三口烧瓶中,升温到80℃,回流反应24小时,反应过程tcl监测(石油醚:乙酸乙酯=20:1,v/v)。反应完成后,停止加热,混合物冷却至室温,减压旋转蒸发除去溶剂。加入40ml二氯甲烷,依次用水(30ml)、饱和氯化钠溶液(30ml)萃取三次。合并有机层,无水硫酸镁干燥除去水。而后过滤去除硫酸镁固体后,旋转蒸发除去二氯甲烷,用硅胶柱层析纯化混合物,洗脱剂为石油醚/乙酸乙酯(25:1,v/v)。最后得到黄色固体2.933g,产率为79.9%。
[0069]
(2)制备n-(4-甲氧基苯基)-1-(4-(1,2,2-三苯基乙烯基)苯基)甲亚胺
[0070]
取100ml的两口圆底烧瓶,在氮气的保护下加入4-(1,2,2-三苯基乙烯基)苯甲醛(1.808g,5mmol),对氨基苯甲醚(0.923g,7.5mmol)和60ml甲醇,70℃下回流反应12小时,产生大量白色沉淀。反应完成后,停止加热。混合物过滤,冷乙醇洗涤三次。真空干燥后得到白色固体粉末2.093g,产率为92%。
[0071]
(3)制备4-甲氧基-n-(4-(1,2,2-三苯基乙烯基)苄基)苯胺
[0072]
在100ml两口圆底烧瓶中,加入n-(4-甲氧基苯基)-1-(4-(1,2,2-三苯基乙烯基)苯基)甲亚胺(1.000g,2.150mmol),50ml四氢呋喃/甲醇(1/1,v/v)。常温下搅拌充分溶解后,在20℃条件下分批次加入硼氢化钠(0.143g,4.300mmol),tcl监测反应的进行,反应后10小时后停止反应。减压旋转蒸发除去溶剂,浓缩液用60ml二氯甲烷溶解,依次用60ml水、
60ml饱和氯化钠萃取三次。合并有机层,无水硫酸镁干燥。过滤,旋转蒸发除去溶剂。最后得到0.894g白色固体,产率为89%。
[0073]
实施例3
[0074]
(1)制备4-(1,2,2-三苯基乙烯基)苯甲醛
[0075]
取250ml的三口烧瓶,在氮气的保护下,将3-溴苯乙烯(3.340g,10mmol),4-甲酰苯硼酸(2.250g,15mmol),碳酸钾(4.150g,30mmol),四(三苯基膦)钯(0.150g,0.15mmol)和四氢呋喃80ml依次加入到三口烧瓶中,升温到75℃,回流反应18小时,反应过程tcl监测(石油醚:乙酸乙酯=20:1,v/v)。反应完成后,停止加热,混合物冷却至室温,减压旋转蒸发除去溶剂。加入40ml二氯甲烷,依次用水(30ml)、饱和氯化钠溶液(30ml)萃取三次。合并有机层,无水硫酸镁干燥除去水。而后过滤去除硫酸镁固体后,旋转蒸发除去二氯甲烷,用硅胶柱层析纯化混合物,洗脱剂为石油醚/乙酸乙酯(25:1,v/v)。最后得到黄色固体2.750g,产率为75%。
[0076]
(2)制备n-(4-甲氧基苯基)-1-(4-(1,2,2-三苯基乙烯基)苯基)甲亚胺
[0077]
取100ml的两口圆底烧瓶,在氮气的保护下加入4-(1,2,2-三苯基乙烯基)苯甲醛(1.808g,5mmol),对氨基苯甲醚(0.769g,6.25mmol)和60ml甲醇,65℃下回流反应10小时,产生大量白色沉淀。反应完成后,停止加热。混合物过滤,冷乙醇洗涤三次。真空干燥后得到白色固体粉末2.047g,产率为92%。
[0078]
(3)制备4-甲氧基-n-(4-(1,2,2-三苯基乙烯基)苄基)苯胺
[0079]
在100ml两口圆底烧瓶中,加入n-(4-甲氧基苯基)-1-(4-(1,2,2-三苯基乙烯基)苯基)甲亚胺(1.000g,2.150mmol),50ml四氢呋喃/甲醇(1/1,v/v)。常温下搅拌充分溶解后,在10℃条件下分批次加入硼氢化钠(0.429g,4.300mmol),tcl监测反应的进行,反应后9小时后停止反应。减压旋转蒸发除去溶剂,浓缩液用60ml二氯甲烷溶解,依次用60ml水、60ml饱和氯化钠萃取三次。合并有机层,无水硫酸镁干燥。过滤,旋转蒸发除去溶剂。最后得到0.934g白色固体,产率为93%。
[0080]
实施例4
[0081]
制备非共轭苯胺桥连四苯乙烯的供体-受体斯坦豪斯加合物dasas,目标产物为式(ⅰ)所示化合物,具体步骤如下:
[0082]
无水无氧和避光的条件下,在25ml两口圆底烧瓶中,4-甲氧基-n-(4-(1,2,2-三苯基乙烯基)苄基)苯胺(0.215g,0.3mmol)溶解于5ml的四氢呋喃中,加入化合物a1(0.083g,0.3mmol),室温条件下反应6小时,反应完成后,加入15ml正己烷继续搅拌。放入冰箱冷却,析出大量沉淀。过滤,正己烷洗涤多次。最后干燥得到蓝色固体0.093g,产率为42%。
[0083]1h nmr(400mhz,chloroform-d)δ12.55(s,1h),7.19(s,1h),7.15
–
6.93(m,23h),6.77(d,j=8.9hz,1h),6.58(d,j=8.9hz,1h),4.56(s,3h),3.84(s,2h),3.75(s,2h),2.83(s,3h),1.26(s,6h).
[0084]
实施例5
[0085]
制备非共轭苯胺桥连四苯乙烯的供体-受体斯坦豪斯加合物dasas,目标产物为式(ⅱ)所示化合物,具体步骤如下:
[0086]
无水无氧和避光的条件下,在25ml两口圆底烧瓶中,4-甲氧基-n-(4-(1,2,2-三苯基乙烯基)苄基)苯胺(0.215g,0.3mmol)溶解于5ml的二氯甲烷中,加入化合物a2(0.075g,
0.3mmol),室温条件下反应12小时,反应完成后,加入15ml正己烷继续搅拌。放入冰箱冷却,析出大量沉淀。过滤,正己烷洗涤多次。最后干燥得到紫红色固体0.121g,产率为56%。
[0087]1h nmr(400mhz,chloroform-d)δ11.28(s,1h),7.61(d,j=4.9hz,1h),7.11
–
6.97(m,23h),6.63(d,j=12.2hz,1h),6.32(d,j=3.5hz,1h),5.29(s,1h),3.83(s,2h),3.74(s,2h),1.98
–
1.87(m,3h),1.26(s,2h),1.07
–
0.96(m,6h).
[0088]
测试例1:式(ⅰ)和式(ⅱ)所示化合物的光致变色性能
[0089]
方法:分别配制式(ⅰ)和式(ⅱ)所示化合物浓度为20μm的甲苯溶液,记录在可见光激发下的紫外-可见吸收光谱。
[0090]
结果:式(ⅰ)和式(ⅱ)所示化合物都具有优异的光致变色性能,如图1所示。其中,图1中的(a)为式(ⅰ)所示化合物甲苯(20μm)溶液在620nm光照下的紫外-可见吸收图谱变化情况;图1中的(b)为式(ⅱ)所示化合物的甲苯(20μm)溶液在560nm光照下的紫外-可见吸收图谱变化情况。在可见光照射前,光谱中的式(ⅰ)和式(ⅱ)所示化合物在波长段550nm-700nm范围内都出现了最大的吸收峰,并且分别显现强烈的蓝色和紫红色的颜色状态。对应于开环态dasas分子,共轭三烯结构的吸收峰。如620nm可见光照射下,式(ⅰ)所示化合物的最大吸收峰强度随着照射时间的增加不断减弱,最终到达光稳态,溶液的紫色变为接近无色的状态。同样地,在可见光照射下,式(ⅰ)和式(ⅱ)所示化合物均出现了最大吸收峰强度的下降,一段时间后达到光稳态。避光黑暗下,两种化合物也能从光稳态回复到初始状态。可见两种目标化合物在溶液中都有优异的光致变色性能,光响应速度快,并伴随显著的颜色变化。由强烈着色的开环态共轭三烯式到无色的闭环态环戊酮式结构变化相应的体现在紫外-可见吸收光谱。式(ⅰ)所示化合物和式(ⅱ)所示化合物相比较,吸收波长红移到620nm,说明改变受体能显著地影响材料的光致变色性能。
[0091]
测试例2:式(ⅰ)和式(ⅱ)所示化合物的抗疲劳性能
[0092]
方法:分别配制式(ⅰ)和式(ⅱ)所示化合物浓度20μm的甲苯溶液,以最大吸收峰对应的波长为吸光度进行可见光/黑暗多次可逆循环抗疲劳实验。
[0093]
结果:如图2中的(a)所示,620nm可见光照射下,吸光度数值下降;黑暗下放置,吸光度数值逐渐回复,式(ⅰ)所示化合物经过6次循环后,吸光度保持在原吸光度数值的98%;对式(ⅱ)所示化合物进行560nm可见光照射和黑暗交替测试,如图2中的(b)所示,进行循环5次之后,吸光度衰减值在2%以内。实验结果证明,式(ⅰ)和式(ⅱ)所示化合物在经过可见光/黑暗下可逆的一定循环次数后,仍具有可逆性和稳定性,说明本发明合成的非共轭苯胺桥连四苯乙烯的供体-受体斯坦豪斯加合物dasas具有优异的抗疲劳性能。
[0094]
测试例3:式(ⅰ)和式(ⅱ)所示化合物的响应速率比较
[0095]
方法:首先选择式(ⅰ)和式(ⅱ)所示化合物,以甲苯作为溶剂,测试两种化合物在各自最大吸收峰吸光度随光照时间的变化谱图。
[0096]
dasas在开环态吸收特定波长的可见光,在可见光激发后结构变换为闭环态,无可见光吸收强度。对最大吸收峰的峰强度分析有助于研究开环态至闭环态的异构化程度。根据数据分析处理后,dasas分子开环态共轭三烯结构转变为闭环态的环戊酮过程的满足了一阶动力学公式:
[0097]
[0098]
式中,a为dasas最大吸收峰吸光度,a0为初始吸光度,a1为影响系数,t为可见光照射时间,t0为开环态至闭环态的光稳态时间。
[0099]
结果:如图3中的(a)所示,式(ⅰ)所示化合物从共轭三烯开环态至环戊酮闭环态达到光稳态的时间最短,只要57.3s。更慢到达平衡的式(ⅱ)所示化合物需要126.2s,如图3中的(b)所示。这是因为硫代巴比妥酸受体在推拉电子效应上比式(ⅱ)所示化合物受体更强,因此在光激发dasas异构化的过程中,更易进行闭环态的转化,在时间上就表现得更加快速得达到稳态。从这两种化合物都到达光稳态的闭环率来看,式(ⅰ)所示化合物的闭环率高达98%,式(ⅱ)所示化合物的闭环率较低为90%。
[0100]
测试例4:式(ⅱ)所示化合物的荧光调控性能
[0101]
与活化的呋喃加合物反应前,4-甲氧基-n-(4-(1,2,2-三苯基乙烯基)苄基)苯胺是aie活性分子。通过荧光发射光谱研究了其在溶液状态和聚集状态下的aie性能。选择四氢呋喃作为有机溶剂,水作为不良溶剂。在向4-甲氧基-n-(4-(1,2,2-三苯基乙烯基)苄基)苯胺的thf溶液中加入水会降低它的溶解度,这会使4-甲氧基-n-(4-(1,2,2-三苯基乙烯基)苄基)苯胺趋向于形成聚集体的悬浮液并诱导荧光发射,如图4所示。其中,图4中的(a)为4-甲氧基-n-(4-(1,2,2-三苯基乙烯基)苄基)苯胺不同水含量h2o/thf混合溶液(1.0
×
10-4
m)的荧光发射光谱;图4中的(b)为4-甲氧基-n-(4-(1,2,2-三苯基乙烯基)苄基)苯胺不同水含量h2o/thf混合溶液的最大发射波长荧光强度。可以看出:含水量0%-40%之间,荧光发射强度在475nm处几乎平行于横坐标;含水量分数到达60%时,荧光发射强度在475nm处最大,继续提高含水量,荧光强度略有下降。结果验证了4-甲氧基-n-(4-(1,2,2-三苯基乙烯基)苄基)苯胺在不同水含量的混合溶剂中具有典型的aie特性,强荧光发射可以归因于分子内旋转的限制。
[0102]
开放形式的式(ⅱ)所示化合物在可见光560nm照射前是弱荧光的,式(ⅱ)所示化合物线性开放形式的荧光淬灭机制可能归因于荧光共振能量转移(fret)。供体四苯乙烯部分的激发态能量转移到受体的dasas部分,其导致的结果是线性共轭三烯和受体结构具有很强的荧光抑制能力。经560nm可见光照射后,开环形式逐渐转变为闭环态的环戊烯酮,其光响应变化体现在紫外-可见光谱,如图5所示。其中,图5中的(a)为式(ⅱ)所示化合物60%水含量thf溶液(1.0
×
10-4
m)在560nm光照射下的紫外-可见光图谱变化情况;图5中的(b)为式(ⅱ)所示化合物相应的荧光光谱变化情况。相对应的荧光强度从开环形式的弱发射转变为增强的荧光发射。fret过程由于dasas结构的变化受到阻碍,从而aie基团的荧光发射增强,在400nm出现发射峰。可以看出式(ⅱ)所示化合物具备有一定的荧光控制能力,在荧光材料应用方面有一定的潜力。
[0103]
应用例1:可见光信息存储应用
[0104]
方法:式(ⅰ)和式(ⅱ)所示化合物(1%wt)掺杂在pmma薄膜应用于信息存储以研究其在实际中的效果。
[0105]
如图6中的(a)所示,镂空的“皇冠”在620nm的可见光照射下,蓝色褪去变为无色,而薄膜上其他未被光照射的部分仍然为蓝色,一个明显的“皇冠”出现在薄膜上。用同样的方法,光源选择为560nm的可见光,如图6中的(b)所示,式(ⅱ)所示化合物的pmma薄膜被印上了一个“蜘蛛”图案。在避光条件下加热薄膜,式(ⅰ)所示化合物和式(ⅱ)所示化合物上的图案逐渐消失,最终恢复到初始状态。表明式(ⅰ)和式(ⅱ)所示化合物这两种光致变色材料
能作为光信息存储的简要模板,其光致变色性能存在一定的应用性。
[0106]
以上详细描述了本发明的较优实施方式,但是,本发明并不限于此。在本发明的技术构思范围内,可以对本发明的技术方案进行多种简单变型,包括各个技术特征以任何其它的合适方式进行组合,这些简单变形和组合同样应当视为本发明所公开的内容,均属于本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
