protein in klebsiella planticola owing to induced secretion into the culture medium)、角质酶(重组thermobifida fusca角质酶的高效胞外表达及其分子机制)、外膜蛋白ompf(excretion of human-endorphin into culture medium by using outer membrane protein f as a fusion partner in recombinant escherichia coli)等通过共表达或融合蛋白可促进外源蛋白分泌至发酵液上清。lpp'-ompa'(display of beta-lactamase on the escherichia coli surface:outer membrane phenotypes conferred by lpp'-ompa'-beta-lactamase fusions)可将融合蛋白定位到外膜表面,少量可以渗漏到胞外。
8.胞外分泌使用的分子伴侣多数为促裂解蛋白或外膜蛋白,促裂解蛋白大量表达加速细菌裂解死亡,从而释放融合蛋白到胞外,但细胞密度难以积累。外膜蛋白定位到细胞外膜,大量表达会有部分分泌到胞外。尽管对大肠杆菌生长影响小,但分子量较大(多数在20kda以上),融合蛋白中目的蛋白占比低,造成产量偏低;且大分子量的分子伴侣由于序列更长,酶切分离目的基因时错切概率增加,会产生更多杂质;另外更长的序列也会形成更复杂的空间结构,容易与目的蛋白发生共价结合,封闭酶切位点,增加分离难度。
技术实现要素:
9.本发明的首要目的在于克服现有技术的缺点与不足,提供lpp或其突变体作为分子伴侣在大肠杆菌中分泌表达重组蛋白的应用。
10.本发明的另一目的在于提供一种用于大肠杆菌分泌表达的融合蛋白,所述融合蛋白由分子伴侣、连接肽、目的蛋白依次连接组成,所述分子伴侣为lpp或其突变体。
11.本发明的再一目的在于提供一种大肠杆菌分泌表达融合蛋白的方法,该方法使用大肠杆菌lpp蛋白或其突变体作为分子伴侣,在大肠杆菌中分泌表达外源蛋白。相比传统的全固相合成,步骤简单,成本更低,环保压力更小。相比目前国内常用的大肠杆菌胞内可溶表达和包涵体表达方式,本发明表达的融合蛋白可直接分泌到胞外培养基,下游纯化步骤少,产量高。相比诺和诺德酿酒酵母表达方式,本发明使用的大肠杆菌生长快,发酵周期短,生产成本更低。
12.本发明的目的通过下述技术方案实现:lpp或其突变体作为分子伴侣在大肠杆菌中分泌表达重组蛋白的应用,是基于本发明发明人意外发现lpp作为目的蛋白的分子伴侣,有利于包含分子伴侣和目的蛋白的重组蛋白的分泌表达,产量高,且对大肠杆菌菌体生长的影响小,无显著的菌体裂解情况,易于实现高密度发酵,便于工业化生产。
13.所述的lpp为脂质蛋白,其氨基酸序列如下所示:
14.mkatklvlgavilgstllagcssnakidqlssdvqtlnakvdqlsndvnamrsdvqaakddaaranqrldnmatkyrk。
15.所述的重组蛋白的结构如下:a-b-c;其中,
16.a为分子伴侣,主要作用是减少目的蛋白降解,协助目的蛋白转运到周质空间,进而分泌到胞外;选自lpp或mlpp,m表示突变体;
17.b为缺失或用于蛋白酶识别的连接肽;缺失表示不存在,即重组蛋白的结构为a-c;连接肽的主要作用是提供蛋白酶识别位点,以便分子伴侣和目的基因的分离,优选ddddk;
18.c为目的蛋白,优选长度为20~50个氨基酸的目的蛋白;更优选长度为27~31个氨
基酸的目的蛋白。
19.一种用于大肠杆菌分泌表达的融合蛋白,是基于上述应用设计得到,其结构式如下:a-b-c;其中,
20.a为分子伴侣,选自lpp或mlpp,m表示突变体;
21.b为缺失或用于蛋白酶识别的连接肽,优选为ddddk;
22.c为目的蛋白,优选长度为20~50个氨基酸的目的蛋白;更优选长度为27~31个氨基酸的目的蛋白;包括但不限于glp-1或其类似物、胰岛素类、蛋白酶类,优选为glp-1或其类似物,包括但不限于glp-1(7-37)、glp-1(9-37)或glp-1(11-37)。
23.一种大肠杆菌分泌表达融合蛋白的方法,包括以下步骤:
24.(1)获得编码上述用于大肠杆菌分泌表达的融合蛋白的融合基因,将上述融合基因构建到表达载体,得到重组载体;
25.(2)将重组载体转化宿主细胞;
26.(3)将含有重组载体的宿主细胞发酵、纯化,获得融合蛋白。
27.所述的大肠杆菌分泌表达融合蛋白的方法,还包括以下步骤:
28.(4)对得到的融合蛋白进行脂肪酸侧链修饰;
29.(5)蛋白酶酶切脂肪酸侧链修饰后的融合蛋白的连接肽,获得侧链修饰的融合蛋白;
30.(6)如有必要,对侧链修饰的融合蛋白进行转肽,连接另外一段多肽。
31.步骤(1)中所述的融合基因可通过直接合成法获得,或是通过片段拼接得到。
32.步骤(1)中所述的表达载体可选自大肠杆菌常用载体或将tac启动子替换pet载体中的t7启动子得到的载体。
33.所述的pet载体是pet系列表达载体;优选为pet-28a( )载体。
34.步骤(2)中所述的宿主细胞为野生型或改造型大肠杆菌,如大肠杆菌bl21(de3)或其改造菌、大肠杆菌w3110或其改造菌。
35.步骤(3)中所述的发酵优选为在发酵后期添加诱导剂,诱导表达。
36.所述的诱导剂优选为iptg。
37.步骤(4)中所述的脂肪酸侧链修饰优选为使用利拉鲁肽或索玛鲁肽脂肪酸酰化剂进行修饰。
38.步骤(5)中所述的蛋白酶优选为肠激酶、胰蛋白酶和赖氨酰内切酶中的至少一种。
39.本发明相对于现有技术具有如下的优点及效果:
40.1、本发明使用商业化大肠杆菌作为宿主菌,生长快速,产量高,发酵密度高。重组蛋白的表达形式为分泌到胞外培养基,无需破碎细胞,直接纯化发酵液上清即可,纯度更高,工艺更简单。相比全固相合成,更加经济环保;相比大肠杆菌胞内可溶或包涵体表达,无需破碎细胞。对宿主菌要求低,直接使用商业化菌株即可,免去繁琐的菌种突变及筛选操作。
41.2、本发明使用lpp作为分子伴侣,利用其高度可溶性和高转录表达,可以增加glp-1及其类似物受体激动剂对蛋白酶的抵抗能力,从而增加产量;lpp可以定位到周质空间,协助目的蛋白转运;lpp等电点和glp-1及其类似物相差较大,空间构象上与lpp可以紧密结合;lpp分子量小,glp-1及其类似物受体激动剂占比高,进一步增加glp-1及其类似物的产
量,lpp融合蛋白对大肠杆菌菌体生长的影响小,无显著的菌体裂解情况。lpp内部碱性氨基酸少,可以使用常规的胰蛋白酶,赖氨酰内切酶,肠激酶等切割分离分子伴侣和目的蛋白,产生的杂质更少,便于纯化。重组蛋白为分泌性表达,对宿主菌体生长影响较小,易于实现高密度发酵,便于工业化生产。
附图说明
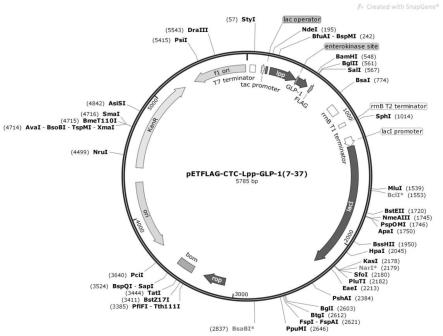
42.图1是petflag-ctc-lpp-glp-1(7-37)质粒图谱图。
43.图2是lpp-arg34-glp-l(7-37)融合蛋白的sds-page图;其中,泳道m为蛋白marker,至上而下的分子量(kda)为40、25、15、10、4.6、1.7;泳道1为w3110/petflag-ctc-lpp-glp-1诱导0h的发酵液上清;泳道2为w3110/petflag-ctc-lpp-glp-1诱导0h的细胞破碎上清;泳道3为w3110/petflag-ctc-lpp-glp-1诱导0h的细胞破碎沉淀;泳道4为w3110/petflag-ctc-lpp-glp-1诱导72h的发酵液上清;泳道5为w3110/petflag-ctc-lpp-glp-1诱导72h的细胞破碎上清;泳道6为w3110/petflag-ctc-lpp-glp-1诱导72h的细胞破碎沉淀;泳道7为bl21(de3)/petflag-ctc-lpp-glp-1诱导72h的发酵液上清;泳道8是bl21(de3)/petflag-ctc-lpp-glp-1诱导72h的细胞破碎上清;泳道9是bl21(de3)/petflag-ctc-lpp-glp-1诱导72h的细胞破碎沉淀。
44.图3是利拉鲁肽质谱图。
45.图4是索玛鲁肽质谱图。
46.图5是检测lpp信号肽-ddddk-arg34-glp-l(7-37)融合蛋白的sds-page图;其中,泳道m为蛋白marker,至上而下的分子量(kda)为40、25、15、10、4.6、1.7;泳道1为bl21(de3)/petflag-ctc-lpp信号肽-glp-1诱导0h的发酵液上清;泳道2为bl21(de3)/petflag-ctc-lpp信号肽-glp-1诱导24h的发酵液上清;泳道3为bl21(de3)/petflag-ctc-lpp信号肽-glp-1诱导48h的发酵液上清;泳道4为bl21(de3)/petflag-ctc-lpp信号肽-glp-1诱导72h的发酵液上清;泳道5为bl21(de3)/petflag-ctc-lpp信号肽-glp-1诱导72h的细胞破碎上清;泳道6为bl21(de3)/petflag-ctc-lpp信号肽-glp-1诱导72h的细胞破碎沉淀。
47.图6是检测lpp'-ompa(46-66)-ddddk-arg34-glp-1(11-37)和lpp'-ompa(46-159)-ddddk-arg34-glp-1(11-37)的sds-page图;泳道1为w3110/petflag-ctc-lpp'-ompa(46-66)-glp-1诱导0h的发酵液上清;泳道2为w3110/petflag-ctc-lpp'-ompa(46-66)-glp-1诱导17h的发酵液上清;泳道3为w3110/petflag-ctc-lpp'-ompa(46-66)-glp-1诱导24h的发酵液上清;泳道4为w3110/petflag-ctc-lpp'-ompa(46-66)-glp-1诱导40h的发酵液上清;泳道5为w3110/petflag-ctc-lpp'-ompa(46-66)-glp-1诱导64h的发酵液上清;泳道6为w3110/petflag-ctc-lpp'-ompa(46-66)-glp-1诱导64h的细胞破碎上清;泳道m为蛋白marker,至上而下的分子量(kda)为40、25、15、10、4.6、1.7;泳道7为w3110/petflag-ctc-lpp'-ompa(46-159)-glp-1诱导0h的发酵液上清;泳道8为w3110/petflag-ctc-lpp'-ompa(46-159)-glp-1诱导17h的发酵液上清;泳道9为w3110/petflag-ctc-lpp'-ompa(46-159)-glp-1诱导24h的发酵液上清;泳道10为w3110/petflag-ctc-lpp'-ompa(46-159)-glp-1诱导40h的发酵液上清;泳道11为w3110/petflag-ctc-lpp'-ompa(46-159)-glp-1诱导64h的发酵液上清;泳道12为w3110/petflag-ctc-lpp'-ompa(46-159)-glp-1诱导64h的细胞破碎上清。
具体实施方式
48.下面结合实施例及附图对本发明作进一步详细的描述,但本发明的实施方式不限于此。
49.实施例1
50.技术服务公司合成基因序列,其翻译氨基酸序列具有如表1所示的以下特征:
51.表1
[0052][0053][0054]
pet-28a( )载体改造:pcr扩增pflag
–
ctc载体(sigma)的tac启动子区域,引物两端加上blpi和sphi酶切位点,blpi和sphi双酶切pcr产物和pet-28a( )载体,t4 dna连接酶连接后化转大肠杆菌top10感受态细胞,pcr鉴定阳性克隆。提取质粒后获得启动子更换的pet-28a( )载体,该载体命名为petflag-ctc。
[0055]
参照大肠杆菌密码子偏好性合成编码上述氨基酸序列的基因序列(如下所示,由技术服务公司合成)。以seq id no.4为例,引物两端加上bamhi和ndei酶切位点,pcr扩增,bamhi和ndei双酶切pcr产物和petflag-ctc,t4 dna连接酶连接后化转大肠杆菌top10感受态细胞,pcr鉴定阳性克隆,最后测序获得目的克隆。提取质粒后获得带有融合蛋白基因的petflag-ctc载体,该重组表达载体命名为petflag-ctc-lpp-glp-1(7-37),质粒图谱如图1所示。含有如下其他基因序列的重组表达载体的构建如前所述。
[0056]
编码lpp-ddddk-arg
34-glp-1(7-37)融合蛋白的核酸序列(seq id no.4):
[0057]
atgaaagcgaccaaactggtgctgggcgcggtgattctgggcagcaccctgctggcgggctgcagcagcaacgcgaaaattgatcagctgagcagcgatgtgcagaccctgaacgcgaaagtggatcagctgagcaacgatgtgaacgcgatgcgcagcgatgtgcaggcggcgaaagatgatgcggcgcgcgcgaaccagcgcctggataacatggcgaccaaatatcgcaaagatgatgatgataaacatgcggaaggcacctttaccagcgatgtgagcagctatctggaaggccaggcggcgaaagaatttattgcgtggctggtgcgcggccgcggc;
[0058]
编码lpp-ddddk-arg
34-glp-1(9-37)融合蛋白的核酸序列(seq id no.5):
[0059]
atgaaagcgaccaaactggtgctgggcgcggtgattctgggcagcaccctgctggcgggctgcagcagcaacgcgaaaattgatcagctgagcagcgatgtgcagaccctgaacgcgaaagtggatcagctgagcaacgatgtgaacgcgatgcgcagcgatgtgcaggcggcgaaagatgatgcggcgcgcgcgaaccagcgcctggataacatggcgaccaaatatcgcaaagatgatgatgataaagaaggcacctttaccagcgatgtgagcagctatctggaaggccaggcggcgaaagaatttattgcgtggctggtgcgcggccgcggc;
[0060]
编码lpp-ddddk-arg
34-glp-1(11-37)融合蛋白的核酸序列(seq id no.6):
[0061]
atgaaagcgaccaaactggtgctgggcgcggtgattctgggcagcaccctgctggcgggctgcagcagcaacgcgaaaattgatcagctgagcagcgatgtgcagaccctgaacgcgaaagtggatcagctgagcaacgatgtgaacgcgatgcgcagcgatgtgcaggcggcgaaagatgatgcggcgcgcgcgaaccagcgcctggataacatggcga
ccaaatatcgcaaagatgatgatgataaaacctttaccagcgatgtgagcagctatctggaaggccaggcggcgaaagaatttattgcgtggctggtgcgcggccgcggc。
[0062]
实施例2大肠杆菌转化及筛选
[0063]
将实施例1得到的重组表达载体转化到大肠杆菌复制扩增,具体过程为:按照氯化钙法(参照《分子克隆实验指南》第三版)制备大肠杆菌top10感受态,取1μl重组表达载体加入到top10感受态中,冰浴30min,42℃热激90s,冰浴5min,加入1ml液体soc培养基(2%w/v胰蛋白胨、0.5%w/v酵母提取物、0.05%w/v nacl、2.5mm kcl、10mm mgcl2、20mm葡萄糖),在37℃摇床中振荡培养1h后涂布到lb固体培养基(含有50mg/l卡那霉素kan),37℃培养箱培养过夜,直至出现肉眼可见菌落。挑菌到lb液体培养基(蛋白胨10g/l,酵母提取物5g/l,氯化钠5g/l,ph7.0~7.5,含有50mg/l卡那霉素kan),37℃摇床中振荡培养至od
600
=1-3,使用omega质粒提取试剂盒,按照说明书提取质粒。
[0064]
按照相同的方法制备大肠杆菌bl21(de3)和w3110化转感受态,转入重组表达载体。涂布到lb固体培养基(含有50mg/l kan),37℃培养箱培养过夜,直至出现肉眼可见菌落,得到的工程菌命名为bl21(de3)/petflag-ctc-lpp-glp-1(x)和w3110/petflag-ctc-lpp-glp-1(x),x表示分别含有如seq id no.4~6序列的三种重组表达载体。挑菌到lb液体培养基(蛋白胨10g/l,酵母提取物5g/l,氯化钠5g/l,ph7.0~7.5,含有50mg/l kan),37℃摇床中振荡培养至od
600
=1-3,加入甘油至终浓度15%v/v,保存于-70℃冰箱。
[0065]
实施例3、大肠杆菌发酵及纯化
[0066]
实施例2保存的菌种制备种子培养物和20l发酵罐发酵工艺:
[0067]
①
制备种子培养物
[0068]
取20μl在-70℃冷冻保存的菌种bl21(de3)/petflag-ctc-lpp-glp-1(x)和w3110/petflag-ctc-lpp-glp-1(x),分别接种至50ml添加了卡那霉素(kanamycin,终浓度为50μg/ml)的lb液体培养基,在28℃,250rpm的摇床中培养16小时,从而活化菌种。再将50ml活化过的菌种接种到400ml添加了50μg/ml卡那霉素的lb液体培养基中,在28℃、250rpm的条件下继续培养3h,获得种子培养物,控制它的菌体浓度od600在0.8~1.2之间。
[0069]
②
20l发酵罐中的发酵培养
[0070]
使用20l搅拌式发酵罐(南京华龙公司),按照发酵培养基配方进行投料,投料体积为8l。严格控制发酵条件:温度控制在28℃~32℃之间,ph控制在6.5~7.0之间,发酵转速控制在150rpm~700rpm(根据do的变化调控)之间,空气流速控制在200l/h~1600l/h之间(根据do的变化调控),溶解氧(do)控制在5~50%的最大氧饱和度之间。培养至碳源耗尽时开始补料,采用匀速补料(补料速率控制在0.6ml
·
min-1
·
l-1
),补料的用量为4l。当培养至菌体浓度od600≈30时,开始添加iptg至终浓度0.3mm,开始诱导,诱导时间为72h。发酵培养基的配方如下:每升含有酵母粉2~5g、蛋白胨3~8g、氯化钠1~2g、磷酸二氢钾2~5g、磷酸氢二钠2~5g、二水合氯化钙0.01~0.02g、硫酸镁1~2g、甘油4~7g、硫酸铵5~7g、微量元素0.875ml;用水定容至1l,ph6.5~7.0;微量元素的组成如下:每升含有四水合氯化亚铁20~30g、氯化锌1~3g、六水合氯化钴2~4g、二水合钼酸钠2~4g、二水合氯化钙1~2g、二水合氯化铜1~2g、硼酸0.4~0.6g、一水合硫酸锰2~3g、浓度为质量百分比37%的浓盐酸10ml,用水定容至1l。补料培养基每l含有500g甘油、25g酵母粉、40g蛋白胨,水定容至1l。
[0071]
取w3110/petflag-ctc-lpp-glp-1(7-37)和bl21(de3)/petflag-ctc-lpp-glp-1
(7-37)发酵液上清稀释5倍后进行sds-page电泳,电泳结果见图2,其中泳道4的融合蛋白浓度为300mg/l,对应的发酵液上清融合蛋白浓度为1.5g/l,根据目的蛋白在融合蛋白中的占比可计算出目的蛋白arg34-glp-l(7-37)浓度为0.49g/l;泳道7的融合蛋白浓度为250mg/l,对应的发酵液上清融合蛋白浓度为1.25g/l,根据目的蛋白在融合蛋白中的占比可计算出目的蛋白arg34-glp-l(7-37)浓度为0.41g/l。从图2可知,lpp作为分子伴侣融合目的蛋白得到的重组蛋白多数分泌到胞外培养基。发酵液离心后收集上清,使用离子交换层析纯化。纯化方法参考诺和诺德专利us6444788b1实施例1。根据在线网站(https://web.expasy.org/compute_pi/)计算等电点,成熟的lpp-glp-l融合蛋白具有和arg34-glp-l(7-37)接近的等电点,分别为4.98和5.53。
[0072]
同样,对于w3110/petflag-ctc-lpp-glp-1(9-37)、bl21(de3)/petflag-ctc-lpp-glp-1(9-37)、w3110/petflag-ctc-lpp-glp-1(11-37)、bl21(de3)/petflag-ctc-lpp-glp-1(11-37)的发酵上清进行检测和纯化,目的蛋白arg34-glp-l(9-37)和arg34-glp-l(11-37)亦为分泌性表达,可以得到目的蛋白arg34-glp-l(9-37)浓度为0.40g/l,目的蛋白arg34-glp-l(11-37)浓度为0.38g/l。可见,lpp作为分子伴侣有利于重组蛋白进行分泌性表达。
[0073]
实施例4、脂肪酸酰化剂合成及修饰
[0074]
利拉鲁肽脂肪酸酰化剂合成参照专利cn97198413.1中例35,索玛鲁肽脂肪酸酰化剂合成参照专利cn201510459093.9实施例6。
[0075]
利拉鲁肽脂肪酸酰化剂修饰实施例3获得的arg
34-glp-1(7-37)融合蛋白参照专利cn97198413.1中例37,得到赖氨酸侧链酰化修饰的arg
34-glp-1(7-37)融合蛋白。
[0076]
索玛鲁肽脂肪酸酰化剂修饰实施3获得的arg
34-glp-1(9-37)融合蛋白参照专利cn201510459093.9实施例9,得到赖氨酸侧链酰化修饰的arg
34-glp-1(9-37)融合蛋白。
[0077]
实施例5、修饰后融合蛋白酶切工艺及纯化
[0078]
将实施例4中获得的经脂肪酸酰化剂修饰的融合蛋白收集液稀释后,用重组赖氨酰内切酶(购自wako日本和光纯药株式会社)进行酶切(按照说明书操作),25℃反应2h后调酸终止反应,经酶切即可得到利拉鲁肽单体,索玛鲁肽前体arg34-glp-1(9-37)。
[0079]
将100ml含利拉鲁肽单体的酶切样品,含索玛鲁肽前体arg34-glp-1(9-37)的酶切样品上样到装有20ml uni ps30-500填料(购自苏州纳微科技有限公司)的层析柱上(其预先用缓冲液1平衡,配方为含0.1%v/v tfa的20%v/v异丙醇的水溶液,上样结束后用平衡缓冲液2(含0.1%v/v tfa的20%v/v异丙醇的水溶液)冲洗至基线平稳。再以100ml的20~80%异丙醇线性梯度(含0.1%v/v tfa缓冲液)洗脱,收集洗脱峰,用等电点法调沉,冷冻干燥即得到利拉鲁肽成品,索玛鲁肽前体arg
34-glp-1(9-37)。
[0080]
实施例6保护二肽合成
[0081]
boc-his(boc)-aib-oh合成按照专利cn201510459093.9实施例26的方法合成。
[0082]
实施例7转肽连接获得索玛鲁肽
[0083]
实施例5获得的侧链修饰的索玛鲁肽前体arg34-glp-1(9-37)与实施例6获得的保护二肽转肽连接方法和纯化方法参照专利cn201510459093.9实施例10,制备得到索玛鲁肽成品。
[0084]
实施例8利拉鲁肽,索玛鲁肽成品的鉴定
[0085]
以利拉鲁肽注射液(购自丹麦诺和诺德公司)为对照品,用超高效液相色谱进行分析,发现本发明的利拉鲁肽成品与诺和诺德公司生产的利拉鲁肽对照品出峰时间一致。经赛默飞高分辨液质联用仪取主峰进行高分辨质谱分析,使用thermo biopharma finder2.0解卷积,测得单同位素分子量为3748.9,质谱分析结果与利拉鲁肽对照一致,质谱图见图3。
[0086]
以索玛鲁肽注射液(购自丹麦诺和诺德公司)为对照品,用超高效液相色谱进行分析,发现本发明的索玛鲁肽成品与诺和诺德公司生产的索玛鲁肽对照品出峰时间一致。经赛默飞高分辨液质联用仪取主峰进行高分辨质谱分析,使用thermo biopharma finder2.0解卷积,测得单同位素分子量为4111.1,质谱分析结果与索玛鲁肽对照一致,质谱图见图4。
[0087]
对比例1
[0088]
使用lpp信号肽或是lpp'-ompa(46-66)、lpp'-ompa(46-159)作为分子伴侣,目的蛋白为arg34-glp-l(7-37),连接肽为ddddk,参照大肠杆菌密码子偏好性合成如下序列:
[0089]
lpp信号肽-ddddk-arg34-glp-l(7-37)融合蛋白的氨基酸序列如下:
[0090][0091]
编码lpp信号肽-ddddk-arg34-glp-l(7-37)融合蛋白的核酸序列如下:
[0092]
atgaaagcgaccaaactggtgctgggcgcggtgattctgggcagcaccctgctggcgggcgatgatgatgataaacatgcggaaggcacctttaccagcgatgtgagcagctatctggaaggccaggcggcgaaagaatttattgcgtggctggtgcgcggccgcggc。
[0093]
lpp'-ompa(46-66)-ddddk-arg34-glp-1(11-37)(lpp信号肽 lpp蛋白1-9氨基酸 ompa蛋白的第46-66位氨基酸)融合蛋白的氨基酸序列如下:
[0094][0095]
其中,lpp信号肽为第1~20位,lpp蛋白1-9氨基酸为第21~29位,连接lpp’和ompa的连接肽为第30~31位。
[0096]
编码lpp'-ompa(46-66)-ddddk-arg34-glp-1(11-37)融合蛋白的核酸序列如下:
[0097]
atgaaagcgaccaaactggtgctgggcgcggtgattctgggcagcaccctgctggcgggctgcagcagcaacgcgaaaattgatcagggcattaacccgtatgtgggctttgaaatgggctatgattggctgggccgcatgccgtataaaggcagcgatgatgatgataaaacctttaccagcgatgtgagcagctatctggaaggccaggcggcgaaagaatttattgcgtggctggtgcgcggccgcggc。
[0098]
lpp'-ompa(46-159)-ddddk-arg34-glp-1(11-37)(lpp信号肽 lpp蛋白1-9氨基酸 ompa蛋白的第46-159位氨基酸)融合蛋白的序列如下:
[0099][0100]
其中,lpp信号肽为第1~20位,lpp蛋白1-9氨基酸为第21~29位,连接lpp’和ompa的连接肽为第30~31位。
[0101]
编码lpp'-ompa(46-159)-ddddk-arg34-glp-1(11-37)融合蛋白的核酸序列如下:
[0102]
atgaaagcgaccaaactggtgctgggcgcggtgattctgggcagcaccctgctggcgggctgcagcagcaacgcgaaaattgatcagggcattaacccgtatgtgggctttgaaatgggctatgattggctgggccgcatgccgtataaaggcagcgtggaaaacggcgcgtataaagcgcagggcgtgcagctgaccgcgaaactgggctatccgattaccgatgatctggatatttatacccgcctgggcggcatggtgtggcgcgcggataccaaaagcaacgtgtatggcaa
aaaccatgataccggcgtgagcccggtgtttgcgggcggcgtggaatatgcgattaccccggaaattgcgacccgcctggaatatcagtggaccaacaacattggcgatgcgcataccattggcacccgcccggataacgatgatgatgataaaacctttaccagcgatgtgagcagctatctggaaggccaggcggcgaaagaatttattgcgtggctggtgcgcggccgcggc。
[0103]
依据实施例1的步骤得到重组表达载体,依据实施例2得到表达菌种bl21(de3)/petflag-ctc-lpp信号肽-glp-1、w3110/petflag-ctc-lpp'-ompa(46-66)-glp-1、w3110/petflag-ctc-lpp'-ompa(46-159)-glp-1,依据实施例3进行表达,结果如图5和图6所示:图5的结果表明lpp信号肽无法表达glp-1;图6的结果表明lpp信号肽 部分lpp蛋白 ompa部分蛋白作为分子伴侣无法表达glp-1。
[0104]
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。