一种白颌大树蛙防御肽zs-cath及其基因和应用
技术领域
1.本发明属于多肽应用技术领域,具体涉及一种白颌大树蛙防御肽zs-cath及其基因和应用。
背景技术:
2.近年来的研究表明,抗菌肽是所有动物、植物和微生物防御系统中的一个重要组成部分。它们是机体为抵御病原微生物侵袭而产生的一类小分子活性多肽,具有分子量小、稳定性好、杀菌迅速和不易产生耐药性等特点。这些特性使得抗菌肽具有非常广阔的运用前景,有望替代目前临床上易于产生耐药性的传统抗生素药物。抗菌肽不易产生耐药性的原因是,其杀菌机理与传统抗生素不同。它们主要是作用于细菌的细胞膜,破坏其稳定性,进而细胞膜渗透性发生改变,使得内容物外泄导致细胞死亡。不同物种来源或同一物种中抗菌肽的结构形式和生物活性差别较大。国内外研究人员一直致力于从不同物种中发掘结构新颖的抗菌肽,直接利用或者以其为模板进行分子改造。目前,已有抗菌肽用于海产品保鲜和动物饲料添加剂中。结合生态环境从各种自然资源中发掘具有潜在药用价值的抗菌肽是目前多肽新药研究的一个热点。
3.两栖动物是抗菌肽资源发掘中最重要的一类资源,其皮肤裸露,为抵御环境中各种微生物的侵袭,它们能够分泌多种分子结构新颖、功能复杂多样的的抗菌肽。这些活性多肽广泛参与机体的各种生理活动,具有各种药理活性,如抗微生物、抗肿瘤、抗氧化、免疫调节、创伤修复、镇痛等作用。树蛙与其它的两栖动物明显不同的地方就是,它们的大部分时间都是在树上度过,而其它的两栖动物大部分时间都在水里或陆地上。这种特异的树栖生活使得它们面临的天敌以及外界微生物都与其他的两栖动物有所差异,经过适应性进化,必然拥有一套具有自身优势的先天免疫防御系统。
4.据国内外文献报道,已从各种生物来源分离得到不同的活性多肽,而且有些已进入临床阶段。虽然我国对两栖动物应用有着悠久的历史,但是都是整体入药,对其活性成分和药理性质的研究比较薄弱。白颌大树蛙主要分布于云南、西藏等地,是我国特色资源动物之一,但其皮肤分泌物中cathelicidin家族的抗菌肽少有报道。
技术实现要素:
5.本发明的目的是克服现有技术中树蛙分泌的多肽研究薄弱的问题。
6.为此,本发明提供了一种白颌大树蛙防御肽zs-cath,该防御肽zs-cath是中国两栖类白颌大树蛙防御肽基因编码的一种环状多肽,分子量3602.47道尔顿,等电点10.49,其氨基酸序列如seq id no.1(askkgkcnfmckvkqklraigsktvigtvvhki)所示。
7.seq id no.1:
[0008][0009]
其第七位半胱氨酸和第十一位半胱氨酸组成一对分子内二硫键。
[0010]
该白颌大树蛙防御肽前体的编码基因由628个核苷酸(seq id no:2)组成,其自5’端至3’端序列如seq id no.2所示。
[0011]
seq id no.2:
[0012][0013][0014]
其中,第352
–
450位核苷酸为成熟白颌大树蛙防御肽zs-cath的编码基因。
[0015]
本发明提供的这种白颌大树蛙防御肽zs-cath可用于制备广谱抗微生物(包括革兰氏阴性细菌和革兰氏阳性细菌)试剂,还对大肠杆菌、金黄色葡萄球菌和粪产碱菌引起的感染疾病具有显著的治疗的作用。
[0016]
与现有技术相比,本发明具有以下优点和有益效果:
[0017]
本发明提供的这种新的具有广谱抗微生物性白颌大树蛙防御肽zs-cath对大肠杆菌、金黄色葡萄球菌和粪产碱菌引起的感染疾病具有显著的抑制细菌和真菌生长的作用,可作抗菌剂和医疗器械涂布药物。
[0018]
以下将结合附图对本发明做进一步详细说明。
附图说明
[0019]
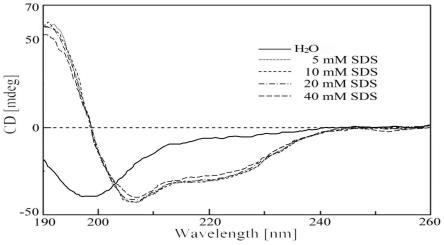
图1是本发明提供的白颌大树蛙防御肽zs-cath在不同浓度sds溶液中的圆二色(cd)光谱分析示意图。
[0020]
图2是本发明提供的白颌大树蛙防御肽zs-cath在不同浓度lps溶液中的圆二色(cd)光谱分析示意图。
具体实施方式
[0021]
下面将结合实施例对本发明中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。尽管已经详细描述了本发明的代表性实施例,但是本发明所属技术领域的普通技术人员将理解,在不脱离本发明范围的情况下可以对本发明进行各种修改和改变。因此,本发明的范围不应局限于实施方案,而应由所附权利要求及其等同物来限定。
[0022]
实施例1:白颌大树蛙防御肽zs-cath的制备和氨基酸序列测定
[0023]
1、白颌大树蛙皮肤总rna提取:
[0024]
活体白颌大树蛙用水清洗干净,放入液氮中速冻10小时,取300mg皮肤组织,加入3ml的trizol溶液,于20ml玻璃匀浆器中匀浆30分钟。加入等体积酚/氯仿溶液,剧烈混匀,室温放置10分钟,4℃,12000rpm离心10分钟,弃除沉淀。上清中加入等体积的异丙醇,室温放置10分钟,4℃,12000rpm离心10分钟,沉淀用75%乙醇洗一次,晾干,管底沉淀物即为白颌大树蛙皮肤总rna。
[0025]
2、白颌大树蛙皮肤mrna的纯化:
[0026]
mrna分离纯化采用美国promega公司的mrna isolation systems试剂盒。
[0027]
提取的白颌大树蛙皮肤总rna溶于500μl的depc水中,放入65℃水浴10分钟,加入3μl的oligo(dt)探针和13μl的20
×
ssc溶液,混匀后放置室温冷却,称为a液。将磁珠(sa-pmp)轻弹混匀,至磁力架吸附30秒,弃上清,加0.3m1的0.5
×
ssc,至磁力架吸附30秒,最后加0.1ml 0.5
×
ssc悬浮,称之为b液。将a液加入b液中,室温放置10分钟,至磁力架吸附30秒,弃上清,用0.1
×
ssc洗涤4次,最后弃上清,加0.1ml depc水悬浮,至磁力架上吸附30秒,将上清移至新的试管,再加入0.15m1 depc水重新悬浮,至磁力架吸附30秒,移上清至上述试管,则上清中为纯化的白颌大树蛙皮肤mrna。加入1/10体积3m乙酸钠,ph5.2,等体积异丙醇,于-70℃放置30分钟,4℃,12000rpm离心10分钟,弃上清,沉淀溶解于10μl=的depc水中。
[0028]
3、白颌大树蛙皮肤cdna文库构建:
[0029]
采用clontech公司creator
tm smart tm cdna library constructionkit质粒cdna文库构建试剂盒。
[0030]
(a)cdna第一链合成(mrna反转录):
[0031]
在0.5ml无菌的离心管加入1μl白颌大树蛙皮肤mrna、1μl smart iv寡聚核苷酸、1μl cds iii/3’pcr引物,加2μl去离子水使总体积达到5μl。混匀离心管中的试剂并以12000rpm离心15秒,72℃保温2分钟。将离心管在冰上孵育2分钟。在离心管中加入以下试剂2.0μl 5
×
第一链缓冲、1.0μl 20mm二硫苏糖醇、1.0μl 10mm dntp混合物、1.0μl powerscript反转录酶。混合离心管中试剂并以12000rpm离心15秒,在42℃保温1小时。将离心管置于冰上中止第一链的合成。从离心管取2μl所合成的cdna第一链备用。
[0032]
(b)采用长末端聚合酶链式反应(ld-pcr)方法扩增第二链
[0033]
95℃预热pcr仪,将2μl cdna第一链(mrna反转录)、80μl去离子水、10μl 10
×
advantage 2pcr缓冲液、2μl 50
×
dntp混合物、2μl 5’pcr引物、2μl cds iii/3’pcr引物以及2μl大肠杆菌聚合酶离心管进行反应。在pcr仪中按以下程序扩增:95℃,20秒钟;22个循
环(95℃,5秒钟;68℃,6分钟)。循环结束后,将离心管中合成的cdna双链进行回收。
[0034]
(c)pcr产物回收:
[0035]
用promega公司的sv gel and pcr clean-up system试剂盒进行抽提回收,步骤如下:
[0036]
将通过pcr得到的cdna双链加入等体积的膜结合缓冲颠倒混匀,然后将混和液转入离心纯化柱,室温静置5分钟,使dna充分与硅胶膜结合。12000rpm离心30秒,倒掉收集管中的废液。加入700μl的洗脱液(含乙醇)于离心纯化柱中,以12000rpm离心30秒,倒掉收集管中的废液。重复步骤2。12000rpm离心5分钟,将离心纯化柱置于新的离心管中。加入30μl超纯水,在室温下静置5分钟。12000rpm离心30秒,管底溶液即为所纯化过的cdna双链。
[0037]
(d)大肠杆菌dh5α感受态细胞的制备:
[0038]
挑取单个dh5α菌落,接种于3ml不含氨苄青霉素的luria-bertani(lb)培养基中,37℃培养过夜,次日取上述菌液按比例1:100再接种于50ml lb培养液中,37℃振荡2小时。当od
600
值达到0.35时,收获细菌培养物。将细菌转移到一个无菌、一次性使用的、用冰预冷的50m1聚丙烯管中,在冰上方置10分钟,使培养物冷却至0℃。于4℃以4100rpm离心10分钟,回收细胞。倒出培养液,将管倒置l min以使最后的痕量培养液流尽。每50ml初始培养液且30ml预冷的0.1mol/lcacl
2-mgcl2溶液(80mmol/l mgcl2,20mmol/l cacl2)重悬每份细胞沉淀。于4℃以4100rpm离心10分钟,回收细胞。倒出培养液,将管倒置l分钟以使最后的痕量培养液流尽。每50m1初始培养物用2m1用冰预冷的0.1mol/l cacl2重悬每份细胞沉淀,分装后备用。
[0039]
4、白颌大树蛙防御肽基因克隆筛选:
[0040]
cathelicidins是最具特征的抗菌肽之一,由于基因编码的cathelicidins在脊椎动物中很保守,由四个外显子组成,第一个外显子编码大小为29-30个氨基酸残基的n端信号肽;第二个和第三个外显子编码高度保守的“cathelin”区域,由99-114个氨基酸组成;第四个外显子编码成熟肽,其抗菌域由12-100个氨基酸组成,因此,可以通过设计cathelicidins的引物,来确认mrna里是否有编码cathelicidins的基因。根据已报道的两栖动物cathelicidins保守区域设计的3’端反向引物zs-cath-r1,序列为:5
’‑
(a/t)(g/c)c(a/g)cag(a/g)(c/t)cttcacctcc-3’,另一5’端扩增引物为clontech公司smart tm cdna library construction kit中自带的5’primer,其序列为5
’‑
aagcagtggtatcaacgcagagt-3’,以白颌大树蛙皮肤二链cdna为模板进行pcr扩增。pcr反应在如下条件下进行:94℃,30s;52℃,45s;72℃,2min,共35个循环。
[0041]
5、白颌大树蛙防御肽基因序列测定:
[0042]
扩增完成后,核酸电泳检测,有一条500bp左右的条带,产物送上海生工测序。根据测序获得的5’端序列,设计5’端引物zs-cath-f1,序列为:ctggcagtgttttctatggctc,配合该建库试剂盒中自带的3’primer,其序列为5
’‑
attctagaggccgaggcggccg-3’,以树蛙皮肤二链cdna为模板进行pcr扩增,反应条件如上所述。扩增完成后,使用dna胶回收试剂盒回收目标片段,将回收片段与pmd19-t载体连接,连接产物转化至大肠杆菌dh5α感受态细胞。转化完成后,此cdna文库构建完成。挑选500bp左右的条带送上海生工测序。
[0043]
基因测序结果表明编码白颌大树蛙防御肽zs-cath前体的基因由628个核苷酸组成(genbankaccessionnumber:om365993),自5’端至3’端序列如seq id no.2所示。
[0044]
seq id no.2:
[0045][0046]
实施例2:zs-cath的合成及结构鉴定
[0047]
根据编码白颌大树蛙防御肽zs-cath基因推断的氨基酸序列,用自动多肽合成仪(433a,applied biosystems)合成其全序列,如seq id no.1(askkgkcnfmckvkqklraigsktvigtvvhki)所示。
[0048]
seq id no.1:
[0049][0050]
其第七位半胱氨酸和第十一位半胱氨酸组成一对分子内二硫键。
[0051]
本实施例中白颌大树蛙防御肽zs-cath由上海杰肽生物科技有限公司合成,通过hplc反向柱层析脱盐纯化,确定其纯度大于98%。所有多肽都溶于超纯水中,用于活性测定,储存浓度为2mg/ml,分装保存于-20℃。
[0052]
使用bioinformatics resource portal工具(http://www.expasy.org/tools/)对理论等电点(isoelectric point,pi)和分子量(molecular weight,mw)进行计算,其分子量为3602.47道尔顿,等电点为10.49。
[0053]
使用圆二色谱分析其结构,圆二色光谱在jasco-810分光偏振计(jasco,东京,日本)上收集,该偏振计在25℃和0.2nm的间隔(190-260nm)下有一个1mm长路径的电池。zs-cath溶于h2o、sds/h2o和lps/h2o中,浓度为0.3mg/ml。使用jasco-810软件对每个光谱的三次扫描数据进行平均。cd数据以平均残余椭圆度(θ)表示,单位为deg.cm2.dmol-1。
[0054]
如图1所示,zs-cath溶于h2o时,cd光谱在199nm处有一个强负峰,在211nm处有一个小负峰,表明它主要为β-折叠构象和无规卷曲构象。zs-cath在膜模拟的sds/h2o溶液环境中,211nm处有一个小负峰,在208和222nm处还有两个不同的负峰,表明zs-cath主要采用
β-折叠结构,并带有一个小的α-螺旋。溶解在40mm sds/h2o溶液中的zs-cath的二级结构构成为:24.6%α-螺旋,39.4%β-折叠和36.0%无规卷曲。此外,如图2所示,lps溶液环境中,存在α-螺旋的特征峰,并且α-螺旋含量的程度随lps浓度的增加而增加。
[0055]
实施例3:白颌大树蛙防御肽zs-cath抗菌活性鉴定
[0056]
以luria-bertani(lb)液体培养基作为培养介质,供试菌株经lb固体培养基复苏后,用无菌水稀释菌落成每毫升含2
×
105个细菌的菌液,备用。测定最小抑菌浓度时,采用二倍稀释法进行抗菌检测,具体方法如下:
[0057]
在0.19ml培养基中加入0.01ml样品作为第一孔,混匀后取0.1ml加入第2孔(已加入0.1ml新鲜培养基),依次倍比稀释,自第6孔吸出0.1ml弃去,四周各孔系对照,将各孔中加入已校正的菌液(2
×
105cfu/ml)0.1ml,混匀后放置37℃培养18小时,于600nm波长处测定光吸收。最小抑菌浓度为看不见细菌生长的最低样品浓度。
[0058]
细菌菌株来源于昆明医科大学,此试验重复三次,取平均值,结果如表1。
[0059]
表1,白颌大树蛙防御肽zs-cath抑制细菌生长的作用:
[0060][0061][0062]
由表1可见,白颌大树蛙防御肽zs-cath具有显著的抑制细菌生长的作用。
[0063]
以上例举仅仅是对本发明的举例说明,并不构成对本发明的保护范围的限制,凡是与本发明相同或相似的设计均属于本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
