一种dapk1磷酸化底物的人工小分子干扰肽及其制药用途
技术领域
1.本发明涉及小分子多肽类药物研发领域,特别是一种dapk1磷酸化底物的人工小分子干扰肽及其制药用途。
背景技术:
2.脑卒中(stroke)又称作“脑中风”,是一组突然起病,以局灶性神经功能缺失为共同特征的急性脑血管疾病,具有发病率高、死亡率高、致残率高、复发率高,有关医护花费高以及并发症多,但是知晓率低,治疗率低和控制率低的特点。据世界卫生组织统计,脑卒中是世界范围内的致死病因第二位,是成人残疾的第一病因,严重影响了人类的健康和生活质量,并给病患家庭和社会造成了严重的心理负担和经济损失。据“中国脑卒中防治报告2018”报道,脑卒中是我国成年人致死致残的首位原因,死亡人数约占全球脑血管病死亡的1/3,每年就有196万人死于脑血管病,现存活患者数1242万,发病率也呈快速上升并呈年轻化趋势。
3.脑卒中分为缺血性和出血性两种,其中缺血性脑卒中约占87%之多,是由于血栓形成或栓塞造成血流中断而引起的一类严重神经疾病,患者会突然出现瘫痪,语言功能损伤或视力丧失甚至死亡。目前有效的治疗是运用重组组织纤溶酶原激活物(rtpa)的溶栓疗法。但是由于脑卒中有效治疗时间窗太短,实际操作上时间的无法控制,并且还面临血液再灌流损伤,易诱发颅内出血等难题,目前只有约5%的患者能够应用溶栓疗法,多数患者只能得到对症支持治疗。所以,应用神经保护剂保护正常神经细胞和挽救未死亡的神经组织,可减少脑梗塞面积,同时可以避免溶栓剂或抗凝治疗方案的并发症,采用前无需进行详细的病因鉴别诊断,使得早期治疗成为可能,而且神经保护剂可用于出血性脑卒中,所以其治疗效果和前景令人期待,是近来脑卒中治疗的研究热点。但是,全球范围内的实验室针对缺血性脑卒中神经保护剂开发的小分子化合物已超过1000种,并开展了200多项临床试验,至今尚未得到普遍认可的神经保护剂,有待持续开发新的药物、探讨新的治疗方法以减少神经细胞死亡对脑卒中的有效治疗极其重要。
4.在缺血性脑卒中时,神经元因为缺氧缺糖会耗尽细胞能量,从而引起多个机制参与的复杂级联反应,其中的相互作用导致神经元损伤及死亡。这些反应包括离子稳态失衡、活性氧(ros)和活性氮(rns)的产生,以及线粒体功能障碍等,最终,细胞通过坏死或凋亡两种途径走向死亡。其中参与级联反应的细胞通路中,死亡相关蛋白激酶1(death associated protein kinase1,dapk1)是一种钙调蛋白调节的丝氨酸/苏氨酸蛋白激酶,发挥很重要的作用。有研究表明,dapk1-nr2b通路,dapk1-danger通路,dapk1-p53通路和dapk1-tau通路等都参与了缺氧缺糖诱导的细胞死亡,在动物缺血缺氧模型的急性治疗中阻断这些级联可有效减少神经元死亡,但是至今未见到基于此成功开发来作为临床治疗的有效药物,因此有必要开发更多针对缺血性脑卒中的药物。
5.多肽,一般是指一种所含氨基酸数量在100个以内的小分子蛋白,有着小分子化合物和蛋白质等大分子药物不可比拟的优势:与小分子化合物一样不需要消化,可直接注射
吸收快,几乎100%吸收利用且不耗能,不导致胃肠道功能负担和代谢负担,可作为载体吸收,又与大分子一样分子认知性好,构效关系明显,药效学显著,药物用量小,生物活性强,毒性小、副作用低或者没有副作用,无蓄积性。是近年来药物开发的重要方向。
技术实现要素:
6.基于上述领域的需求,本发明在小分子多肽药物方向上对缺血性脑卒中药物进行了研发,根据研究成果提供一种防治缺血性脑卒中药物的开发方法,以及一种小分子多肽,其中间产物(基因序列,表达载体)及其在防治缺血性脑卒中药物制药用途。
7.具体地,本发明请求保护以下技术方案:
8.1.一种dapk1磷酸化底物的人工小分子干扰肽,其特征在于,其氨基酸序列如seq id no.1,seq id no.2、seq id no.3、seq id no.4或seq id no.5所示。
9.2.一种dapk1磷酸化底物的人工小分子干扰肽,其特征在于,其具有以下(a)或(b)所示的氨基酸基序:
10.(a)xxx(r/k)(r/k)(r/k)(r/k)x2(s/t/a)x1 xxx;
11.(b)xxx(r/k)(r/k)(r/k)x2(r/k)(s/t/a)x1 xxx
12.其中每个x可以独立地选自任何氨基酸或无氨基酸;
13.x1为极性氨基酸,选自天冬酰胺(n),半胱氨酸(c),谷氨酰胺(q),丝氨酸(s)或苏氨酸(t)
14.x2为非极性氨基酸,选自丙氨酸(a),异亮氨酸(i),亮氨酸(l),甲硫氨酸(m)和缬氨酸(v);
15.其中r/k指该位置上可任意地采用精氨酸(r)或赖氨酸(k);
16.其中s/t/a指该位置上可任意地采用丝氨酸(s)、苏氨酸(t)或丙氨酸(a);
17.优选地,人工小分子干扰肽的氨基酸序列还与seq id no.1,seq id no.2或seq id no.3所示的氨基酸序列中的至少一个相比差异不多于2个氨基酸,即具有至少85%的一致性。
18.3.根据实施例2所述的人工小分子干扰肽,其氨基酸序列如seq id no.6-54任一所示。
19.4.根据实施例2所述的人工小分子干扰模拟肽,其结构为订书肽或环肽,如:首尾成环(酰胺键),侧链成环,硫酯键成环,内酯键成环,se-cys和se-cys间氧化成环,或二硫键的环肽。
20.5.实施例1-3任一所述的人工小分子干扰肽的反向多肽,即与人工小分子干扰肽相比,肽链中氨基酸的顺序改为从c端到n端。
21.6.实施例1-3任一所述的人工小分子干扰肽的d型逆反肽,所述d型逆反肽与所述人工小分子干扰肽相比,是所述人工小分子干扰肽中的每个l-氨基酸残基被其对应的d型氨基酸替换,其氨基酸序列是反转的同时其侧链的原始空间方向和手性与所述人工小分子干扰肽相同,即保持与所述人工小分子干扰肽相似的侧链拓扑结构。
22.7.实施例1-3任一所述的人工小分子干扰肽的衍生肽,其特征在于,是对实施例1-3任一所述的人工小分子干扰肽中的任一个或多个氨基酸替换成其对应的d型氨基酸或高氨基酸而得。
23.8.一种多聚肽,其特征在于,是两条以上小分子肽以同向并联方式聚合构成,其中的每个小分子肽的c端游离,所有小分子肽的n端聚集在一起用于与递送载体连接;
24.所述小分子肽选自实施例1-3任一所述的人工小分子干扰肽,实施例5所述的反向多肽、实施例6所述的d型逆反肽,或实施例7所述的衍生肽。
25.9.一种融合多肽,其特征在于,是在小分子肽的n末端或c末端融合一种或多种递送载体构成;
26.所述小分子肽选自实施例1-3任一所述的人工小分子干扰肽,实施例5所述的反向多肽、实施例6所述的d型逆反肽,或实施例7所述的衍生肽。
27.10.根据实施例8所述的多聚肽或实施例9所述的融合多肽,其特征在于,所述递送载体选自穿膜肽、配体,受体蛋白转导结构域(ptd)、抗体或高分子聚合物;
28.所述穿膜肽选自阳离子型细胞穿膜肽、两亲型细胞穿膜肽、疏水型细胞穿膜肽或合成型细胞穿膜肽;
29.所述高分子聚合物选自聚乙二醇(peg)、聚乳酸,聚lactide-co-glycolide,聚乙醇酸,聚己酸内酯,聚环氧乙烷,聚二噁烷酮,聚丙烯富马酯,三亚甲基碳酸酯,聚酯酰胺环氧乙烷,酯酰胺,β-羟基苯丙酸酯,α-羟基酸,聚羟基烷酸,多聚羟基丁酸,聚酰亚胺碳酸盐,聚亚安酯,聚酸酐,透明质酸,甲壳胺,纤维素,明胶,胶原蛋白。
30.11.根据实施例10所述的融合多肽,其特征在于,
31.所述阳离子型细胞穿膜肽选自seq.id no.55至seq.id no.72所示的氨基酸序列组成的组;
32.所述两亲型细胞穿膜肽选自seq.id no.73至seq.id no.81所示的氨基酸序列组成的组;
33.所述疏水型细胞穿膜肽选自seq.id no.82至seq.id no.85所示的氨基酸序列组成的组;
34.所述合成型细胞穿膜肽具有seq.id no.86所示的氨基酸序列。
35.12.根据实施例11所述的融合多肽,其特征在于,所述人工小分子干扰肽具有seq id no.1-3、seq id no.6-54任一所示的氨基酸序列;所述穿膜肽具有seq.id no.55-seq.id no.86任一所示的氨基酸序列。
36.13.根据实施例10所述的融合多肽,其特征在于,其氨基酸序列如seq.id no.87-seq.id no.96任一所示。
37.14.一种人工制备的核酸分子,其特征在于,其编码小分子多肽,所述小分子肽选自实施例1-3任一所述的人工小分子干扰肽,实施例5所述的反向多肽。
38.15.一种表达载体,其特征在于,装载有14所述的核酸分子。
39.16.一种表达系统,其特征在于,为细胞系或无细胞体系表达系统,含有实施例15所述的载体。
40.17.一种表达产物,其特征在于,由实施例14所述的表达系统表达,其主要成分为小分子多肽;所述小分子肽选自实施例1-3任一所述的人工小分子干扰肽,实施例5所述的反向多肽。
41.18.一种药物,其特征在于,含有多肽分子以及药学可接受的杂质、辅料、溶剂、保护剂、佐剂、载体和/或赋形剂;其中所述多肽分子为:
42.(1)实施例1-3任一所述的人工小分子干扰肽,实施例5所述的反向多肽、实施例6所述的d逆反肽,或实施例7所述的衍生肽或
43.(2)小分子肽的修饰产物,所述小分子肽选自实施例1-3任一所述的人工小分子干扰肽,实施例5所述的反向多肽、实施例6所述的d型逆反肽,或实施例7所述的衍生肽;所述修饰指以下一种或多种:
44.n末端、c末端修饰、标记、环化、脂化、n-甲基化、豆蔻酰化和棕榈酰化、糖基化、生物素化、peg修饰、荧光标记。
45.19.根据实施例18所述的药物,其特征在于,剂型为:吸入气雾剂、口服剂、静脉内给药、动脉内给药、颅内给药、腹膜内给药、鼻内给药、肌肉内给药、皮下给药、滑膜(腔)内给药、胸骨内给药,脊椎内给药制剂。
46.20.小分子肽的的制药用途,其特征在于,所述小分子肽选自实施例1-3任一所述的人工小分子干扰肽,实施例5所述的反向多肽、实施例6所述的d型逆反肽,或实施例7所述的衍生肽;
47.所述制药用途是指用于制备治疗或预防与兴奋性氨基酸毒性机制相关的疾病的药物,所述疾病包括但不限于脑卒中、创伤性脑损伤、脊髓损伤、新生儿缺氧缺血性脑病、神经系统退行性疾病、抑郁症、自闭症;
48.所述神经系统退行性疾病指多发性硬化症,阿尔茨海默氏病,肌萎缩侧索硬化,帕金森病或亨廷顿病。
49.21.小分子肽的的制药用途,其特征在于,所述小分子肽选自实施例1-3任一所述的人工小分子干扰肽,实施例5所述的反向多肽、实施例6所述的d型逆反肽,或实施例7所述的衍生肽;所述制药用途是指用于制备治疗或预防与dapk1-pkd1通路相关的生理异常的药物,所述疾病包括但不限于脑卒中、创伤性脑损伤、脊髓损伤、新生儿缺氧缺血性脑病、神经系统退行性疾病、抑郁症、自闭症;
50.所述神经系统退行性疾病指多发性硬化症,阿尔茨海默氏病,肌萎缩侧索硬化,帕金森病或亨廷顿病。
51.22.一种药物组合,其特征在于,包含实施例18或19所述的药物以及抗凝血药或抗血小板药;
52.优选,实施例18或19所述的药物以及所述抗凝血药或抗血小板药被按照单次剂量、单日剂量或疗程剂量为单位组合包装在一起;
53.其中所述抗凝血药是指醋硝香豆素、4-羟基-3-(1,2,3,4-四氢-1-萘基)香豆素(杀鼠醚)、双香豆素、双香豆素乙酯、苯丙香豆素、苄丙酮香豆素、二苯茚酮、苯茚二酮、噻氯香豆醇、贝米肝素、舍托肝素钠、达肝素、依诺肝素、那屈肝素、帕肝素、瑞维肝素、亭扎肝素、磺达肝素、依达肝素、达那肝素、舒洛地特、硫酸皮肤素、阿哌沙班、贝曲西班、依杜沙班、奥米沙班、利伐沙班、水蛭素、比伐卢定、重组水蛭素、地西卢定水蛭素、阿加曲班、达比加群酯、美拉加群、希美加群、去纤维蛋白多核苷酸、抗凝血酶ⅲ、肝素、可迈丁锭、达比加群酯、艾乐妥、依度沙班、依诺肝素、磺达肝素、重组组织型纤溶酶原激活剂、组织型纤溶酶原激活剂、阿替普酶、瑞替普酶、替奈普酶、尿激酶、沙芦普酶、链激酶、阿尼普酶、孟替普酶、安克洛酶、溶纤维蛋白酵素、纤维蛋白酶,或其组合物;
54.所述抗血小板药是指氯吡格雷、替格瑞洛、普拉格雷、双嘧达莫、西洛他唑、噻氯匹
啶、埃替非巴肽、阿司匹林、阿昔单抗、替罗非班、贝前列素、环前列腺素、伊洛前列素、曲前列环素、阿洛普令、卡巴匹林钙、吲哚布芬、三氟醋柳酸、吡考他胺、特鲁曲班、氯克罗孟、地他唑,或其组合物。
55.23.小分子肽的的疾病治疗用途,其特征在于,所述小分子肽选自实施例1-3任一所述的人工小分子干扰肽,实施例5所述的反向多肽、实施例6所述的d型逆反肽,或实施例7所述的衍生肽;
56.其中给药量是从0.001mg/kg体重至50mg/kg;在此所述的小分子肽的浓度可以广泛地改变,并且根据所选择的给药方式及受试者的体重,年龄,性别等进行选择;
57.优选的剂量范围为剂量从0.01mg/kg体重至50mg/kg;
58.进一步优选的剂量范围为剂量从0.1mg/kg体重至10mg/kg;
59.或者改变剂量范围以便优化一个受试者或一组受试者中的治疗方;
60.所述疾病包括但不限于脑卒中、创伤性脑损伤、脊髓损伤、新生儿缺氧缺血性脑病、神经系统退行性疾病、抑郁症、自闭症;
61.所述神经系统退行性疾病指多发性硬化症,阿尔茨海默氏病,肌萎缩侧索硬化,帕金森病或亨廷顿病。
62.据报道,293t细胞和人脐静脉血管内皮细胞产生氧化应激损伤后,dapk1被激活并导致与其相互作用的蛋白激酶d1(protein kinased1,pkd1)的磷酸化,pkd1的活化对与凋亡信号调节激酶1(apoptosis signal-regulated kinase 1,ask1)结合以及其下游诱导的c-jun氨基末端激酶(c-n-terminal kinase,jnk)的磷酸化至关重要,研究也已表明,ask1依赖的jnk信号传导通路在缺血后介导了半胱天冬酶依赖性凋亡和非半胱天冬酶依赖性坏死的细胞死亡。但是尚未发现有报道确定在缺血缺氧下,神经元的dapk1-pkd1通路是否参与导致细胞死亡的级联反应,干扰或阻断dapk1-pkd1通路是否能有效减少缺血性神经损伤,可否成为研发治疗缺血性脑卒中的药物新的分子靶点。
63.发明人对dapk1-pkd1通路对缺血性神经损伤的影响提出假设,据此设计了pkd的干扰肽,并在此基础上衍生出了具有相同基序的系列小分子肽。对这些小分子多肽在细胞和动物模型上进行了一系列测试,得出了本发明的技术方案pkd1是指蛋白激酶d1属于蛋白激酶d(protain kinase d,pkd)家族,是一种在细胞中广泛表达的胞质丝氨酸-苏氨酸激酶,具有独特的结构、酶学特性和调节特性。pkd家族有pkd1,pkd2,pkd3三个成员,相对pkd2和pkd3,pkd1的研究最多,一般认为pkd2和pkd1在分布和功能上相类似,而pkd3主要往复于细胞质和细胞核之间。在结构域上,pkd三个成员存在高度的同源性。据报道,pkd参与了多种细胞功能,包括高尔基组织化以及质膜引导的运输、转移、免疫响应、细胞凋亡和细胞增殖(doi:10.1152/physiol.00037.2010,生理科学进展2011年第42卷第5期)。
64.本发明开发的小分子多肽药物被应用到离体氧化应激损伤模型和整体动物脑卒中模型中,实验数据证明,本发明开发的小分子多肽药物在谷氨酸盐细胞凋亡模型中具有显著的神经保护功效;并有效抑制氧糖剥夺引起原代神经元细胞损伤,即其能有效地干扰神经元的dapk1-pkd1通路,抑制其下游引起的神经元半胱天冬酶依赖性凋亡和非半胱天冬酶依赖性坏死的信号,降低缺血性卒中后脑损伤。因此,本发明开发的小分子干扰肽可用于制备与兴奋性氨基酸毒性机制相关的疾病的治疗或预防药物,所述疾病包括但不限于脑卒中、创伤性脑损伤、脊髓损伤、新生儿缺氧缺血性脑病、神经系统退行性疾病(比如:多发性
硬化症,阿尔茨海默氏病,肌萎缩侧索硬化,帕金森病,亨廷顿病)、抑郁症、自闭症。
65.术语定义
66.天然氨基酸:指生物体体内能自动生成的20种常规氨基酸,一般情况下为l型氨基酸。
67.术语“d型氨基酸”是指与l型氨基酸在结构上手型对称的氨基酸,是通过d型甘油醛人工合成的氨基酸。除甘氨酸外,所有氨基酸都有立体异构体(其结构的镜像)。
68.术语“高氨基酸”(homo-amino acids),也叫长链氨基酸:是一类天然氨基酸的衍生物,是将一个亚甲基(ch2)插入到紧邻羧基的天然氨基酸碳骨架中,以延长氨基酸的碳链;用以改善多肽的生物活性和生物稳定性。
69.术语“多肽”、“人工小分子多肽”如果特殊定义或说明均具有本领域通常理解的氨基酸序列特征,比如其中的氨基酸残基为天然l型氨基酸,氨基酸序列中左端为α-nh270.基即左边为n端,右末端为α-cooh基及右边为c端。
71.术语“反向多肽”,即与原肽链相比,肽链中氨基酸的顺序改为从c端到n端。比如nsgvrrrrlsnvslc的反向多肽为:nlsvnslrrrrvgsc72.术语“d型逆反肽”,即与天然l型氨基酸构成的原始l-氨基酸肽相比,是原始l-氨基酸肽中的每个l-氨基酸残基被其对应的d型氨基酸替换而得,其氨基酸序列是反转的同时其侧链的原始空间方向和手性与原始l-氨基酸肽相同,即保持与原始l-氨基酸肽相似的侧链拓扑结构。
附图说明
73.图1.示出本发明融合多肽rvtat-pkd-s205的鉴定和定量分析结果,其中
74.(a)rvtat-pkd-s205纯化产品的rp-hplc分析色谱图:合成、纯化生产rvtat-pkd-s205后,用反向hplc分析,在210nm处定量,其峰值的滞留时间是11.797分钟(箭头所指),最终产品纯度为98.3%。
75.(b)rvtat-pkd-s205的质谱图:通过液相色谱质谱法鉴定rvtat-pkd-s205肽,分析表明合成肽的分子量为2920.0道尔顿(箭头所指),理论分子量为2919.43道尔顿。
76.图2.示出本发明融合多肽对谷氨酸诱导的ht22细胞死亡的影响,其中(a)在37摄氏度下,将含有0-1600nm五个不同浓度rvtat-pkd-s205的ht22细胞暴露于6mm谷氨酸(glut)中24小时,mtt测定法确定细胞的细胞毒性。以0nm浓度rvtat-pkd-s205组作为对照。细胞死亡率(%)=100%x(对照od-给药od)/对照od。数据显示为平均值
±
sem(n=3),*p《0.05,**p《0.01,单向anova,然后是与0nm浓度rvtat-pkd-s205组进行多次比较(bonferroni t检验)。(b)实验的时间表和采样方案。
77.图3.示出本发明融合多肽在神经元对氧糖剥夺/复灌模型(ogd/r)中的神经保护作用及不同融合多肽的对比,其中
78.(a)在ogd处理之前30分钟,将不同浓度的rvtat-pkd-s205、rvtat-zipk-t299、rvtat-opmlc-s20添加到大鼠原代皮层神经元(div7)中。为了诱导ogd,将含有20mm ph7.2连二亚硫酸钠(na2s2o4)及测试药物的ebss(即earle's平衡盐溶液(ebss)溶液)短暂作用1.5小时,此后用正常的神经基础培养基代替ogd培养基以模型再灌注,将培养细胞再孵育20小时后,通过mtt测定法测定细胞毒性。以非ogd处理细胞培养物为100%生存作为对照,
测试药物的细胞死亡(%)=100%x(对照od-测试药物od)/对照od。数据显示为平均值
±
sem(n=3),***p《0.005,单向方差分析,然后与ogd对照组进行多重比较(bonferroni t检验)。(b)实验的时间表和采样方案。
79.图4.对比不同融合多肽对谷氨酸诱导的ht22细胞死亡的影响
80.在37摄氏度下,培养基中含400nm不同测试药物(rvtat-pkd-s205、rvtat-zipk-t299、rvtat-rsp6-s235、rvtat-opmlc-s20、rvtat-becn1-t199)的ht22细胞暴露于6mm谷氨酸中,放置24小时之后,通过mtt测定法确定细胞毒性。培养基中不含测试药物的ht22细胞单独暴露于6mm谷氨酸盐作为对照。细胞死亡(%)=100%x(对照od-给药物od)/对照od。数据显示为平均值
±
sem(n=3),*p《0.05,**p《0.01,单向方差分析,然后与谷氨酸对照组进行多次比较(bonferroni t检验)。
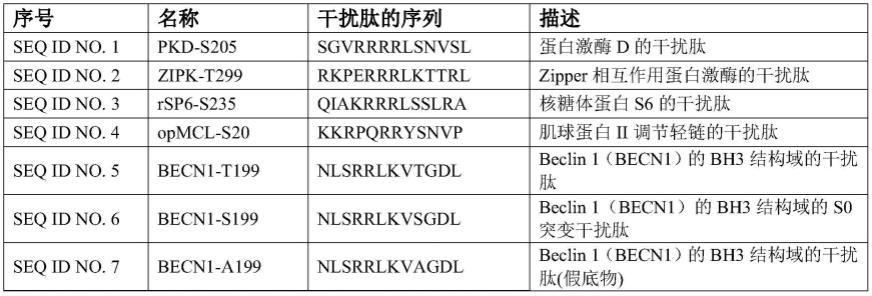
81.图5.示出本发明融合多肽对整体动物短暂性大脑中动脉闭塞及再灌注模型的神经保护作用,其中:
82.(a)实验时间表和采样方案,sprague dawley大鼠经历了90分钟的大脑中动脉闭塞后开始再灌注(tmcao/r),4.5小时后接受3.5mg/2ml/kg静脉注射治疗(rvtat-pkd-s205或对照生理盐水),部分缺血再灌注的大鼠24小时后进行ttc染色,其余的动物在第3,5,和7天进行转棒试验;
83.(b)脑切片的代表性图像;
84.(c)生理盐水组和rvtat-pkd-s205治疗组大鼠的脑梗塞大小的量化比较(盐水组n=13,rvtat-pkd-s205组n=12)。
85.(d)使用转棒试验评估运动能力,记录大鼠在转棒上的转棒时间。(假手术组n=8,生理盐水组n=6,rvtat-pkd-s205组n=10)。数据显示为平均值
±
sem,*p《0.05,**p《0.01,student t检验。采用盲法并随机对动物分组治疗。
86.图6.示出本发明融合多肽对短暂性全脑缺血再灌整体动物脑卒中模型的神经保护作用,其中(a)实验的时间表和采样方案c57bl/6小鼠双侧颈动脉两次闭塞20分钟后再灌注(tbccao/r),并在tbccao 3小时后通过尾静脉用7mg/2ml/kg rvtat-pkd-s205或相同体积的生理盐水治疗处理,24小时再灌注后y迷宫被动回避实验检验,以及mda测定,和脑中的水含量测定;
87.(b)在接受足部点击后学会避开点击区域的小鼠,通过y迷宫被动回避实验检测评估缺血小鼠的学习记忆功能;
88.(c)24小时再灌注后mda elisa测定脑中mda含量;
89.(d)24小时再灌注后测定脑中的含水量;
90.数据显示为平均值
±
sem,(每组n=11),*p《0.05,**p《0.01,与盐水对照组相比,student t检验。采用盲法并随机对动物分组治疗。
具体实施方式
91.下面通过参考附图描述的实施例是示例性的,旨在用于解释本技术,而不能理解为对本技术的限制。基于本技术中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本技术保护的范围。
92.一、小分子干扰肽的研发
93.发明人对dapk1-pkd1通路对缺血性神经损伤的影响提出假设,选取蛋白激酶d的197至210位之间的氨基酸组成小分子干扰肽(pkd-s205),如表1中seq id no.1所示。
94.由于dapk1具有多种磷酸化特定底物,在应激反应触发的信号级联反应中,除了与pkd1相互作用,dapk1还磷酸化肌球蛋白ii调节轻链(myosin regulatory light chain,mlc)进而激活肌球蛋白,导致胞膜空泡化。dapk1磷酸化核糖体蛋白s6(ribosomal protein s6 kinase,rsp6)第235位的丝氨酸(ser235),降低了蛋白质的翻译率。dapk1磷酸化自噬效应蛋白beclin 1(becn1)中的bh3结构域第119位的苏氨酸(thr119),促进beclin 1与b细胞淋巴瘤超大型(b-cell lymphoma-extralarge,bcl-xl)的解离,诱导自噬。dapk1磷酸化zipper相互作用蛋白激酶(zipper-interacting protein kinase,zipk)第299位苏氨酸使其改变其细胞内定位,促进细胞死亡。
95.本发明也针对dapk1的这些磷酸化底物的磷酸化位点设计了干扰肽,如表1中seq id no.2-6。
96.表1.本发明设计的干扰肽
97.[0098][0099][0100]
二、细胞穿膜肽
[0101]
细胞穿膜肽(cell penetrating peptides,cpps),是一类能不依赖特异膜受体独立穿过细胞膜或组织屏障如血脑屏障的短肽,通常不超过30氨基酸,可通过内吞和直接穿透等机制运载蛋白质、rna、dna等大分子进入细胞内发挥其效应功能,进入细胞后能被正常分解,因此具有较好的生物相容性,对细胞毒性小。
[0102]
本领域已经熟知的穿膜肽可用于本发明,例如下表所列:
[0103]
表2.细胞穿膜肽
[0104]
[0105][0106]
三.融合多肽
[0107]
本发明的示例性实施例选择tat(47-57)的反向序列tat(rrrqrrkkrg)作为穿膜肽与本发明所研发的小分子干扰肽连接成融合分子,穿膜肽连接在小分子干扰肽的n末端或c末端,本发明部分融合多肽的氨基酸序列如下表。
[0108]
表3本发明所得部分融合多肽的序列信息
[0109][0110][0111]
四.融合多肽的制备
[0112]
融合多肽可以采用表达系统进行表达,然后纯化,属于本领域成熟技术,不多赘述。
[0113]
本发明提供的融合多肽为小分子多肽,采用化学合成方法也是理想选择。
[0114]
用于本发明后续测试的融合多肽由金斯瑞科技生物股份公司(genscript,china)使用fmoc化学的固相肽合成法(solid phase peptide synthesis,spps)合成。
[0115]
spps法是将氨基酸顺序添加到树脂中以构建肽链。合成完成后,在n端对fmoc基团进行脱保护,然后对侧链保护基进行脱保护,然后将肽从树脂上裂解下来;经制备型反向高效液相色谱(reversed phase high performance liquid chromatography,rp-hplc)纯化,纯化溶剂为乙腈 去离子水分别加入0.1%三氟乙酸(trifluoroacetic acid,tfa)作为缓冲液,进行梯度洗脱。以分析型rp-hplc确认纯度大于95%,并以电喷雾离子质谱分析法(electrospray ionization mass spectrometry,esi-ms)来测定其分子量以确定成分(图1)。用vario micro element analyzer进行定氮法测定多肽的含量。实际多肽量的计算是称重*纯度*含量。
[0116]
本文中的融合多肽均为白色粉末状,避光保存在-20℃,完全溶于水,在无菌水或生理盐水中制成200μm的储备液,并根据损伤模型在0.1至2μm的浓度范围内进行评估。
[0117]
五、离体氧化应激损伤模型
[0118]
1.ht22小鼠海马神经元细胞系谷氨酸攻击模型
[0119]
试剂:
[0120]
神经原基础培养基(neurobasal medium):thermo fisher scientific gibco10888022
[0121]
dmem培养基(dulbecco's modified eagle medium):thermo fisher scientific 10569077
[0122]
b-27
tm plus supplement(50x):thermo fisher scientific gibco a3582801
[0123]
1.1谷氨酸攻击试验
[0124]
将ht22小鼠海马神经元细胞系细胞培养并维持在加有10%胎牛血清,100u/ml青霉素和100μg/ml链霉素的dmem培养基中。将细胞维持在37℃的5%co2/95%空气中。在进行药物实验时,6
×
103个细胞/孔ht22细胞接种于96孔板在co2培养箱中37℃下培养24小时后,将培养基更换成添加有2%b27(b-27
tm plus supplement(50x))的神经原基础培养基(neurobasal medium),以及各种浓度的测试药物,并使ht22细胞暴露于6mm谷氨酸中,在37℃,co2培养箱中进一步持续培养24小时。使用mtt比色法测定细胞活性。
[0125]
1.2mtt测定法分析评估细胞活性
[0126]
通过3-[4,5-二甲基噻唑-2-基]-2,5-二苯基溴化四氮唑(thiazolyl blue tetrazolium bromide,mtt)测定法定量测定细胞活性。
[0127]
将水溶性黄色染料mtt试剂(最终浓度0.5mg/ml)加入到每个孔中,并在37℃下孵育。4小时后,除去温育培养基,加入100μl二甲基亚砜(dimethyl sulfixide,dmso),在室温下溶解30分钟后,在570nm处用分光光度法测定甲臜(formazan)溶液的吸光度。
[0128]
转换mtt吸光度数据以反映相对于未处理和已处理对照的成比例细胞活性,未处理对照被视为100%活力。
[0129]
1.3实验结果
[0130]
ht22细胞暴露于6mm谷氨酸盐并同时加入不同浓度的rvtat-pkd-s205多肽,经24小时后用mtt比色法测量细胞存活率:100nm,200nm,400nm和1600nm的rvtat-pkd-s205肽可相应减少11%,22%,32%和24%的细胞死亡。400nm和1600nm显示出显著神经保护功效,但1600nm的神经保护功效有所降低。
[0131]
实验结果表明,本发明提供的嵌合肽rvtat-pkd-s205在谷氨酸盐细胞凋亡模型中具有显著的浓度依赖性神经保护功效,并且显示400nm是rvtat-pkd-s205多肽最佳的给药浓度(图2)。
[0132]
2.大鼠皮层神经细胞原代培养的氧糖剥夺(oxygen-glucose deprivation,ogd)复灌模型
[0133]
试剂:
[0134]
dulbecco改良的eagle培养基(dmem):thermo fisher scientific 30030
[0135]
earle's平衡盐溶液(ebss):thermo fisher scientific 14155063
[0136]
2.1氧糖剥夺复灌实验
[0137]
在sprague-dawley(sd)大鼠第15至18天的胚胎时制作皮质神经元的原代培养物(wenxiang fan,xiangli,lianglianghuang,shuchenghe,zhichengxie,yuxinfu,weirongfang,yunmanli s-oxiracetam ameliorates ischemic stroke induced neuronal apoptosis through up-regulatingα7nachr and pi3k/akt/gsk3βsignal pathway in rats neurochemistry internationalvolume 115,may 2018,pages50-60https://doi.org/10.1016/j.neuint.2018.01.008),具体如下:将大脑皮层在dulbecco改良的eagle培养基(dmem)中解离,在0.25%的胰蛋白酶消化下于37℃消化5分钟后,通过添加胎牛血清(终浓度为10%)终止消化阶段。然后通过在500
×
g离心5分钟后,通过巴斯德吸管重复吸液而获得。将细胞在补充2%b27(v/v),1mm谷氨酰胺,50单位/毫升青霉素和50单位/毫升链霉素的n神经原基本培养基(neurobasal medium)中解离。将细胞铺板在24孔板中(用0.1mg/ml聚d-赖氨酸包被),每孔密度为1.5x 105个细胞,随后每3天更换一次培养基。在37℃下,5%co2/95%空气的潮湿培养箱中培养保持7天以供使用。
[0138]
氧葡萄糖剥夺实验是根据先前建立的方法(j.huang,n.d.kodithuwakku,w.he,y.zhou,w.fan,w.fang,g.he,q.wu,s.chu,y.li the neuroprotective effect of a novel agent n2 on rat cerebral ischemia associated with the activation of pi3k/akt signaling pathway neuropharmacology,95(2015),pp.12-21)并进行了一些修改以模拟体内缺血和复灌流(ischemia/reperfusion,i/r)损伤,具体如下:暴露于ogd之前,在药物实验组的原代培养中,先在神经基础培养基中加入不同浓度的测试药物,在co2恒温箱中于37℃放置30分钟后,所有原代培养都除去培养基,将ogd组替换为无糖earle's平衡盐溶液(ebss)溶液,该溶液含有或不含药剂的低亚硫酸钠(na2s2o4,20mm,ph 7.2),而对照组用含有6mm葡萄糖的ebss代替,在37℃下继续孵育1.5小时。通过更换成正常的神经原基本培养基,终止ogd攻击,并在37℃下再孵育20小时。最后,通过mtt比色法测定法测定细胞活性(同1.2)。
[0139]
2.2实验结果
[0140]
原代神经元在ogd前30分钟加入两个递进浓度的rvtat-pkd-s205多肽,然后加入连二亚硫酸钠诱导神经元缺氧缺糖60分钟,该段时间之后,恢复到常规的含糖含氧的培养
条件20小时,然后用mtt比色法测量细胞存活率。
[0141]
如图3所示,rvtat-pkd-s205对神经元氧糖剥夺保护功效具有浓度依赖的量效关系,300和1000nm的rvtat-pkd-s205显著减少12%和22%神经元的死亡(图3)。并且数据表明rvtat-pkd-s205以浓度依赖的方式减少了神经元的死亡;300nm多肽rvtat-pkd-s205可以有效抑制氧糖剥夺引起原代神经元细胞损伤。
[0142]
六、整体动物脑卒中模型
[0143]
1.大鼠线栓法中总动脉结扎再灌模型
[0144]
对于急性脑缺血,根据先前的方法(wenxiang fan,xiang li,liangliang huang,shucheng he,zhichengxie,yuxin fu,weirong fang,yunman li s-oxiracetam ameliorates ischemic stroke induced neuronal apoptosis through up-regulatingα7nachr and pi3k/akt/gsk3βsignal pathway in rats neurochemistry international volume 115,may 2018,pages 50-60https://doi.org/10.1016/j.neuint.2018.01.008)
[0145]
建立大鼠大脑中动脉闭塞/再灌注(transient middle cerebral artery occlusion/reperfusion,tmcao/r)脑卒中模型,具体如下:220-250g雄性sprague-dawley大鼠可自由进食和饮水,并在恒定的环境条件下(12/12小时光照/黑暗周期)饲养。但在手术前一天晚上禁食大鼠,可以自由饮水。手术时,用水合氯醛(300mg/kg,腹腔内注射)麻醉大鼠后,将大鼠仰卧固定于手术台上的加热垫上。在外科手术过程中,使用直肠探针连续监测体温,并将体温保持在36.5
–
37.0℃。手术区域用聚维酮碘或70%酒精消毒,在颈正中线切口,并用牵开器将气管上的软组织轻轻拉开。从迷走神经中小心地分离出颈总动脉(cca),颈外动脉(eca)和颈内动脉(ica)。远端结扎eca,翼动脉与ica紧密相连,然后将一个微血管夹置于ica上,并将另一个置于cca上,以防止血液回流。将结扎的eca烧灼以形成一个残端,将带有圆形端的4-0尼龙线栓通过eca残端插入cca连接处,去除放置在ica中的微血管夹,以允许线栓插入。将线栓小心地从cca结插入mca达18至20mm,之后将线栓固定在两个位置(在eca树桩的底部和ica上)。闭塞90分钟后,小心地拔出线栓,将eca切口处扎紧,移除放置在cca中的微血管夹,确认血流再灌注后,缝合颈部皮肤。为了减轻术后的疼痛和不适,在手术切口区域使用局部利多卡因凝胶,并在手术后给动物皮下注射1.0ml生理盐水,以补充水分。假手术组动物进行相同的程序但是不进行动脉插入线栓至血流阻塞。tmcao后4.5小时,在3分钟内静脉内注射剂量为3.5mg/2ml/kg的测试药物或无菌生理盐水。用加热灯将老鼠恢复期间的体温维持在37℃。
[0146]
2.脑组织处理和梗死体积测量
[0147]
再灌注后24小时,处死深度麻醉的大鼠,取出全脑组织,并冠状切片大脑至2毫米厚的切片,然后立即在37℃下用1%2、3、5-三苯四唑(ttc)溶液染色15分钟。使用imagej图像处理软件,计算左半球的面积和右半球的未染色面积(未梗塞的面积),并按如下方法计算梗塞的百分比。脑梗塞面积的百分比=(左半球面积-右半球未梗塞面积)/左半球面积*100%。
[0148]
实验结果:如图5(a,b,c)所示,为了检验rvtat-pkd-s205肽在整体动物内的治疗效果,用90分钟暂时性大脑中动脉栓塞和复灌(tmcao/r)模型进行治疗性研究。将sd大鼠分为2组,单用生理盐水(对照)或生理盐水加rvtat-pkd-s205(3.5mg/kg)治疗,局部缺血后4.5小时尾静脉注射给予单一剂量rvtat-pkd-s205(n=13)和生理盐水(n=12)。造模约24
小时后通过ttc染色评估梗死体积(图5a)。用rvtat-pkd-s205治疗后,与对照组卒中体积相比,统计学上显著减少了总脑梗死体积(约60%)(图5b,c)。这一结果证明rvtat-pkd-s205可以在体内发挥作用,减轻缺血性卒中引起的脑损伤。
[0149]
3.转棒仪评估运动功能
[0150]
应用rotarod转棒仪对sd大鼠在局灶性急性脑缺血之前和之后7天内进行运动功能测试,在tmcao/r手术前三天,大鼠连续三天在转棒仪上接受训练。初始启动坡道设置为4rpm,以确保动物可以在转棒杆上保持1分钟。休息10分钟后,将大鼠在180秒的时间内稳定增加至20rpm,并训练它们在杆上停留超过150秒。在接下来的两天内,无法在转棒杆上停留超过150秒的动物会依次重新定位,直到能够达标。测量大鼠在180秒内能够停留在转棒杆上的持续时间,如果动物掉下了转棒杆或抓住了转棒并连续旋转了2圈而没有试图重上转棒杆,则测试结束。在tmcao/r手术前一天记录3次旋转仪测试的平均持续时间。在tmcao/r后(或假手术后)的第3天,第5天和第7天进行转棒仪测试,每日连续进行三次测量,取三次的平均值,每次测试之间允许动物休息15分钟。
[0151]
实验结果:为了进一步观察rvtat-pkd-s205肽对脑内的运动神经功能缺损恢复情况,采用90分钟暂时性大脑中动脉栓塞和复灌(tmcao/r)模型进行治疗后研究。将sd大鼠分为3组,分别以假模组(无tmcao/r)(n=8)、单纯生理盐水(对照)组(n=6)或生理盐水加pkd干扰肽(3.5mg/kg)治疗组(n=6)。rvtat-pkd-s205和生理盐水在局部缺血后4.5小时尾静脉注射给予单一剂量rvtat-pkd-s205和生理盐水。tmcao/r造模后第3、5、7天通过转棒试验评估神经功能缺损。
[0152]
rvtat-pkd1-s205肽治疗后tmcao/r的大鼠运动性能得到显著改善,与未治疗处理的对照组相比,tmcao/r后5天和7天的持棒时间分别增加70%和75%。治疗组和未治疗组在tmcao/r后3天的平均持棒时间无显著差异(图5d,假手术组n=8,生理盐水组n=6,rvtat-pkd-s205组n=10)。结果证明rvtat-pkd-s205能显著改善缺血性中风引起的大鼠神经行为学症状。
[0153]
4.小鼠短暂性双侧颈总动脉结扎再灌(transient bilateral common carotid artery occlusion and reperfusion,tbccao/r)诱发的脑缺血模型
[0154]
建模:体重20
–
30g(6
–
7周龄)的c57bl/6雄性小鼠,自由进食和水,并在恒定的环境条件下(12/12小时光照/黑暗周期)饲养。腹膜内注射10%水合氯醛(350mg/kg)麻醉小鼠,然后将其放置在加热垫上以保持直肠温度在37℃,并根据先前建立的方法进行bccao手术。用聚维酮碘,然后用70%乙醇清洗剃除毛发的小鼠腹侧颈部区域。在颈部做一个小中线皮肤切口。解剖内侧胸锁乳突肌,并与迷走神经和结缔组织仔细剥离,以暴露出颈总动脉。施加非创伤性血管钳夹以阻塞每条动脉20分钟。取下夹子,血流恢复10分钟。然后再将双侧颈总动脉再阻塞20分钟,再恢复灌注24小时。tbccao后3小时,在3分钟内静脉内注射7mg/2ml/kg的测试药物。在恢复期间,鼠标的体温用加热灯保持在37℃。假手术对照组动物进行除双侧颈总动脉闭塞外的所有外科手术程序。
[0155]
试验:被动回避实验检测tbccao/r小鼠的学习和记忆能力
[0156]
y迷宫装置由三个呈120
°
角的臂(a,b和c)组成,并通过中央区域(cz)连接。电网(由不锈钢制成)放置在每个臂下;每个手臂的外端都有一个提供安全区域光源的灯泡。可以通过计算机将这三个手臂中的任何一个设置为起始区域,在实验开始后将其定义为非安
全区域。其余两个手臂通过y-maze视频跟踪和分析系统随机分为无脚震(当前刺激)的安全区域和有脚震的非安全区域。
[0157]
为了检测rvtat-pkd-s205肽对脑卒中后整体动物认知记忆缺陷的改善,我们在小鼠双侧颈总动脉短暂闭塞及复灌(tbccao/r)的全脑缺血性模型上进行了干扰肽的治疗性研究。在这个模型中,小鼠双侧颈总动脉短暂闭塞及复灌(tbccao/r)主要造成海马区神经元损伤并影响动物的认知和记忆功能。
[0158]
在手术前一天,研究人员要训练小鼠学会避免由光源引起的电击,这可以最大程度地减少气味的影响。将c57bl/6小鼠分为3组(每组n=11),假模组,单剂量静脉注射单纯生理盐水(对照)组,生理盐水加rvtat-pkd-s205(7mg/kg)治疗组。rvtat-pkd-s205肽和生理盐水在造模后3小时尾静脉注射。在tbccao/r造模24小时后,通过y迷宫被动回避任务测量学习和记忆技能(图6a)。
[0159]
3分钟后,将小鼠放在起始区域以开始实验。实施预定强度(0.05-0.8ma)的电流刺激,动物必须逃脱到相邻的安全区域中,以免受到脚部冲击,并保持30秒钟。然后将动物放在起始位置进行后续测试。记录逃生到安全区的次数,任何到非安全区的逃生都被认为是错误。取十次测试的平均值以计算平均逃生百分比。在更换动物之间,用消毒剂和/或酒精喷雾彻底清洁设备。
[0160]
实验结果:用每只小鼠的正确回避百分比确定其活动状态,观察结果表明,与盐水治疗组相比,rvtat-pkd-s205治疗组的小鼠显着增加了成功回避的百分比,rvtat-pkd-s205肽改善tbccao/r引起的记忆指数下降,治疗组与未治疗组相比,记忆指数提高30%(图6b)。该结果支持rvtat-pkd1-s205治疗能显著减轻全脑缺血后海马神经原的损伤。
[0161]
tbccao/r小鼠脑丙二醛(malondialdehyde,mda)测量
[0162]
mda是脂质过氧化重要的产物之一,脂质氧化的程度通过测量mda水平来确定。用硫代巴比妥酸(thiobarbituric acid,tba)方法估算组织中的mda水平。进行上述行为测试后,将小鼠断头并取脑组织。将脑组织在冰冷的盐水中匀浆。将裂解物在4℃下以3500rpm离心10分钟后收集上清液,并按照制造商的规程使用mda tba试剂盒(南京建城生物工程研究所,南京,中国)测定mda含量。从标准曲线评估结果,并计算为nm/mg蛋白质。
[0163]
tbccao/r小鼠脑水肿测量
[0164]
小鼠tbccao/r后24小时,通过湿干法评估卒中诱发的脑水肿,在解剖脑后立即确定湿重,在55℃下将组织干燥至24小时内恒重以确定干重。脑含水量的百分比计算为(湿重-干重)/湿重*100。
[0165]
测量结果:脑组织中mda的浓度被用于评估神经元缺血损伤的严重程度。相对于盐水对照组的tbccao/r小鼠,用rvtat-pkd-s205治疗的tbccao/r小鼠脑中mda浓度降低了55%,明显抑制了神经元缺血损伤后的mda的增长(图6c)。增加通过测量脑水含量来评估脑水肿,rvtat-pkd-s205治疗后与盐水对照组相比脑中水含量明显降低了8.5%(图6d)。结果表明,rvtat-pkd-s205能减轻实验性tbccao/r模型的脑水肿和氧化应激损伤。
[0166]
统计方法:整体动物实验中,研究人员在制备卒中模型和评估卒中的鉴定及测试指标时,对实验药物组和对照(无菌生理盐水)组保持盲法。所有数据均以平均值
±
sem表示。采用单向方差分析法对两组以上的数据进行分析,然后与对照组进行事后检验或未配对的双尾t检验进行多次比较,以评估治疗组与未治疗对照组之间的均值差异。当数据不满
molecularneurobiology,54:4716-4722
[0179]
doi:10.1074/jbc.m505804200mshamloo,lsoriano,twieloch,knikolich,rurfer,doksenberg(2005)death-associatedproteinkinaseisactivatedbydephosphorylationinresponsetocerebralischemiajbiolchem,280:42290-9
[0180]
doi:10.1038/sj.cdd.4402212aeisenberg-lerer,akimchi(2007)dapkinaseregulatesjnksignallingbybindingandactivatingproteinkinasedunderoxidativestresscelldeath&differentiation,14:1908-15
[0181]
doi:10.1074/jbc.m414674200wzhang,szheng,pstorz,wmin(2005)proteinkinasedspecificallymediatesapoptosissigal-regulatingkinase1
–
jnksignallyinducedbyh2o2butnottumornecrosisfactorjbiolchem,280:19036-44
[0182]
doi:10.1523/jneurosci.4407-08.2008rstetler,gcao,ygao,fzhang,swang,zweng,pvosler,lzhang,asignore,sgraham,jchen(2008)hsp27protectsagainstischemicbraininjuryviaattenuationofanovelstress-responsecascadeupstreamofmitochondrialcelldeathsignallingjneurosci,28:13038-55
[0183]
doi:10.1186/1471-2202-4-32yzhang,xlu,bbhavnani(2003)equineestrogensdifferentiallyinhibitdnafragmentationinducedbyglutamateinneuronalcellsbymodulationofregulatoryproteinsinvolvedinprogrammedcelldeath.bmcneurosci,4:32
[0184]
doi:10.1074/mcp.m700579-mcp200sbialik,hberissi,akimchi(2008)ahighthroughputproteomicsscreenidentifiesnovelsubstratesofdeath-associatedproteinkinase.molcellproteomics,7:1089-98
[0185]
doi:10.1186/s12868-015-0158-2jrosario,kfeldmann,tahmed,uamjad,bko,jan,tmahmud,msalama,smei,dasemota,imano(2015)deathassociatedproteinkinase(dapk)-mediatedneurodegenerativemechanismsinnematodeexcitotoxicity.16:25
[0186]
doi:10.1021/bi060413yaschumacher,avelentza,dwatterson,jdresios(2006)death-associatedproteinkinasephosphorylatesmammalianribosomalproteins6andreducesproteinsynthesis.biochemistry,45:13614-21
[0187]
doi:10.1128/mcb.01595-06acraig,jchrystal,kfraser,nsphyris,ylin,bharrion,mscott,idornreiter,thupp(2007)themdmsubiquitinationsignalinthedna-bindingdomainofp53formsadockingsiteforcalciumcalmodulinkinasesuperfamilymembers.mcb,27:3542-55
[0188]
doi:10.1038/embor.2008.246ezalckvar,hberissi,lmizrachy,yidelchuk,ikoren,meisenstein,hsabanay,r.pinkas-kramaiski,akimchi(2009)dap-kinase-mediatedphosphorylationonthebh3domainofbeclin1promotesdissociationofbeclin1frombcl-xlandinductionofautophagy.emborep,10:285-92
[0189]
doi:10.1128/mcb.24.19.8611
–
8626.2004gshani,lmarash,dgozuacik,s
chem,276:38945-65
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。