1.本发明属于常规水稻种子纯度检测技术领域,具体涉及一种用于检测常规水稻种子纯度的试剂盒及检测方法。
背景技术:
2.在种子生产、加工过程中,由于串粉、机械混杂甚至人为掺假等原因,造成种子纯度降低、种子质量下降。我国对用于生产和销售的种子有强制性的质量要求,包含纯度、净度、发芽率、含水量四个方面。对常规稻种子而言,要求原种的种子纯度不得低于99.9%,大田用种种子纯度不得低于99.0%。目前,种子纯度鉴定的常用方法为dna分子标记法,以ssr分子标记最为典型。ssr分子标记广泛分布于植物基因组中,且具有较高的多态性,稳定性强。通过ssr分子标记进行种子纯度鉴定不受植株生长阶段、时间、环境的影响,且鉴定结果十分准确。
3.ssr分子标记鉴定种子纯度时需要对待检对象进行dna提取,一般而言,种子纯度检测时需要几十甚至上百个单株,利用传统的ctab法逐一提取dna过程繁琐、工作量大;在数个ssr位点上盲目的对所有待测单株进行检测工作量大,需要提前进行标记筛选;同一品种不同批次的种子中混杂种子并不一致,之前用于筛选假种子的标记在另一批种子中可能不适用,不像杂交稻可以固定几个标记用于种子纯度鉴定,常规稻需要重新筛选标记进行假种子筛选,因此多重pcr也不适用。
技术实现要素:
4.针对现有技术中存在的问题,本发明的目的在于提供一种用于检测常规水稻种子纯度的试剂盒及检测方法。
5.为了达到上述目的,本发明采用如下技术方案:
6.一种用于检测常规水稻种子纯度的试剂盒,包括扩增水稻20个ssr标记的引物序列;
7.所述20个ssr标记如下:
8.第一个ssr标记位于水稻日本晴参考基因组1号染色体8329860-8330052位置;
9.第二个ssr标记位于水稻日本晴参考基因组2号染色体8760433-8760557位置;
10.第三个ssr标记位于水稻日本晴参考基因组3号染色体36348164-36348246位置;
11.第四个ssr标记位于水稻日本晴参考基因组4号染色体18996785-18996891位置;
12.第五个ssr标记位于水稻日本晴参考基因组10号染色体9818621-9818784位置;
13.第六个ssr标记位于水稻日本晴参考基因组12号染色体2433238-2433453位置;
14.第七个ssr标记位于水稻日本晴参考基因组1号染色体6154019-6154166位置;
15.第八个ssr标记位于水稻日本晴参考基因组2号染色体35141668-35141836位置;
16.第九个ssr标记位于水稻日本晴参考基因组5号染色体36910796-26910946位置;
17.第十个ssr标记位于水稻日本晴参考基因组7号染色体21872196-21872349位置;
18.第十一个ssr标记位于水稻日本晴参考基因组8号染色体6763702-6763889位置;
19.第十二个ssr标记位于水稻日本晴参考基因组9号染色体7888400-7888602位置;
20.第十三个ssr标记位于水稻日本晴参考基因组3号染色体9755616-9755778位置;
21.第十四个ssr标记位于水稻日本晴参考基因组4号染色体21414515-21414681位置;
22.第十五个ssr标记位于水稻日本晴参考基因组6号染色体5426496-5426630位置;
23.第十六个ssr标记位于水稻日本晴参考基因组7号染色体2876165-2876333位置;
24.第十七个ssr标记位于水稻日本晴参考基因组8号染色体17945061-17945202位置;
25.第十八个ssr标记位于水稻日本晴参考基因组9号染色体19320299-19320450位置;
26.第十九个ssr标记位于水稻日本晴参考基因组10号染色体18085499-18085630位置;
27.第二十个ssr标记位于水稻日本晴参考基因组11号染色体27673250-27673372位置。
28.在一个具体的实施例中,所述扩增水稻20个ssr标记的引物序列如seq id no:1-seq id no:40所示。
29.在一个具体的实施例中,所述用于检测常规水稻种子纯度的试剂盒还包括用于扩增水稻20个ssr标记的反应体系溶液pcr mix。所述的pcr mix为常规的可以用于扩增ssr标记的pcr反应体系成分;具体的,在本发明一个具体的实施例中,所述pcr mix所含成分可以为:3mm mgso4,100mm kcl,20mm ph 8.0tris-hcl,10mm edta,0.4mm dntps,0.04u/μl taq dna聚合酶,3%(v/v)二甲基亚砜,12%(v/v)甘油,0.02%(m/v)溴酚蓝,0.02%(m/v)二甲苯腈蓝ff。
30.上述的试剂盒在检测常规水稻种子纯度中的应用;所述的常规水稻种子指的是常规稻,即非杂交水稻。
31.一种检测常规水稻种子纯度的方法,步骤如下:
32.(1)从待测的常规水稻种子中,随机抽取一定数量的种子作为检测对象;提取待检测水稻种子样品的dna,将所提样品的dna编号,每5-10粒种子dna为1组进行等量混样,获得多个dna混池,分别以这些混池为模板,采用上述的试剂盒进行检测;
33.(2)筛选出步骤(1)中针对于某一或某些ssr标记初步检测有差异扩增的混池;对该混池中的所有的样品单独进行针对该差异ssr标记的检测;最终确定对该ssr标记有差异扩增的单株编号;
34.(3)判断“假种子”:如果一粒种子的dna在2个及以上位点扩增出与品种标准材料或绝大多数种子存在差异的条带,则该种子非此品种的种子,为“假种子”;如果一粒种子的dna在0个或1个位点扩增出与品种标准材料或绝大多数种子存在差异的条带,则该种子为此品种种子或疑似此品种种子;
35.(4)计算种子纯度:种子纯度为该品种种子或疑似该品种种子数与检测种子总数的百分比,根据上述(3)中的判断结果,计算待测常规水稻种子的纯度。
36.所述步骤(1)每5-10粒种子dna为1组进行等量混样,在一个具体的实施例中是10
粒种子dna为1组进行等量混样,超过10株差异条带不易检测。
37.在一个具体的实施例中,提取待检测水稻种子样品dna的方法如下:
38.将100mg的水稻材料置于离心管中,同时加入100μl裂解液,研磨破碎;然后将离心管置于沸水中水浴10min;水浴结束后加入中和液10
×
te buffer 100μl混匀,12000rpm离心10min;上清液即为提取的dna样品;
39.其中,所述裂解液成分为0.1m koh、2%(v/v)吐温20;所述中和液10
×
te buffer成分为100mm tris-hcl和10mm edta-na2。
40.上述提取待检测水稻种子样品dna的方法中,水稻材料的用量、裂解液和中和液10
×
te buffer的用量仅为举例说明,而非对其具体用量的绝对限定,当针对的水稻材料的用量大时,任何本领域的技术人员应当理解为裂解液和中和液10
×
te buffer的用量也按照上述比例进行调整。
41.所述检测常规水稻种子纯度的方法中,所述水稻材料为水稻幼苗叶片、萌发后的水稻幼芽或蒸馏水浸泡过夜的水稻种子。
42.所述检测常规水稻种子纯度的方法中,所述步骤(1)中采用上述试剂盒进行检测的方法是以提取的dna混池为模板,分别对20个ssr分子标记进行检测,配制pcr反应体系,进行pcr反应;采用聚丙烯酰胺凝胶电泳检测扩增结果。
43.在一个具体的实施例中,所述pcr采用10μl体系,具体包含pcrmix 5μl,10μm的前后引物各0.5μl,1μl提取的dna,3μl的水。
44.在一个具体的实施例中,所述pcr反应程序为:94℃预变性5min;94℃变性30s,50-65℃退火30s,72℃延伸30s,循环28-33次;72℃延伸7min;10℃保存。
45.本发明技术方案的优点:
46.本发明改良了dna的提取方法,通过4步操作即可实现用于pcr的dna提取,同时通过dna样品混合筛选多态性标记,并在混样区间内筛选扩增差异条带的单株,定位假种子,减少了工作量,在较短的时间内即可实现种子纯度的检测。
47.本发明dna的提取方法中以强碱溶液作为裂解液破坏细胞结构,使dna释放至提取液中,之后以中和液将强碱中和,使所提dna溶液达到pcr反应的要求。
48.分子标记法为常用的种子纯度鉴定方法,应用分子标记进行种子纯度鉴定往往需要对大量材料进行dna提取,费时费力。由于ssr分子标记检测对dna质量要求不高,本发明提供了一种快速的dna提取方法,传统dna提取方法流程需要1-2小时时间,本发明在30分钟内便可实现dna提取,大大节省了时间。另外,同一品种不同批次的常规稻种子中的混杂种子往往是不同的,因此每次种子纯度鉴定都需要进行多态性标记筛选,根据多态性标记差异条带的出现确定“假种子”数量。本发明提供了一种通过种子dna混样进行标记筛选的方法,准确性高,同时也节省人力和成本,大大提高了种子纯度鉴定的效率。
附图说明
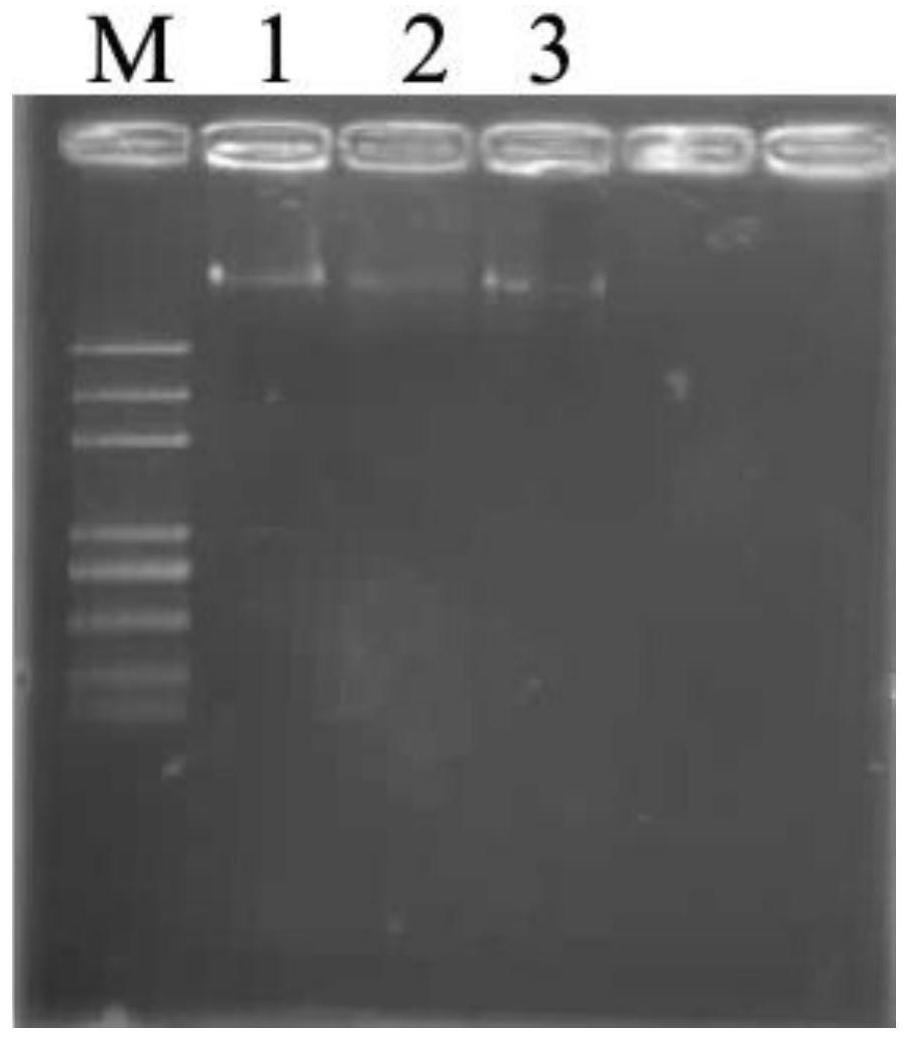
49.图1实施例1方法提取的dna样品质量检测,其中3个泳道均为对快速提取的种子dna的检测;
50.图2以实施例1方法提取的dna为模板用于标记扩增的结果;
51.图3在10个混池、20个标记位点中扩增出差异条带的3个标记;
52.图4标记10在100株单株中的扩增结果;
53.图5标记1在编号1-10、71-80的所有单株内的检测结果和标记6在编号71-80的所有单株的检测结果。
具体实施方式
54.在本发明中所使用的术语,除非有另外说明,一般具有本领域普通技术人员通常理解的含义。
55.下面结合具体实施例,并参照数据进一步详细的描述本发明。以下实施例只是为了举例说明本发明,而非以任何方式限制本发明的范围。
56.实施例1
57.一种dna的快速提取方法,步骤如下:
58.将100mg水稻幼嫩叶片或蒸馏水浸泡过夜的种子置于离心管中,同时加入直径2mm不锈钢珠2-3颗以及100μl裂解液,tp-12研磨仪上4档研磨1min;然后将离心管置于沸水中水浴10min;水浴结束趁热加入中和液10
×
te buffer 100μl,12000rpm离心10min;上清液即为提取的dna样品,将上清液转移至新离心管或96孔板中,-20℃保存或直接用于pcr。
59.其中裂解液成分为:0.1m koh和2%(v/v)吐温20;中和液10
×
te buffer成分为100mm tris-hcl和10mm edta-na2。
60.通过琼脂糖凝胶电泳检测上述方法所提取dna的质量,具体步骤如下:
61.称取琼脂糖0.25g于三角瓶中,加入25ml 1
×
tae电泳缓冲液,微波炉加热使其溶解,室温放置至凝胶溶液低于65℃时加入1mg/ml溴化乙锭溶液20μl,摇晃均匀后倒入制胶槽中,插上样品梳。待凝胶凝固后取下样品梳,将凝胶放置于电泳槽中,电泳液没过凝胶。取上述方法提取的15μl dna溶液,加入2μl上样缓冲液,混匀后加至点样孔中,以5k marker作分子量标准,120v电泳15min,电泳结束后于凝胶成像系统中观察。dna质量检测照片如图1所示,结果表明上述方法提取的dna样品条带清晰,可用于分子标记检测。
62.实施例2
63.一种用于检测常规水稻种子纯度的试剂盒,包括pcr mix和ssr引物。
64.其中,pcr mix所含成分为:3mm mgso4,100mm kcl,20mm ph 8.0tris-hcl,10mm edta,0.4mm dntps,0.04u/μl taq dna聚合酶,3%(v/v)二甲基亚砜,12%(v/v)甘油,0.02%(m/v)溴酚蓝(bromophenol blue),0.02%(m/v)二甲苯腈蓝ff(xylene cyanol ff)。
65.所述的ssr引物指的是20个ssr标记的引物序列,引物的浓度为10μm;20个ssr标记及其对应的引物序列如下:
66.第一个ssr标记位于水稻日本晴参考基因组1号染色体8329860-8330052位置,长度193bp,扩增前引物序列如seq id no:1所示,后引物序列如seq id no:2所示;
67.第二个ssr标记位于水稻日本晴参考基因组2号染色体8760433-8760557位置,长度125bp,前引物序列如seq id no:3所示,后引物序列如seq id no:4所示;
68.第三个ssr标记位于水稻日本晴参考基因组3号染色体36348164-36348246位置,长度83bp,前引物序列如seq id no:5所示,后引物序列如seq id no:6所示;
69.第四个ssr标记位于水稻日本晴参考基因组4号染色体18996785-18996891位置,
长度107bp,前引物序列如seq id no:7所示,后引物序列如seq id no:8所示;
70.第五个ssr标记位于水稻日本晴参考基因组10号染色体9818621-9818784位置,长度164bp,前引物序列如seq id no:9所示,后引物序列如seq id no:10所示;
71.第六个ssr标记位于水稻日本晴参考基因组12号染色体2433238-2433453位置,长度216bp,前引物序列如seq id no:11所示,后引物序列如seq id no:12所示;
72.第七个ssr标记位于水稻日本晴参考基因组1号染色体6154019-6154166位置,长度148bp,前引物序列如seq id no:13所示,后引物序列如seq id no:14所示;
73.第八个ssr标记位于水稻日本晴参考基因组2号染色体35141668-35141836位置,长度169bp,前引物序列如seq id no:15所示,后引物序列如seq id no:16所示;
74.第九个ssr标记位于水稻日本晴参考基因组5号染色体36910796-26910946位置,长度151bp,前引物序列如seq id no:17所示,后引物序列如seq id no:18所示;
75.第十个ssr标记位于水稻日本晴参考基因组7号染色体21872196-21872349位置,长度154bp,前引物序列如seq id no.19所示,后引物序列如20所示;
76.第十一个ssr标记位于水稻日本晴参考基因组8号染色体6763702-6763889位置,长度188bp,前引物序列如seq id no:21所示,后引物序列如seq id no:22所示;
77.第十二个ssr标记位于水稻日本晴参考基因组9号染色体7888400-7888602位置,长度203bp,前引物序列如seq id no:23所示,后引物序列如seq id no:24所示;
78.第十三个ssr标记位于水稻日本晴参考基因组3号染色体9755616-9755778位置,长度163bp,前引物序列如seq id no:25所示,后引物序列如seq id no:26所示;
79.第十四个ssr标记位于水稻日本晴参考基因组4号染色体21414515-21414681位置,长度167bp,前引物序列如seq id no:27所示,后引物序列如seq id no:28所示;
80.第十五个ssr标记位于水稻日本晴参考基因组6号染色体5426496-5426630位置,长度135bp,前引物序列如seq id no:29所示,后引物序列如seq id no:30所示;
81.第十六个ssr标记位于水稻日本晴参考基因组7号染色体2876165-2876333位置,长度169bp,前引物序列如seq id no:31所示,后引物序列如seq id no:32所示;
82.第十七个ssr标记位于水稻日本晴参考基因组8号染色体17945061-17945202位置,长度142bp,前引物序列如seq id no:33所示,后引物序列如seq id no:34所示;
83.第十八个ssr标记位于水稻日本晴参考基因组9号染色体19320299-19320450位置,长度152bp,前引物序列如seq id no:35所示,后引物序列如seq id no:36所示;
84.第十九个ssr标记位于水稻日本晴参考基因组10号染色体18085499-18085630位置,长度132bp,前引物序列如seq id no:37所示,后引物序列如seq id no:38所示;
85.第二十个ssr标记位于水稻日本晴参考基因组11号染色体27673250-27673372位置,长度123bp,前引物序列如seq id no:39所示,后引物序列如seq id no:40所示。
86.表1二十个ssr位点的引物序列
87.88.[0089][0090]
所述用于检测常规水稻种子纯度试剂盒的使用方法,步骤如下:
[0091]
(1)采用实施例1的方法提取待检测水稻种子样品的dna;
[0092]
(2)使用上述的试剂盒,以步骤(1)提取的dna为模板,分别对20个ssr分子标记进行检测,配制pcr反应体系,进行pcr反应;其中,pcr采用10μl体系,具体包含pcrmix5μl,10μm的前后引物各0.5μl,1μl步骤(1)提取的dna粗提液,3μl的水;pcr反应程序为:94℃预变性5min;94℃变性30s,50-65℃退火30s,72℃延伸30s,循环28-33次;72℃延伸7min;10℃保存;
[0093]
(3)聚丙烯酰胺凝胶电泳检测
[0094]
按照表2中的组分,配制6%聚丙烯酰胺凝胶:
[0095]
表2
[0096]
组分体积(ml)29%丙烯酰胺 1%甲叉双丙烯酰胺凝胶母液205
×
tbe缓冲液20temed0.110%过硫酸铵溶液1水60
[0097]
混匀后将凝胶溶液灌至玻璃板中,插上样品梳,等待凝固。凝胶凝固后将其装至电泳槽中,加入0.5
×
tbe电泳缓冲液,取下样品梳,将步骤(2)的pcr产物1μl加至样品孔中,以50bp dna ladder作标准分子量,300v电泳90min。电泳结束后取下玻璃板,将凝胶在水中剥离,染色剂银染10min,蒸馏水冲洗4-5遍后,显色剂显色至条带清晰,蒸馏水漂洗后于胶片观察灯上观察。其中染色剂包含0.2%硝酸银,显色剂包含2%氢氧化钠和0.2%甲醛。
[0098]
其中,随机5个单株在标记10位点的扩增结果如图2所示,结果表明标记条带清晰,dna及试剂盒可用于ssr标记检测。
[0099]
实施例3
[0100]
一种检测常规水稻种子纯度的方法,步骤如下:
[0101]
(1)从待测的常规水稻种子中,随机抽取100粒种子作为检测对象;采用实施例1的方法提取待检测水稻种子样品的dna,将所提样品的dna依次编号为1-100,每10粒种子dna为1组进行等量混样,100粒种子总共可混样为10个dna池,分别以这10个dna池为模板,采用
[0120]
经上述检测发现编号4、71的种子存在2处差异位点,为“假种子”,编号55的种子存在1处差异位点,为疑似此品种种子。
[0121]
(5)种子纯度计算
[0122]
根据上述(4)中的判断结果,在100粒种子中存在“假种子”2粒,疑似此品种种子1粒,此品种种子97粒,种子纯度98%。
[0123]
以上所述,仅是本发明的较佳实施例而已,并非是对本发明作其它形式的限制,任何熟悉本专业的技术人员可能利用上述揭示的技术内容加以变更或改型为等同变化的等效实施例。但是凡是未脱离本发明技术方案内容,依据本发明的技术实质对以上实施例所作的任何简单修改、等同变化与改型,仍属于本发明技术方案的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。