1.本发明涉及药敏检测技术领域,具体地,本发明涉及一种基于肿瘤类器官模型的药物效应检测方法。
背景技术:
2.肿瘤领域的精准医疗旨在鉴定个体特异性的分子病理改变来进行指导用药,最大可能使肿瘤患者获得临床受益。大量的研究已经在临床前模型(细胞系,类器官以及异种移植瘤)上取得了突破性的进展:明确的分子改变可以作为生物标记,鉴定出特定药物的最适人群。目前,临床上已经将分子诊断用于肺癌、结肠癌、皮肤癌、乳腺癌和卵巢癌的靶向用药指导。新一代测序技术用于测序大量病人肿瘤样本中的癌基因,以便于医生做出临床决策。截至目前,pauli应用外显子测序技术,对500例晚期癌症患者的769个原发灶和转移位点样本进行测序和分析,并给出治疗决策。然而仅有不到10%的突变真正引起了癌症,不到1%的突变是可以被fda认证药物所调控的,这就给药物应用带来了局限性。尽管如此,pauli的数据显示,仍有很多病人并不能从基因检测中获得临床受益。对于那些晚期的癌症患者,或者那些经过基因检测却未能给出有效用药方案的患者,则需另寻他法。对于这些没有或者仅有少数临床选择的病人,利用新技术扩增病人源的肿瘤细胞,建立体内或体外模型从而提供一个直接高通量筛选敏感药物的机会。
3.类器官是将具有干性潜能的细胞进行3d培养,从而形成相应器官的类似组织。类器官能最大程度地模拟体内组织结构及功能并能长期传代培养。目前已成功建立了肺、胃、小肠、大肠、肝脏、胰腺、前列腺等类器官模型。与正常组织类似,肿瘤组织也可以利用3d培养体系获得肿瘤类器官(pdo),肿瘤类器官的遗传背景与其来源肿瘤组织遗传背景高度一致,在基因表达谱、蛋白质谱、病理形态、肿瘤异质性等方面很好地模拟患者原位肿瘤。2018年science杂志一项最新研究表明,肿瘤类器官对药物的反应与胃肠道肿瘤患者临床疗效高度一致,提示88%阳性预测率,100%的阴性预测率,这为肿瘤类器官作为精准医疗的筛药工具提供了有力的支撑。
4.目前肿瘤病人的常规治疗还是放疗,化疗和小分子抑制剂,但常规治疗副作用比较大,如果不选对药物,病人面临的局面不是“伤敌1000,自损800”,而是“伤敌100,自损800”甚或不伤敌而只有自损。因此采用某种技术手段为病人筛选出肿瘤敏感药物一直是临床和科研想解决的难题,人源肿瘤异种移植(pdx)模型筛药就是其中之一,但是pdx筛药成本巨大,整个筛药过程时间太长,基本要3-4个月,肿瘤病人基本不能承受这种时间成本,同时pdx模型的成功率相对较低且需要大量肿瘤组织。pdo模型相对于pdx模型在成本和时间上有较大优势,筛药时间基本在3-4周,pdx筛3-5个药的费用,pdo可以筛20-30种药物,同时pdo对肿瘤样本的大小要求没有pdx高。
5.目前全世界尚无对肿瘤类器官体外药物效应检测方法的统一标准,本发明提供针对不同类型肿瘤类器官的体外药物效应检测方法,从而制定出肿瘤类器官体外药敏方法的一个中国标准,为肿瘤病人的临床治疗提供可及性药物的参考。
技术实现要素:
6.为解决上述技术问题,本发明提供一种针对不同类型的肿瘤的类器官制备用于抗癌药物检测的方法。
7.第一方面提供一种针对腺腔型肿瘤类器官的药物效应检测方法。
8.培养获得腺腔型肿瘤类器官,选择培养状态最佳的类器官,将所述最佳类器官与特定抗肿瘤药物混合,并且根据类器官对药物的反应,衡量类器官对药物的敏感性。
9.上述所述药物效应检测方法具体步骤如下:
10.1).获得腺腔型肿瘤类器官,筛选培养效果最佳的类器官;
11.2).将所述类器官机械法与matrigel混合重培养;
12.3).待类器官生长至需要大小时,添加待测药物,继续培养;
13.4).自接入药物时起监控类器官生长状态,根据生长状态判定类器官对药物的敏感程度。
14.优选的,上述步骤1)中,培养效果最佳类器官的评价标准是:机械法稳定传代3代以上;每次传代类器官形成率90%以上;每次传代时间稳定在6-9天;
15.优选的,上述步骤2)中,在重培养前,将类器官与原有的matrigel分离;进一步优选的,所述分离操作为离心;
16.优选的,上述步骤3)中,重培养获得的类器官生长至直径30-50μm时,添加药物混合培养;
17.优选的,上述步骤4)中,自添加药物0时起,对类器官拍照;
18.进一步优选的,上述步骤4)中,判定标准为使用图像软件比较加药组和对照组类器官存活面积和/或进行cck8细胞活力检测。
19.第二方面提供一种针对实心球型肿瘤类器官的药物效应检测方法。
20.具体步骤如下:
21.1).获得实心球型肿瘤类器官,筛选培养效果最佳的类器官;
22.2).将所述类器官酶解消化后与matrigel混合重培养;
23.3).待类器官生长至需要大小时,添加待测药物,继续培养;
24.4).自接入药物时起监控类器官生长状态,根据生长状态判定类器官对药物的敏感程度。
25.优选的,上述方法中,步骤1)中,培养效果最佳类器官的评价标准是:酶解法稳定传代3代以上;每次传代类器官形成率90%以上;每次传代时间稳定在6-9天;
26.优选的,上述步骤2)中,在重培养前,将类器官与原有的matrigel分离;进一步优选的,所述分离操作为离心;
27.优选的,上述步骤2)中,所述酶解消化使用的是tryple
tm express;酶解消化条件为37℃孵育10-30min;
28.优选的,上述步骤2)中,重培养过程中,调整酶解消化后的肿瘤细胞数目至50-100/μl;
29.优选的,上述步骤3)中,重培养获得的类器官生长至直径15-30μm时,添加药物混合培养;
30.优选的,上述步骤4)中,自添加药物0时起,对类器官拍照;
31.进一步优选的,上述步骤4)中,判定标准为使用图像软件比较加药组和对照组类器官存活面积和/或进行cck8细胞活力检测。
32.本发明和现有技术相比,具有以下有益效果:
33.本发明公开的药物效应检测方法中,采用图像法和cck8细胞活性进行检测,其检测结果与现有技术中常用的atp法吻合,且操作简便。其中,图像法相比较现有技术中的atp法节约培养成本和其他耗材成本,而cck8法能够明显缩短培养检测时间。本发明的药物效应检测方法为耐药性肿瘤治疗提供了更易推广的替代药物选择方法。
附图说明
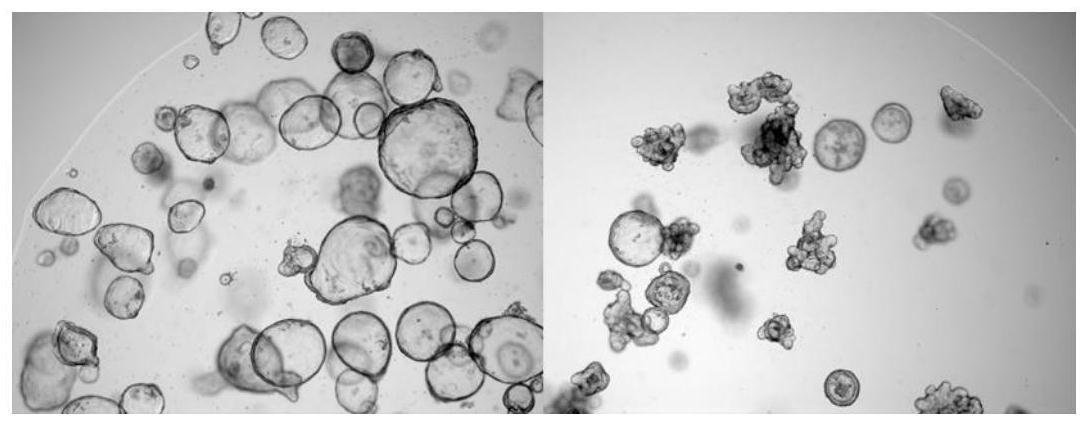
34.图1为结直肠癌类器官最佳形态。
35.图2为结直肠癌类器官生长处于较优状态。
36.图3-4为结直肠癌病人临床治疗预后。
37.图5-6为结直肠癌类器官药敏筛选结果。
38.图7为肺腺癌类器官最佳形态。
39.图8为肺腺癌类器官生长处于较优状态。
40.图9-11为肺腺癌病人临床治疗预后。
具体实施方式
41.下面将结合示意图对本发明公开的肿瘤类器官药物效应检测方法进行更详细的描述,其中表示了本发明的优选实施例,应该理解本领域技术人员可以修改在此描述的本发明,而仍然实现本发明的有利效果。因此,下列描述应当被理解为对于本领域技术人员的广泛知道,而并不作为对本发明的限制。
42.肿瘤培养过程使用的培养基为选择的肿瘤类器官培养基。
43.实施例1、结直肠癌类器官体外药物效应检测
44.1.结直肠癌类器官状态最佳时,去除培养基,每孔添加1ml冰pbs,机械吹打胶滴直至破碎;
45.2.根据需要将6-12孔的结直肠癌类器官移入50ml离心管,800g
×
5min离心,去除上清和部分残存胶;
46.3.添加10-15ml冰pbs,反复吹打清洗,500g
×
5min离心,去除上清,此过程重复2-3次;
47.4.去尽上清残留,加入100-150μl冰matrigel重悬结直肠癌类器官,吹打均匀,取5μl胶液计数结直肠癌类器官碎片数目,调整结直肠癌类器官碎片数目至5-10/μl;
48.5.96孔板接种5-15μl胶液,待胶滴凝固后加入200μl相应结直肠癌类器官培养基,每天观察结直肠癌类器官生长状态;
49.6.结直肠癌类器官生长至直径30-50μm时,特定成像系统拍摄所有类器官初始图片,更换200μl不同单药或组合药物的结直肠癌类器官培养基;
50.7.药物作用第6,12天,特定成像系统拍摄所有结直肠癌类器官中期图片,更换200μl结直肠癌类器官培养基;
51.8.第18天时特定成像系统拍摄所有结直肠癌类器官末期图片;
52.9.图像软件统计分析初始,中期,末期结直肠癌类器官存活面积s
(d0)
,s
(d6)
,s
(d12)
,s
(d18)
。计算s
(d6)
/s
(d0)
,s
(d12)
/s
(d0)
,s
(d18)
/s
(d0)
比值,比值越小药物抑制效果越好,并且整个过程也使用细胞活性检测法(atp法)进行体外药物效应筛选。
53.其中,步骤1中,选择机械法稳定传代3代以上;每次传代类器官形成率90%以上;每次传代时间稳定在6-9天作为结直肠癌类器官最佳状态选择标准,结果如图1所示。
54.结果:
55.腺腔型肿瘤类器官一般接种1-3天可达到直径30-50μm生长状态,此直径大小与肿瘤类器官密度相配合可使类器官生长处于较优状态(图2,40
×
),适合作为腺腔型肿瘤类器官药物干预的初始期(day0),腺腔型肿瘤类器官对药物的反应短期变化不明显,观察时段相对较长。
56.运用image j统计所有肿瘤类器官面积s
(d0)
,s
(d6)
,s
(d12)
,s
(d18)
。我们发现如果结直肠癌类器官在体外能被临床使用的药物组合持续抑制,s
(d18)
/s
(d0)
能在50%以下,病人临床治疗可以获得非常好的预后(图3);如果结直肠癌类器官对临床药物组合持续无反应则病人临床治疗效果也较差(图4),表明结直肠癌类器官体外药物效应与病人临床治疗效果有很好的一致性。
57.对结直肠癌类器官进行多种药物和药物组合的测试,发现敏感性结直肠癌类器官对各种单一药物都能做出不同的反应,药物组合的抑制效应则出现的更早,抑制效果持续更久(图5);而耐受性结直肠癌类器官对各种药物几乎无应答,组合用药也无法抑制其生长(图6),凸显出寻找指南外药物的急迫性。
58.将图像法药筛与atp法相比,发现两者基本趋势一致,但是atp法初始类器官量是图像法的4-5倍,培养成本是3-4倍,额外采用的细胞活性检测试剂盒价格也昂贵,图像法更易于推广使用。
59.实施例2、肺腺癌类器官体外药物效应检测
60.1.肺腺癌类器官状态最佳时,去除培养基,每孔添加1ml冰pbs,机械吹打胶滴直至破碎;
61.2.根据需要将2-4孔的肺腺癌类器官移入50ml离心管,800g
×
5min离心,去除上清和部分残存胶;
62.3.添加tryple
tm
express1-5ml,37℃孵育10-30min;
63.4.添加10-15ml冰pbs,反复吹打,500g
×
5min离心,去除上清,此过程重复2-3次;
64.5.去尽上清残留,加入取200-300μl冰matrigel重悬肺腺癌类器官,吹打均匀,取5μl胶液计数肺腺癌细胞数目,调整肺腺癌细胞数目至50-100/μl;
65.6.96孔板接种5-10μl胶液,待胶滴凝固后加入200μl相应肿瘤类器官培养基,每天观察肺腺癌类器官生长状态;
66.7.肺腺癌类器官生长至直径15-30μm时,cck8细胞活力检测cck8
(d0)
和特定成像系统拍摄所有类器官初始图片,更换含200μl不同单药或组合药物的肺腺癌类器官培养基;
67.8.药物作用第6天,cck8细胞活力检测cck8
(d6)
和特定成像系统拍摄所有肺腺癌类器官末期图片;
68.9.图像软件统计分析初始,末期肺腺癌类器官存活面积s
(d0)
,s
(d6)
。计算s
(d6)
/s
(d0)
比值,同时分析cck8法测试的cck8
(d6)
/cck8
(d0)
比值,比值越小药物抑制效果越好。
69.其中,步骤1中,选择肺腺癌类器官最佳状态判断标准:酶消化法稳定传代3代以上;每次传代类器官形成率90%以上;每次传代间隔时间为6-12天;肺腺癌类器官生长最佳状态,结果如图7所示。
70.肺腺癌类器官一般接种3-5天可达到直径15-30μm生长状态,此直径大小与肿瘤类器官密度相配合可使类器官生长处于较优状态(图8,40
×
),适合作为肺腺癌类器官药物干预的初始期(day0),肺腺癌类器官对药物的反应短期变化明显,观察时段相对较短,并摄取图片和cck8数据后,更换含有药物的类器官培养基;此后摄取day6的类器官图片和cck8数据。
71.结果
72.运用image j统计所有肿瘤类器官面积s
(d0)
和s
(d6)
。我们发现相对于对照组,肺腺癌类器官生长率在体外被抑制最高的药物或药物组合,病人临床用于治疗可以获得非常好的效果(图9,阿法替尼有效);但是治疗一段时间,病人对临床药物耐受,再次穿刺获得的复发肺腺癌类器官体外药敏发现,原有药物已经无法持续抑制复发肺腺癌类器官生长,患者肺腺癌也明显生长(图10,阿法替尼耐受),同时我们发现培美曲塞 卡铂可以明显抑制复发肺腺癌类器官,病人临床采用此治疗方案两月,患者肺腺癌肿瘤生长受到抑制,复发肿瘤明显缩小(图11,培美曲塞联合卡铂有效),表明肺腺癌类器官体外药物效应与病人临床治疗效果有很好的一致性。
73.cck8法相较于图像分析法,在实心球型肿瘤类器官药敏结果上两者基本趋势一致,培养成本一致,cck8法虽然增加了成本,但可以缩短药敏筛选时间。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。