一种采用lc-ms法检测血浆中氨氯地平、氯沙坦及其代谢物氯沙坦羧酸的方法
技术领域
1.本发明涉及药物分析技术领域,具体涉及一种液相色谱-串联质谱法检测血浆中氨氯地平、氯沙坦及其代谢物氯沙坦羧酸的方法。
背景技术:
2.使用复方氨氯地平片(每片含相当于氨氯地平5mg的苯磺酸氨氯地平、以及50mg的氯沙坦钾)后血浆有效成分为氨氯地平、氯沙坦及其代谢产物氯沙坦羧酸(exp-3174)。其中氨氯地平(amlodipine,adp)化学名为6-甲基-2-(2-氨基乙氧基)甲基-4-(2-氯苯基)-1,4-二氢-3,5-吡啶二甲酸甲乙酯,分子式为c
20h25
cln2o5,属于二氢吡啶类钙通道阻滞剂类的抗高血压药物,能够抑制钙离子跨膜进入血管平滑肌和心肌;氯沙坦(losartan,lst)分子式为c
22h23
cln6o,是血管紧张素ii受体拮抗剂类的抗高血压药物,氯沙坦及其具有药理活性的羧酸代谢产物(exp-3174,分子式为c
22h21
cln6o2)可以阻断任何来源或任何途径合成的血管紧张素ii所产生的相应的生理作用。氨氯地平与氯沙坦均为抗高血压的一线药物,氨氯地平联合氯沙坦在临床治疗中疗效显著。现有技术对单一成分的检测方法已经相当成熟,故开发一种同时对复方制剂中三个成分的检测并经过充分验证的且适用性高的分析方法是势在必行的。
3.现有对三个成分同时进行检测的技术“simultaneous determination of losartan,losartan acid and amlodipine in human plasma by lc-ms/ms and its application to a human pharmacokinetic study”公开一种采用lc-ms检测血浆中氨氯地平、氯沙坦及其代谢物氯沙坦羧酸的方法,采用固相萃取技术用于血浆样品的预处理,该方法使用固相萃取小柱成本较高,且可能需要专业人员协助进行方法开发,不便于大规模的推广。因此,有必要开发一种快速灵敏且价格低廉的lc-ms/ms方法,可同时检测氨氯地平、氯沙坦及其活性代谢物氯沙坦羧酸。
技术实现要素:
4.本发明的目的在于提供一种采用液相色谱-串联质谱法(hplc-ms/ms)检测血浆样品中氨氯地平、氯沙坦及其代谢物氯沙坦羧酸的方法。该方法仅用少量血浆不但可以检测氨氯地平(简称“adp”)的含量,而且还可以同时检测氯沙坦(简称“lst”)及其的活性代谢物氯沙坦羧酸(简称“exp-3174”)的含量,并根据“生物样品定量分析验证指导原则”进行验证。本文中的hplc-ms/ms也称“lc-ms”或“lc-ms/ms”。
5.为实现本发明的目的,提供如下实施方案。
6.本发明的一种采用lc-ms法检测血浆中氨氯地平、氯沙坦及其代谢物氯沙坦羧酸的方法,该方法包括以下步骤:
7.(1)取血浆样品,加入含有氨氯地平、氯沙坦及氯沙坦羧酸的内标工作液并混匀,获得混合血浆样品,备用;
8.(2)取步骤(1)的部分混合血浆样品,加入蛋白沉淀剂0.1%甲酸乙腈溶液,振摇、离心、取上清液即得氯沙坦及氯沙坦羧酸样品,备用;
9.(3)取步骤(1)剩余部分混合血浆样品,用氢氧化钠溶液碱化样品,加入萃取剂乙酸乙酯进行萃取,取上清液,在氮气下挥干即得氨氯地平样品;
10.(4)将步骤(3)获得的氨氯地平样品,用步骤(2)的上清液复溶,加入超纯水混匀,注入lc-ms/ms仪检测,其中,
11.色谱柱为beh c8柱,以氨水-甲酸-水溶液为流动相a,以氨水-甲酸-水-乙腈溶液为流动相b,采用梯度洗脱法。
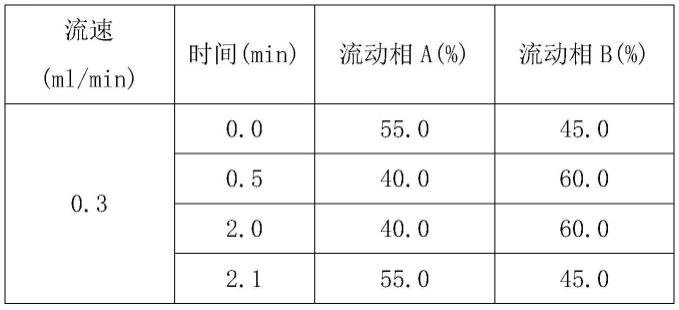
12.优选的,上述本发明的方法,所述流动相a为0.02%氨水-0.1%甲酸-水溶液,所述流动相b为0.02%氨水-0.1%甲酸-10%水-乙腈溶液;所述梯度洗脱法,其梯度变化如下:
[0013][0014][0015]
上述本发明的方法,步骤(2)具体包括:将混合血浆样品与蛋白沉淀剂0.1%甲酸乙腈溶液混合后,振摇5min,12700rpm.min-1
,8℃离心15min,取离心后的上清液样品,即得氯沙坦及氯沙坦羧酸样品,备用;步骤(3)具体包括,在混合血浆样品中加入氢氧化钠溶液碱化样品,加入萃取溶剂乙酸乙酯混合,振摇5min,12700rpm.min-1
,8℃离心5min,取上清液在氮气下蒸发,蒸发温度为45℃,干燥残留品,即得氨氯地平样品。
[0016]
优选的,上述本发明的方法,步骤(2)中,血浆样品与0.1%甲酸乙腈溶液的体积比为5:7;步骤(3)中所述氢氧化钠溶液为1mol.l-1
氢氧化钠溶液,血浆样品与1mol.l-1
氢氧化钠溶液的体积比约为2:1,血浆样品与萃取剂乙酸乙酯的体积比约为1:5,取上清液(在氮气下蒸发)的量(体积)与萃取剂乙酸乙酯的体积比为17:20;步骤(4)中,上清液与超纯水的体积比为6:1。
[0017]
优选的,上述本发明的方法,其色谱条件为:流速0.3ml/min,柱温45℃,进样量2μl;其质谱条件包括:离子模式为esi
,毛细管电压1.0kv,去溶剂温度450℃,去溶剂流速1000l/hr,离子源温度150℃,反吹流速150l/hr,分析室气体6.0bar。
[0018]
更优选的,上述本发明的方法,步骤(1)的血浆量为0.2ml,步骤(2)的部分混合血浆样品为0.05ml。
[0019]
上述本发明的方法,步骤(1)中,所述加入内标,包括在血浆中加入50μl内标混合工作液混匀,所述内标混合工作液为20ng.ml-1
的氨氯地平-d4、200ng.ml-1
的氯沙坦-d4和600ng.ml-1
的氯沙坦羧酸-d4溶液,其溶剂为体积比甲醇:水=1:1的混合溶剂。
[0020]
在一具体实施方案中,本发明提供一种采用lc-ms法检测血浆中氨氯地平、氯沙坦及其代谢物氯沙坦羧酸的方法,该方法包括以下步骤:
[0021]
(1)取血浆样品加入含氨氯地平、有氯沙坦及氯沙坦羧酸的内标工作液并混匀,得到混合血浆样品;
[0022]
(2)分装步骤(1)的一部分混合血浆样品,加入蛋白沉淀剂0.1%甲酸乙腈溶液,振摇,离心、取上清液,得到氯沙坦及氯沙坦羧酸样品,备用;
[0023]
(3)将步骤(1)的剩余部分混合血浆样品用氢氧化钠溶液碱化,加入萃取剂乙酸乙酯进行萃取;取上清液挥干得到氨氯地平样品;
[0024]
(4)将步骤(3)的氨氯地平样品,用(2)的上清液复溶后,加入超纯水混匀,注入lc-ms/ms仪检测;
[0025]
其中,色谱柱为beh c8柱,流动相a为0.02%氨水-0.1%甲酸-水溶液,为流动相b为0.02%氨水-0.1%甲酸-10%水-乙腈溶液,采用梯度洗脱法,其中,其梯度变化如下:
[0026][0027]
在一些具体实施方案中,上述本发明的方法,步骤(1)具体包括:取血浆样品,加入含有氨氯地平、氯沙坦及氯沙坦羧酸三种成分对应的内标混合工作液,振摇混匀,得到混合血浆样品。步骤(2)具体包括分装一部分混合血浆样品,加入蛋白沉淀剂0.1%甲酸乙腈溶液,振摇、离心后,取上清液即得氯沙坦与氯沙坦羧酸样品。
[0028]
在一些具体实施方案中,优选的,上述本发明的方法,步骤(2)中所述的蛋白沉淀具体包括:血浆样品与蛋白沉淀剂0.1%甲酸乙腈溶液混合后,振摇5min,12700rpm.min-1
,8℃离心15min,取离心后,取上清液样品,备用。
[0029]
优选的,上述本发明的方法,步骤(2)中,部分血浆样品与蛋白沉淀剂的体积比为5:7,所述分装的部分混合血浆为0.05ml。
[0030]
在一优选具体实施方案中,上述本发明的方法,步骤(1)中,血浆量为0.2ml,加入50μl内标混合工作液混匀,所述内标混合工作液为20ng.ml-1
的氨氯地平-d4、200ng.ml-1
的氯沙坦-d4和600ng.ml-1
的氯沙坦羧酸-d4溶液,其溶剂为体积比甲醇:水=1:1的混合溶剂。
[0031]
上述本发明的方法,步骤(3)具体包括:剩余部分混合血浆样品,加入氢氧化钠溶液碱化样品,再加入萃取溶剂乙酸乙酯,振摇、离心,取上清液,在氮气下蒸发至干燥即得氨氯地平样品残渣。
[0032]
优选的,上述本发明的方法,步骤(3)中,剩余血浆样品与氢氧化钠溶液的体积比约为2:1,所述氢氧化钠溶液为1mol.l-1
。
[0033]
优选的,上述本发明的方法,步骤(3)的萃取具体包括:混合血浆样品与萃取溶剂混合后,振摇5min,12700rpm.min-1
,8℃离心5min,取上清液在氮气下蒸发,蒸发温度为45℃,干燥残留品,其中,剩余混合血浆样品与萃取溶剂的体积比约为1:5,更优选的,所述取上清液(在氮气下蒸发)的量与萃取剂乙酸乙酯的体积比为17:20。
[0034]
上述本发明的方法,步骤(4)具体包括:取步骤(2)的含有氯沙坦与氯沙坦羧酸样品的上清液溶解步骤(3)的氨氯地平样品残渣,再加入超纯水混匀,取上清液注入lc-ms/ms仪检测,其中,蛋白沉淀上清液与超纯水的体积比为6:1。
[0035]
上述本发明的方法,其色谱条件为:流速0.3ml/min,柱温45℃,进样量2μl;其质谱条件包括:离子模式为esi
,毛细管电压1.0kv,去溶剂温度450℃,去溶剂流速1000l/hr,离子源温度150℃,反吹流速150l/hr,分析室气体6.0bar。
[0036]
在一具体实施方案中,一种采用lc-ms法检测血浆中氨氯地平、氯沙坦及其代谢物氯沙坦羧酸的方法,该方法包括以下步骤:
[0037]
(1)血浆样品加入内标及分装处理,包括:
[0038]
取0.2ml血浆样品,加入50μl内标混合工作液,混匀,得到混合血浆样品;所述内标工作液为20ng.ml-1
的氨氯地平-d4、200ng.ml-1
的氯沙坦-d4和600ng.ml-1
的氯沙坦羧酸-d4溶液,其溶剂为体积比甲醇:水=1:1的混合溶剂;
[0039]
(2)lst和exp-3174的提取物的获得,包含:取50μl混合血浆样品至另一ep管中,加入70μl 0.1%甲酸乙腈溶液沉淀,振摇5min、离心15min(12700rpm,8℃),上清液即为lst和exp-3174的提取物样品;
[0040]
(3)adp的萃取物的获得,包含:在剩余混合样品中加入1mol.l-1
氢氧化钠溶液100μl,混匀,再加入1ml乙酸乙酯,振摇5min、离心5min(12700rpm,8℃),取上清液0.85ml到2ml的ep管中,于45℃的氮气下蒸发至干燥(挥干)即得adp样品;
[0041]
(4)adp萃取物的复溶,包括:取60μl步骤(2)中lst和exp-3174的提取物上清液溶解步骤(3)的adp样品,再加入10μl超纯水混匀,复溶液注入lc-ms/ms仪检测,
[0042]
其中,lc-ms/ms的色谱条件和质谱条件为:
[0043]
所述色谱条件包括:以0.02%氨水-0.1%甲酸-水溶液为流动相a,0.02%氨水-0.1%甲酸-10%水-乙腈溶液为流动相b,以acquity uplc beh c8 2.1x50mm,1.7μm为色谱柱,流速0.3ml/min,柱温45℃,进样量2μl,采用梯度洗脱,其梯度变化如下:
[0044][0045]
所述质谱条件包括:离子模式:esi
;毛细管电压:1.0kv;去溶剂温度:450℃;去溶
剂流速:1000l/hr;离子源温度:150℃;反吹流速:150l/hr;分析室气体:6.0bar。
[0046]
优先的,在上述具体实施方案中,本发明的方法,所述色谱条件还包括:用于定量的离子反应分别为m/z 409.09/238.05(氨氯地平)、锥孔电压5v、碰撞能量12ev,m/z 412.92/237.88(氨氯地平-d4)、锥孔电压5v、碰撞能量12ev;m/z 422.94/206.94(氯沙坦)、锥孔电压29v、碰撞能量10ev,m/z 426.95/210.94(氯沙坦-d4)、锥孔电压21v、碰撞能量15ev;m/z 436.81/234.92(exp-3174)、锥孔电压14v、碰撞能量16ev,m/z 440.96/238.96(exp-3174-d4)、锥孔电压36v、碰撞能量14ev。
[0047]
令人惊奇的是,本发明的方法,因采用lst及代谢物exp-3174的蛋白提取液作为adp萃取物挥干物的复溶溶剂,不但可以提高检测限,减少血浆量,而且还可同时提取出adp、lst和exp-3174,并在同一个用时较短的液相梯度下同时检测adp、lst和exp-3174三个组分,使本发明的方法在血浆用量低到0.2ml时也能实现检测。
[0048]
本发明的有益效果:
[0049]
(1)本发明针对氨氯地平、氯沙坦及氯沙坦羧酸的性质,可以使用液相色谱-串联质谱法测定。
[0050]
(2)本发明新开发的液液萃取结合蛋白沉淀的方法,能同时提取出氨氯地平、氯沙坦及氯沙坦羧酸三种组分,比分别处理血浆样品更简单,经济,使用更少的血浆样品;也比固相萃取小柱处理血浆样品成本更低,更容易推广;并对色谱条件进行优化,使氨氯地平、氯沙坦及氯沙坦羧酸三个待测组分在同一个液相色谱条件上保留显著,避免内源性物质的干扰。可以用在氨氯地平、氯沙坦及氯沙坦羧酸的药物代谢研究与生物等效性研究。
附图说明
[0051]
图1为氨氯地平[m h]
的产物离子扫描图;
[0052]
图2为氨氯地平-d4[m h]
的产物离子扫描图;
[0053]
图3为氯沙坦[m h]
的产物离子扫描图;
[0054]
图4为氯沙坦-d4[m h]
的产物离子扫描图;
[0055]
图5为氯沙坦羧酸[m h]
的产物离子扫描图;
[0056]
图6为exp-3174-d4[m h]
的产物离子扫描图;
[0057]
图7为空白血浆样品中氨氯地平(图7-1)和定量下限样品中氨氯地平(图7-2)的典型色谱图;
[0058]
图8为空白血浆样品中氨氯地平-d4(图8-1)和定量下限样品中氨氯地平-d4(图8-2)的典型色谱图;
[0059]
图9为空白血浆样品中氯沙坦(图9-1)和定量下限样品中氯沙坦(图9-2)的典型色谱图;
[0060]
图10为空白血浆样品中氯沙坦-d4(图10-1)和定量下限样品中氯沙坦-d4(图10-2)的典型色谱图;
[0061]
图11为空白血浆样品中氯沙坦羧酸(图11-1)和定量下限样品中exp-3174(图11-2)的典型色谱图;
[0062]
图12为空白血浆样品中exp-3174-d4(图12-1)和定量下限样品中exp-3174-d4(图12-2)的典型色谱图;
[0063]
图13为人体给药后的氨氯地平血浆药物-时间曲线;
[0064]
图14为人体给药后的氯沙坦血浆药物-时间曲线;
[0065]
图15为人体给药后的氯沙坦羧酸血浆药物-时间曲线。
具体实施方式
[0066]
以下实施例是示例性的,旨在对本发明作进一步的详细说明,以助理解本发明的实质。除非另有指明,本文使用的所有技术和科学术语具有与本技术所属技术领域的普通技术人员通常理解相同的含义。
[0067]
以下实施例中所用的试验材料,除非有具体说明,则均为通过商业渠道购买得到的常规的试验材料,其中:
[0068]
苯磺酸氨氯地平(批号:100374-201605,纯度:100%)购于中国食品药品检定研究所;氨氯地平-d4(批号:12-dpp-27-2,化学纯度:98%,同位素纯度:99.30%)购于trc;氯沙坦钾(批号:100597-201102,纯度:99.9%)购于中国食品药品检定研究所;氯沙坦-d4(批号:23-mjc-117-1,化学纯度:97%,同位素纯度:98.80%)购于trc;氯沙坦羧酸(批号:1-bsr-66-2,纯度:93%)购于trc;氯沙坦-d4羧酸(批号:4-jgc-173-2,化学纯度:95%,同位素纯度:98.60%)购于trc;质谱级甲酸购于fisher公司;色谱级甲醇、乙腈均购于德国默克公司;分析纯氨水、氢氧化钠、乙酸乙酯均购于成都科龙;去离子水由milli-q reference超纯水仪制备。
[0069]
waters公司的超高效液相色谱串联四级杆质谱联用仪,型号:uplc i-class/xevo tq-s和waters unifi v1.8数据处理软件;色谱柱为acquity uplc beh c8 2.1x50mm,1.7μm;梅特勒的百万分之一天平;eppendorf的台式多功能离心机;md200-2氮气吹扫仪。
[0070]
实施例1液相色谱-串联质谱法检测血浆中氨氯地平、氯沙坦及其代谢物氯沙坦羧酸
[0071]
1、血浆样品的前处理
[0072]
取0.2ml血浆样品,加入50μl内标混合工作液(制备见下n0.3),混匀后的混合血浆样品取50μl至另一ep管中用于lst及exp-3174样品提取,剩余混合血浆样品用于adp样品提取。在提取adp的血浆样品中加入1mol.ml-1
氢氧化钠溶液100μl,混匀,再加入1ml乙酸乙酯,振摇5min。离心5min(12700rpm.min-1
,8℃),转移adp样品上清液0.85ml,置于2ml ep管中,在45℃的氮气下蒸发至干燥即得adp样品。在提取lst与exp-3174混合血浆样品中加入70μl 0.1%甲酸乙腈溶液沉淀,振摇5min,离心15min(12700rpm.min-1
,8℃),取60μl该上清液溶解所得adp样品残渣,再加入10μl超纯水混匀后取上清液至96孔板中,进行lc-ms/ms分析。结果见图1~图6,分别代表氨氯地平、氨氯地平-d4,氯沙坦、氯沙坦-d4,氯沙坦羧酸、exp-3174-d4的典型质谱图。
[0073]
2、标准系列样品和质控样品的配制
[0074]
(1)氨氯地平储备液的配制
[0075]
分别称取两份苯磺酸氨氯地平标准品(经纯度校准)置5ml容量瓶中,用50%甲醇溶解,定容,获得浓度分别为0.215mg/ml和0.216mg/ml的氨氯地平储备液,一份用于标准系列溶液的配制,一份用于质控溶液的配制。
[0076]
(2)氯沙坦储备液的配制
[0077]
分别称取两份氯沙坦钾标准品(经纯度校准)置5ml容量瓶中,用50%甲醇溶解,定容,获得浓度分别为0.504mg/ml和0.418mg/ml的氯沙坦储备液,一份用于标准系列溶液的配制,一份用于质控溶液的配制。
[0078]
(3)氯沙坦羧酸储备液的配制
[0079]
分别称取两份氯沙坦羧酸标准品(经纯度校准)置5ml容量瓶中,用50%甲醇溶解,定容,获得浓度分别为0.233mg/ml和0.245mg/ml的氯沙坦羧酸储备液,一份用于标准系列溶液的配制,一份用于质控溶液的配制。
[0080]
(4)氨氯地平、氯沙坦和氯沙坦羧酸标准曲线用混合溶液a的配制
[0081]
分别将配制标准曲线用的氨氯地平储备液用50%的甲醇稀释至1600ng/ml,氯沙坦储备液和氯沙坦羧酸储备液分别用50%的甲醇稀释至200μg/ml,再取300μl adp-1600ng/ml工作液,300μl lst-200μg/ml工作液和300μl exp-3174-200μg/ml工作液,加2100μl 50%甲醇溶液,即得标准曲线用混合溶液a(adp-160ng/ml、lst-20μg/ml和exp-3174-20μg/ml)。
[0082]
(5)氨氯地平、氯沙坦和氯沙坦羧酸标准曲线用混合溶液b的配制
[0083]
分别将配制标准曲线用的氨氯地平储备液用50%的甲醇稀释至600ng/ml,氯沙坦储备液和氯沙坦羧酸储备液分别用50%的甲醇稀释至24μg/ml,再取300μl adp-600ng/ml工作液,300μl lst-24μg/ml工作液和300μl exp-3174-24μg/ml工作液,加2100μl 50%甲醇溶液,即得标准曲线用混合溶液b(adp-60ng/ml、lst-2.4μg/ml和exp-3174-2.4μg/ml)。
[0084]
(6)氨氯地平、氯沙坦和氯沙坦羧酸质控用混合溶液a的配制
[0085]
分别将配制质控用的氨氯地平储备液用50%的甲醇稀释至1600ng/ml,氯沙坦储备液和氯沙坦羧酸储备液分别用50%的甲醇稀释至200μg/ml,再取300μl adp-1600ng/ml工作液,300μl lst-200μg/ml工作液和300μl exp-3174-200μg/ml工作液,加2100μl 50%甲醇溶液,即得质控用混合溶液a(adp-160ng/ml、lst-20μg/ml和exp-3174-20μg/ml)。
[0086]
(7)氨氯地平、氯沙坦和氯沙坦羧酸质控用混合溶液b的配制
[0087]
分别将配制质控用的氨氯地平储备液用50%的甲醇稀释至600ng/ml,氯沙坦储备液和氯沙坦羧酸储备液分别用50%的甲醇稀释至24μg/ml,再取300μl adp-600ng/ml工作液,300μl lst-24μg/ml工作液和300μl exp-3174-24μg/ml工作液,加2100μl 50%甲醇溶液,即得质控用混合溶液b(adp-60ng/ml、lst-2.4μg/ml和exp-3174-2.4μg/ml)。
[0088]
(8)标准曲线样品和质控样品的配制
[0089]
分别取标准曲线用混合溶液a/b以及质控用混合溶液a/b,用50%的甲醇稀释获得标准曲线和质控样品的混合工作液,以空白血浆稀释成标准系列血浆样品和质控血浆样品,同时获得
①
浓度分别0.05、0.1、0.5、1、2、4、6.4和8ng/ml的adp标准曲线系列样品,浓度分别为0.05(lloq)、0.15(ql)、0.75(qml)、3(qmh)和6(qh)ng/ml的adp质控样品;
②
浓度分别2、4、20、40、250、500、800和1000ng/ml的lst标准曲线系列样品,浓度分别为2(lloq)、6(ql)、30(qml)、375(qmh)和750(qh)ng/ml的lst质控样品;
③
浓度分别2、4、20、40、250、500、800和1000ng/ml的exp-3174标准曲线系列样品,浓度分别为2(lloq)、6(ql)、30(qml)、375(qmh)和750(qh)ng/ml的exp-3174质控样品。
[0090]
3、内标工作液的配制
[0091]
(1)氨氯地平-d4储备液的配制
[0092]
称取一份氨氯地平-d4标准品(经纯度校准)置5ml容量瓶中,用50%甲醇溶解,定容,获得浓度为0.233mg.ml-1
的氨氯地平-d4储备液。
[0093]
(2)氯沙坦-d4储备液的配制
[0094]
由于氯沙坦-d4规格为1mg,故直接用50%甲醇溶解,转移至5ml容量瓶中,定容,(经纯度校准)获得浓度为0.192mg.ml-1
的氯沙坦-d4储备液。
[0095]
(3)氯沙坦-d4羧酸储备液的配制
[0096]
由于氯沙坦-d4羧酸规格为1mg,故直接用50%甲醇溶解,转移至5ml容量瓶中,定容,(经纯度校准)获得浓度为0.187mg.ml-1
的氯沙坦-d4羧酸储备液。
[0097]
(4)内标混合工作液的配制
[0098]
分别将氨氯地平-d4储备液、氯沙坦-d4储备液和氯沙坦-d4羧酸储备液用50%的甲醇稀释至10μg.ml-1
的内标中间工作液。然后取36μl adp-d4-10μg.ml-1
工作液,360μl lst-d4-10μg.ml-1
工作液,1080μl exp-3174-d4-10μg.ml-1
工作液,再加入50%甲醇溶液16.524ml,混匀,即得20ng.ml-1
的氨氯地平-d4、200ng.ml-1
的氯沙坦-d4和600ng.ml-1
的氯沙坦羧酸-d4混合溶液即内标工作液。
[0099]
4、lc-ms/ms分析:
[0100]
4.1色谱条件
[0101]
采用acquity uplc beh c8 2.1x50mm,1.7μm色谱柱,以0.02%氨水-0.1%甲酸-水溶液为流动相a,0.02%氨水-0.1%甲酸-10%水-乙腈溶液为流动相b,梯度洗脱。在0min时,流动相a:流动相b体积比为55:45,在0min-0.5min时,流动相a与流动相b的体积比由55:45到40:60,在0.5min-2.0min时,流动相a与流动相b的体积比为40:60,在2.0min-2.1min时,流动相a与流动相b的体积比由40:60到55:45,在2.1min-3.0min时,流动相a与流动相b体积比为55:45;流速0.3ml/min;柱温:45℃;进样量:2μl。
[0102]
4.2质谱条件
[0103]
离子模式:esi
;毛细管电压:1.0kv;去溶剂温度:450℃;去溶剂流速:1000l/hr;离子源温度:150℃;反吹流速:150l/hr;分析室气体:6.0bar。用于定量的离子反应分别为:m/z 409.09/238.05(氨氯地平)、锥孔电压5v、碰撞能量12ev,m/z 412.92/237.88(氨氯地平-d4)、锥孔电压5v、碰撞能量12ev;m/z 422.94/206.94(氯沙坦)、锥孔电压29v、碰撞能量10ev,m/z 426.95/210.94(氯沙坦-d4)、锥孔电压21v、碰撞能量15ev;m/z 436.81/234.92(exp-3174)、锥孔电压14v、碰撞能量16ev,m/z 440.96/238.96(exp-3174-d4)、锥孔电压36v、碰撞能量14ev。
[0104]
实施例2方法学验证
[0105]
1.选择性
[0106]
取不同来源的空白血浆0.2ml(n=6),分别用实施例1中的方法处理样品,取(不加内标)样品进行质谱分析,获得空白血浆样品色谱图。取不同来源的空白血浆(n=6)分别配制标准曲线最低点浓度血浆样品0.2ml,用实施例1的方法处理样品,进行质谱分析,标准曲线最低点浓度血浆样品进行质谱分析,评价方法的选择性。
[0107]
结果表明,内源性物质不干扰氨氯地平、氨氯地平-d4、氯沙坦、氯沙坦-d4、exp-3174、exp-3174-d4的测定。典型的空白血浆样品色谱图和典型的lloq色谱图见图7~图12。
[0108]
2.标准曲线
[0109]
以氨氯地平理论浓度为横坐标(x),氨氯地平与内标氨氯地平-d4的面积比为纵坐标(y),进行线性回归计算(权重因子w=1/x2),氨氯地平的典型回归方程为y=0.238*x 0.00159(r2=0.998946),氨氯地平在0.05~8ng/ml线性关系良好。以氯沙坦理论浓度为横坐标(x),氯沙坦与内标氯沙坦-d4的面积比为纵坐标(y),进行线性回归计算(权重因子w=1/x2),氯沙坦的典型回归方程为y=0.00716*x-0.000841(r2=0.999700),氯沙坦在2~1000ng/ml线性关系良好。以氯沙坦羧酸理论浓度为横坐标(x),氯沙坦羧酸与内标exp-3174-d4的面积比为纵坐标(y),进行线性回归计算(权重因子w=1/x2),氯沙坦羧酸的典型回归方程为y=0.0069*x 0.00108(r2=0.999678),氯沙坦羧酸在2~1000ng/ml线性关系良好。
[0110]
3.精密度和准确度
[0111]
方法验证三个分析批,氨氯地平每个分析批检测定量下限样品(lloq:0.05ng/ml)、低(ql:0.15ng/ml)、中低(qml:0.75ng/ml)、中高(qmh:3ng/ml)、高(qh:6ng/ml)水平qc样品各6个;氯沙坦和氯沙坦羧酸每个分析批检测定量下限样品(lloq:2ng/ml)、低(ql:6ng/ml)、中低(qml:30ng/ml)、中高(qmh:375ng/ml)、高(qh:750ng/ml)水平qc样品各6个。计算批内及批间的精密度和准确度。
[0112]
结果表明:本方法测定氨氯地平、氯沙坦及氯沙坦羧酸的精密度和准确度均可接受,氨氯地平的最低定量下限为0.05ng/ml,氯沙坦和氯沙坦羧酸的最低定量下限为2ng/ml。
[0113]
4.回收率与基质效应
[0114]
分析低、中低、高质控样品各6个作为回收率经预处理后样品。同时另取空白血浆0.2ml,加入50μl 50%的甲醇,混匀后取50μl至另一ep管中用于lst及exp-3174提取基质液,剩余混合样品用于adp提取基质液。按血浆样品前处理方法处理,萃取处理完后,按比例取0.802ml的上清液,置于2ml ep管中,加入8μl adp质控工作液(低、中低、高分别为3ng/ml、15ng/ml、120ng/ml),40μl adp内标工作液(adp-d4:20ng/ml),混匀后在45℃的氮气下蒸发至干燥。蛋白沉淀处理完后,按比例取48μl的上清液溶解所得adp样品残渣,加入2μl lst/exp-3174质控混合工作液(低、中低、高分别为120ng/ml、600ng/ml、15000ng/ml),10μl lst-d4/exp-3174-d4内标混合工作液(lst-d4:200ng/ml,exp-3174-d4:600ng/ml),再加入10μl超纯水混匀后取上清液至96孔板中,配制成低、中低、高浓度的回收率未经预处理样品,进行lc-ms/ms分析。2种样品的氨氯地平峰面积比值即为氨氯地平的提取回收率,氯沙坦面积比值即为氯沙坦的提取回收率,氯沙坦羧酸面积比值即为氯沙坦羧酸的提取回收率。结果表明,氨氯地平3个浓度水平的提取回收率为87.95%;氯沙坦3个浓度水平的提取回收率为98.35%;氯沙坦羧酸3个浓度水平的提取回收率为82.45%;内标氨氯地平-d4的回收率为76.6%;内标氯沙坦-d4的回收率为92.70%;内标氯沙坦-d4羧酸的回收率为72.85%。
[0115]
取不同来源的空白血浆0.2ml(n=6),加入50μl 50%的甲醇,混匀后取50μl至另一ep管中用于lst及exp-3174提取基质液,剩余混合样品用于adp提取基质液。按血浆样品前处理方法处理,萃取处理完后,按比例取0.802ml的上清液,置于2ml ep管中,加入8μl adp质控工作液(低、中低、高分别为3ng/ml、15ng/ml、120ng/ml),40μl adp内标工作液(adp-d4:20ng/ml),混匀后在45℃的氮气下蒸发至干燥。蛋白沉淀处理完后,按比例取48μl
的上清液溶解所得adp样品残渣,加入2μl lst/exp-3174质控混合工作液(低、中低、高分别为120ng/ml、600ng/ml、15000ng/ml),10μl lst-d4/exp-3174-d4内标混合工作液(lst-d4:200ng/ml,exp-3174-d4:600ng/ml),再加入10μl超纯水混匀后取上清液至96孔板中,配制成低、中低、高浓度的常规基质样品,进行lc-ms/ms分析。另取0.2ml的超纯水,按上述步骤处理,配制成低、中低、高浓度的无基质样品。氨氯地平3个质控浓度水平下的内标归一化基质效应因子均值分别为0.95、0.95和0.92,精密度均小于5.40%。氯沙坦3个质控浓度水平下的内标归一化基质效应因子均值分别为0.93、0.92和0.89,精密度均小于2.13%。氯沙坦羧酸3个质控浓度水平下的内标归一化基质效应因子均值分别为0.92、0.89和0.89,精密度均小于3.73%。表明在本试验条件下,可以忽略基质效应对氨氯地平、氯沙坦和氯沙坦羧酸测定的影响。
[0116]
上述实验结果表明:本发明的方法经过方法学验证,建立的方法灵敏度高、选择性好、准确、精密、稳定性好,线性良好。
[0117]
实施例3临床样品检测
[0118]
复方氨氯地平片(每片含相当于氨氯地平5mg的苯磺酸氨氯地平、以及50mg的氯沙坦钾)预be人体生物等效性试验研究。采用12例受试者进行实验,其中6例口服参比制剂,剩余6例口服受试制剂。单次给药,每次一片。在给药前和给药后不同时间点采集血样并分离获得血浆。经过7天的洗脱期后,首次服用参比制剂的6例受试者再次口服受试制剂,首次服用受试制剂的6例受试者再次口服参比制剂。单次给药,每次一片。在给药前和给药后不同时间点采集血样并分离获得血浆。两次获得的血浆采用本发明建立的方法测定血浆中的氨氯地平、氯沙坦及其活性代谢物氯沙坦羧酸浓度。其中以a03受试者为例,口服参比制剂和受试制剂的氨氯地平药物浓度-时间曲线图,见图13;氯沙坦药物浓度-时间曲线图,见图14;氯沙坦羧酸药物浓度-时间曲线图,见图15。
[0119]
综上实施例的结果表明:本发明的方法通过(乙酸乙酯)液液萃取结合(0.1%甲酸乙腈)蛋白沉淀的方法提取血浆中的氨氯地平、氯沙坦及其活性代谢物氯沙坦羧酸,与现有的方法比较,使用更少的血浆量能同时提取并检测三种组分。采用本发明方法可以实现对血浆中氨氯地平、氯沙坦及其活性代谢物氯沙坦羧酸的快速、高灵敏的检测,可以应用于复方氨氯地平片药代动力学与生物等效性的研究。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
