玉米单向杂交不亲和相关蛋白zmga2f及其编码基因与应用
技术领域
1.本发明属于植物基因工程领域,涉及一种与玉米单向杂交不亲和现象相关的基因及其编码蛋白与应用。
背景技术:
2.玉米(zea mays)是典型的雌雄同株、异花授粉作物,天然异交率高达95%,在自然条件下既可自交授粉结实,也可异交授粉结实。但自然界中存在一类玉米,既能够自交结实,也能为其它种类玉米授粉结实,却不能被绝大多数其它种类玉米的花粉授粉结实,这种现象被称为玉米的单向杂交不亲和(unilateral cross-incompatibility,uci)。由于uci调控玉米雌雄配子的传递,故uci位点又被称为gametophyte factor(ga)。玉米的uci现象发现于1902年,但由于uci位点遗传特征的复杂性和uci材料基因组背景的特殊性,其分子机制知之甚少。目前,已有多个uci位点在玉米中被报道,其中ga1、ga2和teosinte crossing barrier 1(tcb1)的单向杂交不亲和性最为彻底,因而被广泛关注。其中,ga1是硬粒型玉米、马齿型玉米和甜玉米与爆裂玉米之间的不亲和系统,ga2是大刍草和玉米之间的不亲和系统,tcb1是大刍草中的不亲和系统。后续研究发现,ga1、ga2和tcb1是三个互相独立的单向杂交不亲和系统,具有独立的不亲和机制且三者之间互不亲和。ga位点被发现已有110多年的历史,但是其研究进度却远远落后自交不亲和现象。由于ga材料基因组背景的特殊性及单向不亲和机制的复杂性,一直以来人们对它的认知都停留在相对简单的表型描述。近些年来,随着参考基因组物理图谱的构建,玉米单向杂交不亲和现象的研究也取得了较大的进展。目前已克隆获得了ga1位点花粉决定因子和tcb1位点的花丝决定因子,并初步揭示了其杂交不亲和的分子机理然而,这离全面解析玉米单向杂交不亲和的分子机制还有很长的路要走。
3.ga2位点控制的单向杂交不亲和现象由两个决定因子共同调控,分别是花丝决定因子(female determinant)和花粉决定因子(male determinant)。其中花丝决定因子控制花丝抵御非同型花粉结实的能力,即female function;花粉决定因子赋予花粉具有突破花丝阻碍授粉结实的能力,即male function。ga2位点有ga2-s,ga2-m和ga2三种类型材料。ga2-s型植株同时具备上述female和male两种功能,而ga2-m型植株只具备male功能,没有female功能,ga2植株的male和female功能均丧失。
4.玉米是我国种植面积最大的作物,随着玉米由粮用到饲料、能源、化工和医药等领域的转化应用,全球的玉米需求量持续增长。玉米产量的增高主要在于杂交种的选育和推广,然而为了防止杂交种混杂,在玉米制种田中不同类型玉米需要进行隔离,这是一件非常困难的挑战,目前时间隔离和空间隔离是生产上常用的隔离手段。但是由于玉米具有花粉量大、花粉存活时间较长,而且花粉可通过风媒传播、传播距离远等特点,时间隔离和空间隔离实际操作起来并非易事,且隔离效果难以保证,易造成品种间混杂。ga2位点的应用为玉米品种间隔离提供了一种新的生物学解决方案,在玉米杂交制种及特用玉米生产中具有广阔的应用前景。此外,转基因玉米和常规玉米之间的生物学隔离,也是目前全球玉米生产
面临的重要问题。在美国转基因玉米种植实践中,通常要将20%左右的非转基因玉米与转基因玉米一起种植,以避免病菌和害虫因受到强烈的人工选择压力而产生剧烈进化。这种无隔离种植和混收的策略势必导致所有玉米食品都含有转基因成分。目前,中国已有转基因玉米获得安全证书,转基因玉米的商业化种植也许不再遥远。如何吸取美国经验教训,避免转基因玉米污染,是中国玉米产业的潜在挑战。ga2位点的应用将为我国转基因玉米和常规玉米之间的生物学隔离提供重要途径。
技术实现要素:
5.本发明的目的是提供一种与玉米单向杂交不亲和现象相关的蛋白及其编码基因与应用。
6.本发明所提供的蛋白质,名称为zmga2f,来源于玉米属的玉米(zea mays l.),是如下(a)或(b):
7.(a)由序列表中序列1所示的氨基酸序列组成的蛋白质;
8.(b)将序列1的氨基酸序列经过一个或几个氨基酸残基的取代和/或缺失和/或添加,且与植物杂交不亲和性相关的由序列1衍生的蛋白质。
9.序列表序列1为zmga2f的氨基酸序列,包括379个氨基酸,在该蛋白质序列中,疏水氨基酸占172个,亲水氨基酸占118个,碱性氨基酸占47个,酸性氨基酸占69个,该蛋白质的分子量为41.29kd,等电点为7.59。
10.为了便于上述(a)中所示蛋白质的纯化,可在由序列表中序列1的氨基酸残基序列组成的蛋白质的氨基末端或羧基末端连接上如下表所示的标签。
11.表:标签的序列
12.标签残基序列poly-arg5-6(通常为5个)rrrrrpoly-his2-10(通常为6个)hhhhhhflag8dykddddkstrep-tag ii8wshpqfekc-myc10eqkliseedl
13.上述(b)中的蛋白质可人工合成,也可先合成其编码基因,再进行生物表达得到。上述(b)中的蛋白质的编码基因可通过将序列表中序列2所示的dna序列中缺失一个或几个氨基酸残基的密码子,和/或进行一个或几个碱基对的错义突变。
14.编码所述蛋白质的核酸分子也属于本发明的保护范围。
15.所述核酸分子可以是dna,如cdna、基因组dna或重组dna;所述核酸分子也可以是rna,如mrna、hnrna或trna等。
16.在本发明的一个实施例中,所述核酸分子具体为编码所述蛋白质的基因(命名为zmga2f),所述基因具体可为如下1)-4)中任一的dna分子:
17.所述基因为如下1)-4)中任一的dna分子:
18.1)序列表中序列2所示的dna分子;
19.2)序列表中序列3所示的dna分子;
20.3)序列表中序列4所示的dna分子;
21.4)在严格条件下与1)-3)中任一限定的dna分子杂交且编码与玉米单向杂交不亲和现象相关的由序列1衍生的蛋白质的dna分子;
22.5)与1)-4中任一限定的dna序列具有90%以上同一性,且编码与玉米单向杂交不亲和现象相关的由序列1衍生的蛋白质的dna分子。
23.其中,序列2为zmga2f基因的cdna序列,序列3为zmga2f基因在玉米基因组中的序列,序列4包含zmga2f基因上游2052-bp的启动子序列,1288-bp的编码序列以及1092-bp终止子序列。。
24.含有上述核酸分子的重组载体、表达盒、转基因细胞系或重组微生物也属于本发明的保护范围。所述重组载体可为重组表达载体,也可为重组克隆载体。
25.所述重组表达载体可用现有的植物表达载体构建。所述植物表达载体包括双元农杆菌载体和可用于植物微弹轰击的载体等,如pgreen0029、pcambia3301、pcambia1300、pbi121、pbin19、pcambia2301、pcambia1301-ubin或其它衍生植物表达载体。所述植物表达载体还可包含外源基因的3’端非翻译区域,即包含聚腺苷酸信号和任何其它参与mrna加工或基因表达的dna片段。所述聚腺苷酸信号可引导聚腺苷酸加入到mrna前体的3’端。使用所述基因构建重组表达载体时,在其转录起始核苷酸前可加上任何一种增强型、组成型、组织特异型或诱导型启动子,例如花椰菜花叶病毒camv35s启动子、泛素基因ubiquitin启动子(pubi)、胁迫诱导型启动子rd29a等,它们可单独使用或与其它的植物启动子结合使用;此外,使用本发明的基因构建重组表达载体时,还可使用增强子,包括翻译增强子或转录增强子,这些增强子区域可以是atg起始密码子或邻接区域起始密码子等,但必需与编码序列的阅读框相同,以保证整个序列的正确翻译。所述翻译控制信号和起始密码子的来源是广泛的,可以是天然的,也可以是合成的。翻译起始区域可以来自转录起始区域或结构基因。为了便于对转基因植物细胞或植物进行鉴定及筛选,可对所用重组表达载体进行加工,如加入可在植物中表达的编码可产生颜色变化的酶或发光化合物的基因、具有抗性的抗生素标记物或是抗化学试剂标记基因等。也可不加任何选择性标记基因,直接以逆境筛选转化植株。
26.在本发明中,所述重组表达载体为将zmga2f基因插入到pcambia3300载体的多克隆位点(如ecor i和hind iii)处后得到的重组质粒。更加具体的,为将pcambia3300载体的酶切位点ecor i和hind iii之间的小片段替换为序列表中序列4的所示dna片段后得到的重组质粒(命名为pcambia3300-zmga2f)。
27.所述表达盒由能够启动所述基因表达的启动子,所述基因,以及转录终止序列组成。
28.所述转基因细胞系为转入所述基因的非繁殖材料。
29.所述蛋白质或所述核酸分子或所述重组载体、表达盒、转基因细胞系或重组微生物在如下任一中的应用也属于本发明的保护范围:
30.(a)植物育种和/或制种;
31.(b)调控植物单向杂交不亲和性。
32.本发明还提供了培育转基因植物的方法。
33.本发明所提供培育转基因植物的方法,可为如下:
34.在此,不接受ga2/ga2类型的玉米材料授粉导致不能结实,称为ga2不亲和;接受
ga2/ga2类型的玉米材料授粉导致能够结实,称为ga2亲和。
35.培育一种转基因植物,使其ga2不亲和,包括如下步骤:
36.(1)向受体植物中导入zmga2f蛋白的编码基因(该受体植物ga2亲和),得到表达所述编码基因的转基因植物;纯合转基因受体植物的ga2不亲和的性状是由于所述受体植物表达有功能的所述zmga2f蛋白引起的;
37.(2)从步骤(1)所得转基因植物中得到不可接受ga2/ga2基因型玉米花粉的转基因植物。;
38.在所述方法的步骤(1)中,所述编码基因可通过以上重组表达载体pcambia3300-ubi-zmga2f导入所述受体植物;
39.在本发明中,所述植物既可为单子叶植物,也可为双子叶植物。其中,所述单子叶植物如禾本科植物,具体如玉米。
40.在培育ga2不亲和的转基因植物时,可将任意一种ga2亲和的玉米材料作为所述受体植物,获得相应的ga2不亲和的转基因玉米。
41.在本发明的一个实施例中,培育ga2不亲和的转基因植物时采用的所述受体植物具体为玉米品种b104。
42.本发明采用图位克隆的策略,用基因型为ga2-s/ga2-s玉米自交系511l与基因型为ga2/ga2玉米自交系w22组配bc1f1群体,将控制这一性状的基因定位到玉米五号染色体两个标记m3和m8之间,以b73v4基因组为参考,物理距离为1.7mb,共包括八个基因。利用基因型为ga2-s/ga2-s玉米自交系511l与基因型为ga2/ga2玉米自交系b73的花丝转录组数据进行de novo拼接,得到位于ga2-s/ga2-s基因型材料的花丝中特异表达的基因,将此基因命名为zmga2f。用转基因技术将zmga2f基因导入ga2亲和的玉米材料中,纯合的zmga2f转基因受体植株不接受ga2/ga2基因型玉米花粉,使其不结实。
43.本发明的zmga2f基因在玉米中能够控制杂交不亲和性,即在ga2亲和的玉米材料中表达,转基因纯合单株具备ga2不亲和的能力。
44.本发明为玉米单向杂交不亲和性的研究提供了新的基因资源,其在玉米育种制种领域的应用中可发挥重要作用。
附图说明
45.图1为zmga2f基因的图位克隆图。
46.图2为定位区间注释基因在玉米自交系511l和b73的花粉中的表达图。
47.图3为xloc_039725在玉米自交系511l和b73中的组织特异性表达图。
48.图4为xloc_039725在不同类型玉米自交系花丝中的表达图。
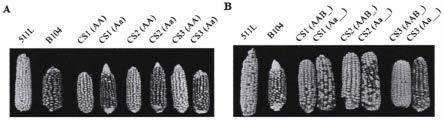
49.图5为转基因功能验证图。(a)杂交亲和性分析。511l(ga2-s/ga2-s)、b104(ga2/ga2)和t1转基因株系(cs1、cs2和cs3)第一天用紫色籽粒zym1(ga2/ga2)授粉,第二天用黄色籽粒mo17(ga2-m)授粉的结实情况;(b)杂交亲和性分析。511l(ga2-s/ga2-s)、b104(ga2/ga2)和t1f2转基因株系(cs1、cs2和cs3)用紫色籽粒zym1(ga2/ga2)授粉和黄色籽粒mo17(ga2-m)授粉的结实情况。
具体实施方式
50.下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
51.下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
52.玉米自交系ga2-s/ga2-s型自交系511l由maizegdb stock center(https://www.maizegdb.org/data_center/stock?id=9020818)提供。玉米自交系ga2-s/ga2-s型gsw1、ga2-m/ga2-m型自交系dm-1和hn160以及ga2/ga2型自交系b73和w22为本实验室收集和保存。玉米基因组测序信息参考maizegdb数据库,该数据库链接如下:http://www.maizegdb.org/。
53.实施例1、玉米单向杂交不亲和基因zmga2f的图位克隆
54.一、遗传定位群体的构建
55.以511l(ga2-s/ga2-s)为父本,普通玉米w22(ga2/ga2)为母本,组配f1(ga2-s/ga2),用511l花粉给f1授粉,得到bc1f1分离群体,取后代单株花粉一对一给511l授粉鉴定其表型,发现结实和不结实比例符合1∶1(104∶116,χ2=0.0233,p>0.05),证明该性状由隐性单基因控制,并将bc1f1群体做为遗传定位群体。
56.二、zmga2f基因的定位
57.以511l(ga2-s/ga2-s)为父本,普通玉米w22(ga2/ga2)为母本,组配f1(ga2-s/ga2),然后用511l花粉给f1授粉,组配bc1f1分离群体,将bc1f1分离群体种植下去,成熟单株用w22一对一授粉。根据分离群体植株的结实情况判断其基因型。然后,从bc1f1群体中选取结实和不结实对应的授粉单株各10株,验证多态性引物是否与单向杂交不亲和性状连锁。筛选出连锁引物,用于对群体中2600个单株基因型的测定,结合雌穗结实表型筛选出基因型与表型不符的为交换单株,并根据不同引物筛选出的交换单株个数的不同,依照减少趋势确定定位区间,由此将zmga2f基因定位于玉米5号染色体的引物标记m3和m8之间,参考已公布的玉米自交系b73基因组测序结果,物理距离约为1.7mb(图1)。其中,用于基因定位的分子标记引物序列如表1所示。
58.表1 用于基因定位的分子标记引物序列
[0059][0060]
三、zmga2f基因的克隆
[0061]
根据花丝决定因子控制花丝阻碍非同型花粉授粉结实的特性推测,花丝决定因子在花丝组织中特异表达。参考b73v4基因组序列信息,对花丝决定因子区段8个注释基因设计引物,检测8个基因在511l和b73材料的花丝组织中的表达量。荧光定量pcr结果显示,只有zm00001d016248基因有微量表达,但在两个材料中没有显著差异,其他7个基因均不表达(图2)。该结果暗示花丝决定因子定位区段8个注释基因不是花丝决定因子的候选基因。
[0062]
基于花丝决定因子定位区段8个注释基因均非花丝决定因子的候选基因,我们推测候选基因在b73的花丝组织中不表达或缺失,导致其未在b73参考基因组中被注释。因此我们通过转录组测序手段,以期找到ga2位点花丝决定因子的候选基因。
[0063]
我们选择511l和b73的未授粉花丝组织进行转录组测序,通过de novo拼接,将转录本重新比对回b73v4参考基因组。结果显示,在花丝决定因子定位区段1.7mb内有8个转录本,其中只有两个转录本被注释,分别是zm00001d016245和zm00001d016248。zm00001d016245在两个材料中几乎不表达,而zm00001d016248转录本在两个材料中微量表达,但两者之间无显著差异。只有转录本xloc_039725在511l的花丝中表达量极高,在b73花丝中几乎不表达(表2)。
[0064]
表2 定位区间内de novo拼接得到的转录本
[0065][0066]
对转录本xloc_039725在511l和b73的花粉组织中进行表达量检测,结果显示xloc_039725在511l的花粉中高表达(图2),在b73几乎不表达。对xloc_039725进行511l和b73的根、茎、叶、花粉和花丝的表达量分析,结果显示该基因在511l花粉中特异表达(图3)。提取ga2-s/ga2-s型自交系511l和gsw1、ga2-m/ga2-m型自交系dm-1和hn160以及ga2/ga2型自交系b73和w22的花丝rna,反转录成cdna,以引物对f1/r1对xloc_039725基因进行荧光定量pcr检测,以引物对f2/r2扩增gapdh基因作为内参。结果表明,xloc_039725在ga2-s材料的花丝中表达,在ga2-m材料和ga2材料的花丝中不表达(图4)。因此推测候选基因xloc_039725为目的基因zmga2f。以玉米自交系511l的cdna为模板,采用引物对f3/r3进行pcr扩增,所得pcr产物的序列为序列表中序列2,序列2即为zmga2f基因的cdna序列。以玉米自交系511l的基因组dna为模板,通过引物对f3/r3扩增得到序列3,序列3即为zmga2f基因在玉米基因组中的编码序列。以玉米自交系511l的基因组dna为模板,通过引物对f4/r4扩增得到序列4,序列4包含zmga2f基因上游2052-bp的启动子序列,1288-bp的编码序列以及1092-bp终止子序列。
[0067]
f1:5
′‑
accgtgaatgttgtagccgac-3
′
;
[0068]
r1:5
′‑
tcaccacgttgtgcttgcc-3
′
。
[0069]
f2:5
′‑
ctggtttctaccgacttccttg-3
′
;
[0070]
r2:5
′‑
cggcatacacaagcagcaac-3
′
。
[0071]
f3:5
′‑
atggcagcagttggcagat-3
′
;
[0072]
r3:5
′‑
gccggctagttgacgatgat-3
′
。
[0073]
f4:5
′‑
gccgtcgcctactcacaag-3
′
;
[0074]
r4:5
′‑
cggagtggtaggggagggta-3
′
。
[0075]
实施例2、玉米单向杂交不亲和基因zmga2f的功能验证
[0076]
一、zmga2f基因自身启动子驱动的表达载体的构建
[0077]
设计针对zmga2f基因的gdna序列的特异引物。具体序列为:
[0078]
p1-f:5
′‑
aacagctatgacatgattacgaattc gccgtcgcctactcacaag-3
′
;
[0079]
p1-r:5
′‑
gtaaaacgacggccagtgccaagctt cggagtggtaggggagggta-3
′
。
[0080]
其中,小写字母所示为与载体连接所需要的同源重组臂,p1-f的大写字母为序列4
所示的前21个碱基,p1-r的大写字母为序列2所示的后22个碱基的反向互补序列。以玉米自交系511l的gdna为模板,采用引物对p1-f/p1-r进行pcr扩增,扩增获得的pcr产物经1.0%琼脂糖凝胶电泳检测然后回收测序,显示其序列如序列表中序列4所示。将序列4与经过ecor i和hind iii酶切回收后的pcambia3300载体连接,经酶切和测序鉴定,构建成为基因自身启动子驱动的pcambia3300-zmga2f表达载体。
[0081]
重组pcambia3300-zmga2f表达载体的结构描述:将pcambia3300载体的酶切位点ecor i和hind iii之间的小片段替换为序列表中序列4所示dna片段后得到的重组质粒。
[0082]
二、玉米遗传转化实验
[0083]
由天津吉诺沃生物科技有限公司完成重组pcambia3300-zmga2f表达载体向玉米自交系b104的遗传转化,具体的转化方法是常规的农杆菌介导的玉米幼胚的遗传转化。
[0084]
三、转基因后代的功能验证
[0085]
由于pcambia3300转化载体含有basta抗性基因,所以确定是否为阳性转基因植株的方法具体如下:苗期时对转基因后代群体中的单株叶片进行涂抹或者喷施5%basta溶剂(10%草铵膦,北京酷来搏科技有限公司),2-3天,叶片颜色没有变化为转基因阳性,叶片变黄轻微枯萎为转基因阴性。
[0086]
通过遗传转化和basta筛选,共获得8株t0代转基因阳性植株。将t0代转基因阳性植株自交获得t1代转基因植株。苗期利用5%basta溶剂筛选出阳性转基因植株。将带有zmga2f候选基因载体的基因型定义为a,不含转基因片段的基因型定义为a,那么转基因t1单株中有三个基因型aa、aa和aa。理论上aa自交不结实,因为没有花粉决定因子。但是导致授粉不结实因素有很多,例如授粉方式、花粉失活、天气温度湿度。因此我们采用下面的授粉验证策略:对苗期t1植株喷洒5%basta除草剂,由于基因型aa植株不具有basta抗性,无法生长,只剩下aa和aa基因型的单株。盛花期第一天用ga2材料紫色籽粒玉米(zym1)给t1代转基因株系授粉,第二天用ga2-m材料黄色籽粒玉米mo17覆盖授粉转基因株系,只有纯合单株才具有阻碍花粉给花丝授粉的能力,所以基因型aa的纯合转基因株系结实籽粒均为黄色,其无法接受ga2型紫色紫玉米的花粉,只接受了ga2-m的黄色籽粒花粉;而基因型aa的植株所结籽粒则大部分为紫色和少部分的黄色。结果显示,8个转基因株系中,有3个转基因株系(cs1、cs2和cs3)的纯合基因型aa的单株所结籽粒全为黄色(图5a)。为了进一步证实该结果,我们将t1代aa植株所结的黄色籽粒(t2)种于温室中,对t2植株喷洒5%basta除草剂,结果显示t2植株均生长正常,为阳性,证明t1植株基因型为aa。随后将t2植株进行自交得到t3植株,将自交得到的t3代植株种于温室,喷洒5%basta除草剂去除非阳性植株,对剩下的阳性植株采用下面的授粉验证策略:第一天用ga2材料紫色籽粒玉米(zym1)的花粉授粉给t3转基因株系,第二天t3代转基因株系自交。我们将花粉决定因子基因型定义为b,t1代植株中,基因型aa植株所结黄色籽粒(t2)的基因型为aabb,经过basta除草剂筛选的阳性t3代植株会有aab_、aabb和aa__这些基因型。对t3阳性植株按照上述策略进行授粉实验,结果显示三个转基因事件的基因型aab_的植株所结籽粒全为黄色,即其不能接受ga2雄配子的花粉;基因型aa__的植株则大部分籽粒为紫色(图5b)。综合上述结果,我们证明了纯合zmga2f能够赋予ga2自交系b104的花丝具有阻碍ga2花粉授粉的能力,zmga2f基因是ga2位点的花丝决定因子,为与玉米单向杂交不亲和现象相关的基因。
[0087]
综合以上各实施例的研究结果,可见:通过图位克隆和转基因功能验证,本发明克
隆的zmga2f基因是与玉米单向杂交不亲和现象相关的基因,该基因编码的蛋白可以赋予ga2/ga2基因型材料具备杂交不亲和障碍,从而使ga2/ga2基因型材料不能使其结实,可在玉米育种制种过程中得以利用。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。