一种多重荧光pcr检测egfr基因突变的引物和探针组合物、试剂盒和检测方法
技术领域
1.本发明属于egfr基因突变检测技术领域,具体涉及一种多重荧光pcr检测egfr基因突变的引物和探针组合物、试剂盒和检测方法。
背景技术:
2.肺癌是目前世界上第一大癌,肺癌的发生率和死亡率在所有肿瘤中都占首位。在肺癌患者中,非小细胞肺癌(nsclc)约占80-85%,目前靶向治疗已经成为非小细胞肺癌(nsclc)临床治疗的重要手段。egfr是一种跨膜受体络氨酸激酶,该区域的激活即磷酸化对癌细胞增殖、生长的相关信号传递具有重要意义,因此,egfr作为nsclc的分子靶标受到普遍关注,并陆续开发出了吉非替尼(gefitinib)、厄洛替尼(erlotinib)和埃克替尼(icotinib)等egfr酪氨酸激酶抑制剂(tyrosine kinase inhibitor,tki),多项临床试验已证实,egfr基因突变的晚期nsclc患者能从egfr-tkis显著获益。egfr基因突变多位于外显子18-21上。目前已经发现至少30种突变与egfr-tkis药物反应性有关,主要是19外显子的缺失突变和21外显子的l858r点突变,二者约占所有突变的80-90%,18外显子g719x约占突变的5%,20外显子插入突变约占1%。此外,大部分患者在服用egfr-tki一段时间后会出现耐药,其中约50%耐药患者可检测到egfr 20外显子t790m突变。因此,检测egfr基因突变对于指导nsclc患者临床用药具有重要的参考价值。
3.arms-pcr(amplification refractory mutation system)技术是一种利用序列特异性引物对模板进行选择性扩增而达到检测基因突变的方法。基本原理:taqdna聚合酶缺少3-5外切酶活性,在一定条件下pcr引物3末端的错配导致产物的急剧减少,针对不同的已知突变设计适当的引物可以通过pcr方法直接达到区分突变和野生型基因的目的。arms-pcr方法灵敏度可达1%,可满足肿瘤组织样本的检测需求。
4.目前市面上的egfr检测试剂盒多为单荧光突变检测,共7个孔,对样本量的要求比较高,成本也较大;厦门艾德生物医药科技股份有限公司的肺癌多基因检测试剂盒中egfr突变检测采用3个荧光,共4个孔。
技术实现要素:
5.发明目的:针对现有技术存在的问题,本发明目的是提供一种多重荧光pcr检测egfr基因突变的引物和探针组合物、试剂盒和检测方法。所述试剂盒采用4个荧光,3个孔即可实现对egfr突变的检测。本发明可以解决微量样本的检测,提高检测合格率。同时方便了操作,提高了检测通量,降低了成本。
6.技术方案:为了达到上述发明目的,本发明所采用的技术方案如下:
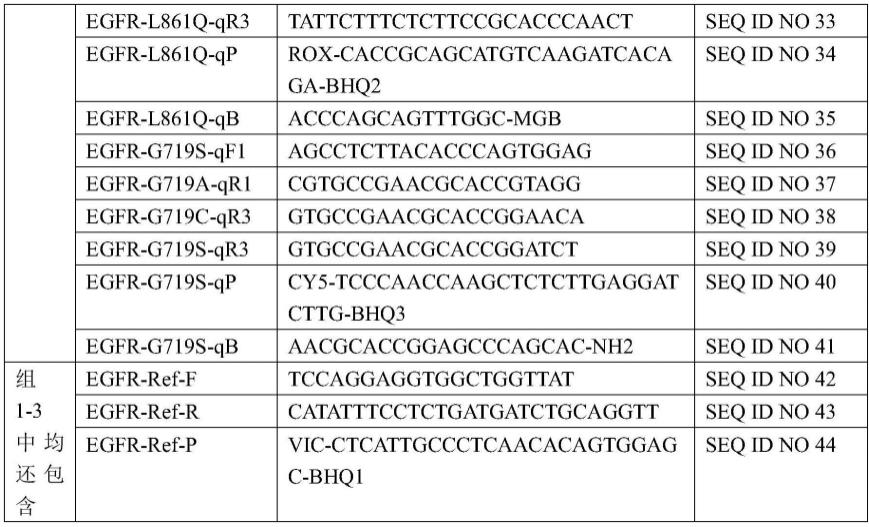
7.一种多重荧光pcr检测egfr基因突变的引物和探针组合物,所述组合物包括19del、s768i、l858r、egfr 20ins、t790m、l861q、g719x及内控的引物和探针,上述引物和探针分为组1、组2和组3,如下表1所示:
8.表1 egfr基因突变引物和探针及分配方式
9.10.。
11.一种多重荧光pcr检测egfr突变的试剂盒,所述试剂盒包含上述引物和探针组合物。
12.优选的,所述试剂盒包含:
13.neb universal probe qpcr master mix、上述引物和探针组合物、阳性对照和阴性对照。
14.进一步优选的,所述阳性对照包括质粒dna和野生型dna混合物;所述阴性对照包括无核酸酶水。所述neb universal probe qpcr master mix包括buffer,taq酶和dntp。
15.作为一种具体实施方案,试剂盒的组成、不同反应管的突变类型和egfr突变检测位点如下表2-4所示:
16.表2试剂盒组成
17.[0018][0019]
表3试剂盒不同反应管的突变类型
[0020][0021]
表4 egfr突变检测位点
[0022]
[0023][0024]
本发明还提供了上述引物和探针组合物,或上述试剂盒在基于多重荧光pcr检测egfr突变中的应用。
[0025]
本发明最后提供了一种多重荧光pcr检测egfr突变的方法,包括如下步骤:
[0026]
(1)准备样品;
[0027]
(2)构建多重荧光pcr扩增反应体系,包括分别由上述的组1、组2和组3构成的三种反应体系,进行pcr反应;
[0028]
(3)根据荧光pcr扩增仪显示的
△
ct值判定检测结果。
[0029]
优选的,步骤(1)中,所述样品包括组织样本,ffpe样本或胸腹水样本。
[0030]
优选的,步骤(2)中,所述三种反应体系包括:
[0031]
19del&l858r体系:权利要求1所述的组1、neb universal probe qpcr master mix、样本;
[0032]
l858r&egfr 20ins体系:权利要求1所述的组2、neb universal probe qpcr master mix、样本;
[0033]
t790m&l861q&g719体系:权利要求1所述的组3、neb universal probe qpcr master mix、样本。
[0034]
实际应用时,上述反应体系中的样本包括待测样本、阳性对照或阴性对照。
[0035]
作为一种具体实施方案,上述三种体系的具体组成如下所示:19del&s768i体系
[0036]
[0037][0038]
l858r&egfr 20ins体系
[0039][0040]
t790m&l861q&g719x体系
[0041][0042]
优选的,步骤(2)中,所述pcr反应的条件如下:
[0043]
第一阶段:95℃,1min,1个循环;
[0044]
第二阶段:95℃,15s,64℃,30s,10个循环;
[0045]
第三阶段:95℃,15s,60℃,30s,38个循环;
[0046]
信号收集:第三阶段60℃时收集fam/vic/rox/cy5信号,执行实时pcr,保存文件。
[0047]
优选的,步骤(3)中,所述根据
△
ct值判定检测结果的方法如下:
[0048]
突变由fam/rox/cy5信号指示,内控由vic信号指示,通过计算
△
ct值的大小进行判断,反应管的
△
ct值≤cutoff值时,则样本为该反应管对应信号突变阳性,反之则为阴性或低于试剂盒的检测下线;
△
ct值=ct值突变位点-ct值内控。
[0049]
有益效果:相对于现有技术,本发明具有以下优势:
[0050]
本发明基于arms-pcr平台,开发一种多重荧光pcr检测egfr基因32种突变的试剂盒和方法。本试剂盒以新鲜组织样本,ffpe样本及胸腹水样本为检测样本,可以在微量样本下实现对egfr基因突变的检测,指导患者egfr-tki用药。本检测方法灵敏度1%,检测时间80分钟即可完成,同时具备特异性好,准确率高,快速廉价,通量高及操作简单等优点,可满足临床快速检测的实际需求。
附图说明
[0051]
图1为1#管fam信号(19del)灵敏度分析实验结果pcr图
[0052]
图2为1#管rox信号(s768i)灵敏度分析实验结果pcr图
[0053]
图3为2#管fam信号(l858r)灵敏度分析实验结果pcr图
[0054]
图4为2#管cy5信号(egfr 20ins)灵敏度分析实验结果pcr图
[0055]
图5为3#管fam信号(t790m)灵敏度分析实验结果pcr图
[0056]
图6为3#管rox信号(l861q)灵敏度分析实验结果pcr图
[0057]
图7为3#管cy5信号(g719x)灵敏度分析实验结果pcr图。
具体实施方式
[0058]
通过以下实施例进一步对本发明进行进一步阐述。这些实施例完全是例证性的,他们仅用来对本发明进行具体描述,不应当理解为对本发明的限制。实施例中未注明具体技术或条件者,按照本领域内的文献所描述的技术或条件,或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可通过正规渠道商购获得的常规产品。
[0059]
实施例1
[0060]
本实施例以基因工程质粒为阳性质粒,阴性临床组织样本为阴性对照。利用本发明的多重荧光pcr检测egfr 32种基因突变的方法包括如下步骤:
[0061]
(1)临床组织样本准备
[0062]
选取已检临床组织阴性样本8例,用te buffer稀释成5ng/ul左右,ddpcr定量为1500copy/ul左右,上样量2ul即3000copy左右。
[0063]
(2)质粒稀释
[0064]
合成的32种egfr阳性质粒用te buffer10倍梯度稀释成30copy/ul,上样量1ul即30copy阳性质粒。
[0065]
(3)构建多重荧光pcr扩增反应体系
[0066]
19del&s768i体系
[0067][0068]
l858r&egfr 20ins体系
[0069]
ct值内控,结果依据表5进行判定。
[0080]
表5结果判断
[0081][0082]
灵敏度分析:取同一份20ul稀释好的1500copy/ul临床组织阴性样本,加入10ul稀释好的30copy/ul质粒,每次加入3ul模板进行扩增反应。结果表明,本发明灵敏度可以检测到1%,结果如图1-7。
[0083]
检测结果表明,本发明的检测体系可以准确检测egfr 32种突变位点,检测的灵敏度可达1%。
[0084]
实施例2
[0085]
运用本发明检测已检临床组织样本egfr突变共55例,并与数字pcr检测进行对照。利用本发明特异性引物和探针检测步骤如下:
[0086]
(1)准备数字pcr已检临床组织样本,其中阴性样本25例,阳性样本30例,其中19del11例,l858r 5例,t790m 5例,s768i 2例,egfr 20ins 2例,l861q 2例,g719x 3例,样本均稀释为5ng/ul左右。
[0087]
(2)建立pcr扩增体系:和实施例1相同
[0088]
pcr反应条件是
[0089]
第一阶段:95℃1min,1个cycle
[0090]
第二阶段:95℃15s,64℃30s,10个cycle
[0091]
第三阶段:95℃15s,60℃30s,38个cycle
[0092]
信号收集:第三阶段60℃时收集fam/vic/rox/cy5信号,执行实时pcr,保存文件。
[0093]
(3)根据荧光pcr扩增仪显示的ct值判定检测结果
[0094]
利用特异性引物和探针进行多重pcr反应,突变由fam/rox/cy5信号指示,内控由vic信号指示,通过计算
△
ct值的大小进行判断,反应管的
△
ct值≤cut off值时,则样本为该反应管对应信号突变阳性,反之则为阴性或低于试剂盒的检测下线。
△
ct值=ct值突变位点-ct值内控,结果依据表5进行判定。
[0095]
在所检测的55例临床样本中,阴性样本25例,阳性样本30例,其中19del11例,l858r5例,t790m 5例,s768i 2例,egfr 20ins 2例,l861q 2例,g719x 3例,与数字pcr检测结果一致,符合率达到100%,见表5,进一步证明本发明检测的准确性。
[0096]
表5多重荧光pcr与数字pcr结果比较
[0097][0098]
申请人声明,本发明通过上述实施例来说明本发明的详细方法,但本发明并不局限于上述详细方法,即不意味着本发明必须依赖上述详细方法才能实施。所属技术领域的技术人员应该明了,对本发明的任何改进,对本发明产品各原料的等效替换及辅助成分的添加、具体方式的选择等,均落在本发明的保护范围和公开范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。