1.本发明属于多肽的新用途领域,具体涉及杜仲籽粕多肽在抗疲劳产品/制备抗疲劳产品中的应用。
背景技术:
2.关于具有抗疲劳作用的杜仲籽粕多肽,以下文献进行过相关披露:
3.cn 112402480a公开了一种具有抗疲劳作用的杜仲雄花提取物制备方法及应用,其步骤为:取一定量杜仲雄花,杜仲雄花用15倍质量的水提取,100℃回流2小时,过滤取滤液待用,再向杜仲雄花中加15倍质量水,二次煮沸回流,过滤收集滤液,两次滤液混合,进行浓缩喷雾干燥,得到杜仲雄花提取物。本发明将杜仲雄花采用水提取,过滤浓缩得到提取物,经过实验证明杜仲雄花提取物及其单体成分可促进墨丸间质细胞墨酮的分泌,可用于抗疲劳为主要功能的保健食品。
4.以上的专利文献所披露的是具有抗疲劳作用的杜仲雄花提取物,是以杜仲雄花为原料,而杜仲雄花中的主要活性成分是桃叶珊瑚苷,京尼平苷酸,绿原酸,京尼平苷,异槲皮苷,紫云英苷等。
5.葛珍珍的《杜仲籽粕蛋白的分离提取及其体外消化产物的抗氧化特性研究》一文中,以杜仲籽粕为原料,采用碱提酸沉法提取杜仲籽粕蛋白,通过单因素和正交试验对提取工艺进行优化,并对其体外消化产物的抗氧化活性进行研究,具体步骤为:将杜仲籽粕进行粉碎过筛,按(1:10、1:15、1:20、1:25、1:30、1:35)加蒸馏水,用氢氧化钠调节ph至8.0-10.5,离心,取上清液用进行酸沉(hcl调至等电点为4.2),净置离心,再添加少量水溶解,并调节ph至7,然后真空冷冻干燥获得杜仲籽粕蛋白。
6.但该文献对杜仲籽粕蛋白提取条件进行了优化,对于其功能评价,除简单的抗氧化实验,并无进一步的研究,而对于活性多肽的研究,则更未涉及。
7.关于杜仲籽粕多肽是否具有抗疲劳的功效,上述的专利文献并未提及。
技术实现要素:
8.为了解决上述的技术问题,本发明提供了一种杜仲籽粕多肽,还提供了上述的杜仲籽粕多肽在抗疲劳产品中的新用途。本发明中的杜仲籽粕多肽与背景技术中所提及的杜仲雄花提取物,是完全不同的原料;杜仲籽粕多肽是以杜仲籽粕为原料,进行酶解所获得的一定分子量范围内的多肽成分以及蛋白成分;而杜仲雄花中的活性成分主要是桃叶珊瑚苷,京尼平苷酸,绿原酸,京尼平苷,异槲皮苷,紫云英苷等。
9.本发明中的杜仲籽粕多肽,2-26个氨基酸长度的总多肽含量为6.02g/100g;10-26个氨基酸长度且分子量为1000-3000da的多肽含量为3.25g/100g;小于或等于500da的寡肽和/或小分子肽含量为2.75g/100g;该多肽中为蛋白质含量为35.17g/100g,且共检出含有13种蛋白质,以xyloglucan:xyloglucosyl transferase(ec 2.4.1.207)(fragment)的含量最高。该多肽总游离氨基酸含量为196.6g/kg,其中,谷氨酸、天冬氨酸、亮氨酸、精氨酸、
甘氨酸、异亮氨酸等含量较高。
10.本发明的杜仲籽粕多肽在抗疲劳产品/制备抗疲劳产品中的应用,可以食品、保健食品、药品的形式应用,包括但不限于固体饮料、液体饮料(普通饮料、口服液、包括酸奶等)、主食(面条、馒头、面包)、压片糖果等一切可行的产品。
11.本发明所要重点保护的是杜仲籽粕多肽在抗疲劳产品中的应用这一新的用途,本发明中的杜仲籽粕多肽是通过以下的方法制备获得的:
12.(1)将杜仲籽粕粉碎、过筛,加入乙醇浸泡提取,过滤,得到滤液a和沉淀a,将沉淀a烘干备用;
13.(2)将沉淀a加水进行水浴提取,过滤,得到滤液b和沉淀b;
14.(3)将沉淀b加水,用氢氧化钠调节ph,搅拌后离心得到上清液a和沉淀c,用盐酸调节上清液a的ph,再离心得到上清液b和沉淀d,将沉淀d加水复溶后调节ph,预冻,再真空冷冻干燥得到杜仲籽粕蛋白;
15.(4)将杜仲籽粕蛋白加水,加热后用氢氧化钠调节ph至碱性,加入碱性蛋白酶酶解,在沸水中灭酶,离心得到上清液c;调节上清液c的ph,离心得到上清液d,即杜仲籽粕多肽溶液;将杜仲籽粕多肽溶液预冻后进行真空干燥得到杜仲籽粕多肽。
16.优选的,(1)中,乙醇浓度60%~90%,添加量为杜仲籽粕粉重量的10~30倍,浸泡时间为:18~48h;沉淀a的烘干温度为50~70℃。
17.优选的,(1)中,乙醇浓度70%,添加量为杜仲籽粕粉重量的20倍,浸泡时间为:36h;沉淀a的烘干温度为60℃。
18.优选的,(2)中,加入15~35重量倍(v/m)的水;提取温度为60~80℃,提取时间为2~4h。
19.优选的,(2)中,加入25重量倍(v/m)的水;提取温度为60~80℃,提取时间为3h。
20.优选的,(3)中,加入15~35重量倍(v/m)的水;用0.1~1mol/l氢氧化钠溶液调节ph值至9~11;提取温度40~60℃,提取时间3~6h,转速2500~5000rpm/min,离心时间10~30min。
21.优选的,(3)中,加入25重量倍(v/m)的水;用0.5mol/l氢氧化钠溶液调节ph值至9;提取温度50℃,提取时间4h,转速3500rpm/min,离心时间15min。
22.优选的,(3)中,盐酸浓度0.1~1mol/l,调节上清液a ph值至3~5;上清液a离心时间10~30min,转速2500~5000rpm/min;加水复溶后的ph调节为6.5~7.5,预冻温度-45~-38℃,预冻时间10~40min,真空冷冻干燥45~55h。
23.优选的,(3)中,盐酸浓度0.5mol/l,调节上清液a ph值至4;上清液a离心时间20min,转速3500rpm/min;加水复溶后的ph调节为7,预冻温度-40℃,预冻时间10~40min,真空冷冻干燥48h。
24.优选的,(4)中,加入10~30重量倍(v/m)的水,水浴温度40~70℃;用0.5~1mol/l的氢氧化钠溶液调节ph值至8~12;加入底物质量比0.5~5%碱性蛋白酶,酶解时间2~5h,灭酶5~10min;用0.3~0.51mol/l的氢氧化钠溶液调节上清液c的ph值至6~8,转速为2500~5000rpm/min,离心时间5~15min;在-40℃下预冻后真空冷冻干燥48h。
25.优选的,(4)中,加入20重量倍(v/m)的水,水浴温度55℃,用0.8mol/l的氢氧化钠溶液调节ph值至9;加入底物质量比2.5%碱性蛋白酶,酶解时间3.5h,灭酶5min;调节上清
液c的ph值至6~8,转速为3500rpm/min,离心时间10min;在-40℃下预冻后真空冷冻干燥48h。
26.更优选的,杜仲籽粕通过如下的步骤所获得:
27.(1)取榨油后的杜仲籽粕,粉碎、过筛,加入体积为60~90%的乙醇溶液浸泡提取18~48h,杜仲籽粕与乙醇溶液的质量体积比为1:10~30;过滤,得到滤液a和沉淀a,将沉淀a于50~70℃低温烘干,备用;
28.(2)在沉淀a中加入其15~35倍重量的水,于60~80℃下水浴提取2~4h,过滤,得到滤液b和沉淀b;
29.(3)在沉淀b中加入其重量15~35倍的水,用0.1~1mol/l氢氧化钠溶液调节ph值至9~11,于40~60℃下恒温搅拌提取3~6h,再在2500~5000rpm/min转速下离心10~30min,得到上清液a和沉淀c,用0.1~1mol/l的盐酸溶液调节上清液a的ph值至3~5,再在2500~5000rpm/min的转速下离心10~30min,得到上清液b和沉淀d,将沉淀d加水复溶后调节ph至6.5~7.5,在-45~-38℃下预冻10~40min,真空冷冻干燥45~55h,得到杜仲籽粕蛋白;
30.(4)在杜仲籽粕蛋白中加入其10~30倍重量的水,于40~70℃中水浴加热,用0.5~1mol/l的氢氧化钠溶液调节ph值至8~12,以杜仲籽粕蛋白的重量计,加入0.5~5%的碱性蛋白酶,酶解2~5h,沸水浴灭酶5~10min,在2500~5000rpm/min转速下离心10~30min得到上清液c;调节上清液c的ph值至6~8,在2500~5000rpm/min转速下离心5~15min,得到上清液d为杜仲籽粕多肽溶液;将杜仲籽粕多肽溶液在-40℃下预冻10~40min,真空冷冻干燥48h,得到杜仲籽粕多肽。
31.本发明的有益效果在于:
32.(1)本发明以杜仲籽粕为原料,将其转化为具有显著抗疲劳活性的杜仲籽粕多肽,实现了对杜仲籽粕的综合利用,提高了废弃的杜仲籽粕的经济效益;
33.(2)通过小鼠负重游泳实验,对其抗疲劳作用进行了验证,结果表明,本发明多肽的抗疲劳作用优异,小鼠负重游泳时间、血乳酸、血清尿素氮、肌糖原等指标,与市售海参肽组、红景天组、人参组、红牛饮料组等对照组比较,均有显著性差异(p《0.05或0.01),说明采用本发明方法所制备的杜仲籽粕多肽样品具有显著的抗疲劳作用,其效果还优于市售的抗疲劳产品。
具体实施方式
34.为了能使本领域技术人员更好的理解本发明,现结合具体实施方式对本发明进行更进一步的阐述。
35.实施例1-6为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其它的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
36.本发明所采用的原料为榨油后的杜仲籽粕,其它未特殊说明的原料均为市售产品,比如所采用的酶类以及常规的试剂等。
37.实施例1
38.具有抗疲劳作用的杜仲籽粕多肽的制备方法包括如下步骤:
39.(1)取杜仲籽粕粉碎、过筛,加入20重量倍(v/m)的70%乙醇浸泡提取36h,过滤,得到滤液a和沉淀a,将沉淀a于60℃低温烘干,备用;
40.(2)将沉淀a加入25重量倍(v/m)的水,于60℃下水浴提取3h,过滤,得到滤液b和沉淀b;
41.(3)将沉淀b中加入25重量倍(v/m)的水,用0.5mol/l氢氧化钠溶液调节ph值至9,于50℃下恒温搅拌提取4h,再在3500rpm/min转速下离心15min,得到上清液a和沉淀c,用0.5mol/l的盐酸溶液调节上清液a ph值至4,再在3500rpm/min的转速下离心20min,得到上清液b和沉淀d,将沉淀d加水复溶后调节ph至7,在-40℃下预冻20min(以下实施例中预冻时间同),真空冷冻干燥48h,得到杜仲籽粕蛋白;
42.(4)将杜仲籽粕蛋白加入20重量倍(v/m)的水,置于55℃水浴中加热,用0.8mol/l的氢氧化钠溶液调节ph值至9,加入底物质量比2.5%碱性蛋白酶,酶解3.5h;酶解结束后,沸水浴灭酶5min,3000rpm/min离心15min得到上清液c;调节上清液c的ph值至7,在3500rpm/min转速下离心10min,得到上清液d,即杜仲籽粕多肽溶液;将杜仲籽粕多肽溶液在-40℃下预冻30min,真空冷冻干燥48h,即得到杜仲籽粕多肽。
43.实施例2
44.(1)取杜仲籽粕粉碎、过筛,加入10重量倍(v/m)的90%乙醇浸泡提取24h,过滤,得到滤液a和沉淀a,将沉淀a于50℃低温烘干,备用;
45.(2)将沉淀a加入15重量倍(v/m)的水,于80℃下水浴提取2h,过滤,得到滤液b和沉淀b;
46.(3)将沉淀b中加入15重量倍(v/m)的水,用0.1mol/l氢氧化钠溶液调节ph值至9,于40℃下恒温搅拌提取3h,再在2500rpm/min转速下离心10min,得到上清液a和沉淀c,用0.1mol/l的盐酸溶液调节上清液a ph值至5,再在2500rpm/min的转速下离心10min,得到上清液b和沉淀d,将沉淀d加水复溶后调节ph至6.5,在-40℃下预冻20min后,真空冷冻干燥48h,得到杜仲籽粕蛋白;
47.(4)将杜仲籽粕蛋白加入10重量倍(v/m)的水,置于40℃中水浴,用0.5mol/l的氢氧化钠溶液调节ph值至8,加入底物质量比0.5%碱性蛋白酶,酶解2h,酶解结束后,沸水浴灭酶5min,2500rpm/min离心10min得到上清液c;调节上清液c的ph值至6,在2500rpm/min转速下离心5min,得到上清液d,即杜仲籽粕多肽溶液;将杜仲籽粕多肽溶液在-40℃下预冻30min后,真空冷冻干燥48h,即得到杜仲籽粕多肽。
48.实施例3
49.(1)取杜仲籽粕粉碎、过筛,加入30重量倍(v/m)的80%乙醇浸泡提取24h,过滤,得到滤液a和沉淀a,将沉淀a于70℃低温烘干,备用;
50.(2)将沉淀a加入20重量倍(v/m)的水,于70℃下水浴提取4h,过滤,得到滤液b和沉淀b;
51.(3)将沉淀b中加入20重量倍(v/m)的水,用1mol/l氢氧化钠溶液调节ph值至10,于60℃下恒温搅拌提取6h,再在5000rpm/min转速下离心20min,得到上清液a和沉淀c,用1mol/l的盐酸溶液调节上清液a ph值至4,再在5000rpm/min的转速下离心20min,得到上清液b和沉淀d,将沉淀d加水复溶后调节ph至7,在-40℃下预冻20min后,真空冷冻干燥48h,得到杜仲籽粕蛋白;
52.(4)将杜仲籽粕蛋白加入30重量倍(v/m)的水,置于50℃中水浴,用1mol/l的氢氧化钠溶液调节ph值至10,加入底物质量比3%碱性蛋白酶,酶解5h,酶解结束后,沸水浴灭酶5min,在5000rpm/min转速下离心20min得到上清液c;调节上清液c的ph值至7,在5000rpm/min转速下离心15min,得到上清液d,即杜仲籽粕多肽溶液;将杜仲籽粕多肽溶液在-40℃下预冻30min后,真空冷冻干燥48h,即得到杜仲籽粕多肽。
53.关于实施例3中的样品,本发明人进行了蛋白质、氨基酸和多肽分析,具体如下:
54.实验方法
55.(一)蛋白质分析
56.样品制备:样品复溶后超滤(10kd),截留大分子蛋白,即得样品溶液。
57.色谱分离:液相所用的a液为0.1%甲酸水溶液,b液为0.1%甲酸乙腈水溶液(乙腈为84%)。液相色谱柱(0.15mm*150mm,rp-c18,column technology inc.)以95%的a液进行平衡,样品由自动进样器上样到zorbax 300sb-c18 peptide traps(agilent technologies,wilmington,de),再经色谱柱分离,相关液相梯度设置如下:
58.0分钟
‑‑‑
50分钟,b液线性梯度从4%到50%;
59.50分钟
‑‑‑
54分钟,b液线性梯度从50%到100%;
60.54分钟
‑‑‑‑
60分钟,b液维持在100%。
61.质谱鉴定:酶解产物经毛细管高效液相色谱分离后用q exactive质谱仪(thermo fisher)进行质谱分析,分析时长:60min。
62.检测方式:正离子;
63.多肽和多肽的碎片的质量电荷比按照下列方法采集:每次全扫描(full scan)后采集10个碎片图谱(ms2 scan)。
64.数据分析:质谱测试原始文件(raw file)用软件mascot 2.2检索相应的数据库,最后得到蛋白质鉴定结果。
65.对优化提取工艺后得到的碱性酶酶解产物,进行蛋白质、氨基酸和肽段分布检测,对酶解前后进行全成分分析比较。
66.样品蛋白质检测结果
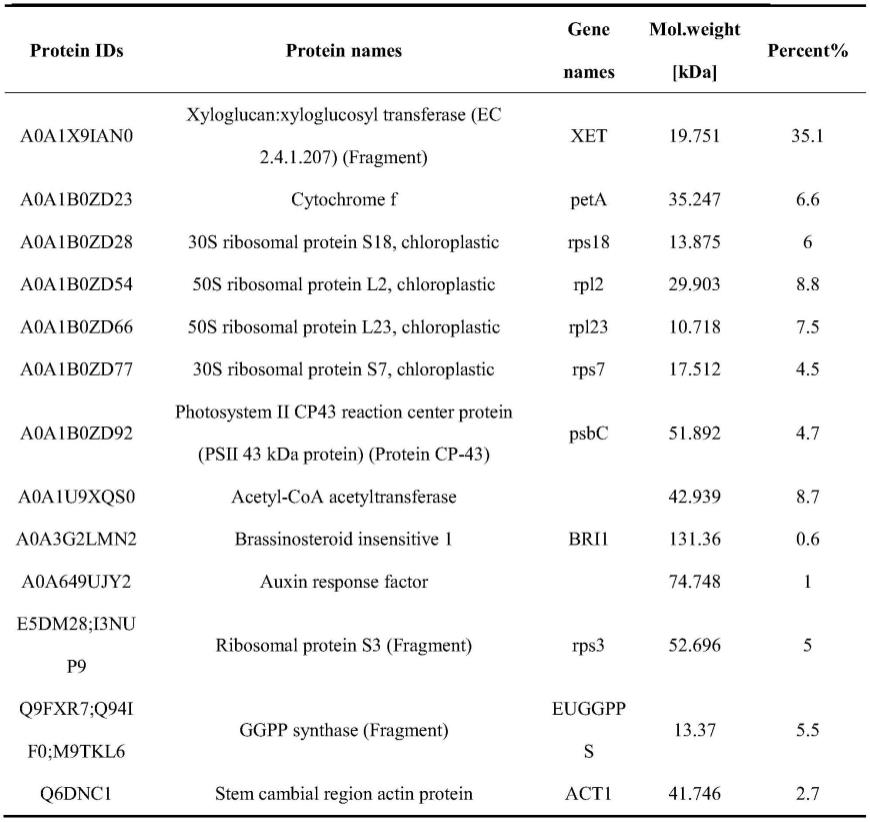
67.本发明实施例3样品经鉴定后,检出含有13种蛋白质,结果如下表。
68.表1蛋白质鉴定结果
[0069][0070]
(二)多肽分析
[0071]
样品制备:样品经超滤(10kd)、脱盐后进行质谱检测。
[0072]
色谱分离:液相所用的a液为0.1%甲酸水溶液,b液为0.1%甲酸乙腈水溶液(乙腈为84%)。液相色谱柱(0.15mm
×
150mm,rp-c18,column technology inc.)以95%的a液进行平衡,样品由自动进样器上样到zorbax 300sb-c18 peptide traps(agilent technologies,wilmington,de),再经色谱柱分离,相关液相梯度设置如下:
[0073]
0分钟
‑‑‑
50分钟,b液线性梯度从4%到50%;
[0074]
50分钟
‑‑‑
54分钟,b液线性梯度从50%到100%;
[0075]
54分钟
‑‑‑‑
60分钟,b液维持在100%。
[0076]
质谱鉴定:样品经毛细管高效液相色谱分离后用q exactive质谱仪(thermo fisher)进行质谱分析,分析时长:60min。
[0077]
检测方式:正离子。多肽和多肽的碎片的质量电荷比按照下列方法采集:每次全扫描(full scan)后采集10个碎片图谱(ms2 scan)。
[0078]
数据分析:质谱测试原始文件(raw file)用软件mascot 2.2分析,最后得到肽段鉴定结果。
[0079]
样品肽链检测结果见下表2。
[0080]
表2肽段鉴定结果
[0081][0082][0083]
(三)氨基酸检测:
[0084]
采用hplc对17种氨基酸进行含量分析。
[0085]
样品氨基酸检测结果
[0086]
本发明实施例3样品经鉴定后,样品总游离氨基酸含量为196.6g/kg,其中,谷氨酸、天冬氨酸、亮氨酸、精氨酸、甘氨酸、异亮氨酸等含量较高,且均为人体必需氨基酸。结果见下表。
[0087]
表3氨基酸鉴定结果
[0088][0089][0090]
从表1~3中可以看出,采用本发明方法制备的杜仲籽粕多肽,肽段数量为10328个,而肽段筛选分数大于20分的有3278个;其中,总多肽(2-26个氨基酸长度)含量为6.02g/100g,多肽(10-26个氨基酸长度,1000-3000da)含量为3.25g/100g,寡肽、小分子肽(*部分机构认为《500da才是小分子肽)含量为2.75g/100g。该多肽中蛋白质含量为35.17g/100g,且共检出含有13种蛋白质,以xyloglucan:xyloglucosyl transferase(ec 2.4.1.207)(fragment)的含量最高。该多肽总游离氨基酸含量为196.6g/kg,其中,谷氨酸、天冬氨酸、亮氨酸、精氨酸、甘氨酸、异亮氨酸等含量较高。
[0091]
实施例4
[0092]
(1)取杜仲籽粕粉碎、过筛,加入15重量倍(v/m)的60%乙醇浸泡提取36h,过滤,得到滤液a和沉淀a,将沉淀a于60℃低温烘干,备用;
[0093]
(2)将沉淀a加入20重量倍(v/m)的水,于75℃下水浴提取2.5h,过滤,得到滤液b和沉淀b;
[0094]
(3)将沉淀b中加入20重量倍(v/m)的水,用0.8mol/l氢氧化钠溶液调节ph值至11,
于55℃下恒温搅拌提取4.5h,再在3500rpm/min转速下离心25min,得到上清液a和沉淀c,用0.8mol/l的盐酸溶液调节上清液a ph值至3.5,再在3500rpm/min的转速下离心25min,得到上清液b和沉淀d,将沉淀d加水复溶后调节ph至7.5,在-40℃下预冻20min后,真空冷冻干燥48h,得到杜仲籽粕蛋白;
[0095]
(4)将杜仲籽粕蛋白加入25重量倍(v/m)的水,置于60℃中水浴,用0.8mol/l的氢氧化钠溶液调节ph值至11,加入底物质量比4.5%碱性蛋白酶,酶解3.5h,酶解结束后,沸水浴灭酶5min,3500rpm/min离心25min离心得到上清液c;调节上清液c的ph值至8,在3500rpm/min转速下离心15min,得到上清液d,即杜仲籽粕多肽溶液;将杜仲籽粕多肽溶液在-40℃下预冻30min后,真空冷冻干燥48h,即得到杜仲籽粕多肽。
[0096]
实施例5
[0097]
(1)取杜仲籽粕粉碎、过筛,加入25重量倍(v/m)的85%乙醇浸泡提取48h,过滤,得到滤液a和沉淀a,将沉淀a于70℃低温烘干,备用;
[0098]
(2)将沉淀a加入35重量倍(v/m)的水。于75℃下水浴提取4h,过滤,得到滤液b和沉淀b;
[0099]
(3)将沉淀b中加入35重量倍(v/m)的水,用0.6mol/l氢氧化钠溶液调节ph值至10.5,于55℃下恒温搅拌提取4.5h,再在4000rpm/min转速下离心20min,得到上清液a和沉淀c,用0.6mol/l的盐酸溶液调节上清液a ph值至3.5,再在5000rpm/min的转速下离心10min,得到上清液b和沉淀d,将沉淀d加水复溶后调节ph至7,在-40℃下预冻20min后,真空冷冻干燥48h,得到杜仲籽粕蛋白;
[0100]
(4)将杜仲籽粕蛋白加入30重量倍(v/m)的水,置于45℃中水浴,用0.6mol/l的氢氧化钠溶液调节ph值至11.5,加入底物质量比2.5%碱性蛋白酶,酶解2.5h,酶解结束后,沸水浴灭酶5min,5000rpm/min离心10min离心得到上清液c;调节上清液c的ph值至7,在5000rpm/min转速下离心5min,得到上清液d,即杜仲籽粕多肽溶液;将杜仲籽粕多肽溶液在-40℃下预冻30min后,真空冷冻干燥48h,即得到杜仲籽粕多肽。
[0101]
实施例6
[0102]
(1)取杜仲籽粕粉碎、过筛,加入30重量倍(v/m)的65%乙醇浸泡提取48h,过滤,得到滤液a和沉淀a,将沉淀a于70℃低温烘干,备用;
[0103]
(2)将沉淀a加入25重量倍(v/m)的水,于80℃下水浴提取3.5h,过滤,得到滤液b和沉淀b;
[0104]
(3)将沉淀b中加入25重量倍(v/m)的水,用0.3mol/l氢氧化钠溶液调节ph值至9,于45℃下恒温搅拌提取3.5h,再在2500rpm/min转速下离心20min,得到上清液a和沉淀c,用0.3mol/l的盐酸溶液调节上清液a ph值至4,再在2500rpm/min的转速下离心20min,得到上清液b和沉淀d,将沉淀d加水复溶后调节ph至7,在-40℃下预冻20min后,真空冷冻干燥48h,得到杜仲籽粕蛋白;
[0105]
(4)将杜仲籽粕蛋白加入10重量倍(v/m)的水,于40℃中水浴加热,用0.5mol/l的氢氧化钠溶液调节ph值至8,加入底物质量比0.5%碱性蛋白酶,酶解2h,酶解结束后,沸水浴灭酶5min,2500rpm/min离心10min离心得到上清液c;调节上清液c的ph值至6,在2500rpm/min转速下离心5min,得到上清液d,即杜仲籽粕多肽溶液;将杜仲籽粕多肽溶液在-40℃下预冻30min后,真空冷冻干燥48h,即得到杜仲籽粕多肽。
[0106]
对比例1
[0107]
对比例1和实施例3的不同之处在于,制备对比例1的样品,采用实施例3的步骤进行(1)~(3)的处理,得到杜仲籽粕蛋白。
[0108]
对比例2
[0109]
对比例2和实施例3的不同之处在于,步骤(4)采用中性蛋白酶,酶解时调节ph至7左右。
[0110]
对比例3
[0111]
对比例3和实施例3的不同之处在于,步骤(4)采用酸性蛋白酶,酶解时调节ph至5左右。
[0112]
对比例4
[0113]
对比例4和实施例1的不同之处在于,步骤(4)采用风味蛋白酶,酶解时调节ph至6左右。
[0114]
对比例5
[0115]
对比例5和实施例1的不同之处在于,步骤(4)采用木瓜蛋白酶,酶解时调节ph至7左右。
[0116]
对比例6
[0117]
对比例6和实施例1的不同之处在于,步骤(4)采用菠萝蛋白酶,酶解时调节ph至7左右。
[0118]
对比例7
[0119]
对比例7和实施例1的不同之处在于,步骤(4)采用胃蛋白酶,酶解时调节ph至1.5左右。
[0120]
对比例8
[0121]
对比例8和实施例1的不同之处在于,步骤(4)采用胰蛋白酶,酶解时调节ph至8左右。
[0122]
实验例1
[0123]
杜仲籽粕多肽抗疲劳效果评价
[0124]
1.1实验样品
[0125]
本发明实施例3、对比例1-8样品,市售海参肽产品、红景天、人参、红牛饮料。
[0126]
1.2实验方法
[0127]
将小鼠适应性饲养1周后,按体质量随机分为14组:空白对照组、本发明实施例3、对比例1-8样品、市售海参肽产品、红景天、人参、红牛饮料,每组10只。本发明实施例3、对比例1-8样品、市售海参肽产品、红景天、人参等组均按照2g/kg/d(以生药量计)剂量灌胃,红牛饮料按照2ml/d灌胃,空白对照组给予等体积的生理盐水,各组每日灌胃1次,连续15d。
[0128]
小鼠负重游泳实验:末次给药30min后,将小鼠尾部负上砝码,负载质量为小鼠自身质量的10%,放入小鼠恒温游泳池中,水温(25.0
±
0.5)℃,放入小鼠后开始计时,记小鼠沉于水面下10s后不能浮出水面的时间作为力竭游泳时间。游泳结束后从小鼠眼眶取血,分离血清。脱颈处死小鼠,取小鼠后腿肌肉。检测血清样品血乳酸、血清尿素氮以及肌糖原水平。
[0129]
1.3统计方法
[0130]
试验数据采用spss22.0统计软件进行统计分析,统计量用均值
±
标准差表示,组间比较用单因素方差分析。
[0131]
1.4实验结果
[0132]
表4杜仲籽粕多肽抗疲劳效果评价
[0133][0134]
与空白组比较,
*
p《0.05,
**
p《0.01。与市售海参肽组比较,
δ
p《0.05。与红景天组比较,
#
p《0.05。与人参组比较,
&
p《0.05。与红牛饮料组比较,
§§
p《0.01。
[0135]
抗疲劳效果实验结果如表4所示,本发明实施例3样品组、市售海参肽组、红景天组、人参组、红牛饮料组均可延长小鼠负重游泳时间,与空白组比较,均有显著性差异(p《0.05或0.01);上述各组血乳酸、血清尿素氮水平均有下降,与空白组比较,均有显著性差异
(p《0.05或0.01);而上述各组的肌糖原水平均有上升,与空白组比较,有显著性差异(p《0.05或0.01);说明上述样品具有明显的抗疲劳作用。
[0136]
表4结果还显示,对比例1-8样品组的小鼠负重游泳时间、血乳酸、血清尿素氮、肌糖原等指标与空白组比较,均无显著性改变,说明对比例1-8样品无抗疲劳作用。此外,本发明实施例3样品组的小鼠负重游泳时间、血乳酸、血清尿素氮、肌糖原等指标,与市售海参肽组、红景天组、人参组、红牛饮料组等对照组比较,均有显著性差异(p《0.05或0.01),说明采用本发明方法所制备的杜仲籽粕多肽样品具有显著的抗疲劳作用,其效果还优于市售的抗疲劳产品。
[0137]
以上抗疲劳实验结果说明,采用本发明方法制备的杜仲籽粕多肽,具有明确的抗疲劳作用。该制备方法及其有益的效果,可满足杜仲籽粕综合开发的需要。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。