1.本发明涉及皮肤外植体模型技术领域,具体涉及一种奶牛趾间皮肤外植体模型构建方法。
背景技术:
2.随着畜牧养殖行业的快速发展,奶牛肢蹄病已经成为继乳房炎和繁殖障碍之后危害奶牛健康养殖的第三大疾病,奶牛肢蹄病是对由环境、管理、营养以及生理等多种不良饲养因素引起奶牛肢蹄部位发生病变的总称。据联合国粮农组织统计,在发达国家奶牛肢蹄病发病率为15%;在发展中国家发病率高达30%~40%。肢蹄病可导致奶牛生产和繁殖性能降低、利用年限缩短以及治疗费用增加等,给奶牛产业带来巨大的经济损失。
3.奶牛趾间皮肤常见感染性疾病包括腐蹄病、蹄皮炎、趾间皮炎等。患病奶牛蹄部皮肤常表现出坏死和裂开,炎症自趾间向皮肤各处蔓延,并伴有全身性症候,奶牛趾间感染性蹄病已经成为一类影响奶牛肢蹄健康的重要群发性疾病。国内外对该类疾病的的炎症发病机理报道较少,究其原因,主要是对奶牛趾间皮肤研究受到实验动物3r(replacement,reduction,refinement)原则以及伦理学等因素的限制。奶牛趾间皮肤外植体模型既能够满足奶牛趾间皮肤感染性疾病研究需要,又符合实验动物伦理要求,因此本发明能够促进奶牛趾间皮肤感染机制的离体试验深入研究,进而推动奶牛健康养殖的可持续性发展。
技术实现要素:
4.本发明的目的在于提供一种奶牛趾间皮肤外植体模型构建方法,该方法构建的奶牛趾间皮肤外植体模型具有高稳定性、高重复性的特点,此外该模型的构建能够大大降低实验动物的使用频率。
5.为了实现上述发明目的,本发明提供以下技术方案:
6.本发明提供了一种奶牛趾间皮肤外植体模型构建方法,包括以下步骤:
7.将奶牛趾间皮肤浸入运输培养基中运输,运输完成后使用洗涤培养基清洗奶牛趾间皮肤,将清洗后的奶牛趾间皮肤培养于含有组织培养基的细胞小室中,完成模型构建,最终对奶牛趾间皮肤外植体模型进行可行性评估;
8.所述运输培养基的成分包括dmem/f-12培养基、青霉素-链霉素-两性霉素b溶液、硫酸庆大霉素、l-谷氨酰胺;
9.所述洗涤培养基的成分包括dmem/f-12培养基、青霉素-链霉素-两性霉素b溶液、硫酸庆大霉素;
10.所述组织培养基的成分包括高糖dmem培养基,dmem/f-12培养基、青霉素-链霉素-两性霉素b溶液、硫酸庆大霉素、l-谷氨酰胺、胎牛血清。
11.优选地,所述运输培养基中,硫酸庆大霉素的浓度为4~6μg/ml,所述dmem/f-12培养基、青霉素-链霉素-两性霉素b溶液与l-谷氨酰胺的体积比为(97.5~98.5):(0.9~1.1):(0.9~1.1)。
12.优选地,所述洗涤培养基中,硫酸庆大霉素的浓度为1~3μg/ml,所述dmem/f-12培养基与青霉素-链霉素-两性霉素b溶液的体积比为(98.5~99.0):(0.9~1.1)。
13.优选地,所述组织培养基中,所述高糖dmem培养基、dmem/f-12培养基、青霉素-链霉素-两性霉素b溶液、l-谷氨酰胺与胎牛血清的体积比为(63~66):(21~22):(0.9~1.1):(0.9~1.1):(9~11),所述硫酸庆大霉素的浓度为4~6μg/ml。
14.优选地,所述清洗的次数为2~4次,每次10~20min。
15.优选地,所述的细胞小室包括内室和外室,外室添加的组织培养基的含量为1~3ml。
16.优选地,所述的细胞小室包括内室和外室,内室中添加组织培养基至奶牛趾间皮肤表皮与真皮交界处。
17.优选地,在奶牛趾间皮肤浸入运输培养基前,使用清水冲洗奶牛蹄部表面污物,再使用质量分数为1~3%葡萄糖酸氯己定清洗奶牛蹄部表面皮肤。
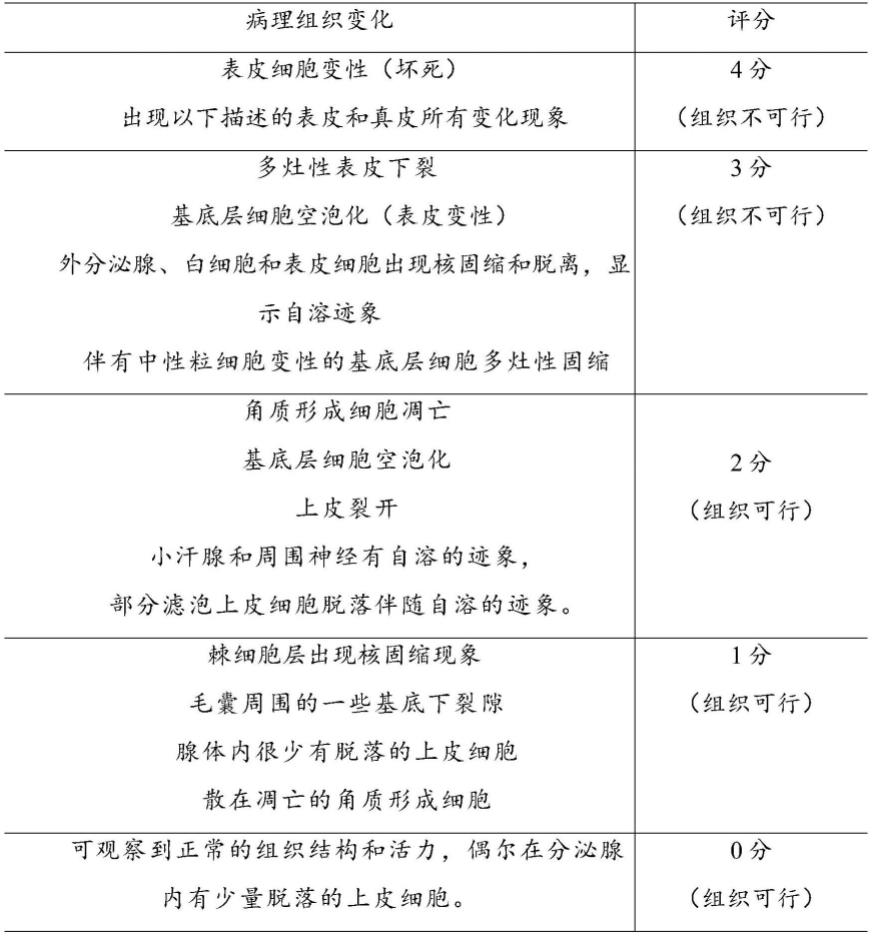
18.优选地,所述可行性评估通过以下指标进行评分:皮肤外植体病理组织变化、凋亡相关蛋白caspase-3表达、tunel细胞凋亡检查凋亡率。
19.优选地,所述可行性评估的标准为皮肤外植体病理组织检查评分<3分、凋亡相关蛋白caspase-3表达阳性综合评分<6分、细胞凋亡率评分<3分时的外植体模型认为是可行的。
20.本发明的有益效果如下:
21.本发明首次提供了一种奶牛趾间皮肤外植体模型构建方法,所构建模型为3d奶牛趾间皮肤模型。该模型相较细胞模型能够更大的维持组织结构的完整性,更真实地模拟皮肤在体环境,同时本外植体模型符合减少、替代、优化等实验动物要求。该模型的构建为深入研究皮肤细胞间的相互作用和细胞信号传导,角质形成细胞的粘附和分化,皮肤屏障功能变化奠定前期基础。
附图说明
22.图1为不同时期奶牛趾间皮肤外植体病理学变化(h.e
×
200)图;
23.图2为不同时期奶牛趾间皮肤外植体中caspase-3蛋白的表达(dab
×
400)图;
24.图3为不同时期奶牛趾间皮肤外植体中细胞凋亡情况图,其中每张图中红色为tunel染色的凋亡细胞(在每张图的右侧),蓝色为dapi染色的全部细胞(在每张图的左侧),其中图中不清楚的字迹和线条不影响对本发明技术内容的理解。
25.图4奶牛趾间皮肤外植体模型组装图。
具体实施方式
26.本发明提供了一种奶牛趾间皮肤外植体模型构建方法,包括以下步骤:
27.将奶牛趾间皮肤浸入运输培养基中运输,运输完成后使用洗涤培养基清洗奶牛趾间皮肤,将清洗后的奶牛趾间皮肤培养于含有组织培养基的细胞小室中,完成模型构建,最终对奶牛趾间皮肤外植体模型进行可行性评估;
28.所述运输培养基的成分包括dmem/f-12培养基、青霉素-链霉素-两性霉素b溶液、硫酸庆大霉素、l-谷氨酰胺;
29.所述洗涤培养基的成分包括dmem/f-12培养基、青霉素-链霉素-两性霉素b溶液、硫酸庆大霉素;
30.所述组织培养基的成分包括高糖dmem培养基,dmem/f-12培养基、青霉素-链霉素-两性霉素b溶液、硫酸庆大霉素、l-谷氨酰胺、胎牛血清。
31.在本发明中,在奶牛趾间皮肤浸入运输培养基前,作为一优选的实施方式,采集奶牛蹄部趾间皮肤时,奶牛蹄部使用清水冲洗,直至表面无肉眼可见污物,再使用质量分数为1~3%葡萄糖酸氯己定消杀奶牛蹄部表面病原微生物。
32.在本发明中,将采集的奶牛蹄部趾间皮肤充分清洗、消毒后,无菌条件下采集奶牛趾间皮肤。
33.在本发明中,采集奶牛趾间皮肤后,将奶牛趾间皮肤浸入运输培养基中运输。所述运输培养基中,硫酸庆大霉素的浓度优选为4~6μg/ml,所述dmem/f-12培养基、青霉素-链霉素-两性霉素b溶液与l-谷氨酰胺的体积比优选为(97.5~98.5):(0.9~1.1):(0.9~1.1)。所述运输优选为低温运输,如采用冰上运输或器官保存运输箱的方式。本发明采用运输培养基能够提供短时间运输途中皮肤组织所需营养物质,维持组织活性。
34.在本发明中,运输完成后,用洗涤培养基清洗奶牛趾间皮肤。所述洗涤培养基中,硫酸庆大霉素的浓度优选为1~3μg/ml,所述dmem/f-12培养基与青霉素-链霉素-两性霉素b溶液的体积比优选为(98.5~99.0):(0.9~1.1)。所述清洗的次数优选为2~4次,每次10~20min,进一步优选为清洗3次,每次12~18min。清洗时,作为一优选的实施方式,将洗涤培养基预热至36~38℃,室温下清洗。本发明的洗涤培养基具有抑制细菌及真菌生长,预防微生物污染的作用。
35.在本发明中,将清洗后的奶牛趾间皮肤培养于含有组织培养基的细胞培养小室中,完成模型构建。所述细胞培养小室可为6孔板、12孔板、24孔板。在本发明中,所述的细胞小室包括内室和外室,外室添加的组织培养基的含量优选为1~3ml。由于离体组织缺少血液系统供应养分,为了保证离体组织获取营养和氧气,作为一优选的实施方式,内室中添加组织培养基至奶牛趾间皮肤表皮与真皮交界处,形成交替暴露于培养液与气相的培养条件,在该培养条件下,皮肤组织在吸收培养基养分的同时增大与气体的接触面积,可以吸收更加充足的氧气,更加接近体内的生理环境。所述组织培养基中,所述高糖dmem培养基、dmem/f-12培养基、青霉素-链霉素-两性霉素b溶液、l-谷氨酰胺与胎牛血清的体积比优选为(63~66):(21~22):(0.9~1.1):(0.9~1.1):(9~11),所述硫酸庆大霉素的浓度优选为4~6μg/ml;所述的培养条件优选为于37℃、5%co2湿化培养箱中培养。在本发明中,在组织培养基中培养时,优选地每隔12h换液一次。本发明的组织培养基可为皮肤组织提供充足的营养和维持存活的基础物质,并为其提供适宜的生存环境。
36.在本发明中,所述在运输培养基、洗涤培养基或组织培养基中的奶牛趾间皮肤直径优选为≤8mm。在运输培养基、洗涤培养基或组织培养基中所述dmem/f-12培养基优选为dmem/f-121:1培养基,所述青霉素-链霉素-两性霉素b溶液优选为青霉素-链霉素-两性霉素b溶液(100x)。
37.在本发明中,将不同培养时间节点皮肤组织采集并固定于4%多聚甲醛中,进行病理学等评估,最终判定奶牛趾间皮肤外植体模型可行性。作为一优选的实施方式,所述可行性评估通过以下指标进行评分:皮肤外植体病理组织变化、凋亡相关蛋白caspase-3表达、
tunel细胞凋亡检查凋亡率。所述可行性评估的标准优选为皮肤外植体病理组织检查评分<3分、凋亡相关蛋白caspase-3表达阳性综合评分<6分、细胞凋亡率评分<3分时的外植体模型认为是可行的。作为一优选的实施方式,奶牛趾间皮肤外植体模型评价方法:1)根据皮肤外植体病理组织变化进行评分:表皮细胞变性(坏死),并出现以下描述的表皮和真皮所有变化现象,记4分(组织不可行);多灶性表皮下裂,基底层细胞空泡化(表皮变性),外分泌腺、白细胞和表皮细胞出现核固缩和脱离,显示自溶迹象并伴有中性粒细胞变性的基底层细胞多灶性固缩,记3分(组织不可行);角质形成细胞凋亡,基底层细胞空泡化,上皮裂开,小汗腺和周围神经有自溶的迹象,部分滤泡上皮细胞脱落伴随自溶的迹象,记2分(组织可行);散在凋亡的角质形成细胞,记1分(组织可行);可观察到正常的组织结构和活力,偶尔在分泌腺内有少量脱落的上皮细胞,记0分(组织可行)。2)根据凋亡相关蛋白caspase-3表达进行阳性评分:
①
阳性率:阳性细胞数/细胞总数
×
100%,反映阳性细胞所占百分比。对细胞阳性比率进行评分:0~5%为0分,6%~15%为1分,16%~50%为2分,51%~75%为3分,》75%为4分;
②
阳性细胞着色强度:测量区域平均阳性强度为0,1,2,3分,阴性无着色,计0分;弱阳性淡黄色,计1分;中阳性棕黄色,计2分;强阳性棕褐色计3分;
③
阳性评分:阳性综合评分为阳性细胞着色强度分值
×
阳性细胞比率分值,数据越大说明综合阳性强度越强。3)根据tunel细胞凋亡检查凋亡率进行评分:计算视野内1000个细胞中阳性细胞所占观察同类细胞的百分比,细胞凋亡率=凋亡细胞数量/1000
×
100%。对细胞凋亡率进行评分:细胞凋亡率在0~5%为0分,6%~15%为1分,16%~50%为2分,认为模型可行;细胞凋亡率在51%~75%为3分,》75%为4分,认为模型不可行。4)模型可行性评分标准:模型可行性根据病理组织学检查评分、阳性综合评分和细胞凋亡率评分综合评定。皮肤外植体病理组织检查评分<3分、凋亡相关蛋白caspase-3表达阳性综合评分<6分、细胞凋亡率评分<3分时的外植体模型认为是可行的。本发明通过上述评估方法,在组织培养基培养36h时,本发明构建的奶牛趾间皮肤外植体组织结构完整,模型可行。
38.在本发明中,若无特殊说明,所有的原料组分均为本领域技术人员熟知的市售商品。
39.下面将结合本发明中的实施例,对本发明中的技术方案进行清楚、完整地描述。显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
40.在本发明的实施例中,所述dmem/f-121:1培养基购自兰杰柯科技有限公司旗下biosharp品牌,货号bl305a;所述高糖dmem购自兰杰柯科技有限公司旗下biosharp品牌,货号bl301a;所述青霉素-链霉素-两性霉素b溶液(100x)购自碧云天生物技术有限公司,货号c0224-100ml;所述l-谷氨酰胺购自北京索莱宝科技有限公司,货号g0200;所述硫酸庆大霉素购自北京索莱宝科技有限公司,货号l1312-10ml;所述胎牛血清购自clark公司,货号fb15015。
41.实施例1
42.(一)试验动物
43.屠宰场新宰杀的健康且蹄形结构良好的同一奶牛后蹄为一组试验样本,采集三头奶牛共计6只后蹄,在相同条件下处理蹄部污物,整个试验过程中运输方式保持一致,均采
用冰上运输。
44.(二)奶牛趾间皮肤外植体模型构建
45.1、培养基的制备:
46.①
运输培养基制备:每100ml运输培养基中,青霉素-链霉素-两性霉素b溶液(100x)1ml、l-谷氨酰胺溶液1ml、5μg/ml硫酸庆大霉素9μl,余量为dmem/f121:1培养基。
47.②
洗涤培养基制备:每100ml洗涤培养基中,青霉素-链霉素-两性霉素b溶液(100x)1ml、2μg/ml硫酸庆大霉素4μl,余量为dmem/f-121:1培养基。
48.③
组织培养基制备:每100ml组织培养基中,青霉素-链霉素-两性霉素b溶液(100x)1ml、l-谷氨酰胺溶液1ml、5μg/ml硫酸庆大霉素10μl,胎牛血清10ml,dmem高糖培养基65.9925ml,余量为dmem/f-121:1培养基。
49.2、样本采集、运输:
50.采集屠宰场新宰杀的健康且蹄形结构良好的同一奶牛后蹄为一组试验对象,共计采集3头奶牛6只后蹄,设立三组对照。将刚屠宰的奶牛蹄部用清水冲洗干净至表面无肉眼可见污物后用质量分数为2%葡萄糖酸氯己定皮肤清洁剂对皮肤表面进行消毒。随后无菌采集整个趾间皮肤后浸入上述运输培养基中,冰上运输至实验室。
51.3、模型的组装
52.使用8mm皮肤活检打孔器从趾间皮肤无菌收集外植体,并浸入预热至37℃的洗涤培养基中,室温下洗涤3次,15min/次,洗涤后的组织放置于12孔细胞培养小室的内室中,并从外室中添加2ml组织培养基,内室中添加组织培养基至外植体表皮与真皮交界处,形成交替暴露于培养液与气相的培养条件。将组装的外植体模型置于37℃、5%co2湿化培养箱中培养,每12h换液1次,于培养0、12、24、36、48和72h各收集2块皮肤外植体,固定于4%多聚甲醛中。
53.4、病理组织切片制备
54.采用黑龙江八一农垦大学动物科技学院病理课题组的国家发明专利,专利申请号201110175687.9,专利名称《动物组织石蜡切片的绿色环保制作技术》,制作石蜡组织切片。
55.1)病理组织形态检查
56.将石蜡切片常规脱蜡至水,梯度乙醇(100%、95%、85%、75%)复水,每梯度3min,蒸馏水2min。苏木素染液染色15min,蒸馏水5min洗去浮色,55℃烘箱中烤干后伊红染色30s,蒸馏水2~3s后快速脱水,中性树胶封固,显微镜下观察皮肤外植体的组织结构完整性,并根据开发的病理组织学评分系统(表1)进行评分。
57.表1病理组织学评分表
[0058][0059]
2)caspase-3蛋白的测定
[0060]
免疫组织化学方法主要步骤如下:石蜡切片常规脱蜡至水,流水冲洗,pbs冲洗3min
×
3次,擦干。胰酶修复抗原,pbs冲洗3min
×
3次,擦干。3%的h2o2消化内源性过氧化物酶,pbs冲洗后用非免疫性动物血清封闭,随后甩去血清,滴加一抗(caspase-3滴度为1:400),4℃冰箱过夜。次日pbs冲洗后,滴加链霉素抗生物素-过氧化物酶溶液,孵育10min。pbs冲洗后,滴加新鲜配制的dab显色液,显微镜下控制显色。苏木素复染细胞核为30s,流水冲洗,烤干后封片观察。
[0061]
观察每张组织切片3组不同视野下caspase-3蛋白的阳性表达率,记录试验结果。
[0062]
根据凋亡相关蛋白caspase-3表达进行阳性评分:
①
阳性率:阳性细胞数/细胞总数
×
100%,反映阳性细胞所占百分比。对细胞阳性比率进行评分:0~5%为0分,6%~15%为1分,16%~50%为2分,51%~75%为3分,》75%为4分;
②
阳性细胞着色强度:测量区域平均阳性强度为0,1,2,3分,阴性无着色,计0分;弱阳性淡黄色,计1分;中阳性棕黄色,计2分;强阳性棕褐色计3分;
③
阳性评分:阳性综合评分为阳性细胞着色强度分值
×
阳性细胞
比率分值,数据越大说明综合阳性强度越强。
[0063]
3)tunel细胞凋亡检测
[0064]
石蜡切片常规脱蜡至水,无水乙醇5min,90%乙醇2min,70%乙醇2min,蒸馏水2min。滴加20μg/ml不含dnase的蛋白酶k,室温下作用20min。pbs冲洗3次,在样品上滴加50μl配制好的tunel检测液,37℃条件下避光孵育60min。pbs冲洗3次后晾干,dapi室温下复染5min,pbs冲洗3次。中性树胶封固,荧光显微镜下观察,红色细胞为凋亡细胞,蓝色细胞为全部细胞。
[0065]
计算荧光显微镜视野内1000个细胞中阳性细胞所占观察同类细胞的百分比,细胞凋亡率=凋亡细胞数量/1000
×
100%。对细胞凋亡率进行评分:细胞凋亡率在0~5%为0分,6%~15%为1分,16%~50%为2分,认为模型可行;细胞凋亡率在51%~75%为3分,》75%为4分,认为模型不可行。
[0066]
(三)皮肤外植体模型评价
[0067]
模型可行性评分标准:模型可行性根据病理组织学检查评分、阳性综合评分和细胞凋亡率评分综合评定。皮肤外植体病理组织检查评分<3分、凋亡相关蛋白caspase-3表达阳性综合评分<6分、细胞凋亡率评分<3分时的外植体模型认为是可行的。
[0068]
(四)奶牛趾间皮肤外植体检查结果
[0069]
1、病理组织学检查
[0070]
由图1可见,采集0h的皮肤组织表皮完整,各层结构清晰,真皮层的结缔组织排列规则,皮下组织位于真皮下方,肌层的肌纤维紧密排列,皮肤附属器官毛囊、皮脂腺以及汗腺等散在分布;12h的皮肤组织真皮层胶原纤维出现紊乱迹象,24h的皮肤组织仍可保持完整的表皮结构;36h的皮肤组织真皮层形态欠佳,胶原纤维紊乱现象较为明显;48h的皮肤组织可见上皮细胞角化过度,灶性棘层增厚,棘层细胞出现变性、坏死,细胞核固缩,真皮层的胶原纤维紊乱,少量毛囊、汗腺坏死;76h的皮肤组织可见表皮脱落、缺失严重,棘层细胞变性,胞质消失,真皮层的胶原纤维紊乱,皮肤附属器官毛囊、皮脂腺等发生不同程度的坏死。
[0071]
对各时间段皮肤外植体病理组织学评分:0h计为0分;12h计为0分;24h计为1分;36h计为2分;48h计为3分;72h计为4分。
[0072]
2、caspase-3蛋白表达检测
[0073]
免疫组化结果显示,体外培养12、24、36、48及72h的皮肤外植体caspase-3蛋白呈阳性表达(见图2),组间阳性表达率差异显著(р<0.01);与对照组0h皮肤外植体相比,12h和24h的皮肤外植体中caspase-3蛋白的阳性表达差异不显著(р>0.05)(见表2),无统计学意义;36h、48h与72h的皮肤外植体中caspase-3蛋白的阳性表达差异显著(р<0.05)(见表2),具有统计学意义。
[0074]
对各时间段皮肤外植体组织切片caspase-3蛋白阳性表达综合评分:0h计为0分;12h计为0分;24h计为2分;36h计为2分;48h计为2分;72h计为2分。
[0075]
表2奶牛趾间皮肤外植体12h、24h、36h、48h及72h caspase-3阳性率比较
[0076]
[0077]
3、tunel细胞凋亡检测
[0078]
细胞凋亡检测结果显示,体外培养12、24、36、48及72h的皮肤外植体caspase-3蛋白呈阳性表达(图3),组间阳性表达率差异显著(p<0.01);与对照组0h皮肤外植体相比,12h和24h的皮肤外植体中细胞凋亡率差异不显著(р>0.05)(表3),无统计学意义;36h、48h与72h的皮肤外植体中细胞凋亡率差异显著(р<0.01)(表3),具有统计学意义。
[0079]
对各时间段皮肤外植体组织切片细胞凋亡率评分:0h计为0分;12h计为0分;24h计为1分;36h计为1分;48h计为2分;72h计为2分。
[0080]
表3奶牛趾间皮肤外植体12h、24h、36h、48h及72h tunel阳性率比较
[0081][0082]
综合上述评分结果,各时间段皮肤外植体组织切片caspase-3阳性综合评分及细胞凋亡评分均在可行范围,但48h皮肤外植体病理组织学评分>3分,36h皮肤外植体组织结构完整,模型可行,其中24h皮肤外植体组织结构比36h更加完整,皮肤外植体状态最佳。
[0083]
实施例2
[0084]
1、奶牛趾间皮肤外植体模型构建方法:
[0085]
1)培养基的制备方法:
[0086]
①
运输培养基制备:每100ml运输培养基中,青霉素-链霉素-两性霉素b溶液(100x)0.9ml、l-谷氨酰胺溶液1.1ml、6μg/ml硫酸庆大霉素10μl,余量为dmem/f121:1培养基。
[0087]
②
洗涤培养基制备:每100ml洗涤培养基中,青霉素-链霉素-两性霉素b溶液(100x)0.9ml、3μg/ml硫酸庆大霉素6μl,余量为dmem/f-121:1培养基。
[0088]
③
组织培养基制备:每100ml组织培养基中,青霉素-链霉素-两性霉素b溶液(100x)0.9ml、l-谷氨酰胺溶液1.1ml、6μg/ml硫酸庆大霉素10μl,胎牛血清11ml,dmem高糖培养基66ml,余量为dmem/f-121:1培养基。
[0089]
2)样本采集、模型组装:将采集的奶牛蹄部用清水冲洗干净至表面无污物,再使用质量分数3%葡萄糖酸氯己定皮肤清洁剂对皮肤表面进行消杀,将无菌条件下切除的奶牛趾间皮肤立即浸入准备好的运输培养基中,冰上运输至实验室,使用8mm皮肤活检打孔器将奶牛趾间皮肤切割成直径为8mm的组织块并放于预热至37℃的洗涤培养基中室温下清洗2次,20min/次。随后将其培养于12孔细胞培养小室中,从外室中添加2ml培养液,内室中添加培养液至外植体表皮与真皮交界处,形成交替暴露于培养液与气相的培养条件,将12孔细胞培养皿置于37℃、5%co2湿化培养箱中培养,完成模型构建,每隔12h换液一次,于不同时间节点采集皮肤组织固定于4%多聚甲醛中。
[0090]
2、奶牛趾间皮肤外植体模型评价:
[0091]
1)根据皮肤外植体病理组织变化进行评分:表皮细胞变性(坏死),并出现以下描述的表皮和真皮所有变化现象,记4分(组织不可行);多灶性表皮下裂,基底层细胞空泡化(表皮变性),外分泌腺、白细胞和表皮细胞出现核固缩和脱离,显示自溶迹象并伴有中性粒
细胞变性的基底层细胞多灶性固缩,记3分(组织不可行);角质形成细胞凋亡,基底层细胞空泡化,上皮裂开,小汗腺和周围神经有自溶的迹象,部分滤泡上皮细胞脱落伴随自溶的迹象,记2分(组织可行);散在凋亡的角质形成细胞,记1分(组织可行);可观察到正常的组织结构和活力,偶尔在分泌腺内有少量脱落的上皮细胞,记0分(组织可行)。
[0092]
2)根据凋亡相关蛋白caspase-3表达进行阳性评分:
①
阳性率:阳性细胞数/细胞总数
×
100%,反映阳性细胞所占百分比。对细胞阳性比率进行评分:0~5%为0分,6%~15%为1分,16%~50%为2分,51%~75%为3分,》75%为4分;
②
阳性细胞着色强度:测量区域平均阳性强度为0,1,2,3分,阴性无着色,计0分;弱阳性淡黄色,计1分;中阳性棕黄色,计2分;强阳性棕褐色计3分;
③
阳性评分:阳性综合评分为阳性细胞着色强度分值
×
阳性细胞比率分值,数据越大说明综合阳性强度越强。
[0093]
3)根据tunel细胞凋亡检查凋亡率进行评分:计算视野内1000个细胞中阳性细胞所占观察同类细胞的百分比,细胞凋亡率=凋亡细胞数量/1000
×
100%。对细胞凋亡率进行评分:细胞凋亡率在0~5%为0分,6%~15%为1分,16%~50%为2分,认为模型可行;细胞凋亡率在51%~75%为3分,》75%为4分,认为模型不可行。
[0094]
4)模型可行性评分标准:模型可行性根据病理组织学检查评分、阳性综合评分和细胞凋亡率评分综合评定。皮肤外植体病理组织检查评分<3分、凋亡相关蛋白caspase-3表达阳性综合评分<6分、细胞凋亡率评分<3分时的外植体模型认为是可行的。
[0095]
实施例3
[0096]
1、奶牛趾间皮肤外植体模型构建方法:
[0097]
1)培养基的制备方法:
[0098]
①
运输培养基制备:每100ml运输培养基中,青霉素-链霉素-两性霉素b溶液(100x)1.1ml、l-谷氨酰胺溶液0.9ml、4μg/ml硫酸庆大霉素8μl,余量为dmem/f121:1培养基。
[0099]
②
洗涤培养基制备:每100ml洗涤培养基中,青霉素-链霉素-两性霉素b溶液(100x)1.1ml、1μg/ml硫酸庆大霉素2μl,余量为dmem/f-121:1培养基。
[0100]
③
组织培养基制备:每100ml组织培养基中,青霉素-链霉素-两性霉素b溶液(100x)1.1ml、l-谷氨酰胺溶液0.9ml、4μg/ml硫酸庆大霉素10μl,胎牛血清9ml,dmem高糖培养基63ml,余量为dmem/f-121:1培养基。
[0101]
2)样本采集、模型组装:将采集的奶牛蹄部用清水冲洗干净至表面无肉眼可见污物,然后用1%葡萄糖酸氯己定皮肤清洁剂对皮肤表面进行消毒,将无菌条件下切除的奶牛趾间皮肤浸入到准备好的运输培养基中,冰上运输至实验室,使用8mm皮肤活检打孔器将奶牛趾间皮肤切割成直径为8mm的组织块并放于预热至37℃的洗涤培养基中室温下清洗4次,10min/次。随后将其培养于12孔细胞培养小室中,完成模型构建,从外室中添加2ml培养液,内室中添加培养液至外植体表皮与真皮交界处,形成交替暴露于培养液与气相的培养条件,将12孔细胞培养皿置于37℃、5%co2湿化培养箱中培养,每隔12h换液一次,于不同时间节点采集皮肤组织固定于4%多聚甲醛中。
[0102]
2、奶牛趾间皮肤外植体模型评价:
[0103]
1)根据皮肤外植体病理组织变化进行评分:表皮细胞变性(坏死),并出现以下描述的表皮和真皮所有变化现象,记4分(组织不可行);多灶性表皮下裂,基底层细胞空泡化
(表皮变性),外分泌腺、白细胞和表皮细胞出现核固缩和脱离,显示自溶迹象并伴有中性粒细胞变性的基底层细胞多灶性固缩,记3分(组织不可行);角质形成细胞凋亡,基底层细胞空泡化,上皮裂开,小汗腺和周围神经有自溶的迹象,部分滤泡上皮细胞脱落伴随自溶的迹象,记2分(组织可行);散在凋亡的角质形成细胞,记1分(组织可行);可观察到正常的组织结构和活力,偶尔在分泌腺内有少量脱落的上皮细胞,记0分(组织可行)。
[0104]
2)根据凋亡相关蛋白caspase-3表达进行阳性评分:
①
阳性率:阳性细胞数/细胞总数
×
100%,反映阳性细胞所占百分比。对细胞阳性比率进行评分:0~5%为0分,6%~15%为1分,16%~50%为2分,51%~75%为3分,》75%为4分;
②
阳性细胞着色强度:测量区域平均阳性强度为0,1,2,3分,阴性无着色,计0分;弱阳性淡黄色,计1分;中阳性棕黄色,计2分;强阳性棕褐色计3分;
③
阳性评分:阳性综合评分为阳性细胞着色强度分值
×
阳性细胞比率分值,数据越大说明综合阳性强度越强。
[0105]
3)根据tunel细胞凋亡检查凋亡率进行评分:计算视野内1000个细胞中阳性细胞所占观察同类细胞的百分比,细胞凋亡率=凋亡细胞数量/1000
×
100%。对细胞凋亡率进行评分:细胞凋亡率在0~5%为0分,6%~15%为1分,16%~50%为2分,认为模型可行;细胞凋亡率在51%~75%为3分,》75%为4分,认为模型不可行。
[0106]
4)模型可行性评分标准:模型可行性根据病理组织学检查评分、阳性综合评分和细胞凋亡率评分综合评定。皮肤外植体病理组织检查评分<3分、凋亡相关蛋白caspase-3表达阳性综合评分<6分、细胞凋亡率评分<3分时的外植体模型认为是可行的。
[0107]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
