vwb-attp和
φ
c31-attp整合酶介导的基因重组方法及在链霉菌中应用
技术领域
1.本发明属于生物技术领域,更具体的,涉及利用vwb-attp整合酶和φc31-attp整合酶系统介导的位点特异性整合重组机制,获得在链霉菌染色特上导入多拷贝数量的目的基因
背景技术:
2.链霉菌是自然界存在的一类可代谢产生天然产物的菌种,在医药工业应用领域,大部分抗生素原料药都是通过链霉菌发酵生产。如红霉素是通过红色糖多孢菌(saccharopolysporaerythraea)发酵生产,阿维菌素是通过阿维链霉菌(streptomyces avermitilis)发酵生产,林可霉素是通过林可链霉素(streptomyces lincolnensis)发酵生产。随着生物技术的发展,通过对链霉菌进行基因改造,可解决工业菌种生产过程中的产量以及组分问题。对于外源基因的引入,可通过同源重组和位点特异性整合的技术来实现。由噬菌体整合酶介导的位点特异性整合方式,具有较高的稳定性,不易发生回复突变,已成为链霉菌中引入外源基因的主要方法。
3.根据不同的链霉菌基因组中是否存在相应种类整合酶识别的attb位点序列,可在体外通过质粒构建相对应的整合酶attp模块,最后将重组质粒导入至链霉菌宿主中,即可实现目的基因在染色体上的特异性整合。本发明人已授权专利(zl200910194419.4φc31介导的基因重组和应用于红霉素产生菌的遗传改造)采用φc31整合酶attp介导的位点特异性重组方法,成功将体外构建的目的基因序列重组至外源引入的红霉素产生菌attb位点上,实现了外源构建的目的基因一个拷贝数量的增加。
4.尽管现有技术中存在整合酶介导的基因重组方法,但是其应用范围还很有限,本领域仍然需要进一步地开发并优化链霉菌的基因重组方法,以期进一步地提高其生物合成的能力。
技术实现要素:
5.本发明的目的在于提供一种vwb-attp和φc31-attp整合酶介导的基因重组方法及在链霉菌中应用。
6.在本发明的第一方面,提供了一种利用vwb-attp和φc31-attp整合酶介导的基因重组方法,其特征在于,包括步骤:
7.(1)在链霉菌的基因组中引入至少1个外源的attb位点,获得携带有外源attb位点的链霉菌;
8.(2)将包含(i)φc31整合酶模块和/或vwb整合酶模块、和(ii)目的基因或目的基因簇的载体引入到步骤(1)的链霉菌中,选择目标基因或目标基因簇整合到链霉菌基因组内源attb位点以及外源attb位点的链霉菌,从而获得整合入多拷贝基因或基因簇的链霉菌。
9.在另一优选例中,所述的链霉菌包括阿维链霉菌、红色糖多孢菌、林可链霉菌,较佳地为林可链霉菌。
10.在另一优选例中,所述外源的attb位点包括φc31整合酶所识别的attb位点和vwb整合酶所识别的attb位点
11.在另一个优选例中,所述的至少1个外源的attb位点为1-2个外源的attb位点;较佳地为1个外源的attb位点。
12.在另一优选例中,所述的链霉菌为林可链霉菌,并且(i)所述外源的attb位点引入到林可链霉菌基因组的cysteate nrps基因簇中,较佳地,取代该基因簇的原slinc0744基因;和/或
13.(ii)所述外源的attb位点引入到林可链霉菌基因组的moenomycin基因簇中,较佳地,取代该基因簇的原slinc6338基因、slinc6339基因和slinc63340基因。
14.在另一优选例中,引入到cysteate nrps基因簇的所述外源的attb位点为外源的vwb整合酶所识别的attb位点。
15.在另一优选例中,引入到moenomycin基因簇的所述外源的attb位点为外源的φc31整合酶所识别的attb位点。
16.在另一优选例中,所述的外源的vwb整合酶所识别的attb位点的序列如seq id no:5所示。
17.在另一优选例中,所述的外源的φc31整合酶所识别的attb位点的序列如seq id no:1所示。
18.在另一优选例中,所述的链霉菌为林可链霉菌,并且林可链霉菌的基因组中包含选自下组的内源的attb位点:
19.(a)位于林可链霉菌slinc_t29的vwb整合酶所识别的attb位点1’,较佳地,序列如seq id no:5所示;
20.(b)位于林可链霉菌slinc_3666与slinc_3667间隔区的vwb整合酶所识别的attb位点2’,较佳地,序列如seq id no:6所示;和
21.(c)位于林可链霉菌slinc_3671与slinc_3672间隔区的vwb整合酶所识别的attb位点3’,较佳地,序列如seq id no:7所示。
22.在另一优选例中,所述的链霉菌为林可链霉菌,并且林可链霉菌的基因组中包含位于林可链霉菌slinc_t29的vwb整合酶所识别的内源的attb位点(attb位点1’)。
23.在另一优选例中,所述的链霉菌为阿维链霉菌,并且所述外源的attb位点引入到阿维链霉菌基因组的寡霉素生物合成基因簇pks中,较佳地,取代该基因簇的原olma1-a7基因。
24.在另一优选例中,引入到寡霉素生物合成基因簇pks的所述外源的attb位点为外源的φc31整合酶所识别的attb位点。
25.在另一优选例中,所述的φc31整合酶所识别的attb位点的核心序列如seq id no:3所示(ggtgccagggcgtgcccttgggctccccgggcgcg)。
26.在另一优选例中,所述的φc31整合酶所识别的attb位点包含一个或多个所述的核心序列,较佳地为8个拷贝的所述核心序列。
27.在另一优选例中,所述的链霉菌为阿维链霉菌,并且阿维链霉菌的基因组中包含
选自下组的内源的attb位点:
28.(a)位于阿维链霉菌基因组sav_t18的vwb整合酶所识别的内源attb位点1,较佳地,序列如seq id no:8所示;
29.(b)位于阿维链霉菌基因组sav_3727与sav_3728间隔区的vwb整合酶所识别的内源attb位点2,较佳地,序列如seq id no:9所示;
30.(c)位于阿维链霉菌基因组sav_3746与sav_3747间隔区的vwb整合酶所识别的内源attb位点3,较佳地,序列如seq id no:10所示;和
31.(d)位于阿维链霉菌基因组sav_4392的φc31整合酶所识别的内源attb位点1,较佳地,序列如seq id no:11所示。
32.在另一优选例中,所述的链霉菌为红色糖多孢菌,并且所述外源的attb位点引入到红色糖多孢菌基因组的nrps基因簇中,较佳地,取代该基因簇中sace_1305基因中的序列。
33.在另一优选例中,引入到nrps基因簇的所述外源的attb位点为外源的φc31整合酶所识别的attb位点。
34.在另一优选例中,所述的链霉菌为红色糖多孢菌,并且红色糖多孢菌的基因组中包含位于红色糖多孢菌基因组sace_8013的vwb整合酶所识别的内源的attb位点,较佳地,序列如seq id no:12所示。
35.在另一优选例中,所述的链霉菌为红色糖多孢菌,并且所述外源的attb位点引入到红色糖多孢菌基因组的geosmin合成基因簇中,较佳地,取代该基因簇的原sace_4907基因。
36.在另一优选例中,取代sace_4907基因的所述外源的attb位点为外源的φc31整合酶所识别的attb位点。
37.在另一优选例中,所述的φc31整合酶所识别的attb位点的核心序列如seq idno:3所示(ggtgccagggcgtgcccttgggctccccgggcgcg)。
38.在另一优选例中,所述的φc31整合酶所识别的attb位点包含一个或多个所述的核心序列,较佳地为8个拷贝的所述核心序列。
39.在另一优选例中,所述方法包括步骤:
40.(1)在红色糖多孢菌的基因组geosmin合成基因簇中引入外源的φc31整合酶所识别的attb位点,取代该基因簇的原sace_4907基因;
41.(2)将包含(i)φc31整合酶模块和vwb整合酶模块、和(ii)目的基因或目的基因簇的载体引入到步骤(1)的红色糖多孢菌中,选择目标基因或目标基因簇整合到链霉菌基因组内源attb位点以及外源attb位点的链霉菌,从而获得整合入多拷贝基因或基因簇的链霉菌。
42.在另一优选例中,所述方法包括步骤:
43.(1)在林可链霉菌的基因组cysteate nrps基因簇中引入外源的vwb整合酶所识别的attb位点,取代该基因簇的原slinc0744基因;和/或在林可链霉菌基因组的moenomycin基因簇中引入外源的φc31整合酶所识别的attb位点,取代该基因簇的原slinc6338基因、slinc6339基因和slinc63340基因。
44.(2)将包含(i)vwb整合酶模块、和(ii)目的基因或目的基因簇的载体引入到步骤
(1)的林可链霉菌中,选择目标基因或目标基因簇整合到链霉菌基因组内源attb位点以及外源attb位点的链霉菌,从而获得整合入多拷贝基因或基因簇的链霉菌,
45.其中,所述的内源attb位点为位于林可链霉菌的vwb整合酶所识别的内源的attb位点(attb位点1’)。
46.在另一优选例中,所述的φc31整合酶模块包括φc31整合酶基因序列、φc31整合酶所识别的噬菌体附着位点靶序列φc31-attp。
47.在另一优选例中,所述的vwb整合酶模块包括vwb整合酶基因序列、vwb整合酶所识别的噬菌体附着位点靶序列vwb-attp。
48.在另一优选例中,所述的靶序列φc31-attp如seq id no:4所示。(ccccaactggggtaacctttgagttctctcagttggggg)
49.在另一优选例中,所述的靶序列vwb-attp如seq id no:2所示(gactcactcagactcactgaggctcatgatcgctttacgttctctcctaaagcgggtgtcgcaggttcgaatcctgccgggggcacaacctgca)。
50.在另一优选例中,所述链霉菌基因组的attb位点与噬菌体附着位点靶序列attp,两者在φc31整合酶和/或vwb整合酶的介导下发生重组,形成杂合位点attl和attr。
51.在另一优选例中,通过接合转移的方法,将所述的载体引入到步骤(1)的链霉菌中。
52.在另一优选例中,所述的接合转移为属间接合转移。
53.在另一优选例中,所述的载体包括质粒和黏粒。
54.在另一优选例中,所述的载体中包含抗性选择标记以及进行属间接合转移所必需的元件orit。
55.在另一优选例中,所述的链霉菌为阿维链霉菌,并且所述的目的基因簇为阿维菌素合成基因簇avea1-avea2-avec。
56.另一优选例中,所述的链霉菌为红色糖多孢菌,并且所述的目的基因簇为红霉素生物合成基因簇。
57.在另一优选例中,所述的链霉菌为林可链霉菌,并且所述的目的基因簇为林可霉素生物合成基因簇。
58.在本发明的第二方面,提供了一种林可链霉菌基因工程菌,该基因工程菌的基因组中包括至少1个外源的attb位点,并且,(i)所述外源的attb位点引入到林可链霉菌基因组的cysteate nrps基因簇中,较佳地,取代该基因簇的原slinc0744基因;和/或
59.(ii)所述外源的attb位点引入到林可链霉菌基因组的moenomycin基因簇中,较佳地,取代该基因簇的原slinc6338基因、slinc6339基因和slinc63340基因。
60.在另一优选例中,所述的林可链霉菌基因工程菌包含至少一个内源的attb位点(内源位点的具体位置和序列与本发明的第一方面的优选例相同)。
61.在本发明的第三方面,提供了一种阿维链霉菌基因工程菌,该基因工程菌的基因组中包括至少1个外源的attb位点,并且,所述外源的attb位点引入到阿维链霉菌基因组的寡霉素生物合成基因簇pks中,较佳地,取代该基因簇的原olma1-a7基因。
62.在另一优选例中,引入到寡霉素生物合成基因簇pks的所述外源的attb位点为外源的φc31整合酶所识别的attb位点。
63.在另一优选例中,所述的阿维链霉菌基因工程菌包含至少一个内源的attb位点(内源位点的具体位置和序列与本发明的第一方面的优选例相同)。
64.在本发明的第四方面,提供了一种红色糖多孢菌基因工程菌,该基因工程菌的基因组中包括至少1个外源的attb位点,并且,所述外源的attb位点引入到红色糖多孢菌基因组的nrps基因簇中。
65.在另一优选例中,引入到nrps基因簇的所述外源的attb位点为外源的φc31整合酶所识别的attb位点。
66.在另一优选例中,所述的红色糖多孢菌基因工程菌包含至少一个内源的attb位点(内源位点的具体位置和序列与本发明的第一方面的优选例相同)。
67.在本发明的第五方面,提供了一种红色糖多孢菌基因工程菌,该基因工程菌的基因组中包括至少1个外源的attb位点,并且,所述外源的attb位点引入到红色糖多孢菌基因组的geosmin合成基因簇中,较佳地,取代该基因簇的原sace_4907基因。
68.在另一优选例中,取代sace_4907基因的所述外源的attb位点为外源的φc31整合酶所识别的attb位点。
69.在本发明的第六方面,提供了一种本发明第二、三、四、五方面所述的基因工程菌的用途,用于制备携带多拷贝目的基因或目的基因簇的链霉菌工程菌。
70.在本发明的第七方面,提供了一种基因组中整合有多拷贝目的基因或目的基因簇的链霉菌工程菌,所述链霉菌工程菌的基因组中至少包括2个拷贝的位于以下位置的目的基因簇:
71.(a)链霉菌工程菌基因组中内源attb位点所在位置,并取代该位置原有的attb位点;
72.(b)本发明第一方面所述方法中的至少1个外源的attb位点所在位置。
73.在本发明的第八方面,提供了一种利用链霉菌高效表达目标基因或目标基因簇的方法,所述的方法包括:
74.(a)以权利要求1所述的方法制备链霉菌工程菌,使链霉菌基因组中整合入多拷贝目标基因或目标基因簇;
75.(b)培养步骤(a)获得的链霉菌工程菌,从而高效表达目标基因或目标基因簇。
76.在另一优选例中,所述的方法还包括对链霉菌工程菌表达目标基因的情况进行检测的步骤。
77.应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
具体实施方式
78.本发明人经过广泛而深入地研究,发现一种可利用vwb-attp和φc31-attp整合酶介导的基因重组方法。具体地,本发明利用vwb-attp整合酶和φc31-attp整合酶系统介导的位点特异性整合机制将这两种整合酶模块构建在同一个含有目的基因的质粒中,通过属间接合转移可快速将需要表达的目的基因以多拷贝的数量重组至链霉菌染色体的相应attb位点上。本发明的方法在阿维菌素和红霉素产生菌中进行了应用。
79.如本文所用,术语“位点特异性重组”是一类依赖于小范围同源序列联会的同源重组方式,需要借助整合酶(如vwb、φc31)与特异性重组位点(如attb/attp)的参与,最终将外源质粒整合至基因组中。
80.如本文所用,术语“引入”或“转化”是指将外源多核苷酸转移进宿主细胞(本发明中为链霉菌)。可选地,外源多核苷酸可以整合进入宿主基因组。
81.如本文所用,术语“外源的”或“异源的”基因或蛋白是指并非天然包含在原生物体(本发明中为链霉菌)基因组中的基因或蛋白。
82.如本文所用,术语“目的基因或目的基因簇”是指引入原生物体(本发明中为链霉菌)基因组中的外源基因。
83.vwb-attp整合酶模块
84.vwb-attp整合酶为vwb温和噬菌体利用其整合酶介导attp与attb位点进行特异性重组整合。vwb-attp整合酶模块包含可表达vwb整合酶的基因及attp位点序列,具体序列如下:
85.gtcgacctgcagcccaagcttcgcgccctccatgaggcgtacccgaagttcaccgaagagcgcattttcgccgcggcccgccgggccgcgccgggcccgctcgacgaggacgccgaggaacgcctgctcaccctgttccgtggtctcaccgaggagcagcagcgttccaagctgatcgagatgagcgcgctgaacgagtccaacaagcagtagccgacgcccgtacaaccgtcggcctgcctcgcgggtctaacgaaaatggactccaccactccccgtgattcctcgggcacttggtgcacgcagagtggtcgcatattcacctacaagggggtacggtcggtcgagcggcctgccctcccccatggccgacggtcaaacgtcgcctgcctgcccgggggatacccatgtgcattcgtgtccgcttcgcgcctctcgacccgctcaacttccggccgtacgacgccgctggaaacacggtcaccctgcctgccaccctcccccgggatgcttccctcgtagcccttcgagccgtccttgaagaactggctgtagagcagcccccggacggtgcagtctgctggtgtggggcagccgtacacatcctgccccgcgttcccgaacagcggaggagcggacaggtgacccatggcgcctagagcgacgaacaacccacggcagttgagggcgaagagctgcggctgccagctgtgcatggagaagtacccgcccgagaagtacggagagcggaaccgccgacgcgactgcaccggctcgtggcaggcgcgttaccgcgacccggccggcaaccagaagcagaaatgctttgcgatcaaggacggcggtaagaaggcagccgaggcgcacctcgacaagatccgcacgcaggtccgcgaacggacgtacgccgacccgaagcgtggcgagatcaccctgtcccagtggtggaaactgtggtgggaggcgcagccggaccgagcagtcacgaccgccaaccggaagcggtcgaactgggccgcgcacatcgagccgaagtgggggcagtggcgtctctgcgacttggagtacatcgagctgcaggcgtggatcacgaaggaggtgaagggctaccacacccggaagaaggttcatgaggtgctgaactcgatgctccgggccgccgtcaaggacggccggcgtatcccgttcaacccggcggccgacctggacattggcgaggcgccggcgaagcatccggacgaactgatgccgcccgaccgcgcgcagtgcgcgctgatcgtcagtcacctgccgatgtactaccggccgctcgtcgtcttccttgaacacaccggtctccggtggggcgaggcgacggcgctgcgctgggagaacgtcgacctggacgcccactacctcaaggtgaaggaagtgctcagtgacgacgaaggcaagctgttccggaagcctgcgccgaagagcaacgccgggttccgcacggtcccgctcacgccgcaggccgaggacgcgatccgcaccatggtcacccggtggcggccgactcccacgatcaccccgattggcgaggacccgtacgacctcgcgccggatgagctcgtgttccgcggcccacagggcggcgtcctgacccggcacaacttccggcgcacatggatccctgcaatcaaggctgcaggcctcgcccgcgaggtgaagaaccgggacaccggccgcatggagtggtggccgcgggtgcacgaccttcgccacgtgttcgccacgtggctcaaggatgtgggcattgacgagaaggacacgcagaccgtgatgggtcacgagcgagggtcgaaggtgacgtggttgtaccagcattcgccggccgacgtggcggcgaaggtgcgggcggcgatggctcccgagaccgagggtgttcgaacgctgcgggcggtgtgacgccggatgccacgcagatgccacagggatgccaca
acaccccctcactgagactcaccgagactcactgaaactcatttatgcaggtgaagcccctatggcgacaggctcactgagactcactcagactcactgaggctcatgatcgctttacgttctctcctaaagcgggtgtcgcaggttcgaatcctgccgggggcacaacctgcatcgcaggtcagggagtcaacggccccccgttccattcgaacggggggccgttgtcgtacccggatgccacatagatgccacatccccacggaatcctgcggatcacgtcgctcgaaagagtgatgtgcacagcagccacaatgcgtagagtgctgtctaccgagcgggccggcgtgctccccacacgcgtcagacggac(seq id no:27)vwb整合酶模块可通过酶切质粒psok804,dna合成,或者pcr的方式获得。
86.φc31-attp整合酶模块
87.φc31-attp整合酶为链霉菌噬菌体利用其φc31整合酶介导attp与attb位点进行特异性重组整合。φc31-attp整合酶模块包含可表达φc31整合酶的基因及attp位点序列,具体序列如下:
88.aagctctagcgattccagacgtcccgaaggcgtggcgcggcttccccgtgccggagcaatcgccctgggtgggttacacgacgcccctctatggcccgtactgacggacacaccgaagccccggcggcaaccctcagcggatgccccggggcttcacgttttcccaggtcagaagcggttttcgggagtagtgccccaactggggtaacctttgagttctctcagttgggggcgtagggtcgccgacatgacacaaggggttgtgaccggggtggacacgtacgcgggtgcttacgaccgtcagtcgcgcgagcgcgagaattcgagcgcagcaagcccagcgacacagcgtagcgccaacgaagacaaggcggccgaccttcagcgcgaagtcgagcgcgacgggggccggttcaggttcgtcgggcatttcagcgaagcgccgggcacgtcggcgttcgggacggcggagcgcccggagttcgaacgcatcctgaacgaatgccgcgccgggcggctcaacatgatcattgtctatgacgtgtcgcgcttctcgcgcctgaaggtcatggacgcgattccgattgtctcggaattgctcgccctgggcgtgacgattgtttccactcaggaaggcgtcttccggcagggaaacgtcatggacctgattcacctgattatgcggctcgacgcgtcgcacaaagaatcttcgctgaagtcggcgaagattctcgacacgaagaaccttcagcgcgaattgggcgggtacgtcggcgggaaggcgccttacggcttcgagcttgtttcggagacgaaggagatcacgcgcaacggccgaatggtcaatgtcgtcatcaacaagcttgcgcactcgaccactccccttaccggacccttcgagttcgagcccgacgtaatccggtggtggtggcgtgagatcaagacgcacaaacaccttcccttcaagccgggcagtcaagccgccattcacccgggcagcatcacggggctttgtaagcgcatggacgctgacgccgtgccgacccggggcgagacgattgggaagaagaccgcttcaagcgcctgggacccggcaaccgttatgcgaatccttcgggacccgcgtattgcgggcttcgccgctgaggtgatctacaagaagaagccggacggcacgccgaccacgaagattgagggttaccgcattcagcgcgacccgatcacgctccggccggtcgagcttgattgcggaccgatcatcgagcccgctgagtggtatgagcttcaggcgtggttggacggcagggggcgcggcaaggggctttcccgggggcaagccattctgtccgccatggacaagctgtactgcgagtgtggcgccgtcatgacttcgaagcgcggggaagaatcgatcaaggactcttaccgctgccgtcgccggaaggtggtcgacccgtccgcacctgggcagcacgaaggcacgtgcaacgtcagcatggcggcactcgacaagttcgttgcggaacgcatcttcaacaagatcaggcacgccgaaggcgacgaagagacgttggcgcttctgtgggaagccgcccgacgcttcggcaagctcactgaggcgcctgagaagagcggcgaacgggcgaaccttgttgcggagcgcgccgacgccctgaacgcccttgaagagctgtacgaagaccgcgcggcaggcgcgtacgacggacccgttggcaggaagcacttccggaagcaacaggcagcgctgacgctccggcagcaaggggcggaagagcggcttgccgaacttgaagccgccgaagccccgaagcttccccttgaccaatggttccccgaagacgccgacgctgacccgaccggccctaagtcgtggtgggggcgcgcgtcagtagacgacaagcgcgtgttcgtcgggctcttcgtagacaagatcgttgtcacgaagtcgactacgggcagggggcagggaacgcccatcgagaagcgcgcttcgatcacgtgggcgaagccgccgaccgacgacgacgaagacgacgcccaggacggcacggaagacgtagcggcgtagcgagacacccgggaagcctg(seq id no:28)
89.φc31整合酶模块可通过酶切质粒pset152,dna合成,或者pcr的方式获得。
90.本发明提供一种简单快速实现目的基因导入至链霉菌染色体的方法,将vwb-attp整合酶模块与φc31-attp整合酶模块构建至同一个含有目的基因的质粒载体上,通过链霉菌属间接合转移导入至含有vwb-attb位点和φc31-attb位点序列的链霉菌染色体中,实现目的基因多拷贝数量的导入。
91.vwb-attp整合酶模块和φc31-attp整合酶模块,可通过酶切、pcr或者dna合成的方式获得,采用酶切连接、重组克隆等技术将两种整合酶克隆至同一个质粒中,即构建好含有两种整合酶模块的基础质粒载体,再克隆连接上需要多拷贝表达的目的基因,即完成质粒构建。将此质粒接合转移至拥有相应attb位点的链霉菌宿主中,通过pcr验证整合后的attl或者attr的方式筛选,即可完成在链霉菌中对目的基因的多拷贝导入。
92.对于已经克隆了目的基因的质粒或者黏粒,可通过gibson克隆,或redet重组的方式,将vwb-attp整合酶模块、或者φc31-attp整合酶模块、或者上述两个模块同时克隆至相应的质粒或者黏粒上,即完成对含有目的基因的质粒改造,最后接合转移至链霉菌宿主中,通过对整合后位点的pcr验证及测序进行筛选即可。
93.本发明的基因改造的链霉菌可以是林可链霉菌,在林可链霉菌的基因组中引入至少1个外源的attb位点,获得携带有外源attb位点的林可链霉菌;
94.其中,(i)所述外源的attb位点引入到林可链霉菌基因组的cysteate nrps基因簇中,较佳地,取代该基因簇的原slinc0744基因;和/或
95.(ii)所述外源的attb位点引入到林可链霉菌基因组的moenomycin基因簇中,较佳地,取代该基因簇的原slinc6338基因、slinc6339基因和slinc63340基因。
96.在林可链霉菌的基因组中还包含选自下组的内源的attb位点,
97.(a)位于林可链霉菌slinc_t29的vwb整合酶所识别的attb位点1’,较佳地,序列如seq id no:5所示;
98.(b)位于林可链霉菌slinc_3666与slinc_3667间隔区的vwb整合酶所识别的attb位点2’,较佳地,序列如seq id no:6所示;和
99.(c)位于林可链霉菌slinc_3671与slinc_3672间隔区的vwb整合酶所识别的attb位点3’,较佳地,序列如seq id no:7所示。
100.本发明的基因改造的链霉菌可以是阿维链霉菌,在阿维链霉菌的基因组中引入至少1个外源的attb位点,获得携带有外源attb位点的阿维链霉菌;
101.其中,所述外源的attb位点引入到阿维链霉菌基因组的寡霉素生物合成基因簇pks中,较佳地,取代该基因簇的原olma1-a7基因。
102.在阿维链霉菌的基因组中还包含选自下组的内源的attb位点:
103.(a)位于阿维链霉菌基因组sav_t18的vwb整合酶所识别的内源attb位点1,较佳地,序列如seq id no:8所示;
104.(b)位于阿维链霉菌基因组sav_3727与sav_3728间隔区的vwb整合酶所识别的内源attb位点2,较佳地,序列如seq id no:9所示;
105.(c)位于阿维链霉菌基因组sav_3746与sav_3747间隔区的vwb整合酶所识别的内源attb位点3,较佳地,序列如seq id no:10所示;和
106.(d)位于阿维链霉菌基因组sav_4392的φc31整合酶所识别的内源attb位点1,较
佳地,序列如seq id no:11所示。
107.本发明的基因改造的链霉菌可以是红色糖多孢菌,在红色糖多孢菌的基因组中引入至少1个外源的attb位点,获得携带有外源attb位点的红色糖多孢菌;
108.其中,(i)所述外源的attb位点引入到红色糖多孢菌基因组的nrps基因簇中,较佳地,取代该基因簇中sace_1305基因中的序列;和/或
109.(ii)所述外源的attb位点引入到红色糖多孢菌基因组的geosmin合成基因簇中,较佳地,取代该基因簇的原sace_4907基因。
110.在红色糖多孢菌的基因组中还包含位于红色糖多孢菌基因组sace_8013的vwb整合酶所识别的内源的attb位点,较佳地,序列如seq id no:12所示。
111.本发明的主要优点包括:
112.(a)通过构建同时含有vwb-attp整合酶模块和φc31-attp整合酶模块的基础质粒,作为通用的质粒载体,后续只需要再克隆目的基因或基因簇至基础质粒上,即可进行在链霉菌中对目的基因的多拷贝导入。
113.(b)通过对红色糖多孢菌,阿维链霉菌,林可链霉菌中的内源attb位点序列定位分析,及引入外源attb位点,实现了相应目的基因簇的多拷贝导入,使得红霉素、阿维菌素、林可霉素发酵效价得到提高。
114.(c)通过在林可链霉菌基因组的cysteate nrps基因簇的slinc0744基因处引入外源attb位点,实现目的基因簇的多拷贝导入,可广泛用于各类链霉菌的遗传改造。
115.(d)由于目标基因簇引入后成离散分布,不易发生同源重组,本发明的方法获得的链霉菌工程菌的遗传稳定性很好,可获得遗传稳定的高产菌株。
116.下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,例如sambrook等人,分子克隆:实验室手册(new york:cold spring harbor laboratory press,1989);链霉菌遗传实验操作手册(genetic manipulation of streptomyces:a laboratory manual.1985.da hopwood the john innes foundation)中所述的条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数是重量百分比和重量份数。
117.通用材料和方法
118.除非特别说明,实施例中的所有质粒和菌株均为常规的或可市售获得。
119.具体地,实施例中涉及的菌株包括:
120.阿维链霉菌s.avermitilis atcc31267,获自美国菌种保藏中心;
121.阿维链霉菌s.avermitilis
△
olm:attb,为本实验构建的菌株,是以s.avermitilis atcc31267为出发菌株,通过同源重组双交换的方式敲除寡霉素生物合成基因簇pks的olma1-a7基因,同时在敲除位置引入人工合成的φc31-8
×
attb重组序列获得的菌株,φc31-8
×
attb重组序列的序列信息参见中国发明专利zl200910194419.4中的seq id no:9。
122.红霉素产生菌株s.erythraea e3-attb,为本实验构建的菌株,是以s.erythraea hl3168 e3为出发菌株,在染色体上将其中一个nrps基因簇敲除的同时外源引入φc31-8
×
attb序列获得的菌株,构建过程及序列信息参见中国发明专利zl200910194419.4中的实施
例1。
123.红霉素产生菌株s.erythraeanrrl2338,获自菌种保藏中心。
124.红霉素产生菌株s.erythraeanrrl2338
-△
4907-8attb,为本发明构建的菌株,将红霉素sace_4907基因敲除,同时在敲除位置引入φc31-8
×
attb序列获得的菌株。
125.林可链霉菌streptomyces lincolnensis nrrl2936,获自菌种保藏中心。
126.林可链霉菌nrrl2936
-△
0744vattb,为本发明构建的菌株,是以streptomyces lincolnensis nrrl2936为出发菌株,将slinc0744基因敲除,同时在敲除位置引入vwb-attb位点序列后获得的菌株。
127.林可链霉菌nrrl2936
-△
0744vmoeφattb,为本发明构建的菌株,是以nrrl2936
-△
0744vattb为出发菌株,将moenomycin基因簇中的slinc6338基因,slinc6339基因,slinc63340基因进行敲除,同时在敲除位置引入一个人工合成的φc31-attb位点序列后获得的菌株。
128.实施例中涉及的质粒和黏粒包括:
129.链霉菌应用质粒psok804为链霉菌常规操作质粒,本实验室保存,序列信息参考genbank:lt545994.1。
130.链霉菌应用质粒pset152为链霉菌常规操作质粒,本实验室保存,序列信息参考genbank:aj414670.1。
131.pcap01质粒为酵母tar重组克隆技术常用操作质粒,本实验室保存,序列信息参考文献pnas 2014,111(5)1957-1962。
132.阿维菌素黏粒71320为本技术构建,利用链霉菌常规操作质粒poj436为载体,通过建立阿维菌素基因组文库克隆后筛选得到包含有34kb的阿维菌素生物合成基因簇aved-avea1-avea2-avec。
133.阿维菌素pba1-71320-804黏粒为本发明构建,在上述71320黏粒中引入vwb-attp整合酶模块。
134.红霉素c5黏粒为本实验室构建,构建过程参见中国发明专利cn201010154463.5实例1。
135.红霉素pba1-c6-804黏粒为本技术构建,在上述c5黏粒中引入vwb-attp整合酶模块。
136.林可霉素pcaplinbgc质粒为本技术构建,用cas9和sgrna完整切割37kb的林可霉素合成基因簇lmra到lmbrc片段,利用pcap01质粒作为载体,采用酵母tar同源重组技术克隆构建。
137.林可霉素pba1-caplinbgc-804质粒为本技术构建,在上述pcaplinbgc质粒中引入vwb-attp整合酶模块。
138.实施例中涉及的培养基包括:
139.红霉素斜面培养基:玉米浆1%、淀粉1%、nacl 0.3%、(nh4)2so
4 0.3%、caco
3 0.5%、琼脂2%、ph=7.0。
140.红霉素种子培养基:淀粉5%、黄豆饼粉1.8%、玉米浆1.3%、nacl 0.3%、(nh4)2so
4 0.1%、nh4no
3 0.1%、caco
3 0.6%、豆油0.5%、ph=6.8-7.0。
141.红霉素发酵培养基(100ml):淀粉3.0%、黄豆饼粉3%、糊精4%、(nh4)2so
4 0.2%、
caco
3 0.6%、豆油1%、ph7.0-7.2。
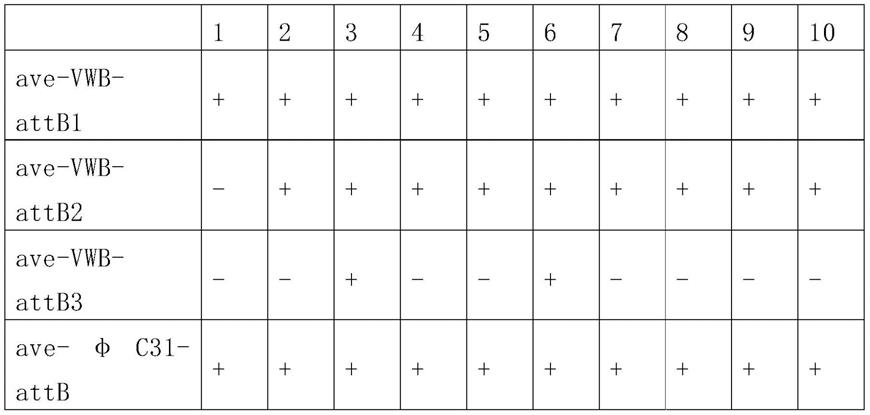
142.实施例中涉及的部分实验方法如下:
143.链霉菌染色体attb整合位点的验证:位点特异性重组整合酶能够准确地识别细菌附着位点attb和质粒中的attp位点,催化介导attb和attp之间的整合,形成attl和attr,并且attl和attr没有显著的重复,不能作为整合酶重组的底物,反应是单向不可逆的,能够稳定的随宿主传代。因此,通过在attb位点两侧设计引物,质粒attp位点两侧设计引物,根据重组后形成的attl和attr进行组合pcr验证,及进一步测序确证。
144.接合转移的方法:采用链霉菌遗传实验操作手册(genetic manipulation of streptomyces:a laboratory manual.1985.da hopwood the john innes foundation)
145.红霉素的发酵方法:将红霉素菌种涂在斜面培养基平板上,34℃培养6~8天待孢子长浓,竹签挖块接种1cm2孢子琼脂块到50ml种子培养基(500ml摇瓶)中,34℃,220rpm培养2天,按10%接种量转接于50ml发酵培养基(500ml摇瓶)中,接种24小时后补加1%正丙醇,34℃,220rpm培养5-6天放瓶取样检测红霉素化学效价。
146.红霉素化学效价检测方法:发酵液500ul离心后,取8ul上清,加入492ul的10m磷酸溶液,沸水浴3分钟,在加入500ul的10m磷酸溶液混匀,最后用紫外分光光度计在485nm波长检测。
147.实施例1构建含有vwb-attp整合酶和φc31-attp整合酶模块的质粒及导入至阿维链霉菌中
148.链霉菌常规应用质粒psok804(genbank:lt545994.1)包含有完整的vwb-attp整合酶模块,链霉菌常规应用质粒pset152(genbank:aj414670.1)中包含有完整的φc31-attp整合酶模块。用xbai酶切psok804质粒,即可获得完整的vwb-attp整合酶模块,然后将其连接至pset152的xbai酶切位点,即得到同时包含vwb-attp整合酶和φc31-attp整合酶模块的质粒,约7.8kb大小,质粒编号命名为pba1。为检验此构建的质粒是否能够在链霉菌中得到完整的应用,通过接合转移的方法将其导入至阿维链霉菌streptomyces avermitilis atcc31267中。根据对阿维链霉菌基因组序列的分析,发现存在3个天然的内源ave-vwb-attb位点序列,三者相隔23kb左右:
149.三个位点序列分别为:
150.ave-vwb-attb1,具有73bp的完整序列,
151.gccttcgtagctcaggggatagagcaccgctctcctaaagcgggtgtcgcaggttcgaatcctgccgggggca(seq id no:8)
152.ave-vwb-attb2,具有42bp的核心序列,
153.ctcctaaagcgggtgtcgcaggttcgaatcctgccgggggca(seq id no:9)
154.ave-vwb-attb3,具有47bp的核心序列,
155.cctctctcctaaagcgggtgtcgcaggttcgaatcctgccgggggca(seq id no:10)
156.和1个天然内源的ave-φc31-attb位点,具有51bp的完整序列,
157.序列为seq4:cggtgcgggtgccagggggtgcccttgggctcgcccggcgcgtactccacc(seq id no:11)
158.分别设计如下attl序列验证引物。
159.质粒pba1的vwb-attp位点一侧引物,
160.vwb-s:gtccgtctgacgcgtgtggg(seq id no:13)
161.质粒pba1的φc31-attp位点一侧引物:
162.φc31-s:cagagcaggattcccgttgag(seq id no:14)
163.阿维链霉菌ave-vwb-attb1位点一侧引物:
164.1s:cgcgaggcactcaaggtactca(seq id no:15)
165.阿维链霉菌ave-vwb-attb2位点一侧引物:
166.2s:ttgcggtctcaatcgccactt(seq id no:16)
167.阿维链霉菌ave-vwb-attb3位点一侧引物:
168.3s:gattcctcacggacgaactgc(seq id no:17)
169.阿维链霉菌ave-φc31-attb位点一侧引物:
170.4s:gcagcccgtgatcccgatgt(seq id no:18)
171.随机挑取10个接合子,进行整合位点的pcr验证。采用整合后attl一侧的预期整合序列进行pcr验证是否发生位点特异性整合,即质粒pba1的引物vwb-s分别与引物1s,引物2s,引物3s进行pcr;质粒pba1的引物φc31-s与引物4s进行pcr,对电泳的条带进行回收测序进一步确证。
172.其中ave-vwb-attb1,ave-vwb-attb2,ave-vwb-attb3的验证pcr产物测序,都存在预期完整的attl序列,ave-vwb-attb1的attl序列如下:gccttcgtagctcaggggatagagcaccgctctcctaaagcgggtgtcgcaggttcgaatcctgccgggggcacaacctgcatcgcag(seq id no:19)
173.ave-vwb-attb2的attl序列如下:
174.tggtcctagcccagggagtcggcggccggaactcctaaagcgggtgtcgcaggttcgaatcctgccgggggcacaacctgcatcgcag(seq id no.:29)
175.ave-vwb-attb3的attl序列如下:
176.gcaggtcagtagccggacaccccaccctctctcctaaagcgggtgtcgcaggttcgaatcctgccgggggcacaacctgcatcgcag(seq id no:20)
177.ave-φc31-attb的attl序列如下:
178.cggtgcgggtgccagggggtgcccttgagttctctcagttgggggcgtagggtcgccgacatgacacaaggggttgtgac(seq id no:21)
179.10个接合子位点整合的统计结果如下:
180.181. 表示pcr验证发生位点整合-表示pcr验证未发生位点整合
182.上述结果可以看出,3个内源的vwb-attb位点和1个内源的φc31-attb位点都有筛选到发生位点整合的接合子。其中,筛选到2个接合子在四个位点同时发生了整合,即增加了四个拷贝的外源质粒整合。因此,只需通过大量的接合子挑选,然后进行pcr验证,可以筛选到至少在4个位点同时整合的外源基因序列,即4个拷贝数量的质粒导入。
183.实施例2在含有阿维菌素合成基因簇avea1-avea2-avec的黏粒71320中增加vwb-整合酶attp模块同时将其导入至s.avermitilis
△
olm:attb菌株中
184.黏粒71320为包含有34kb的阿维菌素生物合成基因簇aved-avea1-avea2-avec,是以poj436质粒作为载体,通过建立阿维菌素基因组文库克隆后筛选得到,71320黏粒骨架上已具有φc31-attp整合酶模块。通过pcr获得vwb-attp整合酶模块,与71320黏粒进行redet重组克隆,即得到同时具有vwb-attp和φc31-attp整合酶模块的71320黏粒,改造后的黏粒编号为pba1-71320-804。
185.s.avermitilis
△
olm:attb菌株为通过同源重组双交换的方式敲除寡霉素生物合成基因簇pks的olma1-a7基因,同时在敲除位置引入人工合成的φc31-8
×
attb插入盒子序列(序列信息参看发明人专利zl200910194419.4)。该菌株染色体中的attb位点相较实施例1中原始s.avermitilis atcc31267菌株多出一个外源引入的φc31-8
×
attb位点。
186.将pba1-71320-804黏粒接合转移导入至s.avermitilis
△
olm:attb菌株中,随机挑选10个接合子进行整合位点的pcr验证以及进一步发酵检测阿维菌素的产量变化情况。采取与实施例1通过pcr验证整合后attl序列一样的方式进行pcr验证。设计φc31-8
×
attb位点一侧的验证引物:
187.5s:attcagccgatagcggtggtgg(seq id no:22)
188.10个接合子位点整合的统计结果如下:
[0189][0190]
表示pcr验证发生位点整合-表示pcr验证未发生位点整合
[0191]
上述结果可以看出,挑选的10个接合子,外源引入的φc31-8
×
attb位点都没有筛选到发生重组的目的基因,可能人工设计的外源φc31-8
×
attb序列在阿维链霉菌中并不完全适合,需要设计成阿维链霉菌自身的φc31-attb位点序列,增加重组整合的效率。其余四种内源的attb位点整合结果同实施例1基本一致,都有筛到发生位点特异性重组整合。10个接合子里面ave-vwb-attb1和ave-φc31-attb都进行了位点整合,ave-vwb-attb2和ave-vwb-attb3位点分别筛到3个发生整合的接合子,挑选的10个接合子里面未筛到同时在四个
内源的attb位点发生整合的接合子,可能是由于pba1系的基础质粒中构建了更大片段的基因簇,增加了筛选的难度,通过大量挑选接合子,进一步筛选验证,应该会增加筛选到在四个内源attb位点同时发生整合的接合子。
[0192]
实施例3将质粒pba1导入至红霉素菌株s.erythraea e3-attb中
[0193]
红霉素s.erythraeae3-attb菌株为发明人已授权专利zl200910194419.4实施例1中涉及的改造菌株,具有一个外源引入的ery-φc31-8
×
attb位点。同时根据红霉素基因组序列分析,还存在一个天然的内源ery-vwb-attb位点完整序列,76bp大小,序列如下:
[0194]
gccctcgtagctcaggggatagagcaccgctctcctaaagcgggtgtcgcaggttcgaatcctgccgggggcgcaa(seq id no:12)
[0195]
通过接合转移的方式,将质粒pba1导入s.erythraea e3-attb菌株中,采用整合后的attl序列两侧引物进行pcr验证,检测是否发生位点特异性重组整合。
[0196]
ery-vwb-attb位点一侧引物6s:atcctcgccgtcgttcggaccttc(seq id no:23)
[0197]
ery-φc31-8
×
attb位点一侧引物7s:gacgctgttccactcctacgcc(seq id no:24)
[0198]
挑选10个接合子,采用引物vwb-s与引物6s进行pcr验证ery-vwb-attb的attl位点整合序列,引物φc31-s与引物7s进行pcr验证ery-φc31-attb的attl位点整合序列。
[0199]
ery-vwb-attb的attl序列如下:
[0200]
gccctcgtagctcaggggatagagcaccgctctcctaaagcgggtgtcgcaggttcgaatcctgccgggggcacaacctgcatcgcag(seq id no:25)
[0201]
ery-φc31-8
×
attb的attl序列如下:
[0202]
tcgggtgccagggcgtgcccttgagttctctcagttgggggcgtagggtcgccgacatgacacaaggggttgtgac(seq id no:26)
[0203]
10个接合子位点整合的统计结果如下:
[0204][0205]
最终结果,5个接合子在ery-vwb-attb和ery-φc31-8
×
attb位点同时发生整合,其余5个接合子分别只发生了ery-vwb-attb位点或者ery-φc31-8
×
attb位点的单独一个整合。因此,在红霉素生产菌株中,引入外源的φc31-attb位点,和天然存在ery-vwb-attb位点,可通过对接合子的大量筛选,然后通过整合位点的pcr验证可以筛选到2个拷贝数量的外源质粒位点特异性重组整合。
[0206]
实施例4在含有红霉素合成基因簇的c5黏粒中增加vwb-attp整合模块同时将其导入至红霉素菌株s.erythraea e3-attb中
[0207]
红霉素c5黏粒为包含有45kb红霉素生物合成基因簇的黏粒,黏粒骨架上同时具有φc31-attp整合酶模块,c5黏粒相关信息在发明人之前申请专利cn201010154463.5实施例1中有相关介绍。c5黏粒在原始的多克隆位点具有单一的xbai酶切位点,以psok804质粒为模板,采用pcr的方式获得完整的vwb-attp整合酶模块,然后采用gibson重组克隆技术连接至c5黏粒的xbai位点,即得到同时具有vwb-attp和φc31-attp整合酶模块的c5黏粒,改造
后的黏粒编号为pba1-c6-804。将pba1-c6-804黏粒接合转移至红霉素s.erythraea e3-attb菌株中,随机挑选10个接合子进行整合位点的pcr验证以及进一步发酵检测红霉素的产量变化情况。
[0208]
整合后attl的序列位点pcr验证所用引物方法同实施例3一致。
[0209]
10个接合子位点整合的统计结果如下:
[0210][0211]
通过pcr验证后,存在6个接合子同时在ery-vwb-attb和ery-φc31-8
×
attb位点发生整合,所有10个接合子都在天然的ery-vwb-attb位点发生整合,有4个接合子未在人工设计导入的ery-φc31-8
×
attb位点整合。因此,结合实施例3和实施例4的结果,在红霉素生产菌株中,天然存在的ery-vwb-attb整合效率比较高,外源引入的ery-φc31-8
×
attb位点可通过挑选大量的接合子,经过pcr验证后,获得相对较多的同时在ery-vwb-attb和ery-φc31-attb位点整合的重组菌株。
[0212]
对10个接合子通过500ml三角瓶进行发酵检测红霉素产量情况,同时用出发菌株s.erythraea e3-attb做对照,结果如下:
[0213][0214]
通过位点特异性整合了红霉素生物合成基因簇后,相较出发菌株s.erythraea e3-attb,除了2号接合子外,红霉素的化学效价得到明显的提升。其中同时在ery-vwb-attb和ery-φc31-8
×
attb位点整合的菌株,相较只在ery-vwb-attb一个位点发生整合,具备筛选到红霉素更高产量的潜力。
[0215]
实施例5将pba1-c6-804黏粒导入至红霉素菌株s.erythraea 2338
-△
4907-8attb中
[0216]
将红霉素模式菌株s.erythraea 2338中的非生长相关基因sace_4907敲除,同时在敲除位置引入φc31-8
×
attb序列(序列信息参见中国发明专利zl200910194419.4中的seq id no:9),获得改造后的菌株s.erythraea 2338
-△
4907-8attb,该菌株除了含有一个内源的ery-vwb-attb位点外,在4907位置引入了一个外源的φc31-8
×
attb位点。
[0217]
将实施例4中的pba-c6-804黏粒接合转移导入改造后的s.erythraea 2338
-△
4907-8attb菌株,随机挑选10个接合子进行整合位点的pcr验证以及进一步发酵检测红霉
素的产量变化情况。
[0218]
采用整合后attl一侧序列进行pcr及测序验证,10个接合子位点整合的统计结果如下:
[0219][0220]
由上述结果可以看出,在敲除sace_4907基因处引入的φc31-8
×
attb位点处,挑选的10个接合子有8个都发生了φc31整合酶介导的位点特异性重组,同时所有接合子在内源的ery-vwb-attb位点都发生了vwb整合酶介导的位点特异性重组,相当于筛到的接合子中有8个都增加了两个拷贝红霉素合成基因簇质粒的导入。通过对10个接合子进行500ml摇瓶发酵,与出发菌株s.erythraea 2338
-△
4907-8attb相比较,红霉素的产量有50%-80%的提升。
[0221]
实施例6在含有林可霉素合成基因簇的pcaplinbgc质粒中,增加vwb-attp整合模块同时将其导入至林可链霉菌中
[0222]
林可霉素pcaplinbgc质粒包含有37kb完整林可霉素生物合成基因簇,lmra到lmrc之间的完整基因。构建过程为,提取林可链霉菌nrrl2936基因组总dna,设计完整林可基因簇外两侧cas9识别位点,利用neb试剂盒engen
tm
sgrna和cas9体外转录合成两个sgrna,同时将总dna进行精准切割,然后以pcap01质粒作为载体,通过酵母tar同源重组的技术完成包含整个林可合成基因簇的质粒构建,质粒名称命名,pcaplinbgc。由于pcap01质粒只含有φc31-attp整合酶模块,因此,构建好的pcaplinbgc质粒也只含有φc31-attp整合酶模块。通过pcr获得vwb-attp整合酶模块,并与pcaplinbgc质粒进行redet重组克隆,即得到同时具有vwb-attp和φc31-attp整合酶模块的质粒,改造后的质粒命名为,pba1-caplinbgc-804。
[0223]
根据对林可链霉菌nrrl2936序列进行比对分析,发现含有3个天然内源的vwb-attb的同源序列位点,分别为:
[0224]
seq6:lin-vwb-attb1,具有76bp的完整序列,
[0225]
gccttcgtagctcaggggatagagcaccgctctcctaaagcgggtgtcgcaggttcgaatcctgccgggggcacag(seq id no:5)
[0226]
seq7:lin-vwb-attb2,具有45bp的核心序列,
[0227]
ctcctaaagcgggtgtcgcaggttcgaatcctgccgggggcacag(seq id no:6)
[0228]
seq8:lin-vwb-attb3,具有45bp的核心序列,
[0229]
ctcctcaagcgggtgtcgcaggttcgaatcctgccgggggcacct(seq id no:7)
[0230]
发明人通过对林可链霉菌nrrl2936的非生长相关基因cysteate nrps基因簇(j.org.chem.2018,83,7102-7108)中的slinc0744基因(genebank:cp016438.1中slinc0744基因)进行敲除,同时在敲除位置引入一个人工合成的vwb-attb位点,序列信息同内源lin-vwb-attb1序列(seq id no:5)一致。敲除后菌株命名编号,nrrl2936
-△
0744vattb。
[0231]
发明人通过对上述菌株nrrl2936
-△
0744vattb的非生长相关基因moenomycin基
因簇中的slinc6338基因,slinc6339基因,slinc63340基因进行敲除,同时在敲除位置引入一个人工合成的φc31-attb位点序列,序列信息为:seq9:cggtgcgggtgccagggcgtgcccttgggctccccgggcgcgtactccacc(seq id no:1)。敲除后的菌株命名编号,nrrl2936
-△
0744vmoeφattb。该菌株具有三个内源的vwb-attb位点,一个外源的vwb-attb位点,一个外源的φc31-attb位点。
[0232]
通过接合转移的方式,将质粒pba1-caplinbgc-804导入nrrl2936
-△
0744vattb菌株中,采用整合后的attl序列两侧引物进行pcr验证,检测是否发生位点特异性重组整合。由于林可链霉菌中不存在天然的φc31-attb位点,未做相关验证。
[0233]
结果如下:
[0234][0235][0236]
表示pcr验证发生位点整合-表示pcr验证未发生位点整合
[0237]
上述结果可以看出,挑选的10个接合子,较为完整的内源lin-vwb-attb1筛选到发生重组整合接合子,外源引入的attb位点也在部分接合子中筛选到重组整合的发生(结果未显示)。
[0238]
对10个接合子通过500ml三角瓶进行摇瓶发酵检测林可霉素产量变化情况,同时用出发菌株林可链霉菌nrrl2936的slinc0744敲除菌株nrrl2936
-△
0744vattb做对照,相较出发菌株20mg/l左右的林可霉素a的产量,增加1个林可生物合成基因簇拷贝数的改造菌株林可霉素a的产量可提升至35-200mg/l,有了大幅度的提升。
[0239]
在nrrl2936
-△
0744vmoeφattb菌株中,除了内源的3个vwb-attb位点之外,还包括有一个新引入的外源vwb-attb位点和一个外源的φc31-attb位点。此菌株中,将含有目的外源基因的pba1系列质粒接合转移进去,通过大量的接合子筛选,具备增加多个外源基因拷贝数位点特异性重组整合的潜力。
[0240]
在本发明提及的所有文献都在本技术中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本技术所附权利要求书所限定的范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。