1.本发明涉及基因工程技术领域,尤其涉及一种高活性高热稳定性的蛋白酶突变体及其制备、应用。
背景技术:
2.蛋白酶作为常用工业酶之一,广泛应用于医药、食品以及轻工业领域。而酶的稳定性与活性作为工业生物催化剂的重要参数,蛋白酶在催化过程中常常面临比较极端的环境,如高温、非水相环境等,因此工业用酶需要具备较高的稳定性和活性。
3.但许多天然酶由于其稳定性不高或者活性不足,限制了其工业化应用。通过基因工程技术进行酶改造可以提高酶的稳定性或者催化活性。基于结构指导的酶改造是工业酶定向进化的有效策略,然而许多研究表明酶稳定性提升的同时,酶活会伴随下降。
4.本技术人发现来源于铜绿假单胞杆菌的蛋白酶可以催化多种小肽合成反应,该酶具有较高的溶剂稳定性,但是温度稳定性一般。现期望通过基于结构的理性设计方法改造该蛋白酶,从而在提升热稳定性的同时,不降低其活力。
技术实现要素:
5.为了解决上述技术问题,而提出的一种高活性高热稳定性的蛋白酶突变体。
6.在前期研究(zhu fc,liu f,wu b,et al.efficient extracellular expression of metalloprotease for z-aspartame synthesis.journal of agricultural and food chemistry,2016,64(51):9631-9638.)中,本发明人已经获得了一种高活性的蛋白酶重组大肠杆菌工程菌,该大肠杆菌表达的氨基酸序列如seq id no.1所示的蛋白酶(称其为wt),编码所述蛋白酶的核苷酸序列如seq id no.2所示。
7.本发明在亲本氨基酸的基础上对其进行适当突变,从而获得了稳定性、酶活均得到提高的突变体,为蛋白酶在产业上的应用提供广阔的前景。
8.本发明的目的之一在于提供一种蛋白酶突变体,以氨基酸序列为seq id no.1的蛋白酶为亲本,亲本蛋白酶的第28位或第116位的天冬氨酸发生突变。
9.优选地,上述亲本蛋白酶的编码核酸序列如seq id no.2所示。
10.优选地,上述亲本蛋白酶的第28位或第116位的天冬氨酸突变为天冬酰胺。
11.优选地,上述蛋白酶突变体的氨基酸序列如seq id no.3或seq id no.4所示。
12.本发明的目的之一在于提供编码上述蛋白酶突变体的核苷酸序列如seq id no.5或seq id no.6所示。
13.本发明的目的之一在于提供携带上述编码蛋白酶突变体核苷酸序列的载体。
14.优选地,载体为pet22b或pet28a。
15.本发明的目的之一在于提供表达上述蛋白酶突变体或携带上述编码蛋白酶突变体核苷酸序列的宿主细胞。
16.优选地,上述宿主细胞包括但不限于毕赤酵母、大肠杆菌、枯草芽孢杆菌。
17.更优选地,上述宿主细胞为大肠杆菌bl21、mg1655和/或rosetta2。
18.本发明的目的之一在于提供一种同时提高蛋白酶热稳定性和酶活的方法,将氨基酸序列为seq id no.1的蛋白酶的第28位或第116位天冬氨酸突变为天冬酰胺。
19.本发明的目的之一在于提供上述蛋白酶突变体的制备方法,诱导上述宿主细胞表达,分离纯化得到所述蛋白酶突变体。
20.本发明的目的之一在于提供上述蛋白酶突变体,或上述蛋白酶突变体的编码基因,或携带上述蛋白酶突变体编码基因的载体,或宿主细胞在催化小肽合成中的应用。
21.本发明在一种高酶活铜绿假单胞杆菌(pseudomonas aeruginosa)蛋白酶基础上,通过定点突变生物技术改造蛋白酶分子结构,通过突变蛋白内部残基达到提高稳定性的效果(如增加内部残基相互作用,把柔性残基替换为刚性残基或者引入二硫键),本发明通过设计蛋白表面残基,增加酶的稳定性,实际突变验证后最终获得两个热稳定性高的突变体d28n、d116n。
22.上述蛋白酶突变体在热稳定显著提高同时,酶的活性不受影响甚至提高了酶活。突变体d116n的60℃下水浴半衰期和水浴1h相对残余酶活提升都最显著,分别是120.8min和83%,较对照分别提高了180%和143.1%。突变体d28n在60℃下水浴半衰期和水浴1h相对残余酶活分别是72min与72%。
23.本发明所得蛋白酶突变体能够在较高温度下进行工业生产,利于生产工艺的灵活性,具有良好的工业应用前景,能在工业、医药、生化、食品领域中得到广泛应用。
附图说明
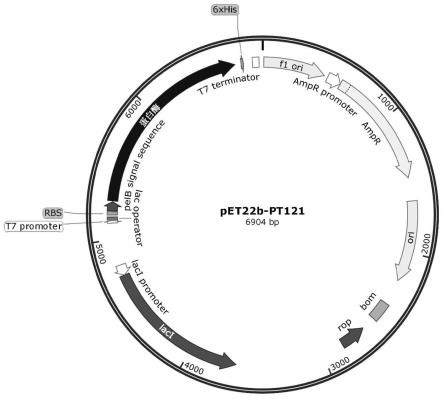
24.图1为定点突变改造的蛋白酶表达载体构建图;
25.图2为分子动力学模拟预测蛋白酶突变体d28n、e31q、d33n、d34n和d116n温度稳定性。
26.图3为蛋白酶突变体d28n、e31q、d33n、d34n和d116n的60℃水浴保温1h后残余酶活对比图;其中,m为wt,m1为d28n,m2为e31q,m3为d33n,m4为d34n,m5为d116n。
27.图4为蛋白酶突变体d28n和d116n催化合成阿斯巴甜前体的效率图。
具体实施方式
28.下面结合具体实施例对本发明作进一步解说。
29.实施例1
30.1)对氨基酸序列为seq id no.1的亲本蛋白酶的三维结构进行分析,通过其三维结构寻找位于n端表面残基天冬氨酸或者谷氨酸,发现第28位天冬氨酸、第31位谷氨酸、第33位天冬氨酸、第34位天冬氨酸和第116位天冬氨酸;
31.2)通过分子模拟软件构建突变体d28n、e31q、d33n、d34n和d116n三维结构模型;
32.3)利用分子动力学模拟软件gromacs对构建的突变体结构进行高温下分子动力学模拟,并计算突变体结构均方根偏差随时间变化曲线,如图2所示;
33.4)通过均方根扰动分析结构稳定性较高的突变体结构为d28n和d116n。
34.实施例2
35.以氨基酸序列为seq id no.1所示的蛋白酶为亲本,分别将其第28位的天冬氨酸
突变为天冬酰胺,将第116位的天冬氨酸突变为天冬酰胺。
36.以将氨基酸序列为seq id no.1所示的蛋白酶第28位天冬氨酸突变为天冬酰胺(d28n)的质粒构建为例,将连接有seq id no.2所示的序列的pet22b-pt121载体为模板(图1),以d28n-f、d28n-r为引物,进行pcr得到编码氨基酸序列第28位天冬氨酸突变为天冬酰胺的突变体(d28n)的核苷酸序列;
37.将上一步得到的含有重组基因的pcr产物用dpn i酶切去除模板,将酶切产物进行纯化,将纯化后的产物化学法转化至bl21(de3)感受态细胞,得到转化液;
38.将转化液涂布于含100μg/l卡那霉素的lb培养基,在37℃培养至长出单菌落,挑取单菌落至含100μg/l卡那霉素lb液体培养基中,37℃培养8-10h,提取菌液中的质粒,进行测序验证,验证正确的即为构建的重组质粒,并将其命名为pet-d28n。
39.利用下表中的引物及与上述相同的步骤,构建得到相应的突变体e31q、d33n、d34n、d116n重组质粒,并分别命名为pet-e31q、pet-d33n、pet-d34n、pet-d116n。
40.nameprimerad28n-f5
′‑
ccgctgatcgtcaacaaccgctgcgagatggac-3
′
d28n-r5
′‑
gtccatctcgcagcggttgttgacgatcagcgg-3
′
e31q-f5
′‑
acgaccgctgccagatggacgacgg-3
′
e31q-r5
′‑
ccgtcgtccatctggcagcggtcgt-3
′
d33n-f5
′‑
gaccgctgcgagatgaatgacggcaacgtcatc-3
′
d33n-r5
′‑
gatgacgttgccgtcattcatctcgcagcggtc-3
′
d34n-f5
′‑
cgctgcgagatggacaatggcaacgtcatcacc-3
′
d34n-r5
′‑
ggtgatgacgttgccattgtccatctcgcagcg-3
′
d116n-f5
′‑
gagaacgcctactggaacggcacggcgatgctc-3
′
d116n-r5
′‑
gagcatcgccgtgccgttccagtaggcgttctc-3
′
41.实施例3
42.将重组菌接种至5ml含有氨苄的lb培养基中,于37℃180rpm培养过夜。然后按体积比为2%的接种量转至50ml的三角瓶中。
43.培养3h后加入诱导剂iptg至终浓度为5μmol/l,l-阿拉伯糖至终浓度为3g/l。在30℃下诱导表达24h,随后取样进行离心(12000
×
g,1min),上清液即为粗酶液。
44.用含有1.0mol/l nacl的tris-hcl(ph=8.0)缓冲平衡phenyl sepharose柱,将粗酶液上样进入柱子进行结合,然后,用1.0mol/l nacl缓冲洗脱目标蛋白,即可获得所需蛋白酶突变体。
45.酶活测定方法:以2%(w/v)的酪蛋白(50mmol/l tris-hcl缓冲液,ph=8.0)作为底物,将酶液与底物分别于40℃保温10min。将200μl底物与等体积的底物与等体积的经稀释的酶液均匀混合后于40℃水浴中反应10min,加入400μl终止反应液,12000
×
g离心15min后取上清并测定280nm处吸光值。
46.以反应处吸光值。以反应初始即加入终止反应液的实验组为阳性对照。蛋白酶活力单位定义:在40℃ph=8.0的条件下,每分钟水解酪蛋白生成1μg酪氨酸所需要的酶量为一个单位。
47.现将蛋白酶突变体置于60℃下水浴1h,测定蛋白酶残余酶活,如图3所示。由图3可
知:本发明所得蛋白酶突变体(d28n和d116n)在60℃水浴下残余酶活最高,证实本发明所得蛋白酶突变体具有高活性和高热稳定性。
48.再将蛋白酶突变体放入60℃下热浴3h,每间隔20min,取样迅速放入冰中冷却,在标准条件下测定残余酶活,计算与初始的酶活比值。通过origin 9.0绘制残余酶活对时间的曲线,并通过拟合计算获得半衰期,具体如下:
[0049][0050][0051]
将蛋白酶突变体加入到含有100mmol/l苄氧羰基天冬氨酸和200mmol/l苯丙氨酸甲酯反应体系中,于37℃180rpm下反应12h,用液相分析转化率,如图4所示。由图4可知:本发明所得蛋白酶突变体催化合成阿斯巴甜前体合成的效率优于亲本蛋白酶,证实本发明所得蛋白酶突变体在催化小肽合成中的应用。
[0052]
以上所述,仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,根据本发明的技术方案及其发明构思加以等同替换或改变,都应涵盖在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。