1.本技术涉及医药技术领域,尤其涉及具有抗神经退行性改变活性的化合物、制备方法及其应用。
背景技术:
2.神经退行性疾病是由神经元和(或)其髓鞘的丧失所致,随着时间的推移而恶化,出现功能障碍。神经退行性疾患在世界范围内影响许多人,例如阿尔茨海默氏病和帕金森氏病,其症状的严重与危害性对患者及其家人的生活质量造成了极大的影响。
3.临床上对神经退行性改变疾病的治疗主要包括手术治疗和化学药物治疗。手术治疗因术后疾病的复发率较高,因此限制了其在治疗神经退行性改变疾病中的广泛使用。在神经退行性改变疾病的药物治疗方面,目前已有的针对治疗阿尔兹海默症的药物仅能够延缓病理症状的加深,并不能有效逆转或者阻止疾病的发生过程,在长期服药后会产生不同程度的耐药性及不良反应,且在停药后容易出现病症复发;而治疗帕金森氏症的药物如左旋多巴(l-dopa)在服用初期即可造成不同程度的腹胀和胃肠反应,长期服用左旋多巴容易产生造成如幻觉或是临床上不可预测的“开关现象”等副作用,较大的影响了患者的日常生活。因此,神经退行性改变疾病的药物治疗仍是临床上亟待解决的难题。
4.目前寻找抗神经退行性改变疾病的药物主要是从天然产物如动植物药中提取分离获得,其生长周期漫长且原料获取难度大,同时大量的原料需求容易造成不同程度的资源匮乏甚至导致枯竭。另外,由于产地差异、以及发生在不同季节的动植物药,其具有活性的次生代谢产物成分和含量截然不同,导致活性成分的获取难以重现。
5.自20世纪以来,科学家们对微生物进行了广泛的次生代谢产物研究,陆续发现了许多具有生物活性的小分子,包括萜类、黄酮类和生物碱等,而从中发现的二萜类化合物具有显著的抗炎、抗氧化、抗肿瘤和神经保护等活性。在自然环境下,不同微生物间拮抗及协同的现象非常普遍,相较于单一微生物的生物合成基因簇的沉默现象,共培养的微生物通过不同代谢酶或者代谢产物的协同下,能产生多样而又丰富的次生代谢产物。由此,采用共培养的方法,优化培养条件,对共培养真菌的发酵产物进行代谢产物及生物活性挖掘,对于开发治疗神经退行性改变疾病的新型药物具有极其重要的意义。
技术实现要素:
6.有鉴于此,本技术的目的在于提供了具有抗神经退行性改变活性的化合物、制备方法及其应用,以在一定程度上解决上述技术问题之一。
7.第一方面,本技术实施例公开了具有抗神经退行性改变活性的化合物,所述化合
物包括如和/或所示的化合物;或者所述化合物的立体异构体、互变异构体或其药学上可接受的盐。
8.在本技术实施例中,所述式i所示化合物包括如和/或所示的化合物;
9.所述式ii所示化合物包括和/或所示的化合物。
10.第二方面,本技术实施例公开了一种抗神经退行性改变疾病的制剂,其特征在于,所述制剂包括第一方面所述的化合物,以及药学上可接受的辅料。
11.所述药学上接受的辅料包括稀释剂、载体和赋形剂中的至少一项。
[0012]“赋形剂”是指参与赋予药物组合物形式或稠度的药学上可接受的材料、组合物或媒介物。每种赋形剂在混合时必须与药物组合物的其他成分相容,从而避免了相互作用,这种相互作用在施用于患者时会大大降低本发明化合物的功效,并且避免了会导致药物组合物不被药学上可接受的相互作用。另外,每种赋形剂必须具有足够高的纯度以使其药学上
可接受。
[0013]
合适的药学上可接受的赋形剂将根据所选的特定剂型而变化。另外,可以针对它们可以在组合物中使用的特定功能来选择合适的药学上可接受的赋形剂。例如,可以选择某些药学上可接受的赋形剂,因为它们具有促进产生均匀剂型的能力。可以选择某些药学上可接受的赋形剂,因为它们具有产生稳定剂型的能力。可以选择某些药学上可接受的赋形剂,因为它们一旦施用于患者从一个器官或身体的一部分到另一器官或身体的另一部分,便易于携带或运输本发明的一种或多种化合物。可以选择某些药学上可接受的赋形剂,因为它们具有增强患者依从性的能力。
[0014]
合适的药学上可接受的赋形剂包括以下类型的赋形剂:稀释剂、填充剂、粘合剂、崩解剂、润滑剂、助流剂、制粒剂、包衣剂、润湿剂、溶剂、助溶剂、助悬剂、乳化剂、甜味剂、调味剂、风味掩蔽剂、着色剂、抗结块剂、湿润剂、螯合剂、增塑剂、增粘剂、抗氧化剂、防腐剂、稳定剂、表面活性剂和缓冲剂。如本领域技术人员将理解的是,取决于制剂中存在多少赋形剂以及制剂中存在什么其他成分,某些药学上可接受的赋形剂可以起到多于一种功能并且可以起到替代的功能。
[0015]
本技术实施例提供的制剂可以为适于以下方式使用的形式:口服使用(例如作为片剂、胶囊剂、囊片、药丸、锭剂、散剂、糖浆剂、酏剂、混悬剂、溶液剂、乳剂,药袋和扁囊剂),局部使用(例如作为霜剂、软膏剂、乳液、溶液、糊剂、喷雾剂、泡沫和凝胶),经皮施用(例如通过透皮贴剂),通过吸入施用(例如作为干粉、气雾剂、悬浮液和溶液),通过吹入施用(例如作为细粉)或肠胃外施用(例如作为用于静脉内、皮下、肌肉内、腹膜内或肌肉内给药的无菌水性或油性溶液剂,或者作为用于直肠给药的栓剂)。
[0016]
第三方面,本技术实施例公开了第一方面所述化合物的制备方法,包括以下步骤:
[0017]
分别得到含有芸薹生链格孢菌和青霉菌的活化菌落;
[0018]
将所述菌落接种至发酵培养基进行发酵,以获得发酵液;以及
[0019]
对所述发酵液进行提取分离,以得到所述化合物;
[0020]
其中,芸薹生链格孢菌,拉丁文名称alternaria brassicicola,来源于中国农业微生物菌种保藏管理中心,保藏号:accc 37296;
[0021]
粒状青霉菌,拉丁文名称penicillium granulatum,来源于中国海洋微生物菌种保藏管理中心,保藏号:mccc 3a00475。
[0022]
在本技术实施例中,含有芸薹生链格孢菌和青霉菌的活化菌落是将菌株接种至pda培养基中于28℃培养得到的。
[0023]
在本技术实施例中,所述发酵培养基包括50wt%大米。
[0024]
在本技术实施例中,所述提取分离的步骤包括:
[0025]
获得粗提浸膏,所述粗提浸膏是将所述发酵液由乙酸乙酯提取得到;
[0026]
获得精提浸膏,所述精提浸膏是将所述粗提浸膏依次经由石油醚、二氯甲烷和乙酸乙酯萃取得到;以及
[0027]
获得所述化合物,所述化合物是将所述精提浸膏经由正相硅胶层析、反相硅胶层析以及高效制备色谱纯化得到的,所述化合物为如权利要求1所述的化合物。
[0028]
在本技术实施例中,获得所述化合物的步骤具体包括:
[0029]
获得第一组分,所述第一组分是将所述精提浸膏上样至正相硅胶柱后,收集洗脱
液得到的;
[0030]
获得第二组分,所述第二组分是将所述第一组分上样至反相硅胶柱后,收集洗脱液得到的;
[0031]
获得第三组分,所述第三组分是将所述第二组分上样至高效液相色谱柱,收集洗脱液得到的,所述第三组分包括如式i和/或如式ii所示的化合物。
[0032]
第四方面,本技术实施例公开了第一方面所述的化合物、或第二方面所述的制备方法制得的化合物在制备抗神经退行性改变疾病药物中的应用。
[0033]
与现有技术相比,本技术至少具有以下有益效果:
[0034]
本技术中涉及具有抗神经退行性改变活性的化合物、制备方法及其应用。通过采取两株菌共培养的策略,改变培养基及培养条件、混合培养比例等研究方法,对其沉默的生物合成基因进行表观遗传调控,尽可能挖掘微生物合成次生代谢产物的能力,在工艺可重复与可持续发展的基础上能进行放大培养,不会造成资源浪费。
[0035]
其次,本技术提供的化合物对神经退行性改变疾病模型细胞均具有神经保护活性,且在25μm的浓度下表现出比阳性药tbhq(特丁基对苯二酚)更好的保护作用。所述化合物可以预期发展成为治疗如阿尔兹海默症和帕金森氏病等神经退行性改变疾病相关的药物。
[0036]
另外,本发明只需按照实验方案将冻存的菌种复苏传代,根据优化好的培养条件进行培养,即可无限放大发酵,并可通过调控发酵物的总量来目的性地调控化合物的产量,最终获得具有抗神经退行性改变疾病的目标产物。
附图说明
[0037]
图1为本技术实施例提供的式ii所示化合物计算ecd的实验值与计算值比对图。
[0038]
图2为本技术实施例提供的式i-2所示化合物的单晶结构图。
[0039]
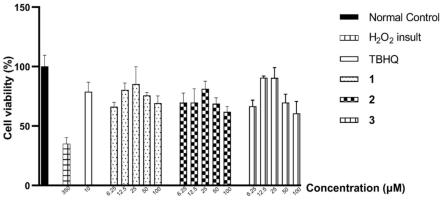
图3为本技术实施例提供的化合物以及阳性药tbhq对sh-sy5y细胞的细胞毒作用图。
[0040]
图4为本技术实施例提供的化合物以及阳性药tbhq对h2o2诱导损伤的sh-sy5y细胞的保护作用图。
[0041]
图5为本技术实施例提供的化合物以及阳性药tbhq对h2o2诱导损伤的sh-sy5y细胞作用效果照片。
具体实施方式
[0042]
为了使本技术的目的、技术方案及优点更加清楚明白,以下结合实施例对本技术进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本技术,并不用于限定本技术。本技术中未详细单独说明的试剂均为常规试剂,均可从商业途径获得;未详细特别说明的方法均为常规实验方法,可从现有技术中获知。
[0043]
如式i\式ii所示化合物的制备
[0044]
1、菌株
[0045]
本技术实施例公开的如式i或式ii所示的化合物是通过真菌发酵培养,以提取分离其次级代谢产物而得到的。
[0046]
本技术实施例中涉及的菌种由以下来源:
[0047]
芸薹生链格孢菌,拉丁文名称alternaria brassicicola,来源于中国农业微生物菌种保藏管理中心,保藏号:accc 37296;
[0048]
粒状青霉菌,拉丁文名称penicillium granulatum,来源于中国海洋微生物菌种保藏管理中心,保藏号:mccc 3a00475。
[0049]
2、菌株活化
[0050]
按照如下所述配方比例配置培养基,操作步骤如下:
[0051]
(1)将称量好的pda倒入蓝盖瓶内,用naoh调节ph至7.0,放入灭菌锅设置121℃、30min。
[0052]
(2)照紫外30min灭菌,待冷却至约50℃,加入抗生素和组蛋白去乙酰化酶抑制剂(烟酰胺),倒平板。
[0053]
(3)照紫外15min,待培养基完全凝固后接菌将芸薹生链格孢菌(alternaria brassicicola)accc 37296和粒状青霉菌(penicillium granulatum)mccc 3a00475按照5:1的重量比例用平板划线法接种到培养基中,28℃培养1周后,即可得到平板菌落。
[0054]
3、发酵
[0055]
将上述培养得到的平板菌落,切块得到含有菌落的琼脂块,按照6wt%(占发酵培养基的重量百分比)的接种比例将琼脂块接种至灭菌的发酵培养基中,常压下空气含氧量发酵28天,以得到发酵液。发酵培养基为50wt%(质量百分比)的大米水溶液,大米可以提前浸泡以及碾碎;
[0056]
4、提取分离
[0057]
(1)获得粗提浸膏和精提浸膏
[0058]
用95%乙醇提取发酵液,提取液减压回收溶剂得到粗提浸膏389g;然后用5l50℃热水混悬,依次用等体积石油醚、二氯甲烷和乙酸乙酯萃取,再用乙酸乙酯萃取部位回收溶剂后得到112g精提浸膏。
[0059]
(2)获得第一组分
[0060]
将112g的精提浸膏,上样至正相硅胶色谱(60-80目)柱,并以石油醚-丙酮梯度(70%石油醚
→
20%石油醚)洗脱后,得到10个流分,依次命名为fr.1-fr.10;
[0061]
将流分fr.6再次上样至正相硅胶柱,并以石油醚-乙酸乙酯(65%石油醚
→
25%石油醚)梯度洗脱后,得到9个流分,依次命名为fr.6.1-fr.6.9;其中,fr.6.7即为第一组分。
[0062]
(3)获得第二组分
[0063]
将第一组分fr6.7上样至反相硅胶柱,并以甲醇-水(70%甲醇
→
30%石油醚)梯度洗脱后,得到6个流分,依次命名为fr.6.7.1-fr.6.7.6;其中,fr.6.7.1即为第二组分。
[0064]
(4)获得第三组分
[0065]
将第二组分流分fr.6.7.1分别上样反相高效色谱制备柱(acclaim
tm trinity q1 lc,货号:083244;流动相:乙腈:水=30:70,2ml/min);能够分别得到式i、式ii所示化合物;
[0066]
若式i、式ii所示化合物分别上样至手性色谱柱制备(大赛璐chiralpak ig色谱柱,流动相:乙腈:水=28:72,2ml/min)能够分别得到式i-1\式i-2所示化合物;以及式ii-1\式ii-2所示化合物。
[0067]
式i\式ii所示化合物的结构鉴定
[0068]
分别经过核磁共振(nmr)、计算电子圆二色谱(ecd)和x-单晶衍射(x-ray)方法获得式i、式ii所示化合物的绝对构型。
[0069]
1、核磁共振
[0070]
式i-1所示化合物:无色块状晶体;1h和
13
c nmr数据,见表1。
[0071]
式ii-1所示化合物:白色粉末;高分辨电喷雾电离质谱(hresims)[m na]
m/z 353.1724(计算值c
20h26
o4na,353.1723);na,353.1723);uv(ch3oh)λ
max
(logε)=234(5.93)nm;ecdλ
max
(δε)212(-4.59),236( 6.04)nm;ir(kbr)ν
max 3455,2927,2872,1761,1698,1457,1383cm
–1;1h和
13
c nmr数据,见表1。
[0072]
式i-2所示化合物:无色块状晶体;高分辨电喷雾电离质谱(hresims)[m na]
m/z 371.2200(计算值c
21h32
o4na,371.2193);uv(ch3oh)λ
max
(logε)=207(5.79),243(5.93)nm;ir(kbr)ν
max 3433,2960,2925,1678,1629,1456,1382cm
–1;1h和
13
c nmr数据,见表2。
[0073]
表1
[0074][0075]
a measured in cd3od
[0076]
表2
[0077][0078][0079]
a measured in cdcl3[0080]
2、通过计算电子圆二色谱(ecd)的方法对化合物1的绝对构型进行验证。
[0081]
结果:实验所测的电子圆二色谱(ecd)的cotton效应与计算值吻合,见图1。
[0082]
3、x-单晶衍射(x-ray)分析
[0083]
通过对式i-2所示化合物的铜靶x-ray分析。
[0084]
结果:确定了式i-2所示化合物的绝对构型,晶体编号:ccdc214277,见图2。
[0085]
最终确定得到的化合物,为
所示的化合物。
[0086]
细胞毒性研究
[0087]
通过cck-8法分析评估细胞存活率,其步骤包括:
[0088]
将sh-sy5y细胞或h2o2(350μm)损伤的sh-sy5y细胞接种在96孔板上24小时;
[0089]
添加10μl 10%(v/v)cck-8溶液,将细胞置于黑暗的培养箱中培养2小时;
[0090]
在450nm处记录吸光度(od)值。
[0091]
通过以下公式计算细胞活力:细胞活力%=(实验组od
–
空白组od)/(正常组od
–
空白组od)
×
100%;细胞存活率的结果由标准偏差(n=3)的平均值获得,其中,
[0092]
空白组:仅加培养基组;
[0093]
正常组(normal control):未经处理组;
[0094]
实验组1:加入不同浓度梯度的化合物1处理组;
[0095]
实验组2:加入不同浓度梯度的化合物2处理组;
[0096]
实验组3:加入不同浓度梯度的化合物3处理组;
[0097]
实验组4:加入不同浓度阳性药物特丁基对苯二酚(tbhq)处理组;
[0098]
其中,化合物1、2、3分别为式ii-1、式i-1、式i-2所示化合物。
[0099]
结果:如图3所示,通过对cck-8法数据分析发现,化合物1~3在200μm浓度范围内对sh-sy5y细胞均无明显细胞毒作用;阳性药物特丁基对苯二酚(tbhq)组仅在10μm浓度范围内对sh-sy5y细胞无明显细胞毒作用。
[0100]
式i、式ii所示化合物对h2o2损伤的sh-sy5y细胞(神经退行性改变疾病模型)的活性实验:
[0101]
采用h2o2损伤的sh-sy5y细胞作为神经退行性改变疾病的模型细胞,运用cck-8法评价化合物的抗神经退行性改变活性。
[0102]
通过cck-8法分析评估细胞存活率,其步骤包括:
[0103]
将sh-sy5y细胞或h2o2(350μm)损伤的sh-sy5y细胞接种在96孔板上24小时;
[0104]
添加10μl 10%(v/v)cck-8溶液,将细胞置于黑暗的培养箱中培养2小时;
[0105]
在450nm处记录吸光度(od)值。
[0106]
通过以下公式计算细胞活力:细胞活力%=(实验组od或模型组od
–
空白组od)/(正常组od
–
空白组od)
×
100%;细胞存活率的结果由标准偏差(n=3)的平均值获得,其中,
[0107]
空白组:仅加培养基组;
[0108]
正常组(normal control):未经处理组;
[0109]
模型组(h2o
2 insult):用350μm h2o2诱导损伤组;
[0110]
实验组1:加入不同浓度梯度的化合物1 350μm h2o2处理组;
[0111]
实验组2:加入不同浓度梯度的化合物2 350μm h2o2处理组;
[0112]
实验组3:加入不同浓度梯度的化合物3 350μm h2o2处理组;
[0113]
实验组4:加入不同浓度阳性药物特丁基对苯二酚(tbhq) 350μmh2o2处理组;
[0114]
其中,化合物1、2、3分别为式ii-1、式i-1、式i-2所示化合物。
[0115]
结果:如图4所示,在25μm浓度时,化合物1~3在0~25μm范围内呈剂量依赖性地保护sh-sy5y细胞免受氧化损伤;其对损伤的细胞存活率恢复水平高于阳性药物tbhq(如图5)。
[0116]
综上所述,本技术通过采取芸薹生链格孢菌和青霉菌两株菌共培养的方式能够产生具有抗神经退行性改变活性的化合物,改变培养基及培养条件、混合培养比例等研究方法,对其沉默的生物合成基因进行表观遗传调控,尽可能挖掘微生物合成次生代谢产物的能力,在工艺可重复与可持续发展的基础上能进行放大培养,不会造成资源浪费。
[0117]
所述化合物对神经退行性改变疾病模型细胞均具有神经保护活性,且在25μm的浓度下表现出比阳性药tbhq(特丁基对苯二酚)更好的保护作用。
[0118]
以上所述,仅为本技术较佳的具体实施方式,但本技术的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本技术揭露的技术范围内,可轻易想到的变化或替换,都应涵盖在本技术的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。