1.本发明涉及药物化学领域,具体涉及一种可以用作mao-b抑制剂的吡咯烷酰胺衍生物的制备方法。
背景技术:
2.单胺氧化酶(mao,ec 1.4.3.4)是一种含黄素酶,为催化单胺氧化脱氨反应的酶,负责对内源性单胺神经递质进行氧化脱氨,内源性单胺神经递质包括:多巴胺、5-羟色胺、肾上腺素或去甲肾上腺素和痕量胺例如苯基乙胺以及许多胺异生素等。单胺氧化酶可分为单胺氧化酶a(mao-a)和单胺氧化酶b(mao-b) 两个亚型。它们的基因编码不同(a.w.bach等,proc.natl.acad.sci.usa 1988,85,4934-4938),并且在结构、组织分布和底物特异性方面也有差异。mao-a多存在于肝脏、胃肠黏膜,可灭活血液循环系统中的儿茶酚胺及饮食中的血管活性物质(如酪氨酸),从而辅助脑内神经递质降解;而mao-b主要存在于脑内及血小板中。mao-a对章鱼胺、5-羟色胺、肾上腺素和去甲肾上腺素具有更高的亲和性;而mao-b的天然底物是酪氨和苯基乙胺。不过这两种同工型均可氧化多巴胺。
3.单胺氧化酶b(monoamine oxidase b,mao-b)是da分解代谢的关键酶之一,通过选择性、特异性抑制内源性和外源性多巴胺分解,延长多巴胺的作用时间,从而改善临床症状,可用于pd早期单药治疗及出现症状波动后的辅助治疗。主要有以下3个作用:(1)将多巴胺分解为3,4-二羟基苯乙酸和高香草酸,同时产生小分子h2o2,对神经细胞产生毒性作用;(2)使刺激多巴胺分泌、抑制多巴胺再摄取的β-苯乙胺脱氨基失去活性;(3)还能将1-甲基-4-苯基-1,2,3,6-四氢嘧啶(mptp)分解为具有神经毒性的l-甲基-4
‑ꢀ
苯基吡啶离子(mpp
)。因此,根据mao-b的生理功能,一方面,抑制mao-b的活性可减少多巴胺的降解和再摄取,提高脑内多巴胺浓度,可改善pd临床症状;另一方面,通过降低h2o2、mpp
等神经毒素水平延缓黑质细胞的死亡过程(heikkila r e,manzino l,cabbat f s,et al.protection against thedopaminergic neurotoxiciy of 1-methyl-1,2,3,6-tetrahydropyridine(mptp)by monoamine inhibitors[p].nature, 1984,311(5985):467-469;youdim m b h,bakhle y s.monoamine oxidase isoforms and inhibitors inparkinson’s disease and depressive illness[j].br j pharmacol,2006,147(s1):s287-s296;naoi m, wakako m.monoamine oxidase inhibitors as neuroprotective agents in age-dependent neurodegenerativedisorders[j].curr pharm des,2010,16(25):2799-2817),可改变pd进程。由于mao-b抑制剂不仅能改善pd症状,而且还能起神经保护作用,因此是目前抗帕金森病药物研究的热点。
[0004]
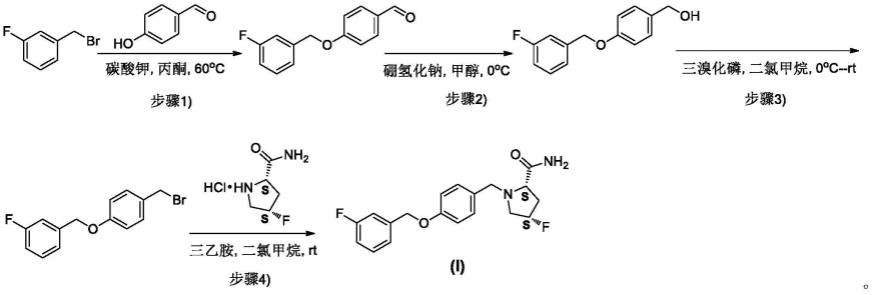
专利申请wo 2019170115(a1)公开了一类具有mao-b抑制活性的化合物,具体公开了具有式(i)所示结构的吡咯烷酰胺衍生物及其制备方法。
[0005][0006]
其中,具体公开了如下所示的式(i)所示化合物的制备方法:
[0007][0008]
其中,上述制备方法中,主要存在以下缺陷:
[0009]
1.步骤3)反应时间长,且得到的化合物不稳定,不易纯化,因此,纯度低;
[0010]
2.步骤4)中的原料容易吸潮,且制备该化合物需要用到的氯化氢的乙酸乙酯溶液,易挥发,容易造成空气污染,同时制备过程复杂,不适合工业生化产;
[0011]
3.步骤4)反应时间长且产率低,也不适合工业化生产;进一步研究发现,在放大生产时,反应时间需进一步延长,且反应过程不可控;
[0012]
4.步骤4)的产物需要经过硅胶柱层析纯化得到,不适合工业化生产。
技术实现要素:
[0013]
为克服现有技术中的上述缺陷,本发明提供了一种制备式(i)所示化合物的新方法。该方法原料便宜易得,条件温和、环保,反应时间短,且安全可控,总产率高,特别适合工业化生产。
[0014]
一方面,本发明提供一种制备式(i)所示化合物的方法,包括:
[0015]
步骤1:式(ii)所示化合物和式(iii)所示化合物在溶剂1中,在碱1的作用下反应得到式(i)所示化合物,
[0016][0017]
在一些实施方案中,所述碱1可以为适合该反应的合适的碱,包括有机碱和无机碱,包括但不限于,碳酸钾、碳酸钠、碳酸氢钠、吡啶、n,n-二异丙基乙胺和三乙胺等。在一些实施方案中,所述碱1为碳酸钾、碳酸钠、碳酸氢钠或三乙胺。
[0018]
在另一些实施方案中,所述碱1的用量为式(ii)所示化合物的多倍当量;在又一些实施方案中,所述碱1的用量为式(ii)所示化合物的2.0-4.0倍当量;在另一些实施方案中,所述碱1的用量为式(ii)所示化合物的2.0倍当量、3.0倍当量或4.0倍当量;优选地,所述碱1的用量为式(ii)所示化合物的3.0倍当量。
[0019]
在一些实施方案中,所述溶剂1为乙腈、丙酮、二氯甲烷、乙酸乙酯、二甲基亚砜或n,n-二甲基甲酰胺;在另一些实施方案中,所述溶剂1为乙酸乙酯。
[0020]
在一些实施方案中,所述步骤1的反应是在一定反应温度下进行的,其中所述反应温度为室温或40℃到70℃;在另一些实施方案中,所述反应温度为40℃到70℃;在另一些实施方案中,所述反应温度为 40℃到60℃;在另一些实施方案中,所述反应温度为50℃到70℃;在另一些实施方案中,所述反应温度为25℃、30℃、40℃、50℃、60℃或70℃;优选地,所述反应温度为60℃。
[0021]
在另一些实施方案中,所述步骤1的反应时间为6-18小时;在又一些实施方案中,所述步骤1的反应时间为6-16小时;在又一些实施方案中,所述步骤1的反应时间为6-14小时;在又一些实施方案中,所述步骤1的反应时间为6-12小时;在又一些实施方案中,所述步骤1的反应时间为6-10小时;在又一些实施方案中,所述步骤1的反应时间为6-8小时。在又一些实施方案中,所述步骤1的反应时间为6 小时、7小时或8小时。
[0022]
在一些实施方案中,本发明所述的制备式(i)所示化合物的方法还包括式(ii)所示化合物的制备方法,其包括:
[0023]
步骤2:式(iv)所示化合物在溶剂2中,在二氯亚砜的作用下反应得到式(ii)所示化合物,
[0024][0025]
在另一些实施方案中,所述溶剂2可以为适合该反应的合适的溶剂,包括但不限于,二氯甲烷、四氢呋喃、乙醚、1,4-二氧六环、二甲基亚砜和n,n-二甲基甲酰胺等。在另一些实施方案中,所述溶剂2为乙醚、1,4-二氧六环、二甲基亚砜或n,n-二甲基甲酰胺。
[0026]
在另一些实施方案中,所述溶剂2的用量为1ml/g到5ml/g式(iv)所示化合物;在另一些实施方案中,所述溶剂2的用量为1ml/g到3ml/g式(iv)所示化合物;在另一些实施方案
中,所述溶剂2的用量为1ml/g、2ml/g、3ml/g、4ml/g或5ml/g式(iv)所示化合物;优选地,所述溶剂2的用量为2 ml/g式(iv)所示化合物。
[0027]
在另一些实施方案中,所述二氯亚砜的用量为式(iv)所示化合物的1.0-2.0倍当量;在另一些实施方案中,所述二氯亚砜的用量为式(iv)所示化合物的1.0-1.5倍当量;在另一些实施方案中,所述二氯亚砜的用量为式(iv)所示化合物的1.0倍当量、1.1倍当量、1.2倍当量、1.3倍当量、1.4倍当量或1.5倍当量;优选地,所述二氯亚砜的用量为式(iv)所示化合物的1.1倍当量。
[0028]
在另一些实施方案中,所述二氯亚砜在0℃下加入,加完后,反应体系转移至25℃下反应。
[0029]
在另一些实施方案中,所述步骤2的反应时间为1-6小时;在又一些实施方案中,所述步骤2的反应时间为2-4小时。在又一些实施方案中,所述步骤2的反应时间为2小时、3小时或4小时。
[0030]
另一方面,本发明涉及式(ii)所示化合物或式(iii)所示化合物,
[0031][0032]
具体地,式(ii)所示化合物和式(iii)所示化合物用于制备本发明所述的式(i)所示化合物。
[0033]
本发明提供了一种制备式(i)所示化合物的新方法,该方法具有预料不到的技术优势:
[0034]
1、所述式(ii)所示化合物的稳定性好;
[0035]
2、所述式(iii)所示化合物的性质稳定,且制备过程简单;
[0036]
3、反应时间短,且产率高。
[0037]
因此,本发明所述的制备式(i)所示化合物的新方法,更适合工业化生产。
[0038]
本发明的详细说明书
[0039]
定义和一般术语
[0040]
现在详细描述本发明的某些实施方案,其实例由随附的结构式和化学式说明。本发明意图涵盖所有的替代、修改和等同技术方案,它们均包括在如权利要求定义的本发明范围内。本领域技术人员应认识到,许多与本文所述类似或等同的方法和材料能够用于实践本发明。本发明绝不限于本文所述的方法和材料。在所结合的文献、专利和类似材料的一篇或多篇与本技术不同或相矛盾的情况下(包括但不限于所定义的术语、术语应用、所描述的技术,等等),以本技术为准。
[0041]
应进一步认识到,本发明的某些特征,为清楚可见,在多个独立的实施方案中进行了描述,但也可以在单个实施例中以组合形式提供。反之,本发明的各种特征,为简洁起见,在单个实施方案中进行了描述,但也可以单独或以任意适合的子组合提供。
[0042]
除非另外说明,本发明所使用的所有科技术语具有与本发明所属领域技术人员的通常理解相同的含义。本发明涉及的所有专利和公开出版物通过引用方式整体并入本发
明。
[0043]
除非另外说明,应当应用本文所使用的下列定义。出于本发明的目的,化学元素与元素周期表cas版,和《化学和物理手册》,第75版,1994一致。此外,有机化学一般原理可参考"organic chemistry",thomassorrell,university science books,sausalito:1999,和"march's advanced organic chemistry”by michael b. smith and jerry march,john wiley&sons,new york:2007中的描述,其全部内容通过引用并入本文。
[0044]
除非另有说明或者上下文中有明显的冲突,本文所使用的冠词“一”、“一个(种)”和“所述”旨在包括“至少一个”或“一个或多个”。因此,本文所使用的这些冠词是指一个或多于一个(即至少一个)宾语的冠词。例如,“一组分”指一个或多个组分,即可能有多于一个的组分被考虑在所述实施方案的实施方式中采用或使用。
[0045]
在本发明的上下文中,所有在此公开了的数字均为近似值。每一个数字的数值有可能会出现1%、2%、 5%、7%、8%或10%等差异。每当公开一个具有n值的数字时,任何具有n /-1%,n /-2%,n /-3%, n /-5%,n /-7%,n /-8%或n /-10%值以内的数字会被明确地公开,其中“ /
‑”
是指加或减。每当公开一个数值范围中的一个下限(dl)和一个上限(du)时,任何处于该公开了的范围之内的数值会被明确地公开。
[0046]
本发明所述的“产物含量”或“产物比例”指的是该反应反应完毕后,经hplc检测的反应体系中产物的含量。
[0047]
本发明中“室温”指的是温度由大约10℃到大约40℃。在一些实施例中,“室温”指的是温度由大约 20℃到大约30℃;在另外一些实施例中,“室温”指的是20℃,22.5℃,25℃,27.5℃等等。
实施例
[0048]
实施例1(2s,4s)-2-氨基甲酰基-4-氟吡咯烷-1-羧酸叔丁酯的合成
[0049][0050]
依次将(2s,4s)-1-(叔丁氧羰基)-4-氟吡咯烷-2-羧酸(1.00g,4.29mmol)、boc酸酐(1.12g,5.15mmol)、碱(1.2eq)和一定量的溶剂加入到100ml单口圆底烧瓶中,在25℃反应4h,降温至5℃,加入一定量的氨水,然后反应3h,取样hplc中控反应液,加入正庚烷(20ml)打浆30min,抽滤,滤饼置于60℃鼓风干燥烘干,得到白色固体。示例1-10的实验结果如表a所示。
[0051]
表a
[0052][0053]
注:“反应溶剂用量”、“氨水用量”是指多少ml/g(2s,4s)-1-(叔丁氧羰基)-4-氟吡咯烷-2-羧酸。例如,反应溶剂用量为5ml/g,即每克(2s,4s)-1-(叔丁氧羰基)-4-氟吡咯烷-2-羧酸,加入反应溶剂5ml。#是指 hplc中控反应液显示反应底物(2s,4s)-1-(叔丁氧羰基)-4-氟吡咯烷-2-羧酸有大量剩余,未进行后处理。
[0054]
示例11:
[0055]
向30l反应釜内依次加入乙酸乙酯(3.00l)、(2s,4s)-1-(叔丁氧羰基)-4-氟吡咯烷-2-羧酸(1.00kg,4.29mol)、二碳酸二叔丁酯(1.12kg,5.15mol)和吡啶(0.41kg,5.15mol);升温至25℃,反应4h,降温至5℃,开始滴加氨水(0.40l),加入完毕后,搅拌15min,升温至25℃,反应3h后取样hplc 中控,后每隔1h取样检测一次,直至(2s,4s)-1-(叔丁氧羰基)-4-氟吡咯烷-2-羧酸≤0.50%;加入正庚烷(12.00 l),保温搅拌0.5h,停止搅拌,准备抽滤瓶和布氏漏斗,过滤;将待烘物料均匀装入鼓风干燥箱烘盘上,控温60℃干燥,12h后开始检测水分,直至水分≤1.0%,结束干燥后降温,出料,称重,得到白色固体(0.93 kg,93.4%)。
[0056]
表征数据:
[0057]
ms(esi,pos.ion)m/z:255.15[m na]
;
[0058]1h nmr(400mhz,dmso-d6)δ(ppm)7.18(d,j=26.3hz,1h),6.95(s,1h),5.20(d,j=53.7hz,1h), 4.12(d,j=8.3hz,1h),3.65
–
3.55(m,1h),3.53
–
3.49(m,1h),2.41
–
2.28(m,1h),2.15(t,j=17.4hz,1h), 1.38(d,j=19.1hz,9h).
[0059]
实施例2(2s,4s)-4-氟吡咯烷-2-羧酰胺的酸加成盐的合成
[0060][0061]
依次将(2s,4s)-2-氨基甲酰基-4-氟吡咯烷-1-羧酸叔丁酯(1.00g,4.31mmol)、一
定量的酸和一定量的溶剂加入到100ml单口圆底烧瓶中,在一定的反应温度下,脱除boc保护基,tlc监测反应原料的剩余,抽滤,滤饼置于60℃鼓风干燥烘干,得到白色固体。
[0062]
按照此方法可制备得到(2s,4s)-4-氟吡咯烷-2-羧酰胺的硫酸盐、三氟乙酸盐和对甲苯磺酸盐,实验结果如表b的示例1-10所示。
[0063]
表b
[0064][0065]
注:“当量(eq)”是指所述物料相对于反应底物(2s,4s)-2-氨基甲酰基-4-氟吡咯烷-1-羧酸叔丁酯的摩尔量的倍数,例如,1.5eq,表示所述物料的摩尔量是反应底物(2s,4s)-2-氨基甲酰基-4-氟吡咯烷-1-羧酸叔丁酯的摩尔量的1.5倍。“反应溶剂用量”是指多少ml/g(2s,4s)-2-氨基甲酰基-4-氟吡咯烷-1-羧酸叔丁酯,例如,反应溶剂用量为10ml/g,即每克(2s,4s)-2-氨基甲酰基-4-氟吡咯烷-1-羧酸叔丁酯,加入反应溶剂10 ml。&1是指tlc监测反应底物(2s,4s)-2-氨基甲酰基-4-氟吡咯烷-1-羧酸叔丁酯有剩余,没有固体析出,未进行后处理。&2是指tlc监测反应底物(2s,4s)-2-氨基甲酰基-4-氟吡咯烷-1-羧酸叔丁酯没有反应完全,有固体析出,未进行后处理。
[0066]
示例11:
[0067]
向30l反应釜内依次投入乙酸乙酯(6l)和(2s,4s)-2-氨基甲酰基-4-氟吡咯烷-1-羧酸叔丁酯(1.00kg, 4.31mol),升温至50℃,开始加入对甲苯磺酸一水合物(1.06kg,5.60mol),加入完毕开始计时,控温反应4h后,tlc监控至(2s,4s)-2-氨基甲酰基-4-氟吡咯烷-1-羧酸叔丁酯显色基本消失,降温至35℃,准备抽滤瓶和布氏漏斗,过滤得到固体,固体
用60℃鼓风干燥至水分≤1.0%,得到白色固体(1.24kg,95.0%)。
[0068]
表征数据
[0069]
ms(esi,pos.ion)m/z:133.20[m h]
;
[0070]1h nmr(400mhz,cd3od)δ(ppm)7.72(s,1h),7.70(s,1h),7.26(s,1h),7.24(s,1h),5.39(dt,j=51.7, 3.7hz,1h),4.52(dd,j=10.6,3.7hz,1h),3.79
–
3.71(m,1h),3.60
–
3.47(m,1h),2.85
–
2.68(m,1h),2.52
–ꢀ
2.43(m,1h),2.37(s,3h).
[0071]
实施例3 1-((4-(氯甲基)苯氧基)甲基)-3-氟苯的合成
[0072][0073]
将(4-((3-氟苄基)氧基)苯基)甲醇(2.00g,8.62mmol)和一定量的溶剂加入到100ml单口圆底烧瓶中,转移至0℃,加入一定量的氯化亚砜,加完后,转移至25℃下反应,tlc监测原料的剩余,降温至10℃,加入水(10ml),搅拌30min,抽滤,滤饼置于35℃真空干燥烘干,得到白色固体。示例1-8的实验结果如表c所示。
[0074]
表c
[0075][0076][0077]
注:“当量(eq)”是指所述物料相对于反应底物(4-((3-氟苄基)氧基)苯基)甲醇的摩尔量的倍数,例如, 1.1eq,表示所述物料的摩尔量是反应底物(4-((3-氟苄基)氧基)苯基)甲醇的摩尔量的1.1倍。“反应溶剂用量”是指多少ml/g(4-((3-氟苄基)氧基)苯基)甲醇,例如,反应溶剂用量为2ml/g,即每克(4-((3-氟苄基) 氧基)苯基)甲醇,加入反应溶剂2ml。*是指tlc监测反应杂点比较多,未进行后处理。
[0078]
示例9:
[0079]
向30l反应釜内依次投入n,n-二甲基甲酰胺(2l)和(4-((3-氟苄基)氧基)苯基)甲醇(1.00kg,4.31mol),降温至-5℃,开始加入氯化亚砜(0.56kg,4.74mol),控温30℃以下,加完后,升温至25℃反应2h, tlc监控至(4-((3-氟苄基)氧基)苯基)甲醇显色基本消失;降
温至10℃,开始加入水(5l),加完后搅拌 30min,准备抽滤瓶和布氏漏斗,过滤得到固体;真空35℃干燥至水分≤1.0%,得到白色固体(0.84kg, 77.6%)。
[0080]
表征数据:
[0081]1h nmr(400mhz,cdcl3)δ(ppm)7.39
–
7.35(m,1h),7.34(s,1h),7.32(s,1h),7.20(d,j=7.8hz,1h), 7.17(d,j=9.5hz,1h),7.03(td,j=8.4,2.0hz,1h),6.97(s,1h),6.95(s,1h),5.07(s,2h),4.58(s,2h).
[0082]
实施例4(2s,4s)-4-氟-1-(4-(((3-氟苄基)氧基)苄基)吡咯烷-2-羧酰胺的合成
[0083][0084]
依次将1-((4-(氯甲基)苯氧基)甲基)-3-氟苯(1.00g,3.99mmol)、(2s,4s)-4-氟吡咯烷-2-羧酰胺4-甲基苯磺酸盐(1.46g,4.79mmol)、一定量的碱和一定量的溶剂,加入到100ml单口圆底烧瓶中,在一定的反应温度下,反应一定的时间,tlc监测反应原料的剩余,浓缩,加n,n-二甲基甲酰胺(3ml)溶解,直至溶解完全,加入水(15ml),搅拌3h,抽滤,滤饼置于60℃鼓风干燥烘干,得到灰白色固体。示例1-15的实验结果如表d所示。
[0085]
表d
[0086]
[0087]
注:“当量(eq)”是指所述物料相对于反应底物1-((4-(氯甲基)苯氧基)甲基)-3-氟苯的摩尔量的倍数,例如,3.0eq,表示所述物料的摩尔量是反应底物1-((4-(氯甲基)苯氧基)甲基)-3-氟苯的摩尔量的3.0倍。“反应溶剂用量”是指多少ml/g 1-((4-(氯甲基)苯氧基)甲基)-3-氟苯,例如,反应溶剂用量为10ml/g,即每克 1-((4-(氯甲基)苯氧基)甲基)-3-氟苯,加入反应溶剂10ml。**是指tlc监测反应底物1-((4-(氯甲基)苯氧基) 甲基)-3-氟苯没有反应完全,未进行后处理。
[0088]
示例16:
[0089]
向30l反应釜内依次投入乙酸乙酯(10l)、(2s,4s)-4-氟吡咯烷-2-羧酰胺4-甲基苯磺酸盐(1.46kg, 4.79mol)和三乙胺(2.00l,14.37mol),升温至25℃,加入1-((4-(氯甲基)苯氧基)甲基)-3-氟苯(1.00kg, 3.99mol),加入完毕后,升温至60℃,反应16h后,tlc监控至1-((4-(氯甲基)苯氧基)甲基)-3-氟苯显色基本消失,停止反应。
[0090]
降温至45℃,减压蒸干至没有乙酸乙酯,结束减压蒸干;降温至25℃,加n,n-二甲基甲酰胺(3l) 溶解,直至溶解完全,加入水(15l),搅拌3h,过滤得到固体,固体用60℃鼓风干燥至水分≤1.0%,得到灰白色固体(1.18kg,85.3%)。
[0091]
表征数据:
[0092]
ms(esi,pos.ion)m/z:347.10[m h]
;
[0093]1h nmr(400mhz,dmso-d6)δ(ppm)7.48
–
7.40(m,1h),7.31
–
7.25(m,2h),7.21(s,1h),7.18(d,j= 2.9hz,1h),7.16
–
7.11(m,1h),6.99(s,1h),6.97(s,1h),5.20
–
5.05(m,1h),5.12(s,2h),3.82(d,j=12.8 hz,1h),3.32(d,j=12.9hz,1h),3.04
–
2.96(m,2h),2.60
–
2.36(m,2h),2.02
–
1.78(m,1h);
[0094]
13
c nmr(101mhz,dmso-d6)δ(ppm)175.4,162.7(d,j=243.6hz),157.8,140.6(d,j=7.4hz),131.0, 130.9(d,j=1.3hz),130.5,124.0(d,j=2.7hz),115.1,115.0,114.9,114.8,114.5,92.8(d,j=174.7hz),68.8, 66.1,59.3(d,j=20.9hz),58.0,37.8(d,j=22.0hz)。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
