1.本发明属于药物合成技术领域,具体涉及一种米拉贝隆关键中间体的合成方法。
背景技术:
2.米拉贝隆是用于治疗成年人的膀胱过度活动症(oab)的药物。和当前以常使用的膀胱过度活动症治疗药,比如抗胆碱能药物托特罗定和达菲那新等,这些药是通过阻断乙酰胆碱与m3受体结合,进而缓解膀胱平滑肌收缩,达到治疗oab的作用,米拉贝隆是通过激活膀胱逼尿肌中介导膀胱松驰的β3肾上腺能受体而改善膀胱储尿容量,进而缓解膀胱过度活动症的症状,而且不影响膀胱排尿功能。米拉贝隆是首先用于治疗oab的β3肾上腺素受体激动剂类治疗药物,米拉贝隆的成功上市,它填补了β肾上腺素受体激动剂这类药物在oab方面的一个空白。
3.目前r)-2-羟基-n-[[2-(4-硝基苯基)乙基]氨基]-1-苯基乙醇一盐酸盐合成路线存在以下缺陷:成本相对较高,遇水反应剧烈并放出可燃性气体,对眼睛、皮肤、呼吸系统有刺激,对操作人员和生态环境不利,混合溶剂不易回收,生产和后处理成本增加。
技术实现要素:
[0004]
本部分的目的在于概述本发明的实施例的一些方面以及简要介绍一些较佳实施例。在本部分以及本技术的说明书摘要和发明名称中可能会做些简化或省略以避免使本部分、说明书摘要和发明名称的目的模糊,而这种简化或省略不能用于限制本发明的范围。
[0005]
鉴于上述的技术缺陷,提出了本发明。
[0006]
本发明提供一种米拉贝隆关键中间体的合成方法,其由以下步骤组成,
[0007]
(1)缩合反应:以苯乙酮酸为起始物料,在缚酸剂、脱水剂存在下于有机溶剂中与对硝基苯乙胺盐酸盐反应,反应温度4~40℃,反应时间4~24h,得到产物i;其中,苯乙酮酸与对硝基苯乙胺盐酸盐的摩尔比为1~1.1:1;
[0008]
(2)酶催化反应:反应产物i在反应溶剂中,加入甲酸铵、ew1309-he酶、ew1310-hg酶,用氢氧化钠调ph到8~9,反应温度25~35℃,反应时间12~24h,加入萃取溶剂萃取得到产物ii的溶液;其中,产物i与甲酸铵的摩尔比为1~5;所述的溶剂为异丙醇、水混合溶剂,产物i:水:异丙醇的重量体积比1:(2~8):(1~5);
[0009]
(3)还原反应:在所述产物ii的溶液中,加入路易斯酸,滴加还原剂,反应温度40~70℃,反应时间12~36h,得到产物iii。
[0010]
作为本发明所述米拉贝隆关键中间体的合成方法的优选方案,步骤(1)中,苯乙酮酸与脱水剂的摩尔比为1~1.1:1,所述的脱水剂为edc.hcl。
[0011]
作为本发明所述米拉贝隆关键中间体的合成方法的优选方案,步骤(2)中,所述萃取溶剂选自二氯甲烷、氯仿中的一种。
[0012]
作为本发明所述米拉贝隆关键中间体的合成方法的优选方案,产物ii与路易斯酸的摩尔比为1:2~3,所述的路易斯酸为三氯化铝或三氯化铁中的一种;产物ii与还原剂的
摩尔比为1:2.5~3.5,所述的还原剂为四甲基二硅氧烷。
[0013]
作为本发明所述米拉贝隆关键中间体的合成方法的优选方案,步骤(1)中,反应温度为20~30℃。
[0014]
作为本发明所述米拉贝隆关键中间体的合成方法的优选方案,步骤(2)中,产物i与萃取溶剂的重量体积比1:5~10。
[0015]
作为本发明所述米拉贝隆关键中间体的合成方法的优选方案,所述步骤(3)中,产物ii与路易斯酸的摩尔比为1:2~3,所述的路易斯酸为三氯化铝或三氯化铁等中的一种。
[0016]
作为本发明所述米拉贝隆关键中间体的合成方法的优选方案,所述步骤(3)中,产物ii与还原剂的摩尔比为1:2.5~3.5,所述的还原剂为四甲基二硅氧烷。
[0017]
作为本发明所述米拉贝隆关键中间体的合成方法的优选方案,所述步骤(1)中,苯乙酮酸与有机溶剂的重量体积比1:4~10,所述的有机溶剂选自二甲基甲酰胺、二氯甲烷中的一种。
[0018]
作为本发明所述米拉贝隆关键中间体的合成方法的优选方案,所述步骤(1)中,苯乙酮酸与缚酸剂的摩尔比为1~1.1:1,所述的缚酸剂为三乙胺。
[0019]
本发明的有益效果:本发明避免了硼烷四氢呋喃、dmi的使用,减少了环境污染,降低了安全风险,降低了生产成本;选择用酶催化代替手性拆分获得手性羟基,选择性更加高,转化率更加高,成本相对更低,手性纯度相对更高。
[0020]
避免了昂贵的r-氧化苯乙烯的使用,生产成本更低,更适用于工业化。
[0021]
避免了磺酰化试剂的使用,减少环境污染,降低研制的难度,将对生产过程控制的要求,更加有利于成本控制,更加有利于工业化的生产。
[0022]
本发明避免了昂贵试剂、危险试剂、含致癌警示结构试剂的使用,采用酶催化获得手性,工艺更加环保,采用廉价、安全的路易斯酸和四甲基二硅氧烷的还原体系代替硼烷四氢呋喃进行还原反应,进一步降低了安全风险,另外反应和萃取溶剂都可以回收套用,对环境污染明显减少,三步反应之间不用分离干燥,只在最后一步分离干燥,收率上有明显提高,三步反应总收率超过87%,所得产品的纯度在99.5%以上,手性杂质在0.1%以下。
附图说明
[0023]
为了更清楚地说明本发明实施例的技术方案,下面将对实施例描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其它的附图。其中:
[0024]
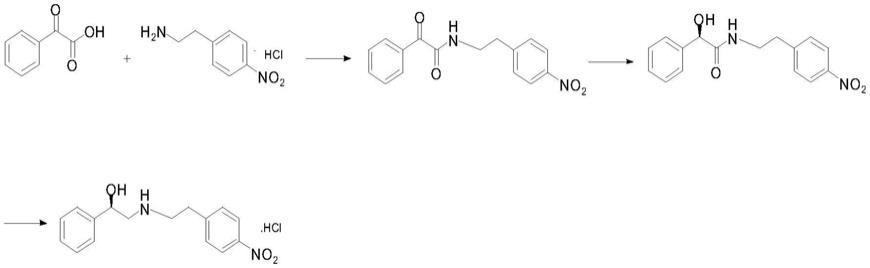
图1为本发明米拉贝隆关键中间体的合成路线图。
具体实施方式
[0025]
为使本发明的上述目的、特征和优点能够更加明显易懂,下面结合具体实施例对本发明的具体实施方式做详细的说明。
[0026]
在下面的描述中阐述了很多具体细节以便于充分理解本发明,但是本发明还可以采用其他不同于在此描述的其它方式来实施,本领域技术人员可以在不违背本发明内涵的情况下做类似推广,因此本发明不受下面公开的具体实施例的限制。
[0027]
其次,此处所称的“一个实施例”或“实施例”是指可包含于本发明至少一个实现方式中的特定特征、结构或特性。在本说明书中不同地方出现的“在一个实施例中”并非均指同一个实施例,也不是单独的或选择性的与其他实施例互相排斥的实施例。
[0028]
本发明提供米拉贝隆关键中间体r)-2-羟基-n-[[2-(4-硝基苯基)乙基]氨基]-1-苯基乙醇一盐酸盐的制备方法,该方法安全可靠,环境污染小,副产物少,产品纯度高,成本低。以苯乙酮酸为起始物料,与对硝基苯乙胺盐酸盐缩合,再用生物酶将酮还原成手性羟基,再用新型还原剂四甲基二硅氧烷脱去酰胺上的氧。
[0029]
(1)缩合反应:以苯乙酮酸为起始物料,在缚酸剂、脱水剂存在下于有机溶剂中与对硝基苯乙胺盐酸盐反应,反应温度0~40℃,反应时间4~24h,反应完全,得产物i;
[0030]
其中:
[0031]
苯乙酮酸与对硝基苯乙胺盐酸盐的摩尔比为1~1.1:1
[0032]
苯乙酮酸与脱水剂的摩尔比为1~1.1:1,所述的脱水剂为edc.hcl;
[0033]
苯乙酮酸与缚酸剂的摩尔比为1~1.1:1,所述的缚酸剂为三乙胺或其他有机胺。
[0034]
起始原料与有机溶剂的重量体积比(即,g/ml)是1:4~10,所述的有机溶剂选自二甲基甲酰胺、二氯甲烷中的一种。
[0035]
(2)酶催化反应:上述反应产物i在反应溶剂中,加入甲酸铵、ew1309-he酶、ew1310-hg酶,用氢氧化钠调ph到8~9,反应温度25~35℃,反应时间12~24h,反应完全,回收反应溶剂,加入萃取溶剂萃取得产物ii的溶液;
[0036]
其中:
[0037]
产物i与甲酸铵的摩尔比为1~5,酶的用量适量。
[0038]
产物i与反应溶剂的重量体积比(即,g/ml)是1:2~8:1~5(产物i:水:异丙醇),所述的溶剂为异丙醇、水混合溶剂。
[0039]
产物i与萃取溶剂的重量体积比(即,g/ml)是1:5~10,所述的溶剂选自二氯甲烷、氯仿等其中的一种。
[0040]
(3)还原反应:上述反应产物ii溶液中,加入路易斯酸,滴加还原剂,反应温度40~70℃,反应时间12~36h,反应完全,得产物iii;
[0041]
其中:
[0042]
产物ii与路易斯酸的摩尔比为1:2~3,所述的路易斯酸为三氯化铝或三氯化铁等中的一种。
[0043]
产物ii与还原剂的摩尔比为1:2.5~3.5,所述的还原剂为四甲基二硅氧烷。
[0044]
所述的反应产物iii经萃取、成盐、析晶得到本发明产物。
[0045]
本发明步骤(1)中在缚酸剂及脱水剂存在的情况下,苯乙酮酸与对硝基苯乙胺盐酸盐缩合反应,反应结束后,萃取,洗涤,浓缩得产物i。
[0046]
本发明步骤(2)中所述的酶催化反应,将产物i溶解,加入甲酸铵、ew1309-he酶、ew1310-hg酶,调ph到8~9,反应完成后,浓缩回收溶剂套用,加二氯甲烷或氯仿萃取,干燥,得产物ii。
[0047]
本发明步骤(3)中所述的还原反应,在产物ii的溶液中加入三氯化铝或三氯化铁,滴加四甲基二硅氧烷,升温回流反应完全,降温,过滤,洗涤,烘干,所得产品的纯度在99%以上,手性杂质在0.1%以下。
[0048]
本发明的工艺路线:
[0049][0050]
实施例1:
[0051]
缩合反应制备反应产物i:
[0052]
初始原料:苯乙酮酸,30g(约0.2mol);
[0053]
有机溶剂:本实施例选自二氯甲烷150ml;
[0054]
脱水剂:本实施例选edc.hcl(1-乙基-(3-二甲基氨基丙基)碳化二亚胺盐酸盐)36g(0.2mol);
[0055]
缚酸剂:本实施例选自三乙胺20.2g(约0.2mol);
[0056]
缩合反应过程:反应瓶中加入30g(约0.2mol)初始原料苯乙酮酸和33.4g(约0.2mol)对硝基苯乙胺盐酸盐,控温25℃,加入150ml二氯甲烷,滴加20.2g(约0.2mol)三乙胺,再加入36g(0.2mol)edc.hcl,保温反应约6小时,加入100ml水,萃取分层,二氯甲烷层再加入100ml水洗涤,分层,二氯甲烷层浓缩至干得反应产物i约57.8g(约0.194mol),收率97%,用于下步反应。
[0057]
酶催化反应制备反应产物ii:
[0058]
原料1:反应产物i 57.8g(约0.194mol);
[0059]
原料2:甲酸铵2g;
[0060]
水:232ml 232ml;
[0061]
反应溶剂:异丙醇116ml;
[0062]
萃取溶剂:二氯甲烷448ml;
[0063]
ew1309-he酶:0.08g;
[0064]
ew1310-hg酶:0.07g;
[0065]
缩合反应过程:反应瓶中加入产物i、232ml水、116ml异丙醇、2g甲酸铵,用氢氧化钠调ph至8~9,控制反应温度为30℃,加入0.08g ew1309-he酶和0.07g ew1310-hg酶,反应时间约14小时,反应完全之后,过滤,浓缩回收异丙醇,加入448ml二氯甲烷萃取,分层,232ml水洗,有机层加入干燥剂无水硫酸镁干燥,过滤得到反应产物ii(约0.186mol)的溶液,收率95.8%,用于下步反应。
[0066]
还原反应制备本发明产物r)-2-羟基-n-[[2-(4-硝基苯基)乙基]氨基]-1-苯基乙醇一盐酸盐:
[0067]
原料:反应产物ii的二氯甲烷溶液(约0.186mol);
[0068]
路易斯酸:三氯化铝62g(0.465mol);
[0069]
洗涤剂:二氯甲烷100ml;
[0070]
还原剂:四甲基二硅氧烷70g(0.52mol);
[0071]
还原反应过程:反应瓶中加入产物ii的二氯甲烷溶液,加入62g三氯化铝,滴加70g四甲基二硅氧烷,升温至40℃保温反应16h,降温至25℃,滴加22g盐酸,保温1小时,过滤,100ml二氯甲烷洗涤,烘干,得到产品57g,产品纯度达到99.5%以上,手性杂质≤0.1%,该步收率为94.6%。
[0072]
对照例1:
[0073]
缩合反应制备反应产物i:
[0074]
缩合反应过程:反应瓶中加入30g(约0.2mol)初始原料苯乙酮酸和33.4g(约0.2mol)对硝基苯乙胺盐酸盐,控温25℃,加入150ml二氯甲烷,滴加20.2g(约0.2mol)三乙胺,再加入25.2g(0.2mol)dic(二异丙基碳二亚胺),保温反应约6小时,加入100ml水,萃取分层,二氯甲烷层再加入100ml水洗涤,分层,二氯甲烷层浓缩至干得反应产物i约47.7g(约0.16mol),收率80%。
[0075]
对照例2:
[0076]
缩合反应制备反应产物i:
[0077]
缩合反应过程:反应瓶中加入30g(约0.2mol)初始原料苯乙酮酸和33.4g(约0.2mol)对硝基苯乙胺盐酸盐,控温25℃,加入150ml乙酸乙酯,滴加20.2g(约0.2mol)三乙胺,再加入36g(0.2mol)edc.hcl,保温反应约6小时,加入100ml水,萃取分层,乙酸乙酯层再加入100ml水洗涤,分层,乙酸乙酯层浓缩至干得反应产物i约50.6g(约0.17mol),收率85%。
[0078]
对照例3:
[0079]
酶催化反应制备反应产物ii:
[0080]
缩合反应过程:反应瓶中加入产物i 0.2mol、232ml水、150ml甲醇、2g甲酸铵,用氢氧化钠调ph至8~9,控制反应温度为30℃,加入0.08g ew1309-he酶和0.07g ew1310-hg酶,反应时间约14小时,反应完全之后,过滤,浓缩,加入448ml二氯甲烷萃取,分层,232ml水洗,有机层加入干燥剂无水硫酸镁干燥,浓缩,得到反应产物ii(约0.15mol),收率75%,用于下步反应。
[0081]
对照例4:
[0082]
还原反应制备本发明产物r)-2-羟基-n-[[2-(4-硝基苯基)乙基]氨基]-1-苯基乙醇一盐酸盐:
[0083]
还原反应过程:反应瓶中加入产物ii的二氯甲烷溶液0.186mol,加入62g三氯化铝,滴加70g四甲基二硅氧烷,升温至20℃保温反应16h,滴加22g盐酸,保温1小时,过滤,100ml二氯甲烷洗涤,烘干,得到产品40g,产品纯度96%,手性杂质≤0.1%,该步收率为66.4%。
[0084]
对照例5:
[0085]
还原反应制备本发明产物r)-2-羟基-n-[[2-(4-硝基苯基)乙基]氨基]-1-苯基乙醇一盐酸盐:
[0086]
还原反应过程:反应瓶中加入产物ii的二氯甲烷溶液0.186mol,加入62g三氯化铝,滴加35g四甲基二硅氧烷,升温至40℃保温反应16h,滴加22g盐酸,保温1小时,过滤,100ml二氯甲烷洗涤,烘干,得到产品45g,产品纯度达到96.5%,手性杂质≤0.1%,该步收
率为74.7%。
[0087]
本发明避免了硼烷四氢呋喃、dmi的使用,减少了环境污染,降低了安全风险,降低了生产成本;选择用酶催化代替手性拆分获得手性羟基,选择性更加高,转化率更加高,成本相对更低,手性纯度相对更高。避免了昂贵的r-氧化苯乙烯的使用,生产成本更低,更适用于工业化。避免了磺酰化试剂的使用,减少环境污染,降低研制的难度,将对生产过程控制的要求,更加有利于成本控制,更加有利于工业化的生产。本发明避免了昂贵试剂、危险试剂、含致癌警示结构试剂的使用,采用酶催化获得手性,工艺更加环保,采用廉价、安全的路易斯酸和四甲基二硅氧烷的还原体系代替硼烷四氢呋喃进行还原反应,进一步降低了安全风险,另外反应和萃取溶剂都可以回收套用,对环境污染明显减少,三步反应之间不用分离干燥,只在最后一步分离干燥,收率上有明显提高,三步反应总收率超过87%,所得产品的纯度在99.5%以上,手性杂质在0.1%以下。
[0088]
应说明的是,以上实施例仅用以说明本发明的技术方案而非限制,尽管参照较佳实施例对本发明进行了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的精神和范围,其均应涵盖在本发明的权利要求范围当中。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。