1.本发明涉及微藻养殖技术领域,尤其涉及一种耐高温高光的四爿藻的筛选。
背景技术:
2.微藻是一类在水体中分布广泛,营养丰富、光合利用度高的自养植物,能够通过其高效的光合作用,利用光能,吸收co2和h2o,将它们转化为碳水化合物、蛋白质、脂肪等有机物,并释放出o2。细胞代谢产生多糖、蛋白质、油脂、色素等,使其在医药工业、食品工业、生物饵料等领域均具有广阔的开发前景。
3.微藻本身为纯天然绿色生物性饵料,其必需氨基酸含量高,并且富含多不饱和脂肪酸。微藻营养丰富且易被鱼虾吸收消化,用微藻生物饵料取代传统饵料科学养殖鱼虾,可以有效减少病虫害,提高存活率,降低药成本,养殖户的经济效益可以得到显著提升。微藻作为生物饵料的培养利用比较广泛,能够进行人工大量培养的微藻饵料有小球藻、扁藻、角毛藻等。
4.目前,国内绝大部分水产育苗企业都是自备微藻养殖设施自行生产各类微藻饵料,缺乏既定标准,造成微藻浓度低、饵料效价低。因此,微藻养殖的一大目标是培育高浓度的微藻饵料以满足育苗需求。
5.南方沿海地区的微藻养殖更为困难。因南方地区夏天的温度远远高于微藻的适宜生长温度,微藻不能在这类环境下快速增长,这大大限制了微藻的产业化生产。所以,有必要筛选出新的耐热的微藻株,以用于南方等地高温天气下的水产养殖。
技术实现要素:
6.有鉴于此,本发明要解决的技术问题在于提供一种耐高温高光的四爿藻。本发明提供了一种耐高温高光的四爿藻及其培养方法。
7.本发明提供了保藏编号为cctcc no:m2021121的四爿藻。
8.本发明中,所述的四爿藻的培养方法的步骤如下:保藏编号为cctcc no:m2021121的四爿藻接种于液体培养基,15℃~35℃,光照50μe
·
m-2
·
s-1
~200μe
·
m-2
·
s-1
,进行培养。
9.本发明中,所述接种方式为将藻液接种于液体培养基。所述接种至初始od
750
为0.5。作为优选,所述藻液为生长对数期的藻液。
10.本发明中,所述液体培养基为f/2液体培养基。
11.一些实施例中,f/2培养基可以设置不同的盐浓度。
12.本发明提供的四爿藻mew-a-176的最适培养条件,温度为35℃,光强为200μe
·
m-2
·
s-1
。
13.本发明中,所述培养的光照的时长为24小时/天。
14.本发明测定了高温高光环境下所述的四爿藻的蛋白含量、总碳水化合物含量、淀粉含量、油脂含量和叶绿素含量等生理指标。结果表明,本发明提供的四爿藻mew-a-176在
高温高光环境下培养,它的蛋白占藻体干重48.156%(包括丰富的必须氨基酸)、碳水化合物占藻体干重24.57%、淀粉占藻体干重17.109%、油脂占藻体干重12.499%,多不饱和脂肪酸占总脂肪酸的62.3%,营养丰富。本发明提供的四爿藻含有丰富的营养物质,适合作为水产饲料的原料。
15.本发明提供了四爿藻在制备水产饲料中的应用。一些实施例中,所述水产饲料为鱼或虾的饲料。
16.本发明还提供了一种水产饲料,其包括本发明所述的四爿藻。
17.本发明还提供了一种水产养殖方法,其包括给予本发明所述的水产饲料。
18.本发明筛选得到一种四爿藻,编号为cctcc no:m20211216,该藻株在35℃高温下培养的od750可达3.0以上,且该藻株在200μe
·
m-2
·
s-1
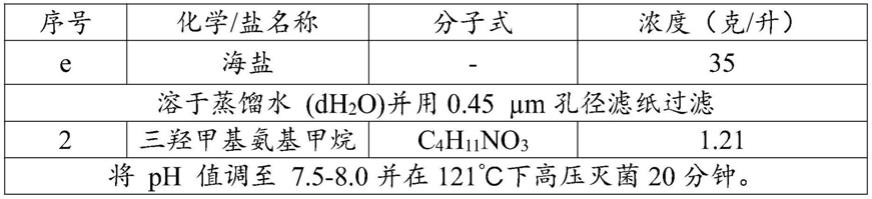
光照条件下比在50μe
·
m-2
·
s-1
光照条件长势好。高温高光培养条件下,该藻株密度高,其干重中含蛋白48.156%(包括丰富的非必须氨基酸)、碳水化合物24.57%、淀粉17.109%、油脂12.499%,其中多不饱和脂肪酸占总脂肪酸的62.3%。该藻株营养丰富,适宜作为鱼虾的饵料。
19.生物保藏说明
20.四片藻mew-a-176tetraselmis sp.mew-a-176,于2021年09月26日保藏在中国典型培养物保藏中心,地址为:中国.武汉.武汉大学,保藏编号为cctcc no:m 20211216。
21.注:本发明提供的四爿藻mew-a-176在保藏时用名为四片藻mew-a-176。
附图说明
22.图1示四爿藻mew-a-176在不同温度条件下的生长情况;
23.图2示四爿藻mew-a-176在不同光照条件下的生长情况;
24.图3示四爿藻mew-a-176在不同盐浓度条件下的生长情况;
25.图4示蛋白浓度测定标准曲线图;
26.图5示碳水化合物浓度测定标准曲线图;
27.图6示淀粉浓度测定标准曲线图;
28.图7示藻种的色素含量;
29.图8示藻种在高温高光条件下所测定的部分生理指标;
30.图9示在光学显微镜下所观察到的藻细胞图片;
31.图10示藻种的脂肪酸测定的饼状统计图。
具体实施方式
32.本发明提供了特异性菌株及其应用,本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本发明内容、精神和范围内对本文的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。
33.本发明采用的试材皆为普通市售品,皆可于市场购得。下面结合实施例,进一步阐述本发明:
34.实施例1藻株的分离鉴定
35.(1)藻株的分离培养
36.采集土壤和水样。样品到达实验室后,将石头、鹅卵石和稻草移走清洗样品,样品置于4℃待用。将土壤样品彻底混合,将具有代表性的10~15g土壤或10ml均匀混合的水样加入装有100ml的f/2培养基的烧瓶中。
37.将烧瓶置于25℃恒温环境,给予强度为100μe
·
m-2
·
s-1
,每天16小时的光照,直到培养基的颜色变为绿色或棕色,说明有藻类生长,获得藻悬液。
38.在f/2琼脂平板上散布藻悬液,数天后,观察到近似均匀的混合微藻与真菌污染。选取生长速度快的微藻菌株,通过反复扩散和划线板法进行纯化。
39.挑选纯化的微藻株进行液体培养基培养,每隔24小时用750nm的波长测定od值。
40.(2)藻类f/2培养基的配置
41.藻株的分离培养过程中所用到的f/2藻类培养基的配置过程如步骤i、步骤ii和步骤iii所示。
42.步骤i、配置海盐溶液和三羟甲基氨基甲烷溶液,溶液配置详细过程和配方如表1海盐溶液和三羟甲基氨基甲烷溶液表所示。
43.表1海盐溶液和三羟甲基氨基甲烷溶液表
[0044][0045]
步骤ii、配制母液,母液配置详细过程和配方如表2f/2培养基母液成分表所示。配置好以后,121℃加热灭菌15分钟,加入步骤i制备的溶液中。
[0046]
表2 f/2培养基母液成分表
[0047][0048]
步骤iii、配置微量元素溶液,配置的详细过程和配方如表3微量元素溶液配置表所示。
[0049]
表3微量元素溶液配置表
[0050]
[0051][0052]
(3)藻株的鉴定
[0053]
分别将上述藻种培养至对数生长期,收集藻体,并提取其基因组dna,然后用its rrna基因的通用引物its1(5
’‑
tccgtaggtgaacctgcgg-3’)和its(5
’‑
tcctccgcttattgatatgc-3’)进行pcr,扩增its序列。pc r鉴定藻株的具体步骤如下:
[0054]
a.取海藻培养液于6000r/min离心5分钟,丢弃上清液,加入无菌去离子水(dh2o)清洗海藻细胞。重复三次,去除残留的盐分。
[0055]
b.提取海藻细胞的基因组dna。
[0056]
c.以海藻细胞的基因组dna模板,its rrna基因的通用引物为引物,设置合适的pcr程序,扩增its序列并测序比对。
[0057]
所述的用于扩增its序列的pcr体系如表4所示,所述的pcr程序设置如表5所示。
[0058]
表4 pcr体系表
[0059]
原料体积(μl)ddh2o13.210
×
buffer2dntp(2.5mm each)1.6forward primer(10μmol/l)1reverse primer(10μmol/l)1template(10μmol/l)1easy-taq polymerase(2.5u/μl)0.2
[0060]
表5 pcr程序表
[0061][0062]
鉴定的序列如seq id no:1所示,比对结果显示本发明筛选的藻株属于四爿藻(tetraselmis sp),将其命名为mew-a-176。该菌株保藏在中国典型培养物保藏中心,保藏时用名为:四片藻mew-a-176tetraselmis sp.mew-a-176。
[0063]
实施例2四爿藻tetraselmis sp(mew-a-176)耐受性试验:
[0064]
(1)不同温度对藻种生长的影响
[0065]
将藻液接种于f/2培养基中,初始od
750nm
值为0.5,分别设置15℃、25℃、28℃、35℃
的培养温度,给予50μe
·
m-2
·
s-1
、24小时/天的光照进行培养,并且于培养的第2天、第4天、第6天、第8天分别测定各组藻液的od
750nm
值。
[0066]
结果如图1所示,在四种温度条件下,四爿藻tetraselmis sp(mew-a-176)的od
750nm
值均随着时间逐步增加,且在28℃~35℃的温度范围内,温度越高,四爿藻tetraselmis sp(mew-a-176)的od
750nm
值越大,最高值出现在35℃的条件下。
[0067]
(2)不同光照对藻种生长的影响
[0068]
将藻液接种于f/2培养基中,初始od
750nm
值为0.5,设置温度为25℃,分别给予50μe
·
m-2
·
s-1
和200μe
·
m-2
·
s-1
强度的、24小时/天的光照,进行培养,并于培养的第2天、第4天、第6天、第8天分别测定各组藻液的od
750nm
。
[0069]
结果如图2所示,随着时间的增加,四爿藻tetraselmis sp(mew-a-176)在两种条件下的藻体密度均表现出上升趋势,并且该藻在200μe
·
m-2
·
s-1
培养条件下的浓度比在50μe
·
m-2
·
s-1
条件下高。
[0070]
(3)不同盐度对藻种生长的影响
[0071]
将藻液接种于f/2液体培养基中,初始od
750nm
值为0.3。f/2液体培养基的盐浓度依次为18g/l、35g/l、70g/l、105g/l,设置温度为25℃、给予50μe
·
m-2
·
s-1
、24小时/天的光照,分别于培养的第2天、第4天、第6天、第8天测定各组的od
750nm
。
[0072]
结果如图3所示,四爿藻tetraselmis sp(mew-a-176)在四种盐浓度条件下的藻体密度都呈上升趋势,且在35g/l盐浓度条件下的生长速率最大。
[0073]
实施例3四爿藻tetraselmissp(mew-a-176)生理指标测试试验
[0074]
藻类细胞中含有丰富的营养成分,包括蛋白质、碳水化合物、脂质等。蛋白质是组成细胞的重要成分和功能分子,很多的生理功能包括细胞生存都需要通过蛋白质来实现。碳水化合物是生命细胞结构的主要成分及主要供能物质,有调节细胞活动的功能。淀粉是植物中糖的主要存储形式,其含量测定对于评价食品营养价值和植物体内糖代谢都有重要意义。脂类是生物体最主要的能量储备形式,微藻的脂类主要分为两大类:中性脂和极性脂,其中中性脂主要由甘油三酯、固醇脂类、游离脂肪酸组成,而极性脂主要由磷脂和糖脂组成。微藻的总脂含量为7%—20%,其中磷脂占总脂的40%—70%,磷脂对于鱼虾蟹幼体的生长发育具有重要的作用。微藻不但富含磷脂,而且富含动物所需要的多不饱和脂肪酸,因此微藻对鱼虾蟹幼体营养价值高,测定微藻的油脂含量和不饱和脂肪酸的含量对于评估微藻在水产养殖中的应用有重要意义。此外,微藻的油脂作为重要的生物能源原料,有巨大的生物质生产潜力,可用于制生物柴油。叶绿素是植物进行光合作用的主要色素,它在光合作用的光吸收中起核心作用,是植物进行光合作用的必要条件。
[0075]
综上所述,为了评估本发明所筛选的四片藻tetraselmis sp(mew-a-176)的营养价值和应用价值,需要测定该藻株的蛋白质、糖类、淀粉、油脂、不饱和脂肪酸、必需氨基酸以及色素的含量,这对于评估微藻在水产养殖中的应用有重要意义。
[0076]
(1)测定四爿藻tetraselmis sp(mew-a-176)的蛋白质占干重百分比。
[0077]
利用蛋白质与考马斯亮蓝g250结合时在595nm处的显色反应,先测定标准浓度的蛋白的od
595nm
值,制作蛋白浓度与od
595nm
的标准曲线,然后测定藻粉溶液的od
595nm
,计算藻粉的蛋白质含量。详细步骤如下:
[0078]
a.从藻粉中提取蛋白溶液。设置3个平行组,每组称取10mg藻粉样品,加入100ul的
1m的naoh溶液,振荡混匀后置于80℃水浴10min,然后置于冰上并加入0.9ml水,16000g离心10min,收集上清液。重复提取三次并混合上清液,再用0.1m的naoh溶液稀释蛋白溶液至合适浓度。
[0079]
b.配置标准浓度的蛋白液:设置2个平行组,每组称取3mg的蛋白标品,重复步骤a以配置蛋白溶液。然后如表6所示,用0.1m的naoh溶液稀释蛋白溶液至0.35mg/ml、0.3mg/ml、0.25mg/ml、0.2mg/ml、0.15mg/ml、0.1mg/ml、0.05mg/ml、0mg/ml;
[0080]
c.测定蛋白和考马斯亮蓝结合的od
595nm
值:取蛋白标准溶液或者藻粉提取液100ul,各加入1ml的bradford工作液,颠倒混匀后于室温下反应10min,然后依次用分光光度计测定od
595nm
值;
[0081]
d.绘制标准曲线并计算藻粉提取液的蛋白含量:以蛋白标准溶液的od
595nm
值为纵坐标,以对应的蛋白质浓度为横坐标,绘制标准曲线;根据藻粉提取液的od
595nm
值在标准曲线上找到对应的蛋白质浓度,计算藻粉提取液的蛋白含量。测得蛋白质占藻粉干重的百分比平均值为48.156%。
[0082]
表6 bradford法测定标准蛋白的浓度表
[0083]
标品梯度母液0.1m naoh(ml)终浓度(mg/ml)l10.7ml1.30.35l20.6ml1.40.3l31.5ml的l20.30.25l41.2ml的l30.30.2l50.9ml的l40.30.15l60.6ml的l50.30.1l70.4ml的l60.40.05l80.1.00.0
[0084]
(2)测定四爿藻tetraselmis sp(mew-a-176)的碳水化合物占干重的百分比。
[0085]
测定多糖浓度的原理是:多糖在硫酸的作用下先水解成单糖,并迅速脱水生成糖醛衍生物,然后与苯酚生成橙黄色化合物,在490nm处具有吸光值。详细步骤如下:
[0086]
a.配制标品。在烧杯中称取用50ml的水溶解300mg的d-葡萄糖,溶解后转至容量瓶定容至100ml,得到3mg/ml的葡萄糖母液。然后如表7所示梯度稀释葡萄糖母液至1.5mg/ml、1.0mg/ml、0.5mg/ml、0.2mg/ml、0.1mg/ml浓度。吸取100μl葡萄糖标样到对应编号的15ml离心管中。
[0087]
表7糖标品梯度稀释表
[0088]
[0089][0090]
b.水解藻粉。设置3个平行实验组,称取10mg藻粉于15ml离心管,加入0.5ml的冰乙酸,震荡混匀后于85℃水浴20min,然后加入10ml的丙酮震荡混匀。1000g离心10min,去上清(不要晃动藻粉),沉淀中加入2.5ml 4m的三氟乙酸并震荡混匀,然后沸水浴4小时水解样品,期间每隔1小时取出来震荡混匀一次。结束后,取出样品,放在冰上冷却。取200μl上述水解液于1.5ml离心管中,加入800μl蒸馏水混合均匀,12000g离心5min,吸取100μl上清到对应编号的15ml的离心管中,置于冰上。
[0091]
c.显色。显色液的配方是:15ml h2so4、7.5ml h2o、0.15g苯酚,现用现配。将硫酸加入水中,冷却至室温后加入苯酚,确保苯酚完全溶解后将显色液放置于冰上待用。分别向样品和标品中加入4.5ml的显色液,震荡混匀,置于100℃水浴20min,冷却至室温,水溶液为空白对照组,用10mm 2ml的比色皿装3ml样品,测490nm处的吸光度。
[0092]
d.绘制标准曲线并计算藻粉的碳水化合物的含量。通过总碳水化合物浓度测定的方法,测定出四爿藻tetraselmis sp(mew-a-176)提取液中总碳水化合物的od
490nm
值,再根据标准曲线得出所对应的浓度。然后结合藻粉对应的藻液的体积,得出相应的总碳水化合物的质量,再与藻粉的质量经行比值得出四爿藻tetraselmis sp(mew-a-176)的总碳水化合物含量所占藻粉干重的百分比。该实验设置3个平行组测定总碳水化合物含量所占藻粉干重的百分比,三次平均值为24.57%。
[0093]
(3)测定四爿藻tetraselmis sp(mew-a-176)的淀粉占干重的百分比。
[0094]
本实验使用南京建成生物工程研究所的植物淀粉试剂盒测试淀粉浓度,其原理是:用80%的乙醇把样品中的可溶性糖与淀粉分开,然后用酸水解法将淀粉分解为葡萄糖,再用蒽酮比色法对葡萄糖含量进行定量,从而计算出相关淀粉的含量,详细步骤如下:
[0095]
a.样本的前处理。称取0.01g~0.02g干藻粉,加1ml的淀粉试剂盒中的试剂1,加入0.05g玻璃珠,机械均浆破碎2分钟,80水浴20分钟,4000转/分钟的速度离心5分钟,去除上清留下沉淀。往上述的沉淀中加入0.5ml蒸馏水,95℃糊化15分钟,冷却静置,加入0.35ml的淀粉试剂盒中的试剂2,于95℃糊化10分钟,期间每5分钟拿出混匀一次。完成后加入0.85ml蒸馏水,震荡混匀充分,4000转/分钟的速度离心10分钟,取上清液待测(通常需要稀释10倍、100倍)。
[0096]
b.淀粉标准品前处理。如表8所示,将0.5mg/ml的标准液用蒸馏水稀释成s1(0.00625mg/ml)、s2(0.0125mg/ml)、s3(0.025mg/ml)、s4(0.05mg/ml)、s5(0.1mg/ml)。
[0097]
表8淀粉标准品制备
[0098][0099]
c.绘制标准曲线并计算藻粉中淀粉的含量。用淀粉试剂盒测试淀粉标准品四爿藻tetraselmis sp(mew-a-176)提取物的相应od值,根据淀粉标准品的浓度和od值制备标准曲线,然后根据四片藻提取物的od值在标准曲线上读取对应的浓度,结合藻液的体积,得出相应的淀粉的质量,再与藻粉的质量进行比值,得到四爿藻tetraselmis sp(mew-a-176)的淀粉占藻粉干重的百分比。实验设置三个平行,该藻株中淀粉占藻粉干重的百分比的三次平均值为17.107%。
[0100]
(4)测定四爿藻tetraselmis sp(mew-a-176)的油脂占干重的百分比。
[0101]
测定四爿藻藻粉的油脂含量的原理是:将试样分散于氯仿-甲醇混合液中,在水浴中轻微沸腾,氯仿-甲醇及样品中一定的水分形成提取脂类的溶剂,在使样品中组织中结合态脂类游离出来的同时与磷脂等极性脂类的亲和性增大,从而有效地提取出脂类,详细操作步骤如下:
[0102]
称取30mg干藻粉于ep管中,加入50mg玻璃珠和0.5ml氯仿,震荡混匀2分钟,加入3.5ml氯仿和2ml甲醇,将ep管中的藻体冲进15ml的玻璃离心管中,摇床中震荡,200rpm,12~16小时。向15ml的玻璃离心管中加入3.6ml,50mm的ph7.4的磷酸缓冲液,以2500rpm转速离心5分钟。称量一个新的15ml的玻璃离心管的质量记为w0,取下层氯仿层至该离心管中并置于氮吹仪中吹20~30分钟后置于60℃真空烘箱中干燥3h,称重记为wt,则总油的质量为wt-w0,除以干藻粉的质量即得四爿藻tetraselmis sp(mew-a-176)的油脂占干重的百分比。本实验设置三个平行组,最后得出结论:总油占藻粉干重的百分比三次的平均值为12.499%。
[0103]
(5)测定四爿藻tetraselmis sp(mew-a-176)的不饱和脂肪酸占总脂肪酸的百分比。
[0104]
测定脂肪酸含量的原理为:气相色谱法,即在色谱柱中装入担体及固定液,用载气把欲分析的混合物带入色谱柱,在一定的温度与压力条件下,各气体组分在载气和固定液薄膜的气液两相相中的分配系数不同。随着载气的向前流动,样品各组分在气、液两相中反复分配,使脂肪酸的各组分的移动速度产生差异,从而分离,然后分别测定各组分的含量。脂肪酸含量的测定具体步骤如下:
[0105]
称取10mg干藻粉放入已预冷的研钵中,加入液氮研磨(重复3次)。加入6ml甲醇氯仿甲酸提取液(体积比v
甲醇
:v
氯仿
:v
甲酸
=20:10:1),振动10min,加入3ml磷酸钾氯化钾溶液(0.2m h3po4,1m kcl),振动2min,以1000rpm的转速离心10min,待溶液分层,用吸管吸底层氯仿溶液到2ml安捷伦小玻璃管(序号5182-0716)中,氮气吹干。按照24μl.mg-1
的浓度比例用氯仿甲醇溶液(体积比v
氯仿
:v
甲醇
=1:1)复溶吹干的样品,得到样品溶液。然后在新的2ml安
捷伦棕色小玻璃管中依次加入10μl的样品溶液、200μl的氯仿甲醇溶液(体积比v
氯仿
:v
甲醇
=2:1)、300μl的盐酸甲醇溶液(5%体积盐酸,95%体积甲醇)、25μl的碳十三酸溶液(c13:0,10mg.ml-1
的母液稀释至200ppm),在85℃的金属浴中进行1小时甲酯化反应。待甲酯化反应完冷却到常温,加入1ml正己烷溶液摇匀,静止1小时。在安捷伦小管中插入内插管,依次加入5μl碳十五烷c15溶液(10mg.ml-1
稀释至200ppm)、200μl的正己烷溶液,最后置于气相色谱质谱联用测定各脂肪酸的含量。
[0106]
表9藻株脂肪酸含量测定表
[0107][0108][0109]
测定的结果如表9所示,根据测试结果计算每一种脂肪酸的含量百分比,统计结果如图10所示,饱和脂肪酸占总脂肪酸的37.7%,多不饱和脂肪酸占总脂肪酸的62.3%,该藻株含不饱和脂肪酸的比例较高。
[0110]
(6)测定四爿藻tetraselmis sp(mew-a-176)的氨基酸含量
[0111]
本实验以hplc-ms/ms方法,检测四爿藻mew-a-176的样品中水解氨基酸组分含量。
[0112]
①
试剂、耗材与标准品
[0113]
1、17种氨基酸混标标准品(sigma-aldrich)
[0114]
2、色谱级乙腈(购自德国默克)
[0115]
3、醋酸钠、三乙胺等试剂为分析纯
[0116]
②
仪器设备
[0117]
tg-16g台式高速离心机(湖南凯达科学仪器有限公司)
[0118]
1、fa1204电子天平(上海衡际科学仪器有限公司)
[0119]
2、安捷伦1260液相色谱串联ab4000质谱仪
[0120]
3、ps40a超声清洗仪(深华泰科学仪器有限公司)
[0121]
4、水浴氮吹仪(上海那艾仪器有限公司)
[0122]
③
提取步骤
[0123]
氨基酸提取
[0124]
1、将样品研磨粉碎,准确称量约粉碎后的样品于试管中;
[0125]
2、加入6m的hcl的5ml,密封,110℃水解24h;
[0126]
3、将水解后液体转移至15ml离心管,4℃,12000g离心5min;
[0127]
4、取上清液,调节ph至中性,以水定容至10ml;
[0128]
5、混匀,取1ml上清液,以水定容至100ml。
[0129]
6、混匀,取1ml上清液,过0.22μm有机相滤膜,放入-20℃冰箱待上机检测。
[0130]
④
色谱条件
[0131]
1、色谱柱:information-hilicz(2.7um,3.0*100);
[0132]
2、柱温:35℃;
[0133]
3、流动相:a:75%乙腈水;b:0.1mol/l醋酸钠
[0134]
4、流速:0.3ml/min
[0135]
5、进样体积:1μl
[0136]
⑤
实验结果。藻株干重中各氨基酸含量的测定结果如表10所示,dw代表干重的含义。
[0137]
表10藻株各氨基酸含量测定表
[0138]
amino acidsmew-176(mg.g-1
,dw)phe苯丙氨酸7.381leu亮氨酸15.472ile异亮氨酸8.442met甲硫氨酸0.182val缬氨酸0.018thr苏氨酸3.113his组氨酸2.956lys赖氨酸8.613cys半胱氨酸0.238arg精氨酸9.38tyr酪氨酸13.541pro脯氨酸33.591ala丙氨酸4.566gly甘氨酸8.629ser丝氨酸6.201glu谷氨酸18.172asp天冬氨酸13.624teaas46.177taas200.296
[0139]
⑥
结果分析
[0140]
如表10所示,在四爿藻mew-a-176的氨基酸分析中,含量最多的是脯氨酸pro,含量达到33.591mg.g-1dw,占总氨基酸含量的16.77%;含量较多的氨基酸有谷氨酸glu、亮氨酸leu、天冬氨酸asp、酪氨酸tyr、精氨酸arg、甘氨酸gly、赖氨酸lys、异亮氨酸ile和苯丙氨酸phe。其中,谷氨酸glu含量为18.172mg.g-1dw,占总氨基酸含量的9.07%;亮氨酸leu含量为15.472mg*g-1dw,占总氨基酸含量的7.72%;天冬氨酸asp含量为13.624m.g-1dw,占总氨基酸含量的6.80%,酪氨酸tyr含量为13.541mg.g-1dw,占总氨基酸含量的6.76%。必需氨基酸指动物体内不能合成或合成速度远不能适应机体需要,必须由食物蛋白质供给的氨基酸,对人而言,必需氨基酸有九种,即:赖氨酸、色氨酸、苯丙氨酸、甲硫氨酸、苏氨酸、异亮氨
酸、亮氨酸、缬氨酸、组氨酸。动物种类不同,所需的必需氨基酸也不同,鱼类的必需氨基酸与人类略有不同,它有10种,除了包括和人一样的赖氨酸、色氨酸、苯丙氨酸、苏氨酸、异亮氨酸、亮氨酸、组氨酸、缬氨酸8种氨基酸,还包括蛋氨酸和精氨酸,但是不包括甲硫氨酸。mew-a176藻株中:必需氨基酸的含量为46.177(mg.g-1
,dw),占该藻株总氨基酸含量的23.054%,在所有必需氨基酸中,亮氨酸leu的含量最高,占总必需氨基酸的33.505%,异亮氨酸ile和赖氨酸lys的含量也较高,分别为8.442mg.g-1dw和8.613mg.g-1dw。本发明提供的mew-a176藻株含有丰富的人和鱼的必需氨基酸。
[0141]
(7)测定四爿藻tetraselmis sp(mew-a-176)的色素含量
[0142]
测定色素含量的原理为:根据叶绿体色素提取液对可见光谱的吸收,利用分光光度计在某一特定波长下测定其吸光度,再用公式计算出色素的含量。
[0143]
详细步骤如下:
[0144]
取1ml藻液以12000rpm转速离心10分钟,去除上清液并加入50mg玻璃珠,机器破碎2分钟。随后加入1m甲醇,并于60℃水浴30分钟,混匀后以最高转速离心10分钟。取上清液,于分光光度计中测定440nm、644nm、662nm、665nm、750nm处的吸光值,分别记作a
440
、a
662
、a
665
、a
750
。最后依据以下公式计算色素的含量(mg/l):
[0145]
chl a=13.9
×
(a
665-a
750
)
[0146]
chl b=21.43
×a644-4.65
×a662
[0147]
car=4.7
×a440-(1.38
×a662
5.48
×a644
)
[0148]
本实验设置了三个平行组,测得四爿藻tetraselmis sp(mew-a-176)的色素含量分别为:chl a=16.207mg/l、chl b=5.777mg/l、car=8.838mg/l。
[0149]
(8)测定四爿藻tetraselmis sp(mew-a-176)高光高温条件下第八天的干重。
[0150]
0.45微米的玻璃纤维滤纸在120℃的烘箱中提前干燥过夜,并取出称重记为w0;藻株在200μe
·
m-2
·
s-1
光照条件和35℃高温下培养第八天收藻,取10ml藻液进行过滤并用20ml的纯水洗涤;过滤后的滤纸再次放入到120℃的烘箱中干燥24小时;取出称重记为wt。藻株mew-176的干重即为wt-w0(g/l)。本实验设置了三个平行组,测得四爿藻tetraselmis sp(mew-a-176)的干重含量为3.1207g/l。
[0151]
以上仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
