胰腺内分泌祖细胞及其用途
1.相关申请的交叉引用
2.本技术要求2019年9月17日提交的国际专利申请号pct/cn2019/106093 的优先权和权益,其全部公开内容通过引用并入本文。
背景技术:
3.胰腺由三个主要细胞成分组成:内分泌胰岛、外分泌腺泡和导管。 langerhans胰岛的胰腺β细胞是唯一在人类以及几乎所有其他脊椎动物中产生胰岛素的细胞。在小鼠中,胰岛被形成球形结构,其中β细胞形成一个核心,由α细胞、δ细胞和胰多肽(pp)细胞组成。这些细胞分别产生胰岛素、胰高血糖素、生长抑素和胰多肽(pp;ppy)(pan和wright,2011)。β细胞的再生能力有限,这是糖尿病发展的一个易感因素(hardikar,2016)。
4.细胞疗法被认为是传统糖尿病治疗方法的潜在替代疗法。胰岛和全胰腺移植可以通过补充β细胞来恢复葡萄糖稳态(lysy等,2013)。由于可用供体受限,人们试图寻找在体外生成β细胞的策略。除了使用基于胚胎干细胞(es)/诱导多能干细胞(ipsc)的技术来产生可移植的β细胞(cheng等,2012;pagliuca 等,2014;rezania等,2014;sneddon等,2012),直接来源于感兴趣组织的类器官也已被研究。然而,迄今为止已证明难以从胚胎或成人胰腺培养中产生新的β细胞,而密切相关的肠道分泌细胞很容易在此类类器官中产生(gehart等, 2019)。
5.以三维(3d)培养的小鼠胚胎胰腺祖细胞在体外反映外分泌和内分泌细胞分化,但不支持胰腺细胞的长期扩增(greggio等,2013;sugiyama等,2013)。使用成人导管(bonner-weir等,2000;gao等,2005;huch等,2013;jin等, 2013;ramiya等,2000;rovira等,2010;yatoh等,2007)、腺泡(minami等, 2005)和低胰岛素(seaberg等,2004;smukler等,2011)细胞的组织培养策略对扩增和分化推定的祖细胞成为β样细胞仅略微有效。
6.因此,需要用于体外生产和长期扩增β细胞的方法和组合物。
技术实现要素:
7.本发明在一个方面提供一种体外产生胰腺类器官的方法,所述方法包括:提供内分泌祖细胞;和在适合产生包含功能性β细胞和/或β样细胞的胰腺类器官的条件下,在类器官培养基中体外3d培养所述内分泌祖细胞,优选地,所述类器官培养基还包含三维基质,如matrigel
tm
和水凝胶。
8.在一些实施方案中,所述内分泌祖细胞可以从成体胰岛细胞中分离。在一些实施方案中,所述内分泌祖细胞在成体胰岛细胞群内提供(例如,没有分离)。在一些事实方案中,内分泌祖细胞群可以以基本上纯和分离的形式提供,或与其他成体胰岛细胞共同富集的形式提供,或以从受试者获得的成体胰岛细胞内天然存在的形式提供。
9.在一些实施方案中,所述成体胰岛细胞可以来自人,所述内分泌祖细胞可以是msln
。所述内分泌祖细胞还可以表达upk1b,s100a6,lgals4,sdcbp2, sdc1,igfbp3,hmga1,itgb4,itgb6,hn1,gprc5a,slpi,lamc2, fermt1,mgll,sema3b,tst,sfn,cdh3和
procr中的一种或多种。在一些实施方案中,所述方法还包括:使分离的成体人胰岛细胞与抗msln抗体或其抗原结合片段体外接触,之后进行荧光辅助细胞分选(facs),以分离所述内分泌祖细胞。在某些实施方案中,用于培养人类细胞的所述类器官培养基可以包括如dmem/f12的基础培养基,所述基础培养基补充有以下一种或多种的:10-200(例如,50)ng ml-1
egf,1-50(例如,10)ng ml-1
fgf2,1-10(例如,3)μm wnt激动剂如chir99021或1-100(例如,30)ng/ml wnt替代物如 ngs(下一代替代物),0.1-5(例如,0.5)μm tgf-beta通路抑制剂如sb431542 或a83-01,10-500(例如,100)ng ml-1
bmp抑制剂如noggin,1-10(例如,2.5) μm rock抑制剂如y27632,和1-10(例如,0.5)μm p38抑制剂sb202190;其中,任选地,所述基础培养基还补充有以下的一种或多种:1-5%(例如,2%)b27, 0.1-5%(例如,1%)its,0.1-5(例如,2)μg ml-1
肝素和1-100(例如,50)ng ml-1 vegfa。
10.在一些实施方案中,所述成体胰岛细胞可以来自小鼠,且所述内分泌祖细胞可以是procr
。在一些实施方案中,所述内分泌祖细胞还可以表达rspo1、 fgf1、upk3b、hoxa5和msln中的一种或多种。在一些实施方案中,所述3d 培养步骤还可以包括与多个内皮细胞共培养。在一些实施方案中,所述方法还包括使分离的成体鼠胰岛细胞和抗procr抗体或其抗原结合片段体外接触,之后进行荧光辅助细胞分选(facs),以分离内分泌祖细胞。在一些实施方案中,所述用于小鼠细胞的培养基可以包括如dmem/f12的基础培养基,所述基础培养基补充有以下一种或多种:10-200(例如,50)ng ml-1
egf,1-50(例如, 10)ng ml-1
fgf2和1-20(例如,5)ng ml-1
vegfa;任选地,所述基础培养基还包括以下的一种或多种:1-5%(例如,2%)b27,0.1-5%(例如,1%)its,和 0.1-5(例如,2)μg ml-1
肝素。
11.在一些实施方案中,所述3d培养或共培养步骤可以包括培养直至内分泌祖细胞形成直径约100-300μm的集落,并继续培养所述集落以形成直径约 150-500μm的胰腺类器官。
12.本发明在另一个方面提供一种体外获得胰腺类器官的方法,所述方法包括: (a)从成体胰腺中富集内分泌细胞,优选地,所述富集通过以下一种或多种方法进行:(1)用tsq(6-甲氧基-8-对甲苯磺酰胺-喹啉)染色分离的成体胰腺细胞,之后进行facs;(2)密度梯度离心分离的成体胰腺细胞;和(3) 从成体胰腺中手挑并分离胰岛;和(b)在适合产生包含功能性β细胞和/或β样细胞的条件下,在类器官培养基中3d培养所述富集的内分泌细胞,优选地,所述类器官培养基还包括三维基质。
13.在一些实施方案中,所述类器官培养基可以包括matrigel
tm
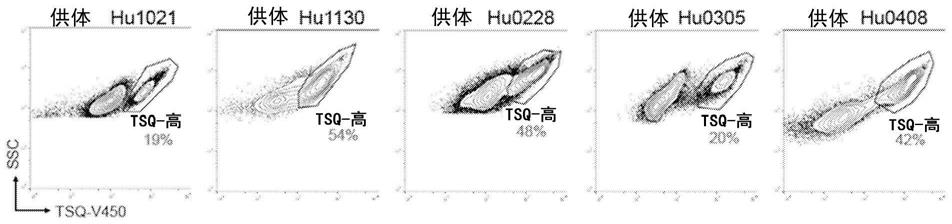
或水凝胶和如 dmem/f12的基础培养基,所述基础培养基补充有以下一种或多种:10-200(例如,50)ng ml-1
egf,1-50(例如,10)ng ml-1
fgf2,1-10(例如,3)μm wnt激动剂如chir99021或1-100(例如,30)ng/ml wnt替代物如ngs(下一代替代物),0.1-5(例如,0.5)μm tgf-beta通路抑制剂如sb431542或a83-01,10-500 (例如,100)ng ml-1
bmp抑制剂如noggin,1-10(例如,2.5)μm rock抑制剂如 y27632,和1-10(例如,0.5)μm p38抑制剂sb202190;在一些实施方案中,所述基础培养基可以补充有以下一种或多种:1-5%(例如,2%)b27,0.1-5%(例如,1%)its,0.1-5(例如,2)μgml-1
肝素和1-100(例如,50)ngml-1
vegfa。在一些实施方案中,所述胰腺类器官直径约为50-500或约为100-300μm。
14.在多个实施方案中,本文公开的任何一种方法还包括:通过至少10次、至少20次、或至少30次传代扩增所述胰腺类器官。所述方法可以还包括培养所述扩增的胰腺类器官约1-12或1-4或2-12周(例如,约 1,2,3,4,5,6,7,8,9,10,11,12周或更长时间,或约7-100天)
以产生成熟的类器官。在一些实施方案中,所述成熟的类器官可以检测葡萄糖并响应葡萄糖而产生和分泌胰岛素。
15.本发明还提供一种获得内分泌细胞的方法,所述方法包括:使成体胰岛细胞与抗msln抗体或其抗原结合片段体外接触;和分离与所述抗msln抗体或其片段结合的msln
内分泌祖细胞,优选地,使用荧光辅助细胞分选(facs)。
16.本发明还提供一种获得内分泌祖细胞的方法,所述方法包括:使成体胰岛细胞与抗procr抗体或其抗原结合片段体外接触;和分离与所述抗procr抗体或其片段结合的procr
内分泌祖细胞,优选地,所述分离使用荧光辅助细胞分选(facs)。
17.本发明还提供一种组合物,所述组合物包括从成体胰岛细胞中分离出的多个内分泌祖细胞,培养基和任选还包含多个内皮细胞。在一些实施方案中,所述内分泌祖细胞表达procr。在一些实施方案中,所述培养基还包括三维基质,优选matrigel
tm
或水凝胶。
18.在一些实施方案中,所述成体胰岛细胞为人源,且内分泌祖细胞表达 msln和任选还表达upk1b,s100a6,lgals4,sdcbp2,sdc1,igfbp3, hmga1,itgb4,itgb6,hn1,gprc5a,slpi,lamc2,fermt1,mgll, sema3b,tst,sfn,cdh3和procr中的一种或多种。在一些实施方案中,用于人细胞的培养基包括如dmem/f12的基础培养基,所述基础培养基补充有以下一种或多种:10-200(例如,50)ng ml-1
egf,1-50(例如,10)ng ml-1 fgf2,1-10(例如,3)μm wnt激动剂如chir99021或1-100(例如,30)ng/mlwnt替代物如ngs(下一代替代物),0.1-5(例如,0.5)μm tgf-beta通路抑制剂如sb431542或a83-01,10-500(例如,100)ng ml-1
bmp抑制剂如noggin, 1-10(例如,2.5)μm rock抑制剂如y27632,和1-10(例如,0.5)μm p38抑制剂sb202190;其中,任选地,所述基础培养基还辅以一种或多种1-5%(例如,2%)b27,0.1-5%(例如,1%)its,0.1-5(例如,2)μg ml-1
肝素和1-100(例如,50) ng ml-1
vegfa。
19.在一些实施方案中,所述成体胰岛细胞为鼠源,且所述内分泌祖细胞表达 procr和任选还表达rspo1,fgf1,upk3b,hoxa5和msln中的一种或多种。在一些实施方案中,用于鼠细胞的培养基包括如dmem/f12的基础培养基,所述基础培养基补充有以下一种或多种:10-200(例如,50)ng ml-1
egf,1-50(例如,10)ng ml-1
fgf2和1-20(例如,5)ng ml-1
vegfa;任选地,所述基础培养基还包括1-5%(例如,2%)b27,0.1-5%(例如,1%)its,和0.1-5(例如,2)μgml-1
肝素中的一种或多种。
20.本发明另一个方面还涉及一种胰腺类器官,所述类胰腺器官包含从内分泌祖细胞体外分化的功能性β细胞和/或β样细胞,其中,所述内分泌祖细胞从成体胰岛细胞中分离。在一些实施方案中,所述胰腺类器官能检测葡萄糖并响应葡萄糖而产生和分泌胰岛素。在一些实施方案中,所述胰腺类器官直径约为 50-500或约为100-300μm。
21.本发明另一个方面还涉及本文公开的培养基,所述培养基用于胰腺祖细胞和胰腺类器官的体外扩增和/或分化。
22.本发明还提供了如本文所述的类器官的用途,用于治疗或预防糖尿病,或用于体外筛选治疗或预防糖尿病的试剂。
附图说明
23.图1a-1m表示单细胞rna测序分析揭示了具有emt特性的新型胰腺细胞群。图1a的图表描述胰腺单细胞(sc)rna测序数据的每个细胞的唯一分子识别符(umi)数量(左)和每
个细胞检测到的基因数量(右)的分布。图1b为三个生物学重复之间的再现性的点图。三个单细胞rna测序实验的所有细胞的平均基因表达值(log2(tpm 1))用于计算(r=pearson相关系数)。图1c为三个独立的单细胞rna测序实验的t-sne图。每个实验的细胞计数和指示的细胞类型在括号中标记。在整个图中,除非另有说明,“mesen”表示间充质,“endo.”表示内皮,“new pop”表示新的群。图1d为内分泌或外分泌细胞的标志物基因表达的一系列t-sne图。对于图1d、1e和1i,post hoc簇注释基于已知细胞类型标志物的表达;且不同的簇代表相同的细胞类型,如图 1c所示。图1e为除内分泌和外分泌外的细胞谱系的标志物基因表达的一系列 t-sne图。图1f为7160个胰腺单细胞(sc)rna测序谱(点)和post hoc注释的t-sne图。新的群(new pop.)是。指定细胞类型的细胞计数在括号中。细胞从三个生物学重复中汇集在一起。图1g是一系列tsne图和随附的vlin 图,说明了不同胰腺细胞类型的基因表达。图1f表明不同的簇代表相同的细胞类型。图1h是一系列tsne图和随附的vlin图,说明了不同胰腺细胞类型的基因表达。不同的簇代表相同的细胞类型,如图1f所示。图1i为新细胞群的标志物基因表达的t-sne图。图1j是细胞类型富集基因的热图。每列代表一个细胞,每一行代表一个特征基因。阴影范围从深阴影到较亮阴影,分别表示相对基因表达水平从低到高。图1k为每个簇的特征基因的点图。阴影表示平均表达水平,点的大小表示分数表达。图1l为新群中上调基因(1536个基因被选择,p值5x10-3
)的选定基因本体论(go)术语的图。图1m包括tsne 图和vlin图,说明上皮和间充质标志物的表达水平被投影到t-sne图上。t-sne 图下的vlin图显示了每种细胞类型中指定基因的表达水平(log2(tpm 1))。 (圈出的)新群表达上皮和间充质标志物,表明emt特性。
24.图2a-2i表示成体胰岛中的新群与胚胎内分泌细胞亚群一致。图2a是 tsne图,显示了两个不同的单细胞rnaseq数据集,包含与目前公开的成体单细胞rna测序数据集和post hoc注释的表达e14.5ngn3的内分泌前体。显示为对齐(左)和拆分(右)图。每个数据集的细胞计数和新群(new pop.) 显示在括号中。图2b为显示每种指定细胞类型的胰腺内分泌和外分泌标志物基因表达水平的tsne图,显示了每个指示基因的颜色条和log2(tpm 1)值。图2c为表达e14.5ngn3的内分泌前体的上皮和间充质标志物表达水平的 t-sne图。显示了每个指示基因的颜色条和log2(tpm 1)值。与成体新细胞群相似,表达e14.5 ngn3的内分泌前体的(圈出的)新亚群表达上皮和间充质标志物,表明emt特性。图2d为显示ngn3表达水平的t-sne图。图2e为显示新群中rspo1和procr表达的t-sne图。显示了每个指示基因的颜色条和 log2(tpm 1)值。e14.5 ngn3
的新群体细胞(圈出)和成体新群体细胞对于 rspo1和procr表达水平一致,而成体新群体细胞ngn3表达缺失。图2f为点图,显示了三个数据集中新细胞群的表达特征。图2g为t-sne图,显示了新细胞群中标志物基因的表达水平。三个数据集分别显示用于比较。显示了每个指示基因的颜色条和log2(tpm 1)值。在每个数据集中,细胞被分为新细胞群和其他。阴影表示平均表达水平,点的大小表示分数表达。图2h为由monocle2 产生的成体新细胞群和α、β、δ和pp细胞(使用4,986个细胞)的发育轨迹的图表。左侧图中的颜色表示单元格类型,指定细胞类型的细胞计数标记在括号中,拟时间(任意单位)从深蓝色到浅蓝色(右图)描绘。图2i为基因分支热图,描绘了拟时间沿每个分支的基因表达。在每个分支的整个拟时间轨迹上计算一个独立的表达式模式。因此,为每个分支分别显示分支点之前的轨迹部分。基因基于跨越拟时间的表达模式成簇,沿着分支具有差异表达的选定基因在右侧标记。
25.图3a-3l使用procr表面标记表征分离的新胰岛群。图3a为描绘未染色对照胰岛procr表达细胞的facs分析门控策略图。基于前向散射和触发脉冲宽度排除双峰。cd31、cd45、和ter119抗体标记排除了lin
细胞。procr
细胞在epcam
胰岛上皮细胞中进行分析。图3b为描绘胰岛procr表达细胞抗体标记样品的facs分析门控策略图。基于前向散射和触发脉冲宽度排除双峰。 cd31、cd45、和ter119抗体标记排除了lin
细胞。procr
细胞在epcam
胰岛上皮细胞中进行分析。在图3a和图3b中,显示了三个生物学重复之一。图3c为在手工挑选的小鼠胰岛中表达procr的细胞的facs分析的总结图。根据lin(包括cd31、cd45和ter119)和epcam抗体染色,将lin
和非上皮细胞排除在外。在lin-epcam
胰岛上皮隔室内1.02
±
0.14%的细胞是procr
。数据来自五个生物学重复,并表示为平均值
±
s.e.m.。图3d为通过qpcr测量的每个分离的细胞群(即,facs分选的胰岛或非胰岛procr
和procr-胰腺细胞) 中新的群体特征基因的表达水平的图。胰岛procr
细胞为富集的新群体,具有高水平的新群体标志物表达。n=3为生物学重复。对于每个重复,从四只小鼠中分离出细胞。数据表示为平均值
±
s.e.m.。图3e为ngn3-cre、rosa26-tdtomato 胰岛中procr
细胞的facs分析图。胰岛上皮细胞以lin-,epcam
标记。大多数的procr
细胞是tdtomato
(tdtom
)。显示了三个相似的生物学重复之一。图3f为在procr的atg起始密码子之后插入膜gfp(mgfp)-2a-lacz盒的procr的双报告等位基因的图。图3g为产生procrmgfp-2a-lacz敲入型双报告小鼠的靶向策略的图。southern印迹探针和基因分型引物的设计如图所示。图3h包括:使用5'外部探针对来自小鼠胚胎干细胞的bamhi-消化的dna进行的southern印迹分析图像,除了9.9kb wt条带(左)外,还显示了8.5kb 条带;以及使用3'外部探针对来自小鼠胚胎干细胞的saci-消化dna进行的 southern印迹分析图像,在procr基因座发生同源重组的克隆中,除了6.9kbwt 带(右)外,还显示了5.6kb带。图3i为基因分型pcr反应产物的凝胶图像,图像表明#2、3、5、7通道为杂合子。图像显示了三个类似实验之一。图3j 为全封装x-gal染色的图像,显示了procrmgfp-2a-lacz胰岛内的单个lacz 表达(procr
)细胞。野生型阴性对照显示在右侧。比例尺为20μm。在三只小鼠中观察到类似的分布模式。图3k为procr
和procr-细胞(图像)的facs分析图和说明procr
细胞和mgfp
细胞重叠的图,其验证了procrmgfp-2a-lacz 敲入型报告小鼠。胰岛procr
或procr-细胞通过mgfp免疫染色进行facs分选和验证。对排序的procr
和mgfp
细胞的重叠定量。procrmgfp-2a-lacz敲入小鼠概括了胰岛中的procr表达。n=3为生物学重复。数据表示为平均值
±
s.e.m.。比例尺为20μm。图3l包括procrmgfp-2a-lacz胰岛全封装免疫染色的代表性共聚焦图像,这表明mgfp 细胞(procr
细胞,箭头)不与成熟的β细胞(ins
)、α细胞(gcg
)、δ-细胞(sst
)或pp细胞(ppy
)重叠。比例尺为20μm。n=3只小鼠证实了类似的结果。图3m为胰腺切片免疫染色的代表性共聚焦图像,显示mgfp
细胞(procr
细胞,箭头)表达上皮标记epcam 和间充质标记物col1a1。比例尺为20μm。对n=3只小鼠的切片进行染色和分析。
26.图4a和4b为培养7天和28天的胰腺类器官。图4a为在7天后培养的新鲜分离的原代胰岛细胞的明场图像。procr
或procr-胰岛细胞从icr小鼠中分选并分别培养。只有procr
细胞形成集落。对n=3个生物学重复进行了实验。对于每个重复,从至少5只小鼠中分选细胞。比例尺为50μm。图4b是散点图,显示培养7或28天的每个胰岛类器官的大小、有无内皮细胞。对3个生物学重复进行了实验。显示了三个类似结果之一。平均尺寸显示为平均值
±
s.e.m.。图5a-5n证明源自单个procr
胰岛祖细胞的胰岛类器官可以表达胰岛素。图5a分别
显示经分选(来自icr或fvb小鼠)和与cd31
内皮细胞(来自肌动蛋白
ꢀ‑
dsred)共培养的procr
和procr-细胞的facs分析。procr的facs分析)。明场/荧光代表图像显示了5或8天后培养的新鲜分离的原代胰岛细胞。红色荧光指示cd31
内皮细胞的位置。在这种培养条件下,只有procr
细胞会形成胰岛类器官。n=5个生物学重复。对于每个重复,从至少5只小鼠中分选细胞。比例尺为50μm。图5b为培养28天的procr
细胞衍生的胰岛类器官的明场(左) 和全封装免疫荧光图像(右)。procr
细胞和cd31
内皮细胞均从icr小鼠中分选出来。内皮细胞用红色的cd31抗体染色标记。n=3个生物学重复。对于每个重复,从至少5只小鼠中分选细胞。“org.”表示类器官。比例尺为50μm。图5c是散点图,显示了培养7天或28天的每个胰岛类器官的大小。n=3个生物学重复,显示了三个类似结果之一。平均类器官大小表示为平均值
±
s.e.m.。图5d包括在培养7或28天的新鲜胰岛或类器官中进行全封装胰岛素免疫染色 (有无葡萄糖挑战)的代表性共聚焦图。比例尺表示20μm。“hi glucose”表示高葡萄糖。图5e为散点图,显示了在每个指示条件下每个类器官的胰岛素
(高表达)细胞的百分比。n=3个生物学重复,显示了三个类似结果之一。平均百分比表示为平均值
±
s.e.m.。“d7”表示第7天;“hi glu”表示高葡萄糖。图5f包括显示在每种指定条件下通过qpcr检测的β细胞标志物基因的表达水平图。 n=3个生物学重复。数据表示为(平均值 最小值)/最大值。图5g为动态归一化fluo-4荧光强度的代表性群体测量值,图显示了用2、20、2、20、2和 20mm葡萄糖和30mm kcl依次挑战的初始第28天(primary day 28)胰岛类器官。x轴代表时间。n=3个生物学重复分别显示在图中。图5h包括每个指定培养条件下切片细胞内颗粒的电子显微镜图像和定量(e)。图示为新鲜的胰岛β细胞样品。葡萄糖挑战后第28天的类器官中发现越来越多的结晶胰岛素颗粒,表明β细胞成熟。n=3个生物学重复。显示了三个相似的定量结果之一。比例尺表示1μm。“d7”表示第7天;“d28”表示第28天;“hi glu.”表示高葡萄糖;“org.”表示类器官。图5i是图5h中观察到的结果量化的散点图。图5j为elisa测量胰岛类器官分泌的胰岛素示意图,所述胰岛类器官是依次用2、20、2、20、 2和20mm葡萄糖挑战的第28天胰岛类器官,每种条件孵育30分钟。n=3个生物学重复。数据表示为平均值
±
s.e.m.。图5k包括由新鲜胰岛中的细胞表达的α-细胞标志物gcg、δ-细胞标志物sst或pp-细胞标志物ppy的全封装免疫染色图。图5l是图5k中观察到结果的定量图。图5k包括由第28天的类器官中的细胞表达的α-细胞标志物gcg、δ-细胞标志物sst或pp-细胞标志物ppy 的全封装免疫染色图。图5n是图5m中观察到结果的定量图。对于图5k-5n,基于n=3个生物重复验证了类器官内不同类型的激素表达细胞的存在。显示了三个相似的量化结果之一。n=3只小鼠用于新鲜胰岛的定量。比例尺表示20 μm。数据表示为平均值
±
s.e.m.。
27.图6a-6n说明了procr
细胞衍生的类器官可以在体外扩增。图6a包括来自不同通道的培养的类器官的代表性图像。所有传代实验均针对n=3个生物学重复进行。比例尺为50μm。图6b为图6a的培养类器官的大小示意图。显示了三个相似的量化结果之一。类器官的平均大小显示为平均值
±
s.e.m.。图 6c是胰岛类器官(源自原代小鼠胰岛procr
细胞)从第1代到第20代的扩增曲线。n=3个生物学重复。数据表示为平均值
±
s.e.m.。图6d是类器官扩增/成熟模型示意图。图6e为葡萄糖挑战后在第15次传代第30天类器官中的β-细胞标志物ins、α-细胞标志物胰高血糖素(gcg)、δ-细胞标志物生长抑素(sst)和pp
‑ꢀ
细胞标志物胰多肽(ppy)的全封装免疫染色的代表性图像。比例尺为20μm。图 6f为图6e中的全封装免疫染色的定量图。n=3个生物学重复。显示了三个相似的量化结果之一。平均百分比表示为
平均值
±
s.e.m.。图6g为葡萄糖挑战后在第7次传代第30天类器官中β细胞标志物ins、α细胞标志物胰高血糖素 (gcg)、δ细胞标志物生长抑素(sst)和pp细胞标志物胰多肽(ppy)的全封装免疫染色的代表性图像。比例尺为20μm。图6h为图6g中的全封装免疫染色的定量图。n=3个生物学重复。显示了三个相似的量化结果之一。平均百分比表示为平均值
±
s.e.m.。图6i为胰岛类器官的动态归一化fluo-4荧光强度的代表性群体测量值,所述胰岛类器官是用2、20、2、20、2和20mm葡萄糖和30mm kcl依次挑战的第15次传代第30天胰岛类器官。x轴代表时间。 n=3个生物学重复分别显示。图6j包括切片细胞内颗粒的电子显微镜图像。葡萄糖挑战后第15代第30天的类器官中发现结晶的胰岛素颗粒,表明β细胞成熟。n=3个生物学重复。比例尺表示1μm。图6k为胰岛类器官分泌胰岛素的 elisa测量图,所述胰岛类器官是依次用2、20、2、20、2和20mm葡萄糖挑战的第15传代的第30天胰岛类器官,每个浓度孵育30分钟。n=3个生物学重复。数据表示为平均值
±
s.e.m.。图6l为切片细胞内颗粒的电子显微镜图像。在葡萄糖挑战后的第7天,第30天的类器官中发现了结晶的胰岛素颗粒。n=3 个生物学重复。比例尺表示1μm。图6m为第7次传代第30天胰岛类器官的分泌胰岛素的elisa测量的图,所述胰岛类器官依次用2、20、2、20、2和 20mm葡萄糖挑战,每种条件孵育30分钟。n=3个生物学重复。数据表示为平均值
±
s.e.m.。图6n为胰岛类器官的动态归一化fluo-4荧光强度的代表性群体测量值,所述胰岛类器官是用2、20、2、20、2和20mm葡萄糖和30mm kcl 依次挑战的第7次传代第30天的胰岛类器官。x轴代表时间。n=3个生物学重复分别显示。
28.图7a-7n证明了长期培养的类器官恢复了链脲佐菌素(stz)诱导的t1d 小鼠的胰岛素依赖性葡萄糖稳态。图7a是显示移植后血糖水平的图。在移植前7天,免疫缺陷小鼠用链脲佐菌素(stz)制成糖尿病。常规检查随机喂食的血糖水平。在移植1,000个第7代或第15代胰岛类器官后,血糖降至正常水平,类似于移植小鼠300个胰岛的对照。未移植的糖尿病患者仍然处于高血糖状态。组由彩色线表示,每组测量的小鼠数量在括号中标记。数据表示为平均值
±
s.e.m.。图7b为移植后小鼠体重的图。免疫缺陷小鼠在移植前7天用链脲佐菌素(stz)制成糖尿病。定期检查体重变化。糖尿病患者的体重减轻可以通过移植1,000个第7或第15代胰岛类器官来挽救,类似于移植300 个胰岛的对照。未移植的糖尿病患者的体重不断下降。组由彩色线表示,每组测量的小鼠数量在括号中标记。数据表示为平均值
±
s.e.m.。图7c是移植后1 个月施用的葡萄糖耐量测试(gtt)的图,其表明在移植的类器官和移植的胰岛组中葡萄糖耐受显著改善。组由彩色线表示,每组分析的小鼠数量在括号中标记。数据表示为平均值
±
s.e.m.。图7d是显示在葡萄糖注射之前和之后(葡萄糖注射后15分钟)每个指定组的血清胰岛素的elisa测量的图。每组使用的小鼠数量与图7a和7c中的相同。数据表示为平均值
±
s.e.m.。图7e是移植类器官1个月后,再生组织的β细胞标志物ins、α细胞标志物gcg、δ细胞标志物sst或pp细胞标志物ppy的免疫荧光染色代表性图像。n=3只小鼠。比例尺为20μm。“org.”表示类器官。图7f是移植类器官1个月后,再生组织中的不同激素表达细胞的定量图。n=3只小鼠。图7g为切片细胞内颗粒的电子显微镜图像。移植后1个月分离出类器官细胞。结晶的胰岛素颗粒表明β细胞成熟。n=3只小鼠。比例尺表示1μm。图7h为2,129个移植的激素表达单细胞rna测序谱(点)的t-sne2图。移植后1个月分离类器官细胞。数据通过与上述主要单细胞rna测序数据集对齐来显示,并通过簇分配和post hoc 注释(左)着色,或按细胞源着色(右)。从n=3只小鼠中汇集移植的细胞。图7i是显示移植的单细胞(sc)rna测序数据集的每个细胞的umi数量(左) 和每个细胞检测到的基因数量(右)
的分布图。图7j包括拆分视图中移植或原始样品的sc rna测序概况(点)的t-sne图,通过簇分配着色并进行post hoc 注释。括号中标记了指定样品和细胞类型的细胞计数。“mesen.”表示间充质;“endo.”表示内皮;“new pop.”表示新群。图7k是内分泌细胞类型特征基因的热图。每列代表一个细胞,每一行代表一个特征基因。为了比较相似性,移植或原代细胞分别显示。从深阴影到浅阴影的阴影分别表示从低到高的相对基因表达水平。图7l包括显示原代细胞和移植细胞之间α或β细胞标志基因的可比较表达水平(log2(tpm 1))的vlin图。图7m是内分泌细胞类型的特征基因的点图。分别显示移植或原代细胞以进行比较。阴影表示平均表达水平,点的大小表示表达分数。图7n包括vlin图,显示原代细胞和移植细胞之间的δ或pp细胞标志物的可比较表达水平(log2(tpm 1))。
29.图8a和8b表明在人类胰岛中发现了缺乏内分泌标志物表达的procr
细胞。图8a为来自指定供体的人胰腺切片上的内分泌激素(以绿色显示)和 procr(以红色显示)染色的代表性共焦图像。胰岛轮廓已圈出。与小鼠类似,人胰岛procr
细胞不与激素表达细胞重叠。比例尺为20μm。8b为来自指定供体的人胰腺切片上的procr(以红色显示)染色的代表性共焦图像。procr 也在人胰腺的外分泌室中表达。比例尺为20μm。
30.图9a-9c说明了通过facs分离人胰岛单细胞。图9a为hu0124供体中 tsq染色的代表性facs图谱。三个不同级别的tsq染色被门控。图9b为代表性共焦图像,对hu0124供体分选的每个指定细胞群中内分泌标志物 ins/gcg或外分泌标志物amy/krt19染色(以红色显示)。高tsq细胞富含胰岛激素表达细胞,而外分泌细胞是tsq-低(tsq-low)或tsq-阴性(tsq-neg)。比例尺为20μm。图9c为不同供体中tsq染色的facs概况。
31.图10a-10d说明了筛选促进人类胰岛类器官生长的因子。图10a为类器官的代表性明场图像,注释显示在每个指示的条件下从供体hu1021培养的类器官的数量和定量类器官大小的图。图10b为类器官的代表性明场图像,注释显示在每个指示的条件下从供体hu1130培养的类器官的数量和定量类器官大小的图。图10c为定量类器官大小示意图,注释显示在每个指示的条件下从供体hu0228培养的类器官的数量。图10a-10c的数据以平均值
±
s.e.m.表示。图 10d是来自hu1130供体的类器官中内分泌标记ins(以红色显示)和gcg(以绿色显示)染色的代表性共焦图像。图10a、10b和10d的比例尺为20μm。
32.图11a-11d表示建立3d培养系统以扩增人类胰岛类器官。图11a为来自3个不同供体的每10,000个高tsq胰腺细胞形成的原代传代类器官数量示意图。图11b为来自hu0228供体的胰岛类器官的代表性明场图像,培养天数标记在括号中。还图示了具有显著中空结构的代表性导管类器官以进行比较。比例尺为100μm。图11c为从第1代到第7代的胰岛类器官(源自初级hu0408 供体)的大小和生长曲线。数据以平均值
±
s.e.m.表示。图11d为从hu0408供体培养的每个指定通道的胰岛类器官(org)的代表性明场图像。培养天数在括号中。比例尺为100μm。
33.图12a-12e说明人类胰岛类器官可以表达胰岛素、响应葡萄糖刺激并包含不同的内分泌细胞类型。图12a为来自供体hu0228的指定通道(培养天数在括号中)的胰岛类器官(org)中胰岛素染色的代表性共焦图像。图12b为来自供体hu0408指定通道(培养天数在括号中)的胰岛类器官(org)中胰岛素染色的代表性共焦图像。如图12a和12b所示,胰岛素(ins)
β样细胞在胰岛类器官中占主导地位,而胰高血糖素(gcg)
α样细胞以较低频率出现。在胰岛类器官中未检测到sox9(导管细胞标记)表达。比例尺为20μm。图 12c是导管类器官
中sox9染色的代表性共焦图像。比例尺为20μm。图12d 为显示用2、20、2、20、2和20mm葡萄糖依次挑战的第一个胰岛类器官(来自hu0228供体)的动态归一化fluo-4荧光强度的代表性群体测量值的图。x 轴代表时间。图12e为来自hu0228或hu0408供体的第3代和第6代胰岛类器官中ins染色的代表性共焦图像。比例尺为20μm。
34.图13a-13c表明类器官中的procr
细胞是高度增殖的。图13a为用于edu 染色来自hu0228或hu0408供体的第3代和第6代胰岛类器官的代表性共焦图像。比例尺为20μm。图13b是来自hu0228供体的第一胰岛类器官培养物中procr
细胞百分比的facs分析图。图13c为用于edu染色的代表性共聚焦图像和从胰岛类器官分选的procr
/procr-细胞中edu
细胞百分比的量化。 procr
类器官细胞比procr-类器官细胞的增殖能力明显更高。比例尺表示 20μm。
35.图14a-14f为scrna测序分析揭示了成人胰腺中潜在的胰岛祖细胞群。 (如图14a-14b所示)20,660个人和7,051小鼠胰腺单细胞(sc)rna测序谱(点)的t-sne图,通过簇分配着色并进行post hoc注释。显示了整合(图 14a)和拆分(图14b)视图。祖细胞群以蓝绿色圈出。每个簇的细胞数显示在(图14b)括号中。细胞从小鼠的n=3个生物复制和人类的8个数据集中汇集。“quie.”表示休眠的。“act.”表示活性的。“endo.”表示内皮的。(图14c) 个体基因t-sne图显示了每种细胞类型的代表性标志物基因的表达水平和分布。从灰色到蓝色的颜色表示从低到高的相对基因表达水平。(图14d)细胞类型富集基因的热图。每列代表一个细胞,每一行代表一个特征基因。从紫色到黄色的颜色表示相对基因表达水平从低到高。胰岛祖细胞的标志物基因显示在左侧的蓝绿色框中。“quie.”表示休眠的。(图14e)单个基因vlin图显示了代表性胰岛祖细胞标志物基因跨不同细胞簇的表达水平(log2(tpm 1))。(图 14f)由monocle 2产生的胰岛祖细胞、α和β细胞的发育轨迹。上图中的颜色表示细胞类型。拟时间(任意单位)从深蓝色到浅蓝色(底部面板)描绘。图 15a-15f表明msln
胰岛细胞是具有类器官形成能力的成人胰岛祖细胞。(图 15a-15b)人胰腺切片中msln表达细胞的免疫荧光染色图。胰岛隔室基于绿色的胰岛素染色来区分。基于管腔结构框出导管区域。msln抗体染色以红色显示。msln
细胞是位于胰岛内的小亚群(图15a)。在胰岛外存在一些msln
细胞(图15b)。比例尺=20μm。(如图15c所示)人胰腺切片中msln表达细胞的facs分析。基于细胞的触发脉冲宽度去除双峰。在tsq 胰岛上皮隔室中,约4%的细胞是msln
。在tsq-非胰岛隔室中,~1%的细胞是 msln
。分析了n=2个人体样品。抗体未染色样品显示为apc-cy7的对照。(图15d-15e)将总tsq-hi细胞或tsq-hi、msln
细胞或tsq-hi、msln
‑ꢀ
细胞进行facs分选并培养成胰岛类器官。图15d显示培养第4天的代表性图像。tsq-hi、msln
细胞具有最高的类器官形成效率,比总tsq-hi细胞高 6.6倍,而msln-细胞几乎不能形成类器官(图15e)。(图15f)第14天类器官的facs分析显示大多数msln
细胞是procr
。
36.图16a-16c表明与内皮细胞共培养可促进体外人胰岛类器官的生长。(图 16a)源自tsq-hi胰岛细胞的人胰岛类器官的延时图像(培养第0天至第10 天)。(图16b)源自tsq-hi胰岛细胞和内皮细胞(ec,箭头)共培养的人胰岛类器官的延时图像(培养第0天至第10天)。还显示了从凝胶中释放的第10天类器官的代表性图像。(如图16c所示)类器官大小的量化表明ec 共培养促进了类器官生长。***p《0.001。
37.详细说明
38.体外生产功能性β细胞通常已被证明具有挑战性。本发明的公开内容基于在成年
小鼠和人胰岛中发现表达蛋白c受体(procr)的新细胞群。这些procr
细胞不表达分化标志物并具有上皮-间质转化(emt)特征。procr
细胞约占胰岛细胞的1-3%,procr表达允许从胰岛中分选这些细胞。分离的小鼠procr
细胞在与内皮细胞(ec)以克隆密度培养时可以稳健地形成胰岛样类器官,而人类胰岛细胞不需要内皮细胞来形成类器官。通过连续传代可以在体外长期维持指数扩增,并且可以在培养的任何时间点诱导分化。β-细胞在procr
祖细胞衍生的分化胰岛类器官中占优势,而α-、δ-和胰多肽(pp)细胞以较低频率出现。procr
祖细胞衍生的类器官能响应葡萄糖并且能分泌胰岛素。在糖尿病患者体内移植后,所述类器官可以逆转疾病。本文公开的发现表明,成人胰岛含有具有祖细胞样能力的procr
内分泌细胞群。
39.定义
40.方便起见,将说明书、实施例和所附权利要求中使用的特定术语汇集在此。除非另外定义,否则本文使用的所有技术和科学术语具有本发明所属领域的技术人员通常理解的含义。
41.以下参考文献为技术人员提供了本发明中使用的许多术语的一般定义:singleton等,,dictionary of microbiology和molecular biology(2nd ed.1994); the cambridge dictionary of science和technology(walker ed.,1988);theglossary of genetics,5th ed.,r.rieger et al.(eds.),springer verlag(1991);和 hale&marham,the harper collins dictionary of biology(1991).除非另有说明,本文所用的以下术语具有下文给出的涵义。
42.除非另外说明或由从上下文中显而易见的,否则如本文所用,术语“或”应理解为包括性的。除非另外说明或由从上下文中显而易见的,否则如本文所用,术语“一个”、“一种”和“该”应理解为单数或复数。
43.除非特别说明或从上下文清楚表明,如本文所使用的术语“约”应理解为本领域正常容许的范围,例如平均的标准差在2以内。约可理解为在所示值的 10%、9%、8%、7%、6%、5%、4%、3%、2%、1%、0.5%、0.1%、0.05%,或0.01%之内。除非本文另有明确表示,本文提供的所有数值均用术语约修饰。
[0044]“procr”和“procr”可互换使用,是指蛋白c受体,“procr”通常指基因或 mrna,“procr”指蛋白产物,除非另有说明。应当理解,这些术语包括完整基因、cdna序列、完整氨基酸序列或其任何片段或变体。
[0045]
如本文所用,“抗体”是由一种或多种多肽组成的蛋白质,所述多肽包含结合靶表位的结合结构域。术语抗体包括单克隆抗体,所述单克隆抗体包括免疫球蛋白重链和轻链分子,单重链可变域抗体,和其变体和衍生物,包括单克隆和单重链可变结构域抗体的嵌合变体。结合域基本上由免疫球蛋白基因或免疫球蛋白基因片段编码,其中蛋白质免疫特异性地结合抗原。已被认识的免疫球蛋白基因包括κ,λ,α,γ,δ,ε和μ恒定区基因,以及大量免疫球蛋白可变区基因。轻链被归类为κ或λ。重链被归类为γ、μ、α、δ或ε,这进而确定了免疫球蛋白类别,分别为igg、igm、iga、igd和ige。对于包括人类和鼠类在内的大多数脊椎动物生物体,典型的免疫球蛋白结构单元包含一个由两对相同的多肽链组成的四聚体,每对具有一条“轻链”(约25kd)和一条“重链”(约50-70kd)。“v
l”和“v
h”分别指这些轻链和重链的可变结构域。“c
l”和“c
h”分别指这些轻链和重链的恒定结构域。”v
l
和vh上各三个β链环负责与
抗原结合,被称为“互补决定区”或“cdr”。“fab”(抗原结合片段)区包括来自抗体的每条重链和轻链的一个恒定区和一个可变区即v
l
,c
l
,vh和ch1。
[0046]
抗体包括完整的免疫球蛋白及其抗原结合片段。术语"抗原结合片段"指与抗原结合或与完整抗体(即其衍生来源的完整抗体)竞争抗原结合(即特异性结合)的抗体多肽片段。抗原结合片段可以通过本领域熟知的重组或生化方法产生。示范性抗原结合片段包括fv,fab,fab',(fab')2,cdr,互补位和单链fv抗体(scfv),其中vh和v
l
链结合在一起(直接或通过肽接头)形成连续的多肽。
[0047]
另一类称为重链抗体(hca,也称为双链或双链重链抗体)的抗体已在骆驼科动物中被报道,如单峰骆驼、双峰驼、野生双峰驼、美洲驼、羊驼、骆马、和原驼(hamers-casterman等,nature,363,446-448(1993);wesolowski等,med. microbiol.immunol(2009)198:157-174;另见美国专利no.5,759,808;美国专利no.5,800,988;美国专利no.5,840,526和美国专利no.5,874,541)。与同样由骆驼科产生的常规igg型四链免疫球蛋白相比,这些抗体缺少常规免疫球蛋白的轻链和ch1结构域,它们的可变结构域有时被称为“vhh”。vhh可以包括四个框架区或“fr”,fr1、fr2、fr3和fr4。框架区被三个cdr、cdr1、 cdr2和cdr3中断。这些天然存在的重链抗体的显著特征之一是glu、arg 和gly分别主要存在于其vhh的vl界面位置44、45和47(kabat编号)。常规四链抗体vh中的相同位置几乎完全被gly、leu和trp占据。与传统四链抗体的vh结构域的相对不溶性相比,这些差异被认为是骆驼hca可变结构域(vhh)的高溶解度和稳定性的原因。骆驼vhh结构域的另外两个显著特征是它们相对较长的cdr3和cdr中半胱氨酸对的高发生率。似乎半胱氨酸对介导二硫键的形成,因此参与调节抗体结合位点的表面拓扑结构。在骆驼sdab-溶菌酶复合物的晶体结构中,从sdab突出并且部分被cdr二硫键稳定的刚性环延伸出结合位点并深入溶菌酶活性位点(desmyter等,naturestruct.biol.,3,803-811(1996))。
[0048]
抗体还包括变体、嵌合抗体和人源化抗体。如本文所用,术语“抗体变体”是指在重链和/或轻链中具有单个或多个突变的抗体。在一些实施方案中,突变存在于可变区中。在一些实施方案中,突变存在于恒定区中。“嵌合抗体”指如下抗体,其中重链和轻链各自的氨基酸序列的一部分与源自特定物种或属于特定类别的抗体中的相应序列同源,而链的剩余区段与其他物种或类别的相应序列同源。典型地,在这些嵌合抗体中,轻链和重链的可变区模仿源自一种哺乳动物的抗体可变区,而恒定部分与源自另一种哺乳动物的抗体中的序列同源。这些嵌合形式的一种显著优点是例如能使用来自非人宿主生物的轻易可得的杂交瘤或b细胞便利地从目前已知的序列衍生可变区,而从例如人细胞制备物衍生恒定区。虽然可变区具有易于制备且特异性不受其来源的影响的优点,但当注射抗体时,恒定区为人类,与非人类来源的恒定区相比,不易引发人类受试者的免疫反应。然而,定义不限于此特定示例。“人源化”抗体是指具有基本上来源于非人类物种的免疫球蛋白的抗原结合位点的分子,并且所述分子的剩余免疫球蛋白结构基于人类免疫球蛋白的结构和/或序列。抗原结合位点可包括融合在恒定区上的完整可变区或仅移植到可变区中的合适框架区的互补决定区(cdr)。抗原结合位点可以是野生型或通过一个或多个氨基酸取代修饰,例如修饰为更类似于人免疫球蛋白。人源化抗体的一些形式保留了所有的cdr 序列(例如人源化小鼠抗体,其包含来自小鼠抗体的全部六个cdr)。其他形式的人源化抗体具有相对于原始抗体改变的一个或多个cdr(一个、两个、三个、四个、五个或六个),其也被称为“衍生自”一个或多个cdr
(例如,至少一种或至少两种)内源性β细胞的特征并表现出类似于内源性成体β细胞的gsis反应的β样细胞。本发明组合物和方法的新颖性并没有被群体中天然产胰岛素细胞(例如,β细胞)的存在所否定。还预期例如通过本文公开的方法产生的产胰岛素细胞群可以包含成熟的胰腺β细胞,并且还可以包含非产胰岛素细胞(即具有β细胞样表型但不产生或分泌胰岛素的细胞)。
[0055]
在细胞个体发育的上下文中,形容词“分化的”或“分化”是一个相对的术语,意指“分化的细胞”是相比与之进行比较的细胞而言,在发育过程中进一步发展下去的细胞。因此,干细胞可以分化为谱系限制的前体细胞(诸如中胚层干细胞),其可以进一步分化为其他类型的前体细胞(如心肌细胞前体),然后分化为终末期分化细胞,其将在某些组织类型中发挥特征作用,并且可能会也可能不会保留进一步扩增的能力。
[0056]
如本文所指的术语“细胞培养基”(本文也称为“培养基质”或“培养基”)是用于培养细胞的培养基,其含有维持细胞活力和支持增殖的营养物。细胞培养基可以适当组合包含以下任何一种:盐、缓冲液、氨基酸、葡萄糖或其他糖、抗生素、血清或血清替代物,以及其他组分,例如肽生长因子等。通常用于特定细胞类型的细胞培养基是本领域技术人员已知的。本文使用的示例性基础培养基包括dmem/f-12(dulbecco's modified eagle medium/nutrient mixture f-12;可从thermo fisher scientific获得)。基础培养基可以补充有下述一种或多种物质:合适的缓冲液(例如,hepes(4-(2-羟乙基)-1-哌嗪乙磺酸)),化学限定的补充物,诸如n2(0.1-10%,例如1%)和b27(0.1-10%,例如1%) 无血清补充物(可购自赛默飞世尔科技公司),抗生素,诸如青霉素/链霉素 (0.1-10%,例如1%),mem非必需氨基酸(伊格尔极限必需培养基(eagle
′
sminimal essential medium)(mem),其由平衡的盐溶液、氨基酸和维生素组成,他们对培养细胞的生长是必需的,并且当补充非必需氨基酸时,产生 mem非必需氨基酸溶液),葡萄糖(0.1-10%,例如0.30%),l-谷氨酰胺(例如,glutamax
tm
),抗坏血酸和/或dapt(n-[n-(3,5-二氟苯乙酰基)-l-丙氨酰基]-s-苯甘氨酸叔丁酯)。如本文公开的诱导分化的因子如wnt激动剂,例如chir99021,或wnt替代物,例如ngs,tgf-β途径抑制剂,例如 sb431542或a83-01,rho-rock途径抑制剂,例如y27632,bmp抑制剂,例如noggin,egf(表皮生长因子)、胰岛素转铁蛋白硒混合物(its,可从sigma 获得)、fgf2(成纤维细胞生长因子2)、肝素、y27632和b27也可以添加到培养基中。
[0057]
术语“细胞系”是指基本上或实质上相同的细胞群,其通常衍生自单个祖先细胞或来自确定的和/或基本上相同的祖先细胞群。细胞系可能已经或可能能够在培养中维持较长时间(例如,数月、数年、无限期)。它可能经历了自发或诱导的转化过程,从而赋予细胞无限的培养寿命。细胞系包括本领域公认的所有细胞系。应当理解,细胞随时间获得突变和可能的表观遗传变化,使得细胞系的单个细胞的至少一些特性可能彼此不同。在一些实施方式中,细胞系包含 procr
内分泌祖细胞,如本文所述任一实施方式所述。
[0058]“类器官”是指在某种程度上模拟体内器官的三维多细胞体外构建体。例如,胰腺类器官包含模拟胰岛细胞功能的细胞。如本文所用,“成熟的类器官”是指在分化培养基中培养的类器官。在一些实施方案中,成熟的类器官具有与其模拟的器官相似或相同的基因表达特征。
[0059]
术语“分离的”、“纯化的”或“生物纯的”是指在不同程度上不含天然状态下通常伴随它的成分的材料。分离(“isolate)”表示与原始来源或周围环境的分开(separation)程
度。纯化(“purify)表示高于分离的分开程度。”“纯化的”或“生物纯化的”蛋白质完全不含其他材料,从而使任何杂质均不会实质性地影响蛋白质的生物学特性或引起其他不利后果。
[0060]
如本文所述,术语“分离的细胞”是指已从最初发现它的生物体中取出的细胞或这种细胞的后代。任选地,细胞已经在体外培养,例如在其他细胞存在的情况下。任选地,随后将细胞引入第二生物体或重新引入分离它的生物体(或它所来自的细胞)。
[0061]
如本文所述,关于分离的细胞群的术语“分离的群”是指已从混合或异质细胞群中去除和分离的细胞群。在一些实施方式中,相较于从中分离或富集细胞的异质群,分离群是基本上纯的细胞群。
[0062]
就特定细胞群而言,术语“基本纯(的)”指相对于构成总细胞群的细胞而言,至少约75%、优选至少约85%、更优选至少约90%且最优选至少约95%纯的细胞群。如本文术语定义,就procr
内分泌祖细胞而言,重述术语“基本纯 (的)”或“基本上纯(的)”指这样的细胞群,其含有少于约20%,更优选少于约15%、10%、8%、7%,最优选少于约5%、4%、3%、2%、1%或少于1%的不是procr
内分泌祖细胞。在一些实施方案中,本发明公开的内容包括扩增 procr
内分泌祖细胞群的方法,其中procr
内分泌祖细胞的扩增群体是基本上纯的procr
内分泌祖细胞群。
[0063]
术语“富集”或“富含”在本文中可交换地使用,并意指一种类型细胞的产率 (分数)比该类型细胞在起始培养物或制剂中的分数增加至少10%。
[0064]
术语“更新”或“自我更新”或“增殖”在本文中互换使用,用于指干细胞或祖细胞通过在长时间和/或数月到数年内分裂成相同的非特化细胞类型来自我更新的能力。在一些情况下,增殖是指通过单细胞反复分裂成两个完全相同的子细胞来扩增细胞。
[0065]
术语“diabetes(糖尿病)”和“diabetes mellitus(dm)”在本文中可互换使用。世界卫生组织针对糖尿病定义了具有诊断价值的空腹血糖浓度为7.0 mmol/l(126mg/dl)及以上(全血6.1mmol/1或110mg/dl)或2小时血糖水平11.1mmol/l或更高(200mg/dl或更高)。其他提示或表明糖尿病高风险的值包括动脉压升高140/90mm hg或更高;血浆甘油三酯升高(1.7mmol/l; 150mg/dl)和/或低hdl-胆固醇(男性低于0.9mmol/l,35mg/dl;女性低于1.0mmol/l,39mg/dl);中心性肥胖(男性:腰臀比高于0.90;女性:腰臀比高于0.85)和/或体重指数超过30kg/m2;微量白蛋白尿,其中尿白蛋白排泄率20μg/min或更高,或白蛋白:肌酐比30mg/g或更高)。术语糖尿病包括所有形式的糖尿病,例如i型、ii型和1.5型。
[0066]
术语“受试者”和“个体”在本文中可互换使用,是指动物,例如人,从其获得细胞和/或用本文描述的细胞对其进行治疗,包括提供预防性治疗。对于对特定动物如人受试者具有特异性的那些感染、病症或疾病状态的治疗,术语受试者是指该特定动物。如本文可互换使用的“非人类动物”和“非人类哺乳动物”包括哺乳动物,例如大鼠、小鼠、兔、羊、猫、狗、牛、猪和非人类灵长类动物。术语“对象”还涵盖任何脊椎动物,包括但不限于哺乳动物、爬行动物、两栖动物和鱼类。然而,有利地,受试者是哺乳动物,例如人,或其他哺乳动物,例如驯养哺乳动物,例如狗、猫、马等,或生产哺乳动物,例如牛、羊、猪等。
[0067]
如本文所用,术语“治疗”是指向受试者施用有效量的组合物,使得受试者作为疾病的至少一种症状的减轻或疾病的改善,例如,有益或期望的临床结果。对于本发明的目的,有益或期望的临床结果包括但不限于减轻一种或多种症状、减轻疾病程度、稳定(即不
恶化)疾病状态、延迟或减缓疾病进展,疾病状态的改善或缓解,以及缓解(无论是部分的还是全部的),无论是可检测的还是不可检测的。治疗可以指与未接受治疗的预期存活相比延长存活。因此,本领域技术人员认识到治疗可以改善疾病状况,但可能不是对疾病的完全治愈。如本文所用,术语“治疗”包括预防。或者,如果疾病的进展减少或停止,则治疗是“有效的”。“治疗”也可以指与不接受治疗的期望存活相比延长生存期。需要治疗的人包括那些已经被诊断出患有心脏病的人,以及那些由于遗传易感性或其他因素(如体重、饮食和健康)而可能发展为心脏病的人。
[0068]
如本文所用,术语“施用”、“引入”和“移植”在描述将本公开的细胞(例如胰腺类器官)置于对象中可互换使用,通过将引入的细胞至少部分定位在所需位置的方法或途径。可以将细胞(例如,胰腺类器官、胰腺β细胞或胰腺β样细胞)直接植入胰腺,或者通过任何合适的途径施用,该途径将细胞递送到受试者的所需位置,其中至少一部分植入的细胞或细胞成分保持活力。给予对象后细胞的存活期可以短至几小时,例如二十四小时,至几天,长至几年。在一些情况下,细胞也可以例如以胶囊(例如,微囊)在非胰腺位置施用,例如在肝脏或皮下,以将植入的细胞维持在植入位置并避免植入的细胞迁移。
[0069]“有效量”是指相对于未治疗的患者而言改善疾病症状所需的量。用于实践本发明以治疗疾病的活性化合物的有效量取决于给药方式、受试者的年龄、体重和一般健康状况。最终,主治医师或兽医将决定适当的量和剂量方案。该量称为“有效”量。
[0070]
本文提供的范围应理解为该范围内所有值的简写。例如,1到50的范围被理解为包括选自下组的任何数字、数字的组合或子范围:1、2、3、4、5、6、 7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、 42、43、44、45、46、47、48、49或50。
[0071]
如本文所用,术语“包含”或“包括“是针对存在于给定实施方式中的组合物、方法及其各自的组分来使用的,为开放式,可包含未指定要素。
[0072]
如本文所用,术语基本上由
“……
组成”是指给定实施方式所需的那些要素。该术语允许存在实质上不影响本公开的该实施方式的基本和新颖的或功能的特征的附加要素。
[0073]
术语由
“……
组成”指本文所述的组合物、方法及其各自的组分,其排除了在该实施方式的描述中未列举的任何要素。
[0074]
本说明书和所附权利要求书中,单数形式“一”和“所述”包括复数含意,除非另有明确说明。因此,例如,“所述方法”包括一种或多种方法,和/或本文所述类型步骤,这些方法对于本领域技术人员在阅读本公开等后将变得显而易见。
[0075]
在以下小节中更详细地描述了各个方面和实施例。本文提供的任何组合物或方法可以与本文提供的任何其他组合物和方法中的一种或多种组合。
[0076]
procr
内分泌祖细胞
[0077]
令人惊讶地发现,procr
内分泌祖细胞作为胰岛中存在的一小部分细胞 (约1-3%)存在于成人胰腺中。procr是编码位于内分泌祖细胞表面的蛋白质的wnt靶基因。人procr是一种高度糖基化的i型跨膜蛋白,具有238 个氨基酸(uniprotkb id no.q9unn8)。这些氨基酸包括信号肽(氨基酸 1017)、细胞外结构域(氨基酸18-210)、21-aa跨膜结构域(氨基酸211-231) 和7-aa胞质内序列(氨基酸232-238)一起编码约46kda的蛋白质。去糖基化会将蛋白质质量降低到25kda。
[0078]
procr是蛋白c的受体,蛋白c是抗凝途径中的关键蛋白。蛋白c 抗凝途径作为控制血栓形成、限制炎症反应和潜在地减少由炎性细胞因子和缺血引起的内皮细胞凋亡的主要系统。该途径的基本成分包括凝血酶、血栓调节蛋白、procr、蛋白c和蛋白s。当凝血酶与内皮表面的血栓调节蛋白结合时启动该途径。procr通过结合蛋白c并将其呈递给凝血酶-血栓调节蛋白激活复合物来增强蛋白c的激活。活化蛋白c(apc)保留其结合procr的能力,并且这种复合物似乎参与了一些下调炎性细胞因子形成(tnf、il-6)的细胞信号传导机制。procr通过炎症介质和凝血酶从脉管系统中脱落。 procr在涉及蛋白酶3和mac-1的过程中与活化的中性粒细胞结合。
[0079]
procr可以被切割以在循环中释放可溶形式(sprocr)。这种sprocr 被检测为43kda的单一物种,这是由于金属蛋白酶的作用导致膜procr脱落,金属蛋白酶受凝血酶和一些炎症介质的刺激。可溶性procr以相似的亲和力结合pc和apc,但它与apc的结合通过阻断其与磷脂的结合并通过消除其灭活因子va的能力来抑制apc的抗凝活性。可以在血浆中检测到 sprocr。在正常人中,sprocr的水平为83.6 /-17.2ng/ml。sprocr水平升高与血栓形成风险升高呈正相关。此外,单倍型(a3等位基因)与sprocr 水平升高(264 /-174ng/ml)有关。
[0080]
人procr的全基因序列为44819bp(genbank id no.nc_000020.11)。人 cdna的序列长度为717bp(genbank id no.nm_006404.4)。小鼠procr基因全基因序列为4354bp(genbank id no.nc_000068.7)。
[0081]
在一些实施方案中,从小鼠胰腺分离的procr
细胞可以表达 r-spondin1(rspo1)、成纤维细胞生长因子1(fgf1)、uroplakin 3b(upk3b)、 homeobox a5(hoxa5)和间皮素(msln)(以及图2f中所示的其他基因),并且这些基因的表达构成了这些祖细胞的独特且先前未报道的表达特征。这些procr
祖细胞可以表现出emt特性。在一些实施方案中,emt特征包括上皮标志物epcam、krt8和cldn10和间充质标志物mmp2、colla1和vim的共表达。 emt在胰岛形成过程中起关键作用。在内分泌胰岛形成之前,定型(committed) 的内分泌前体细胞可能通过emt从躯干上皮脱离。也有人提出,在后期,导管细胞可以作为兼性内分泌祖细胞,这被认为是通过重新唤醒胚胎emt过程而发生的。在特定的培养条件下,β细胞可以经历emt并去分化,从而失去其成熟特征。所得的成纤维细胞样细胞可以广泛扩增并重新分化为内分泌细胞类型。
[0082]
procr
细胞源自ngn3
细胞,ngn3
细胞似乎处于部分emt状态,共表达上皮标志物和间充质标志物。ngn3
细胞存在于胚胎内分泌前体细胞群中,具有相似的emt特征和共享的特征基因,例如procr、rspo1、hoxa 5和decorin(dcn)。ngn3
内分泌前体代表胚胎胰腺中的一种瞬时细胞类型。虽然大多数ngn3
内分泌前体在成熟为内分泌细胞后失去其前体状态,但似乎有一个亚群在器官发生后保留在内分泌祖细胞状态。这个储备种群不表达ngn3,但它保留了emt特征和基因表达特征。
[0083]
这些procr
细胞可以使用本文所述的方法从成人胰腺中分离出来。在本公开的各个方面,procr
内分泌祖细胞被分离,然后在适合于产生胰腺类器官的条件下培养。在一些实施方案中,小鼠procr
内分泌祖细胞还表达procr、rspo1、 hoxa 5和dcn中的一种或多种。在一些实施方案中,可以通过使细胞与特异性结合procr的抗体接触来从胰岛分离procr
祖细胞。在一些实施方案中,procr
祖细胞通过荧光激活细胞分选(facs)分离。本文
还包含本领域已知的用于基于标志物表达分离细胞的其他方法。
[0084]
msln
内分泌祖细胞
[0085]
另一个意外的发现是msln
内分泌祖细胞群作为胰岛中存在的一小部分细胞(约3-5%)存在于成人胰腺中。在一些实施方案中,内分泌祖细胞是 procr
和msln
。
[0086]
间皮素(msln)基因编码71-kd前体(uniprotkb id no.q9unn8),它是一种糖基磷脂酰肌醇(gpi)锚定的膜糖蛋白,在精氨酸295(arg 295)处裂解为两种产物:一个称为巨核细胞增强因子(mpf)的可溶性31-kd n端蛋白和一个40-kd的膜结合片段,称为msln(间皮素)。mpf和msln 都具有生物活性,但它们的确切功能在本公开之前仍不清楚。mpf作为一种细胞因子发挥作用,可以刺激骨髓巨核细胞的集落形成,而其在人体中的活性是未知的。msln最初被描述为在间皮瘤和卵巢癌细胞以及正常间皮细胞上表达的膜蛋白。
[0087]
msln在胸膜、心包和腹膜的正常间皮细胞以及卵巢、阴道膜、睾丸网和输卵管表面的上皮细胞中以微量表达。相反,在各种癌细胞中观察到msln 的异常过表达。此外,msln脱落到实体瘤患者的血清中,称为可溶性msln 相关蛋白(smrp)。smrp的产生可能与异常剪接有关,这导致分泌形式或其通过tnfα转换酶adam17从膜上裂解。smrp也被确定为间皮瘤患者血清中的癌症生物标志物,其中血清中smr水平升高与晚期和疾病负担增加相关。然而,smrp作为卵巢癌肿瘤标志物的敏感性和特异性有限。可溶性msln 在诊断和预测癌症进展中的价值仍有待确定。
[0088]
人msln的全基因序列为8132bp(genbank id no.nc_000016.10)。变体1的人类msln cdna序列长度为1869bp(genbank id no. nm_005823.6)或变体2的长度为1893bp(genbank id no.nm_013404.4)。
[0089]
小鼠msln的全基因序列为5766bp(genbank id no.nc_000083.6)。变体1的小鼠msln cdna序列长度为1878bp(genbank id no. nm_001356286.1)或变体2的长度为1890bp(genbank id no. nm_001374653.1)。
[0090]
在一些实施方案中,从人胰腺分离的msln
细胞可以表达以下一种或多种:upk1b(uroplakin 1b)、s100a6(s100钙结合蛋白a6)、lgals4(半乳凝素4)、sdcbp2(结合蛋白2)、sdc1(多配体聚糖1)、igfbp3(胰岛素样生长因子结合蛋白3)、hmga1(高迁移率组at-hook 1)、itgb4(整合素亚基4)、itgb6(整合素亚基6)、hn1(血液学和神经学表达1)、gprc5a (g蛋白偶联受体c类5组成员a)、slpi(分泌性白细胞肽酶抑制剂)、 lamc2(层粘连蛋白亚基γ-2)、fermt1(铁蛋白家族成员)、mgll(单甘油酯脂肪酶)、msln(间皮素)、sema3b(信号素3b)、tst(硫代硫酸盐硫转移酶)、sfn(分层蛋白)和cdh3(钙粘蛋白3),这些基因的表达构成了这些内分泌祖细胞独特的、以前未知的表达特征。
[0091]
这些msln
细胞可以使用本文所述的方法从成人胰腺中分离出来。在本公开的各个方面,msln
内分泌祖细胞被分离,然后在适合于产生胰岛类器官的条件下培养。在一些实施方案中,人msln
内分泌祖细胞还表达upk1b, s100a6,lgals4,sdcbp2,sdc1,igfbp3,hmga1,itgb4,itgb6,hn1, gprc5a,slpi,lamc2,fermt1,mgll,msln,sema3b,tst,sfn,cdh3 和procr中的一种或多种在一些实施方案中,可以通过使细胞与特异性结合 msln的抗体(或其抗原结合片段)接触,例如抗人msln抗体(biolegend, cat#530203),从胰岛分离msln
祖细胞。在一些实施方案中,msln
祖细胞可以通过荧光激活细胞分选(facs)分离。本文考虑了本领域已知的用于基于标志物表达分离细胞的其他方法。
[0092]
类器官生产
[0093]
在胰腺中识别内分泌祖细胞库(例如,procr
和/或msln
内分泌细胞) 允许原位或离体扩增方法来增加β细胞质量。内分泌祖细胞的扩增和分化能力可用于建立胰岛样器官的扩增和诱导培养系统。由此产生的类器官主要是被α、δ和pp细胞包围的β细胞,这对于类器官功能很重要,因为适当的葡萄糖调节需要各种胰岛细胞类型之间的协调。
[0094]
分离的procr
和/或mslb 细胞可用于产生表现出胰腺功能(例如,葡萄糖输送和胰岛素产生和分泌)的类器官。在一些实施例中,procr
和/或 msln 内分泌祖细胞可以从成人胰岛细胞中分离并培养以产生本公开的类器官,其可以从任何胰腺来源获得。例如,胰岛细胞可以从商业来源或人类来源获得。在一些实施方案中,胰岛细胞的来源是人类尸体。在一些实施方案中,胰岛细胞的来源是胰腺功能异常的人类患者(例如,1型或2型糖尿病患者,或mody(青少年发病的成人型糖尿病)患者)。从人类患者获得的在胰岛中存在的procr
和/或msln
内分泌祖细胞可以培养产生类器官,该类器官包括产生胰岛素的葡萄糖敏感性胰岛细胞(即,β样细胞)。
[0095]
通常,为了形成类器官,首先将分离的细胞扩增。为了扩增细胞(即,形成分离细胞的集落),将细胞在适合细胞生长和繁殖的条件下在类器官培养基中培养。类器官培养基可以是补充有生长因子以促进细胞生长和繁殖的无血清培养基。在一些实施方案中,类器官培养基不包含足以导致细胞分化的分化因子。在一些实施方案中,类器官培养基不含分化因子。可用于类器官培养基的生长因子包括但不限于wnt激动剂chir99021或ngs、tgf-β通路抑制剂 sb431542或a83-01、rho-rock通路抑制剂y27632、bmp抑制剂noggin、 egf(表皮生长因子)、its、fgf2(成纤维细胞生长因子2)、肝素、整合素β1的激活抗体,和b27。此外,生长促进条件可以包括激活wnt、fgf、整合素和/或bmp信号通路的任何条件(例如,培养基、温育时间、培养基更换频率等)。生长促进条件可能需要抑制其他细胞信号通路。例如,在一些实施方案中,生长促进条件可以包括抑制tgfβ和/或rho-rock途径。
[0096]
一种用于培养小鼠细胞的示例性类器官培养基是dmem/f12(含青霉素
‑ꢀ
链霉素)加1-5%(例如,2%)b27,0.1-5%(例如,1%)its,10-200(例如,50)ng ml-1
egf,0.1-5(例如,2)μg ml-1
肝素,1-50(例如,10)ng ml-1
fgf2和1-20(例如,5)ng ml-1
vegfa。用于培养人细胞的另一种示例性类器官培养基是 dmem/f12(含青霉素-链霉素)加1-5%(例如,2%)b27,0.1-5%(例如,1%)its, 10-200(例如,50)ng ml-1
egf,0.1-5(例如,2)μg ml-1
肝素,1-50(例如,10)ngml-1
fgf2,1-10(例如,3)μm chir99021,1-10(例如,2)μm a83-01,10-500(例如,100)ng ml-1
noggin,1-50(例如,10)μm y27632。
[0097]
分离的祖细胞可以在模拟细胞天然存在的至少部分细胞生态位的微环境中培养。细胞生态位(niche)可以通过在生物材料存在下培养干细胞来模拟,所述生物材料有例如代表控制细胞命运的关键调节信号的基质、支架和培养基质。生物材料可以是天然的、半合成的和合成的生物材料,和/或它们的混合物。支架提供二维或三维网络。适用于支架的合成材料包括选自多孔固体、纳米纤维和水凝胶的聚合物,例如肽,包括自组装肽、由聚乙二醇磷酸酯、聚乙二醇富马酸酯、聚丙烯酰胺、聚甲基丙烯酸羟乙酯、聚醋酸纤维素和/或共聚物组成的水凝胶-聚合物(参见,例如,saha等,2007,curr.opin.chem.biol.11(4): 381-387;saha等,2008,biophysical journal 95:4426-4438;little等,2008,chem. rev.108,1787-1796)。如本领域技术人员所知,支架的机械特性如弹性影响干细胞的增殖、分化和迁
移。优选的支架包含可生物降解的(共)聚合物,其在移植到受试者体内后被天然存在的成分替代,例如以促进组织再生和/或伤口愈合。进一步优选地,支架在移植到受试者后基本上不诱导免疫原性反应。所述支架可以补充有天然的、半合成的或合成的配体,它们提供干细胞增殖和/或分化和/或迁移所需的信号。在一个优选的实施方案中,配体包含确定的氨基酸片段。合成聚合物的实例包括f127嵌段共聚物表面活性剂(basf)和(johnson和johnson)。
[0098]
细胞生态位部分由祖细胞和周围细胞以及由生态位中的细胞产生的细胞外基质(ecm)决定。在一些实施方案中,分离的细胞附着于ecm。ecm由多种多糖、水、弹性蛋白和糖蛋白组成,其中糖蛋白包括胶原蛋白、肌动蛋白 (巢蛋白)、纤连蛋白和层粘连蛋白。ecm由结缔组织细胞分泌。不同类型的ecm是已知的,包括不同的成分,包括不同类型的糖蛋白和/或不同的糖蛋白组合。ecm可以通过在容器中培养ecm产生细胞,例如成纤维细胞,然后除去这些细胞和添加分离的祖细胞来提供。产生细胞外基质的细胞的例子是软骨细胞,主要产生胶原蛋白和蛋白多糖,成纤维细胞,主要产生iv型胶原蛋白、层粘连蛋白、间质前胶原和纤连蛋白,以及结肠肌成纤维细胞,主要产生胶原蛋白(i、iii和v型)、软骨素硫酸盐蛋白聚糖、透明质酸、纤连蛋白和生腱蛋白-c。或者,ecm可以商购。可商购的细胞外基质的例子是细胞外基质蛋白(invitrogen)和matrigeltm(bd biosciences)。使用ecm培养祖细胞增强了细胞的长期存活和未分化细胞的持续存在。此外,ecm的存在允许培养三维组织类器官。
[0099]
在一些实施方案中,适合使用的ecm可以包括至少两种不同的糖蛋白,例如两种不同类型的胶原或胶原和层粘连蛋白。ecm可以是合成水凝胶细胞外基质或天然存在的ecm。matrigel tm(bd biosciences)提供了示例性的 ecm,其包含层粘连蛋白、巢蛋白和胶原蛋白iv。
[0100]
在一些实施方案中,分离的procr
和/或msln
细胞可以与内皮细胞以约 1:10至约10:1,例如约1:5、约1:3或约1:1的比例共培养。内皮细胞提供关键的生态位成分,并且在一些实施方案中,共培养基补充有vegfa。
[0101]
类器官可以每5-30天传代一次以扩大。对于传代,类器官可以使用分散酶从基质胶中释放出来并解离成单个细胞(例如,使用胰蛋白酶-edta)。然后可以将单细胞悬液与新鲜分离的cd31 ecs以1:1的比例混合,然后以约 1:2-1:10、或约1:3-1:8、或约1:4-1:6的分流比重涂。类器官可以传代至少20次 (约6个月),至少30次,或无限期地传代,扩增速率不会减慢。
[0102]
这种扩张持续时间为类器官提供了成熟的时间,使得β样细胞能够响应葡萄糖刺激而产生和分泌胰岛素。然后可以将这些传代的类器官从扩增循环中取出并使其成熟一段额外的时间(例如,约1-4周或约2-3周或约3周(重新接种为单细胞后28-30天)),成熟的类器官可能看起来类似于初级类器官。在一些实施方案中,对类器官进行测试以确定它们产生和分泌胰岛素的能力。在一些实施方式中,所述测试在体外进行。在一些实施方案中,在体内进行测试,例如,在将类器官移植到受体(例如,小鼠或人)中之后。可以通过本领域已知的任何技术评估类器官中或由类器官产生的胰岛素和/或分泌。例如,胰岛素的表达可以通过酶联免疫吸附测定(elisa)或其他免疫测定进行评估,该测定利用特异性结合胰岛素(或在类器官中表达的另一种感兴趣的分子,包括但不限于胰高血糖素、生长抑素和胰多肽)的抗体。在一些实施方案中,可以通过在培养物中获得至少一种类器官并直接对其进行
测试来在体外评估类器官中胰岛素产生的检测。可以通过本领域已知的任何方式在体外在培养基中检测类器官的胰岛素分泌。例如,可以将培养物离心并测试不含类器官(或基本上不含)的上清液中的胰岛素。在一些实施方案中,可通过分析来自已接受本公开的类器官治疗的受试者的采血并与治疗前受试者中的胰岛素水平比较来评估移植的类器官的体内胰岛素产生。所述测量是本领域常规的。
[0103]
使用产生胰岛素的类器官
[0104]
源自procr
和/或msln
的内分泌祖细胞,例如本文所述的类器官或使用本文所述的方法产生的类器官可用作治疗和预防糖尿病(dm)或对目前描述的产生胰岛素有反应的任何疾病或病症的治疗剂和预防剂类器官。
[0105]
实现最佳或令人满意的结果所必需的药物组合物中本文所述的类器官的数量可能因接受治疗的受试者而异。例如,完全丧失内源性胰岛素产生的人所需的类器官的数量可能少于保留至少一些内源性胰岛素产生的患者所需的类器官的数量。在一些实施方案中,存在于药物组合物中的类器官的数量可以在约100至约10,000,000个类器官之间,约1,000-1,000,000个类器官,或约 10,000-100,000个类器官,或任何更小、更大或介于两者之间的数量。确定精确的有效剂量可以基于每个个体受试者的因素,包括他们的大小、年龄、性别、体重和状况。本领域技术人员可以从本公开内容和本领域知识容易地确定剂量。本领域技术人员还可以容易地确定组合物中的和在本发明的方法中施用的类器官的数量和任选的添加剂、媒介物和/或载体的量。
[0106]
本公开的特征在于可用于治疗糖尿病的治疗方法的组合物和方法。更具体地,将上述类器官施用于有需要的人(例如,人类糖尿病患者),其可以改善、减少或以其他方式治疗或预防患者的异常胰腺功能。在一些实施方案中,类器官来源于从患者获得的内分泌祖细胞,任选地随后通过基因编辑例如crispr 来校正突变(如果有的话)。从患者身上获取自体胰岛细胞可降低对患者进行类器官排斥的风险。在一些实施方案中,类器官来源于从异源人类受试者(例如类器官库或库)获得的内分泌祖细胞。
[0107]
用于治疗糖尿病(或可能对类器官有反应的任何其他疾病或病症)的本公开的类器官的施用可以通过任何合适的方式,这些方式使得治疗性类器官的浓度有效改善、治疗或预防糖尿病。
[0108]
在一些实施方案中,类器官被直接移植到患者的胰腺或身体的其他部位,例如肝脏、脾脏、肾包膜、网膜袋、皮肤、肌肉、骨髓(参见例如,doi: 10.3389/fmed.2018.00202,其通过引用并如本文)。还可以向受试者施用抗排斥药物以降低移植的类器官被患者免疫系统排斥的可能性。
[0109]
在一个方面,本发明提供了一种监测治疗进展的方法。该方法包括确定患有或易患糖尿病、或与胰岛功能受损相关的其他疾病或症状的受试者的胰岛素 (或其他标志物(例如胰高血糖素、生长抑素或胰多肽)或诊断测量(例如筛选、测定)水平)的步骤,其中,受试者已被施用本文公开的足以治疗疾病或其症状的procr
和/或msln
类器官的有效量。可以将在该方法中确定的胰岛素(或其他标志物)水平与健康正常对照或其他患病患者中的已知胰岛素水平进行比较,以确定受试者的疾病状态。在另一个实施方案中,在确定第一水平之后的时间点确定受试者中胰岛素的第二水平,并且将这两种水平进行比较以监测疾病进程或治疗的功效。在某些优选的实施方案中,在开始根据本发明的治疗之前确定受试者
中胰岛素(或其他标志物)的治疗前水平;然后可以将该治疗前胰岛素(或其他标志物)水平与治疗开始后受试者中的胰岛素(或其他标志物)水平进行比较,以确定治疗的功效。
[0110]
筛选试验
[0111]
本公开的一些方面提供筛选测定,其中procr
和/或msln
本公开的内分泌祖细胞或类器官在体外环境中用于测试胰岛素产生激动剂或拮抗剂或用于诱导或以其他方式影响胰腺内分泌祖细胞分化的其他化合物、组合物或试剂的功效。在一些实施例中,所述类器官来源于健康受试者获得的procr
和/或 msln
内分泌祖细胞。在其他实施方案中,所述类器官来源于患有糖尿病或以胰岛功能受损为特征的另一种疾病或病症的受试者。如果胰岛素产生激动剂或其他化合物或组合物在促进胰岛素增加方面有效,那么胰岛素将在培养基中积聚并且可以定量。在一些情况下,给予类器官的所述化合物或组合物可能对类器官的健康有害。例如,类器官可能会停止生长和/或繁殖,可能会表现出改变的形态,或者可能会死亡。这样的结果表明该化合物或组合物具有毒性特征。
[0112]
在一些实施方案中,包含本公开的类器官的体外筛选可用于更好地了解β细胞或胰岛功能或其他内分泌细胞功能。在一些实施方案中,由procr
和/或 msln
可以研究源自患有疾病或病症(例如,糖尿病)的受试者的内分泌祖细胞,以更好地了解导致受试者疾病或病症的分子和细胞因素,包括基因突变和微环境因素。
[0113]
提出以下实施例是为了向本领域普通技术人员提供有关如何进行和使用本发明的测定、筛选和治疗方法的完整公开和描述,而不是限制本发明的范围。发明者认为他们的发明。
实施例
[0114]
实施例1:来自常驻procr
祖细胞的胰岛类器官的长期扩增
[0115]
成人胰岛中的procr
祖细胞群
[0116]
由于procr是一种表面蛋白,据报道它可以标记几种成人组织中的干细胞,包括乳腺(wang等,2015),内皮细胞(yu等,2016)和造血系统(balazs等, 2006;fares等,2017;iwasaki等,2010;zhou等,2016),我们使用单细胞(sc)rna 测序在小鼠胰岛中搜索procr阳性细胞。分离来自8周龄成年小鼠的胰腺并富集内分泌细胞(参见下面的方法部分)。使用单细胞rna测序方法对7,160 个细胞进行了分析(图1a-1d)。每个簇被映射到已知丰富的内分泌(α,β-,δ和pp细胞),丰富的外分泌(腺泡和导管细胞),或稀有(间充质、内皮、免疫细胞和星状)细胞类型(图1d-1g)。单个簇包含不同于任何已知细胞群的细胞(图1f-1h)。该新细胞群显示出独特的特征基因,包括rspo1、fgf1、 upk3b、hoxa5、和procr(图1h-1k),但是不表达已知的内分泌或外分泌分化标志物,如t分布随机邻域嵌入所示(图1d、1e、1g、1k)。基因本体(go) 分析鉴定了细胞迁移、上皮间质转化(emt)和wnt信号通路-go术语的富集(图1l)。wnt激动剂基因rspo1和wnt靶基因procr的特征表达表明wnt 信号通路活性增强。t-sne分析显示的新细胞群中上皮标志物(epcam、krt8 和cldn10)和间充质标志物(mmp2、col1a1和vim)共表达,所述分析支持了其emt特征(图1m)。
[0117]
emt与由定型内分泌前体细胞形成内分泌胰岛有关(rukstalis和habener, 2007)。新群体中缺乏分化标记表达也表明潜在的前体状态。为了深入了解新种群的性质,将表达数据与先前报道的胚胎内分泌祖细胞数据集合并(byrnes 等,2018;scavuzzo等,
2018)。在成人胰腺中观察到的所述新群与第14.5天的neurog3(ngn3)
细胞簇一致(图2a-2b)。有趣的是,在e14.5的这个群体也表现出emt特征,即上皮和间充质标志物的组合表达(图2c)。所述 e14.5集落为ngn3
,而成人对应物是ngn3-(图2d)。重要的是,所述e14.5 种群共享一个基因特征,包括rspo1、fgf1、dcn、upk3b、hoxa5、和procr (图2e-2g)。所述e14.5种群与胚胎内分泌前体的相似性表明procr
种群代表了一种祖细胞状态。因此,通过使用monocle 2的拟时间分析来检查已识别的内分泌群体之间的前体-后代关系(qiu等,2017)。如此预测了两种发育轨迹:一种朝向β细胞,一种朝向α细胞(图2h-2i)。
[0118]
对胰岛中的procr
细胞排序
[0119]
胰岛和非胰岛组织通过手工挑选分离。胰岛细胞制备物经历血系的阴性选择,上皮细胞的阳性选择,然后进一步分离成procr
(lin-,epcam
,procr
) 和procr-(lin-,epcam
,procr-)群(图3a-3b)。使用的抗procr抗体是来自ebioscience的pe或apc抗小鼠procr(克隆1560)。小群(1.0
±
0.14%) 的胰岛细胞是procr
(图3b-3c)。考虑到稀有的间充质细胞、星状细胞和内皮细胞可以表达procr,如单细胞rna测序所示的(图1h),procr
和procr-细胞也从非胰岛细胞中分离出来。qpcr分析表明新群的特征基因,例如rspo 1、fgf1、upk3b和hoxa5,仅在procr
胰岛细胞中表达(图3d)。
[0120]
接下来分析ngn3-cre;r26-tdtomato小鼠,其中,所有内分泌谱系都在 tdtomato中标记,因此它们都来自胚胎ngn3
内分泌祖细胞(gu等,2002)。 facs分析证实procr
胰岛细胞都是tdtomato
(图3e),将细胞鉴定为ngn3
内分泌前体的后代。值得注意的是,它们似乎代表了一种缺乏α、β、δ和pp 细胞分化标志物表达的新型后代。
[0121]
为了使该群可视化,产生了在procr的atg处插入有膜gfp(mgfp)-2a-lacz盒的双报告基因等位基因(图3f-3i)。如全封装x-gal染色所示,procr表达发生在胰岛中分散模式的少数细胞中(图3j)使用facs 通过procr抗体进一步验证mgfp
细胞(图3k)。全封装胰岛染色证实 mgfp
(procr
)细胞不表达内分泌分化标志物(图3l),但共表达上皮标志物 epcam和间充质标志物col1a1(图3m),这与单细胞rna测序分析一致。
[0122]
单个procr 胰岛细胞在培养中形成胰岛样类器官
[0123]
假设procr
胰岛细胞可以作为体外新β细胞的细胞来源。procr
胰岛细胞经过facs分离,并在无血清培养基中3d培养以克隆密度接种,补充有生长因子,包括b27、its、egf、肝素和fgf2。虽然未分选的胰岛细胞集落形成效率非常低(即,从2,000个铺板的总细胞中形成1个集落),但procr
胰岛细胞的克隆形成性增加了130倍(即,15个铺板细胞中有1个形成集落)(图 4a)。相反,procr-胰岛细胞不能形成集落(图4b)。然而,来自未分选的胰岛细胞或procr
胰岛细胞的集落不能维持超过7天。
[0124]
内皮细胞(ecs)被提议作为关键生态位组件,然后被添加到共培养中(补充有vegfa,参见下面的方法部分)。当与ec共培养时,procr
胰岛细胞表现出强大的集落形成能力(即,由4个铺板的procr
细胞形成1个集落)。从第5天开始容易观察到集落。到第8天,观察到平均直径为145μm的菌落 (图5a)。相反,procr-胰岛细胞保持为单个细胞(图5a)。procr
细胞来源的集落在相同条件下继续培养总共28天。观察到更精细结构的形成:在中心具有大的上皮类器官,被内皮网络包围和浸润(图5b)。平均类器官直径达到210μm(图5b-5c),与体内小鼠胰岛的大小相似。
[0125]
检查胰岛素(ins)表达作为功能性β细胞形成的指示。ins染色在第7天不存在并且
在第28天以低水平出现(图5d)。在葡萄糖刺激后(用低浓度葡萄糖孵育12小时,然后用高浓度葡萄糖处理12小时,总共3轮,参见下面的方法部分),第28天类器官中的ins表达达到与新鲜分离的胰岛相当的水平 (图5d-5e)。然而,相同的葡萄糖刺激治疗对第7天类器官中的ins表达只有适度的影响,这表明长时间培养对于β细胞的形成至关重要。通过qpcr分析测量,与新鲜分离的胰岛相比,β细胞关键调节因子mafa、ucn3和pdx1 在第28天高糖处理的类器官中上升到相似的水平(图5f)。第28天,类器官响应葡萄糖迅速增加细胞溶质ca
2
浓度并随后恢复到基线(图5g),表明它们能够对葡萄糖作出急性响应(mohammed等,2009)。.通过透射电子显微镜(tem)进行的超微结构分析显示,第28天的类器官含有丰富的内分泌颗粒(图5h-5i)。elisa证实了在第28天的类器官受到葡萄糖刺激后培养基中的胰岛素分泌(图5j)。除了丰富的ins
β样细胞外,类器官还含有较少数量的胰高血糖素(gcg)
α样细胞、生长抑素(sst)
δ样细胞和胰多肽 (ppy)
pp样细胞,使人联想到新鲜胰岛的组成(图5k-5n)。因此,建立了利用procr
细胞的内分泌祖细胞样能力的培养系统,这允许在体外产生胰岛样器官。这些类器官内的细胞能够产生包装好的胰岛素颗粒、能进行葡萄糖检测 (sensing)和胰岛素分泌。
[0126]
胰岛样类器官能在体外长期扩增
[0127]
上文所述类器官通过传代扩增。在补充新鲜ec的相同培养条件下,每7-8 天以1:4-6的比例重新接种分离的单细胞(即,将1个孔中的细胞重新接种到 4-6个孔中)(参见下面的方法部分)。在该培养系统中,平均类器官大小在传代期间保持稳定(图6a、6b)。然而,类器官的数量随着每次传代增加了 3到7倍(图6c)。类器官可以传代至少20次或6个月,而扩增速率没有减慢(图6c)。
[0128]
当将传代的类器官从扩增循环中取出并使其成熟额外3周(即,在被重新接种为单细胞后28-30天;参见图6d)时,出现类似于上述初级类器官的成熟类器官。以第7代和第15代类器官为例,与初级通道类器官相比,它们显示了相似的α、β、δ和pp细胞百分比(图6e-6h)、葡萄糖检测和胰岛素分泌能力、胰岛素颗粒数和ca
2
响应(图5g-5h,图6i-6n)。这些结果表明细胞的扩增和分化能力长期保持。
[0129]
长期培养的类器官在体内逆转糖尿病
[0130]
长期培养的类器官移植到链脲佐菌素(stz)诱导的糖尿病小鼠的肾囊中,以测试类器官的全部潜力。监测所述小鼠的血糖改善。每只受体小鼠移植了 1000个类器官(来自第7代或第15代,在培养的第7天采集)或300个新鲜分离的胰岛,它们含有相似的细胞数量(约300,000个细胞)。移植后1 周,血糖水平明显降低(图7a),体重减轻停止(图7b)。在整个分析期间维持血糖改善(图7a)。值得注意的是,类器官移植组表现出与新鲜胰岛移植组相似的拯救效果(图7a和7c)。在移植后1个月,移植了类器官的小鼠表现出葡萄糖清除能力和血清胰岛素水平与接受新鲜胰岛的小鼠几乎相同(图 7c-7d)。因此,移植的类器官能够在糖尿病小鼠模型中分泌胰岛素并改善进行性高血糖症。
[0131]
移植后1个月取出移植的类器官细胞并进行分析。检测到所有四种内分泌细胞类型,其中绝大多数是ins
β细胞(图7e-7f)如tem所示(图7g),移植的细胞还含有高密度的内分泌颗粒。通过单细胞rna测序进一步分析鉴定所述细胞。移植的细胞在体内成熟后与原代内分泌细胞聚集在一起(图7h-7k)。特别地,编码胰岛细胞标志物、激素和转录调节因子的基因在原代小鼠内分泌细胞和移植的类器官细胞之间以相当的水平表达(图7l-7n)。
[0132]
讨论
[0133]
在目前的研究中,我们确定了成年小鼠胰腺中的一组内分泌祖细胞。这些细胞不表达已知的成熟内分泌细胞标志物,具有emt特征,并在其表面表达 procr。分离的procr
胰岛细胞可以克隆密度生长成胰岛样类器官,包括所有内分泌细胞类型,并能够检测葡萄糖和分泌胰岛素。这些类器官可以通过长时间的连续传代在体外呈指数级扩增。长期培养的胰岛样器官可以在体内逆转糖尿病。
[0134]
emt在胰岛形成过程中起关键作用。在内分泌胰岛形成之前,定型的内分泌前体细胞可能通过emt从躯干上皮分离(rukstalis和habener,2007)。也有人提出,在后期,导管细胞可以作为兼性内分泌祖细胞,这被认为是通过重新唤醒胚胎emt过程而发生的(al-hasani等,2013)。在特定的培养条件下,β细胞可以经历emt,去分化从而失去其成熟特征。所得的成纤维细胞样细胞可以广泛扩增并重新分化为内分泌细胞类型(gershengorn等,2004; ouziel-yahalom等,2006;russ等,2008)。在本研究中,我们确定了健康成人胰岛中的一组细胞,这些细胞似乎处于部分emt状态,共表达上皮标志物和间充质标志物。有趣的是,胚胎内分泌前体细胞群中似乎也存在对应的细胞群,具有相似的emt特征和共享特征基因,如procr、rspo1、hoxa 5和dcn等。 ngn3
内分泌前体代表胚胎胰腺中的一种瞬时细胞类型。虽然大多数ngn3
内分泌前体在成熟为内分泌细胞后失去其前体状态,但似乎有一个亚群在器官发生后保留在内分泌祖细胞状态。这个储备群体不再表达ngn3,但它保留了 emt特征和指示的特征基因。使用ngn3-cre介导的谱系追踪,我们确认 procr
细胞(内分泌祖细胞)来自ngn3
内分泌前体。
[0135]
作为这些细胞的替代来源,我们不能正式排除导管树。越来越多的证据表明成人胰腺导管树内存在胰腺祖细胞池。胰腺的严重损伤会刺激非内分泌前体细胞,例如导管细胞,增殖并分化为腺泡(criscimanna等,2011;furuyama等, 2011),导管(criscimanna等,2011;furuyama等,2011;kopp等,2011),以及内分泌谱系(包括-细胞)(criscimanna等,2011;inada等,2008;pan等, 2013;van de casteele等,2013;xu等,2008)。在本研究中,我们在procr
内分泌祖细胞已经物理位于胰岛中的状态下分析该内分泌祖细胞。我们通过 lacz和mgfp敲入报告基因对这些细胞进行可视化,我们通过手工挑选的胰岛中的epcam 和procr
表面标记对这些细胞进行facs分离。我们进一步研究它们在培养中的克隆形成、扩增和多能内分泌谱系分化能力。
[0136]
鉴定胰腺本身的内分泌祖细胞库允许原位或离体扩增方法来增加β细胞质量。本研究探讨了后一种可能性。通过建立用于胰岛样类器官扩增和诱导的培养系统,我们利用了内分泌祖细胞的扩增和分化能力。由此产生的类器官主要是被α、δ和pp细胞覆盖层包围的β细胞。我们证明这些类器官是改善小鼠模型糖尿病的有用细胞来源。越来越多的证据表明,适当的葡萄糖调节需要各种胰岛细胞类型之间的协调(johnston等,2016;van der meulen等,2015)。因此,在体外产生整个胰岛而不是将细胞分化成特定细胞类型可能是有利的。
[0137]
总之,本研究在成年小鼠胰腺中发现了一种新的内分泌祖细胞,并建立了一种用于长期扩增和诱导胰岛样器官的体外方法。最终,所述祖细胞群可能会因其在人类中的存在和对糖尿病的治疗而被开发。
[0138]
方法
[0139]
关键资源表
[0140][0141]
[0142]
[0143]
[0144][0145]
实验动物:
[0146]
本研究中使用了rosa26-tdtomat,ngn3-cre,actin-dsred,procr
mgfp-2a-lacz
,野生型cd1,c57bl/6,fvb/nj和裸鼠。所述procr
mgfp-2a-lacz
小鼠品系是通过敲入procr基因起始密码子后面的mgfp-2a-lacz盒产生的。靶向构建体、 southern印迹验证和基因分型方法显示在图3g-3i中。所有动物实验程序均经中国科学院上海生物化学与细胞生物学研究所动物护理与使用委员会批准,项目许可证号为ibcb0065。
[0147]
胰岛富集和纯化
[0148]
通过从总导管注射2-4ml消化缓冲液(含有iv型胶原酶(1000-1500 u/ml)、10%fbs(胎牛血清)和25mm hepes)的dmem 1640培养基来灌注小鼠胰腺。然后仔细解剖胰腺以保持灌注组织的完整性,然后在37℃下孵育5-6分钟,然后轻轻摇动3-6分钟。适当的灌注和消化时间对于胰岛产量和结构完整性至关重要。消化后,将组织悬浮在含有10%fbs的20mlhbss中,并在20秒内上下剧烈摇晃40次,然后洗涤两次hbss。然后用 500μm细胞过滤器过滤消化的组织。为了丰富胰岛,过滤后的样品进行密度梯度离心或转移到显微镜下以手动挑选胰岛。为了准备密度梯度离心,首先将组织重新悬浮在10ml histopaque-1077中,然后用10ml hbss缓慢覆盖而不破坏界面。所述再悬浮组织以2,400rpm的速度离心22分钟,加速和制动最慢,以获得hbss/histopaque-1077界面处的富集胰岛隔室。密度梯度离心步骤后,胰岛的纯度约为20%至70%,具体取决于早期灌注和消化过程的质量。为确保胰岛的高纯度,将样品重新悬浮在含有10%fbs的hbss中进行手工挑选。高纯度胰岛在解剖显微镜下手工挑选至少3轮。
[0149]
胰岛x-gal染色
[0150]
纯化胰岛的x-gal染色是按照标准方案进行的,有微小的变化。简而言之,胰岛在4℃的fix a溶液(1%甲醛、0.2%戊二醛、0.02%np-40的pbs) 中固定30分钟,用pbs洗涤3次,然后在x-gal染色液中染色(1mg/mlx-gal、5mm k3[fe(cn)6]、5mm k4[fe(cn)6]、2mm mgcl2的pbs溶液)在室温下放置5小时。染色后,用pbs清洗胰岛,用zeiss倒置显微镜拍摄全封装图像。
[0151]
免疫荧光、全封装染色和显微镜检查
[0152]
为了准备冷冻切片的样品,将解剖的胰腺在4℃下固定在4%pfa中4 小时,用pbs洗涤3次,然后用最佳切割温度(oct)包埋。将组织切片与一抗在4℃下孵育过夜,然后在pbst(pbs 0.1%triton-x 100)中洗涤,并在室温下与二抗和dapi孵育2小时。然后将切片清洗并封装用于共聚焦成像。
[0153]
为了进行全封装染色,将胰岛或培养的类器官在4℃下固定在4%pfa 中1小时,然后进行3次pbs洗涤。然后将胰岛或培养的类器官在室温下用全封装封闭缓冲液封闭1小时。封闭缓冲液在pbst中含有10%fbs。一抗在封闭缓冲液中稀释,并在用pbst洗涤3次后在4℃下孵育过夜。二抗和dapi在4℃下孵育过夜。然后清洗胰岛或类器官,并用封装介质封装以进行共聚焦成像。
[0154]
所有共聚焦图像均由安装在leica dmi6000显微镜上的leica sp8共聚焦检测系统捕获。
[0155]
胰岛单细胞悬液的制备和facs分析
[0156]
纯化的胰岛样品在37℃下用2ml 0.05%胰蛋白酶-edta处理4分钟,然后用0.1mg/ml dnase i消化4分钟并轻轻移取样品约20次。消化的细胞通过70μm细胞过滤器过滤。
[0157]
对于facs分析和细胞分选,抗体在hbss中冰上孵育25分钟,其中5%fbs稀释为1:200。所有分析和分类实验均使用facs jazz(bectondickinson)进行。对分选种群的纯度进行常规检查,确保95%以上。
[0158]
小鼠胰岛类器官的共培养和传代
[0159]
将200μl matrigel包被在48孔板的一个孔中,然后转移到37℃esco 培养箱中进行凝胶化。小鼠胰岛epcam
、procr
/-细胞从手工挑选的野生型 cd1、c57bl/6或fvb小鼠胰岛中进行facs分选。cd31
内皮细胞(ecs) 从腹股沟脂肪垫或actin-dsred小鼠的皮肤中分离出来。胰岛细胞和ecs以 1:3的比例混合并接种在500μl包含dmem/f12(含青霉素-链霉素)加2% b27、1%its、50ng/ml egf、2μg/ml肝素、10ng/ml fgf2和5ng/ml vegfa 的小鼠类器官培养基中。培养基每2-3天更新一次。为了诱导β细胞成熟,进行了葡萄糖激发。将hbss中的20mm葡萄糖与有机体培养基以1:1的比例混合,以制备最终浓度为11mm葡萄糖的高浓度葡萄糖培养基。首先将类器官在低浓度葡萄糖(2mm)中培养12小时,然后在高浓度葡萄糖(11mm) 中培养12小时3轮。
[0160]
类器官每6-14天传代一次。为了传代,使用分散酶(37℃40分钟)从基质胶中释放类器官,并用1ml 0.05%胰蛋白酶-edta(37℃6-9分钟)解离成单细胞。单细胞悬液与新鲜分离的cd31 ecs以1:1的比例混合,然后以1:4-6 的分流比重新接种。
[0161]
葡萄糖刺激的胰岛素分泌
[0162]
在第28天培养时使用了大约100个小鼠类器官。首先用krebs缓冲液洗涤类器官3次,然后在低浓度葡萄糖(2mm)中预孵育2小时以去除残留的胰岛素。然后将类器官在krebs缓冲液中洗涤2次,然后在低浓度葡萄糖中孵育30分钟。收集上清液样品,将类器官在krebs缓冲液中洗涤2次,然后在高浓度葡萄糖(20mm)中孵育30分钟,然后收集上清液样品。该过程重复两次。使用小鼠超灵敏胰岛素elisa试剂盒按照标准方案分析上清液样品中的胰岛素水平。
[0163]
透射电子显微镜(tem)。
[0164]
为了制备tem样品,将类器官或胰岛在4℃下固定在0.1m二甲胂酸钠缓冲液(ph 7.4)中的1%戊二醛中过夜,然后在4℃下在2%四氧化锇水溶液中固定1.5小时。然后将样品在逐渐的乙醇(30%至100%)和环氧丙烷中脱水,嵌入epon812中,并在60℃下固化48小时。在200目铜网格上收集50nm超薄切片,并用乙酸双氧铀(10分钟)和柠檬酸铅(5分钟) 染色,然后通过透射电子显微镜检查。使用fei tecnai g2 spirit透射电子显微镜拍摄图像。
[0165]
ca
2
成像
[0166]
在分散酶解离后收获类器官,并平铺在没有基质胶的35mm玻璃底培养皿上24小时。细胞簇用krebs缓冲液洗涤两次,并用fluo4-am孵育30分钟。fluo4-am用krebs缓冲液洗掉,细胞簇在没有染料的情况下在37℃下再孵育15分钟。然后将细胞簇放置在nikon ai倒置共聚焦显微镜上,以获取高分辨率时间序列图像。每10秒采集一次时间序列图像。成像期间葡萄糖挑战进展和刺激时间的条件如下:低浓度葡萄糖(2mm)中5分钟,用krebs 洗涤,在高浓度葡萄糖(20mm)中5分钟,用krebs洗涤。这种连续处理进行了3次,然后用含有30mm kcl的2mm葡萄糖进行最终孵育5分钟。对于平均荧光强度的测量,图像通过imaris软件(v8.2.0)进行定量。
[0167]
糖尿病小鼠移植
[0168]
在移植前7天,通过单次腹膜内注射链脲佐菌素(stz,160mg/kg在ph 4.5柠檬酸盐缓冲液中)对裸受者诱发糖尿病。使用onetouch血糖仪从尾静脉样品中测量非空腹血糖,以选择血糖水平增加到约20mm的糖尿病受者。将300个小鼠胰岛或1,000个类器官(第7代或第15代,在第7天培养) 移植到受体小鼠的肾囊下方。移植1个月后常规测量非空腹血糖和体重。移植后1个月按照标准方案进行葡萄糖耐量测试(gtt)。
[0169]
简而言之,小鼠禁食过夜并接受每公斤体重2克葡萄糖的腹膜内注射。
[0170]
在葡萄糖激发后0、15、30、60、90和120分钟测量血糖水平。还收集葡萄糖注射前后的血清样品并通过elisa测量。移植后1个月处死受体,收获再生组织进行切片和内分泌标记染色或消化成单细胞进行透射电镜分析和 10x sc rna测序。
[0171]
rna分离和pcr
[0172]
按照制造商的说明进行原代细胞或类器官的rna分离。样品在rnaisoplus中裂解。使用primerscript rt主试剂盒将提取的rna逆转录为cdna。 qpcr样品使用sybr green mixture制备,并使用applied biosystemsstepone plus机器进行检测。所有qpcr引物都列在上面的关键资源表中。
[0173]
使用10x基因组铬平台进行单细胞rna测序
[0174]
对于初级胰腺单细胞rnaseq,使用用于重复1和重复2的icr小鼠和用于重复3的c57bl/6小鼠进行3次生物重复。如上所述,通过密度梯度离心富集胰岛。为了尽量减少组织解离过程中释放的外分泌酶的损害,手挑胰岛没有作为纯化步骤进行(在室温下手工采摘胰岛至少需要1小时)。或者,使用tsq(6-甲氧基-8-对甲苯磺酰胺-喹啉)通过facs分选以富集内分泌细胞(huch等,2013)。将细胞重新悬浮在含有tsq(0.2mg/ml)的溶液中。在 facs分选后,内分泌(tsq
)和非内分泌(tsq-)隔室以1:1的比例混合在一起,形成一个测序样品。在加载到3'库芯片之前在显微镜下检查细胞质量,并确保细胞活力高于75%,确保超过90%的细胞为单峰。加载了13,000个单细胞,回收率为3,706;2,349;和1,111个细胞。分别对于每个生物重复。内分泌室与非内分泌室的输出比高于1:1。这可能是由于腺泡细胞相对较大,导致在使用10x genomics方法时它们的代表性不足(见下文)。
[0175]
为了取回移植的细胞进行测序,将移植物从肾脏中仔细解剖,然后用胰蛋白酶-edta和dnase i切碎和消化移植物。分离的单细胞对tsq
细胞进行 facs分选,对其进行测序,然后与原代小鼠胰岛细胞比较。加载从3只受体小鼠(1只移植第7类器官的小鼠和2只移植第15类器官的小鼠)收集的13,000个移植细胞,回收了2,129个细胞。
[0176]
对于文库制备,根据制造商的建议(10x genomics),将单细胞加载到铬单细胞3'文库(v2)的3'文库芯片上。简而言之,在gemcode仪器中将单个细胞分成乳液中的凝胶珠,进行细胞裂解和rna的条码逆转录,然后进行扩增、剪切和5'接头和样品索引连接。在illumina hiseq pe150上对文库进行测序。
[0177]
使用cell ranger(v2)管道(10x genomics)执行过滤(多路处理)、与 mm10转录组的比对和唯一分子标识符(umi)-折叠。seurat 3r包用于数据集成、分析和可视化,如butler等在nat biotechnol 36,411-420(2018)中所述,其内容通过引用整体并入本文。具体来说,seurat对象是通过选择在至少两个细胞中表达的基因以及至少检测到300个基因和检测到3,000个umi的细胞来创建的。从重复3原代胰腺样品中仅过滤了6个细胞(从1,111个细胞到1,105个细胞)。在涉及来自byrnes等,nat commun 9,3922(2018)和 scavuzzo等,nat commun 9,3356(2018)的e14.5 ngn3
单细胞rna测序数据的分析中(各自的内容通过引用以其整体并入本文),相同的过滤标准用于 seurat对象的创建,并且ngn3
细胞通过neurog3 umi》0过滤。采用“vst”方法发现可变基因,选取前2000个基因进行主成分分析(pca)。使用t随机邻域嵌入方法(tsne)进行降维。使用了前20个主成分(pc)。细胞簇基于共享最近邻(snn)方法,原代细胞或原代vs移植细胞的分辨率值设置为 0.9,原代vs e14.5 ngn3
细胞的分辨率值设置为0.8。基于表达谱和标记基因的相似性,一些簇被组合成一种细胞类型。对于数据显示,分别使用seurat工具包vlnplot、doheatmap、dotplot和featureplot函数生成给定基因的小提琴图、热图、点图和单个tsne图。
[0178]
如qui等在nat methods 14,979-982(2017)中所述,使用monocle 2r包对原代胰腺细胞进行拟时间分析,其内容以引用的方式整体并入。将α、β、δ、 pp和新细胞群直接从seurat转移到monocle 2以创建monocle celldataset 对象,并进一步过滤了321个细胞。seurat鉴定的前2,000个可变基因被用作排序基因。使用“ddrtree”方法进行降维,将max_components设置为2,生成一个分支点。分裂热图是从选定的基因中生成的,这些基因在拟时间(q值《e-10)中显示出显著变化。
[0179]
统计学
[0180]
进行未配对的双尾学生t检验,并在比较两组样品时使用graphpadprism 6计算p值。对于所有带有误差线的实验,计算平均标准误差(sem) 以指示每个实验中的变化。
[0181]
数据可用性
[0182]
单细胞rna测序数据可在网站www.biosino.org/node/index上获得,访问编号为no.oep000249和oep000250。
[0183]
实施例2:人类胰岛类器官的长期培养和扩增
[0184]
尸体器官捐赠的胰岛和整个胰腺的移植提供了在补充导致疾病的β细胞缺乏恢复后葡萄糖稳态的概念验证(lysy等,2013)。供体的稀缺导致寻找在体外产生β细胞的策略。事实证明,在体外制造新的β-细胞具有挑战性。糖尿病的细胞疗法需要确定候选细胞来源和新的培养策略。我们之前在鼠胰腺中的研究(见实施例1)确定了一个新的内分泌祖细胞群。这些细胞不表达胰腺分化标志物,可以根据表面蛋白c受体(procr)的表达从胰岛中分选出来。这些细胞可以在培养中形成胰岛样类器官,对葡萄糖有响应,分泌胰岛素,并且可以长期扩增。在目前的研究中,我们利用了人类中这种内分泌祖细胞群的存在及其在体外产生新的人β样细胞中的意义。
[0185]
为了探测人胰岛中procr
细胞的存在,对人胰腺切片中的procr进行了免疫染色。在胰岛内检测到少量procr
胰岛细胞(图8a)。有趣的是,这些procr
细胞与其在小鼠中的对应物类似,不表达内分泌分化标志物(图 8a)。在人胰腺的外分泌隔室中也发现了procr
细胞(图8b)。
[0186]
接着,分离培养这些procr
胰岛细胞。人胰岛是通过胶原酶灌注和密度梯度离心获得的,然后是手工挑选纯化。由于在胶原酶灌注期间procr从细胞表面切割或内吞,我们无法从原代胰岛中分离procr
细胞。然而,通过实验胶原酶和其他条件,我们相信可以使用来自人胰岛的抗procr抗体分离procr
细胞,类似于实施例1中的小鼠实验。尽管如此,培养了来自人的总胰岛细胞。为此,用tsq(6-甲氧基-8-对甲苯磺酰胺-喹啉,一种荧光锌指示剂,用于富集内分泌细胞)染色分离(解离)的单细胞并通过facs分选对 tsq
细胞进行阳性选择。代表性的facs概况显示了人类胰岛样品中三种不同水平的tsq摄取,tsq-高、tsq-低和tsq-阴性(图9a)。对这三个群体进行分类,然后进行细胞离心涂片和内分泌(ins、gcg)和外分泌(amy、krt19) 标记染色。本文发现高tsq分数也显示出丰富的外分泌标志物表达(图9b),与小鼠中的发现一致。
[0187]
接下来,对来自各种供体组织的3d培养中的tsq-高细胞(内分泌/胰岛细胞)进行分选和培养(图9c)。为建立人胰岛细胞培养基,在小鼠胰岛类器官培养所用基础培养基(dmem/f12 egf its fgf2 heparin b27)的基础上,筛选小分子和生长因子,包括wnt激动剂chir99021或ngs(wnt通路激活肽)、tgf-β通路抑制剂sb431542或a83-01、rho-rock通路抑制剂y27632、bmp激动剂bmp2或bmp抑制剂noggin,以支持生长(图 10a-10c)。根据菌落形成率和菌落/类器官大小,建立了促生长条件 (dmem/f12 egf its fgf2 肝素 y27632 b27 chir99021 noggin a83-01),该条件需要激活wnt、fgf和 bmp信号传导并抑制tgfβ和rho-rock途径(图10c)。激活integrin beta1 抗体(1nm)也有助于生长。在这种培养条件下形成的类器官包含大部分ins
β样细胞和少量gcg
α样细胞(图10d),类似于人类胰岛的细胞组成。
[0188]
胰岛类器官由三个不同的供体产生。类器官形成效率始终为约0.8%(图 11a),表明类器官不太可能由受污染的非内分泌细胞形成。事实上,内分泌胰岛类器官和外分泌导管类器官表现出不同的表型。胰岛类器官更紧凑,具有类似于胰岛的“葡萄串”结构(图11b(第12天)),而导管类器官则表现出典型的“环状”结构(图11b(第14天))。在培养第18天,类器官大小范围为50-300μm(图11c)。当解离为单个细胞并在相同的培养条件下重新接种时,在每次传代期间类器官的数量扩大了3-9倍(图11c),传代后的类器官的平均大小略有减少,并在许多传代中保持稳定(图11c-11d)。
[0189]
检查胰岛素(ins)表达作为功能性β细胞形成的指示。在初级类器官中进行全封装免疫染色。大多数类器官细胞表现出高水平的胰岛素(图12a-12b)。这些类器官也含有少量的gcg
α样细胞(图12a-12b),类似于在小鼠胰岛类器官中的观察结果。与表现出导管标记sox9表达的导管类器官不同(图 12c),胰岛类器官不表达sox9(图12a-12b)。此外,这些胰岛类器官可以对葡萄糖产生强烈反应。类器官细胞响应葡萄糖迅速增加胞质ca
2
浓度并随后恢复到基线(图12d)。在传代的类器官中也证实了胰岛素表达(图12e),表明在长期培养和扩增后可以实现β细胞分化。
[0190]
edu掺入测定表明类器官内存在增殖细胞群(图13a),表明类器官内存在增殖/未
分化细胞和分化的激素表达细胞。通过facs分析这些类器官中的 procr表达。人类胰岛类器官中大约2.5%的细胞是procr
(图13b),类似于在小鼠胰岛类器官中发现的procr
细胞比例。此外,与procr-细胞相比,类器官中的procr
细胞表现出约10倍高的edu掺入(图13c),表明这些细胞更具增殖性并且可能是类器官形成的主要贡献者。
[0191]
总之,该数据表明本文所述的方法和组合物可以在体外产生功能性人β样细胞。分离的人胰岛细胞可以克隆密度生长成胰岛样器官,其包含各种内分泌细胞类型,能够检测葡萄糖和分泌胰岛素。这些类器官可以通过长期连续传代在体外呈指数级扩增。
[0192]
方法
[0193]
患者和方法
[0194]
所有人类胰岛或标本均来自长征医院。使用样品进行研究得到了伦理委员会的批准并且患者签署了知情同意书。
[0195]
统计学
[0196]
进行了未配对的双尾学生t检验,当比较两组样品时,使用graphpadprism 6计算p值。对于所有带有误差线的实验,计算平均值的标准误差 (sem)以指示每个实验中的变化。
[0197]
胰岛富集和纯化
[0198]
人胰岛富集由长征医院按照标准方案(灌注后密度梯度离心)进行。高纯度胰岛用于临床移植。纯度较低(~5%-20%)的胰岛通过手工挑选进一步富集并用于本研究。根据tsq染色和facs分析,胰岛的纯度范围为~20%-70%。
[0199]
胰岛单细胞悬液的制备和facs分析
[0200]
通过在37℃下用2ml 0.05%胰蛋白酶-edta处理纯化的胰岛5分钟和0.1mg ml-1
dnase i再处理5分钟,获得单细胞悬液,轻轻吹打约20次。然后通过70μm细胞过滤器过滤细胞。
[0201]
对于procr的facs分析,抗体在hbss中冰上孵育25分钟,其中5%fbs稀释为1:200。为了排除外分泌和其他细胞谱系,将分离的单细胞重新悬浮在含有tsq(0.2mg ml-1
)的溶液中。对tsq高的细胞进行分类培养,以确保生成的类器官是内分泌来源的。所有分析和分类实验均使用facs jazz (becton dickinson)进行。对分选种群的纯度进行常规检查,确保95%以上。
[0202]
人类胰岛类器官生成和传代培养系统的建立
[0203]
将200μl matrigel包被在48孔板的一个孔中并转移到37℃esco培养箱中进行固化。将tsq高的人胰腺细胞进行facs分选并接种在500μl 人类器官培养基中,该培养基由dmem/f12(含青霉素-链霉素)组成并加有2% b27,1%its,50ng ml-1
egf,2μg ml-1
肝素,10ng ml-1
fgf2,3μm chir99021, 2μm a83-01,100ng ml-1
noggin,10μm y27632。培养基每2-3天更新一次。
[0204]
类器官每7-21天传代一次。为了传代,使用分散酶(37℃30分钟)从基质胶中释放类器官,并用1ml 0.05%胰蛋白酶-edta(37℃3-6分钟)解离成单细胞。然后将单个细胞重新悬浮在培养基中并以1:3-1:8的分流比接种。
[0205]
免疫荧光、全封装染色和显微镜检查
[0206]
为了准备冷冻切片的样品,将解剖的胰腺在4℃下固定在4%pfa中4 小时,用pbs
洗涤3次,然后用最佳切割温度(oct)包埋。将组织切片与一抗在4℃下孵育过夜,然后在pbst(pbs 0.1%triton-x 100)中洗涤,与二抗和dapi在室温下孵育2小时,然后将切片清洗并封装以进行共聚焦成像。
[0207]
为了进行全标本染色,将人胰岛或培养的类器官在4℃下在4%pfa中固定1小时,然后用pbs洗涤3次,然后在室温下用全封装封闭缓冲液封闭 1小时。封闭缓冲液在pbst中含有10%fbs。一抗在封闭缓冲液中稀释并在4℃下孵育过夜,用pbst洗涤3次后,二抗和dapi在4℃下孵育过夜。然后清洗胰岛或类器官,并用封装介质封装以进行共聚焦成像。
[0208]
所有共聚焦图像均由安装在leica dmi6000显微镜上的leica sp8共聚焦检测系统捕获。
[0209]
实施例3:鉴定人类成人胰腺内分泌/胰岛祖细胞并在体外培养成胰岛类器官
[0210]
为了鉴定人类潜在的内分泌祖细胞群,我们使用来自2个供体的分离胰腺细胞进行scrna-seq。它们与已发表的人类胰腺数据集相结合(baron等, 2016;enge等,2017;gr
ü
n等,2016;lawlor等,2017;muraro等,2016; segerstolpe等,2016),并与已发布的小鼠胰腺数据集集成((wang等,2020),也在实施例1中)。总共20,660个人体细胞(8个数据集)和7,051个小鼠细胞 (3个数据集)进行了分析(图14a-14b)。每个簇被映射到已知丰富的内分泌(α、β、δ、ε和pp细胞)、丰富的外分泌(腺泡和导管细胞)或稀有(内皮细胞、免疫细胞、休眠和活性星状)细胞类型(图14a-14c)。整合方法揭示了人类细胞中潜在的内分泌祖细胞簇,包含与小鼠procr
祖细胞聚集的细胞(图 14a-14c)。所述新人类细胞群显示出独特的特征基因,包括upk1b,s100a6, lgals4,sdcbp2,sdc1,igfbp3,hmga1,itgb4,itgb6,hn1,gprc5a, slpi,lamc2,fermt1,mgll,msln,sema3b,tst,sfn和cdh3(图 14d-14e),但不表达已知的内分泌或外分泌分化标志物,如t-分布随机邻域嵌入(t-sne)分析所示(图14c)。使用monocle 2的拟时间分析预测了从内分泌祖细胞开始的两个发育轨迹:一个朝向β细胞,一个朝向α细胞(图14f)。令我们惊讶的是,在所述特征中没有找到procr。人胰岛中存在procr
细胞已通过人胰腺切片中procr的免疫染色证实(图8a,实施例2)。在 scrna-seq分析中,鉴定特征中缺少procr可能是由于procr转录本的丰度低。
[0211]
为了寻找可用于分离这种潜在的人类内分泌祖细胞群的更丰富表达的标记,我们筛选了编码表面蛋白的特征中的基因。我们鉴定了msln。人胰腺切片中msln的免疫染色证实了其在一小群胰岛细胞中的表达(图15a)。这些msln
细胞不表达胰岛素(ins)(图15a)。在外分泌腺泡和导管中也可以检测到少量的msln
细胞(图15b)。通过facs分析,我们发现msln
细胞由大约3-5%的总胰岛细胞组成(tsq-高,tsq-hi)(图15c)。msln
细胞也可见于0.5-1%的外分泌细胞(tsq-中(tsq-mid)或tsq-低(tsq-low)) (图15c)。接下来,我们将tsq-hi隔室内的总tsq-hi细胞以及msln
和 msln-细胞分选(图15a),并在先前研究中建立的条件下培养它们(图10,在实施例2中)。我们发现总tsq-hi和tsq-hi、msln
细胞可以形成类器官,而msln-细胞不能(图15d)。与总tsq-hi细胞相比,tsq-hi、msln
细胞表现出显著更高(约7倍)的类器官形成效率(图15d和图15e)。这些数据表明msln
细胞富含能够在体外形成类器官的人胰腺内分泌祖细胞。
[0212]
在培养第14天,我们通过facs分析了分离的类器官细胞。有趣的是,我们发现大多数msln
细胞也是procr
,双阳性细胞占所有类器官细胞的17% (图15f)。这表明msln
和procr
细胞是相同的群体,强化了scrna-seq 中procr缺失可能是由于procr转录本丰度低
的观点。
[0213]
在我们之前培养小鼠胰岛祖细胞的工作中(在实施例1中),与内皮细胞(ec)共培养对于类器官的形成至关重要。接下来,我们探讨添加ec是否有利于人类胰岛类器官的形成。基于cd31或cd34表达从人胰腺组织中分离ec。胰岛细胞和ec以5:1到1:1的比例混合。在这些实验中,添加了vegfa(50ng/ml)以支持ec生长。在单独的胰岛细胞组中,形成了胰岛类器官,在培养第10天时,其大小范围为45-100μm(图16a和图16c)。与ec共培养显著增加了类器官的大小,在培养第10天的范围为80-180μm(图16b和图16c)。这些结果表明,虽然胰岛类器官可以在特定的培养条件下长期维持(如实施例2所示),但与ec共培养可以促进胰岛类器官的生长,类似于我们在小鼠胰岛类器官培养中发现的情况。
[0214]
总之,这些数据表明,本文所述的方法和组合物可以1)通过上述特征定义人胰岛祖细胞,2)基于表面msln表达分离人胰岛祖细胞,和3)在体外产生功能性人β样细胞。分离的人胰岛细胞可以在体外长成胰岛样类器官。
[0215]
其他实施方式
[0216]
藉由之前描述,显而易见的是可以对此处描述的本发明进行变化和修改以使其适应各种用途和条件。这类实施方式也落在本文权利要求书的范围内。
[0217]
本文变量的任何定义中对元素列表的引用包括该变量作为任何单一元素或列出的元素组合(或子组合)的定义。本文的实施方式的引用包括该实施方式作为任何单一实施方式或与任何其他实施方式的组合或其部分。
[0218]
本说明书中提到的所有专利和公开通过引用纳入本文,就好像将各篇单独的专利或公开专门和单独地通过引用纳入本文那样。
[0219]
参考文献
[0220]
al-hasani,k.,pfeifer,a.,courtney,m.,ben-othman,n.,gjernes,e.,vieira,a.,druelle,n.,avolio,f.,ravassard,p.,leuckx,g.,等(2013).成人导管衬里细胞可以重新编程为β样细胞,能够对抗毒素诱导的糖尿病的重复周期(adultduct-liningcellscanreprogramintobeta-likecellsabletocounterrepeatedcyclesoftoxin-induceddiabetes.)devcell26,86-100.
[0221]
balazs,a.b.,fabian,a.j.,esmon,c.t.,和mulligan,r.c.(2006).内皮蛋白c受体(cd201)明确识别小鼠骨髓中的造血干细胞(endothelialproteincreceptor(cd201)explicitlyidentifieshematopoieticstemcellsinmurinebonemarrow.)blood107,2317-2321.
[0222]
bonner-weir,s.,taneja,m.,weir,g.c.,tatarkiewicz,k.,song,k.h.,sharma,a.,和o'neil,j.j.(2000).从扩张的导管组织体外培养人胰岛(invitrocultivationofhumanisletsfromexpandedductaltissue.)procnatlacadsciusa97,7999-8004.
[0223]
butler,a.,hoffman,p.,smibert,p.,papalexi,e.,和satija,r.(2018).整合不同条件、技术和物种的单细胞转录组数据(integratingsingle-celltranscriptomicdataacrossdifferentconditions,technologies,andspecies.)natbiotechnol36,411-420.
[0224]
byrnes,l.e.,wong,d.m.,subramaniam,m.,meyer,n.p.,gilchrist,c.l.,knox,
s.m.,tward,a.d.,ye,c.j.,和sneddon,j.b.(2018).单细胞分辨率下小鼠胰腺发育的谱系动力学(lineagedynamicsofmurinepancreaticdevelopmentatsingle-cellresolution.)natcommun9,3922.
[0225]
cheng,x.,ying,l.,lu,l.,galvao,a.m.,mills,j.a.,lin,h.c.,kotton,d.n.,shen,s.s.,nostro,m.c.,choi,j.k.,等(2012).由人类多能干细胞产生的自我更新内胚层祖细胞系(self-renewingendodermalprogenitorlinesgeneratedfromhumanpluripotentstemcells.)cellstemcell10,371-384.
[0226]
criscimanna,a.,speicher,j.a.,houshmand,g.,shiota,c.,prasadan,k.,ji,b.,logsdon,c.d.,gittes,g.k.,和esni,f.(2011).成年小鼠胰腺损伤后,导管细胞有助于内分泌细胞和腺泡细胞的再生(ductcellscontributetoregenerationofendocrineandacinarcellsfollowingpancreaticdamageinadultmice.)gastroenterology141,1451-1462,1462e1451-1456.
[0227]
fares,i.,chagraoui,j.,lehnertz,b.,macrae,t.,mayotte,n.,tomellini,e.,aubert,l.,roux,p.p.,和sauvageau,g.(2017).epcr表达标志着um171扩增的cd34 脐血干细胞(epcrexpressionmarksum171-expandedcd34 cordbloodstemcells.)blood129,3344-3351.
[0228]
furuyama,k.,kawaguchi,y.,akiyama,h.,horiguchi,m.,kodama,s.,kuhara,t.,hosokawa,s.,elbahrawy,a.,soeda,t.,koizumi,m.,等(2011).成年肝脏、外分泌胰腺和肠道中表达sox9的祖细胞区的持续细胞供应(continuouscellsupplyfromasox9-expressingprogenitorzoneinadultliver,exocrinepancreasandintestine.)natgenet43,34-41.
[0229]
gao,r.,ustinov,j.,korsgren,o.,和otonkoski,t.(2005).人胰岛的体外新生反应了分化的人胰岛细胞的可塑性(invitroneogenesisofhumanisletsreflectstheplasticityofdifferentiatedhumanpancreaticcells.)diabetologia48,2296-2304.
[0230]
gehart,h.,vanes,j.h.,hamer,k.,beumer,j.,kretzschmar,k.,dekkers,j.f.,rios,a.,和clevers,h.(2019).通过实时单细胞分化图谱鉴定肠内分泌调节因子(identificationofenteroendocrineregulatorsbyreal-timesingle-celldifferentiationmapping.)cell176,1158-1173e1116.
[0231]
gershengorn,m.c.,hardikar,a.a.,wei,c.,geras-raaka,e.,marcus-samuels,b.,和raaka,b.m.(2004).上皮细胞向间充质细胞转化产生增殖的人胰岛前体细胞(epithelial-to-mesenchymaltransitiongeneratesproliferativehumanisletprecursorcells.)science306,2261-2264.
[0232]
greggio,c.,defranceschi,f.,figueiredo-larsen,m.,gobaa,s.,ranga,a.,semb,h.,lutolf,m.,和grapin-botton,a.(2013).人工三维生态位在体外解构胰腺发育(artificialthree-dimensionalnichesdeconstructpancreasdevelopmentinvitro.)development140,4452-4462.
[0233]
gu,g.,dubauskaite,j.,和melton,d.a.(2002).胰腺谱系的直接证据:ngn3 细胞是胰岛祖细胞,不同于导管祖细胞(directevidenceforthepancreaticlineage:
ngn3 cellsareisletprogenitorsandaredistinctfromductprogenitors.)development129,2447-2457.
[0234]
hardikar,a.a.(2016).胰岛生物学,第一版(pancreaticisletbiology,1edn)(switzerland:springerinternationalpublishing).
[0235]
huch,m.,bonfanti,p.,boj,s.f.,sato,t.,loomans,c.j.,vandewetering,m.,sojoodi,m.,li,v.s.,schuijers,j.,gracanin,a.,等(2013).通过lgr5/r-海绵蛋白轴,通过有效的胰腺祖细胞无限体外扩增成人(unlimitedinvitroexpansionofadultbi-potentpancreasprogenitorsthroughthelgr5/r-spondinaxis.)emboj32,2708-2721.
[0236]
inada,a.,nienaber,c.,katsuta,h.,fujitani,y.,levine,j.,morita,r.,sharma,a.,和bonner-weir,s.(2008).碳酸酐酶ii阳性胰腺细胞是出生后内分泌和外分泌胰腺的祖细胞(carbonicanhydraseii-positivepancreaticcellsareprogenitorsforbothendocrineandexocrinepancreasafterbirth.)procnatlacadsciusa105,19915-19919.
[0237]
iwasaki,h.,arai,f.,kubota,y.,dahl,m.,和suda,t.(2010).表达内皮蛋白c受体的造血干细胞位于胎肝窦周生态位(endothelialproteincreceptor-expressinghematopoieticstemcellsresideintheperisinusoidalnicheinfetalliver.)blood116,544-553.
[0238]
jin,l.,feng,t.,shih,h.p.,zerda,r.,luo,a.,hsu,j.,mahdavi,a.,sander,m.,tirrell,d.a.,riggs,a.d.,等(2013).成年小鼠胰腺中的集落形成细胞可在基质凝胶中膨胀,并在层粘连蛋白水凝胶中形成内分泌/腺泡集落(colony-formingcellsintheadultmousepancreasareexpandableinmatrigelandformendocrine/acinarcoloniesinlamininhydrogel.)procnatlacadsciusa110,3907-3912.
[0239]
kopp,j.l.,dubois,c.l.,schaffer,a.e.,hao,e.,shih,h.p.,seymour,p.a.,ma,j.,和sander,m.(2011).sox9 导管细胞在整个发育过程中都是多能祖细胞,但在正常或受损的成年胰腺中不会产生新的内分泌细胞(sox9 ductalcellsaremultipotentprogenitorsthroughoutdevelopmentbutdonotproducenewendocrinecellsinthenormalorinjuredadultpancreas.)development138,653-665.
[0240]
lammert,e.,cleaver,o.,和melton,d.(2001).通过血管信号诱导胰腺分化(inductionofpancreaticdifferentiationbysignalsfrombloodvessels.)science294,564-567.
[0241]
lysy,p.a.,weir,g.c.,和bonner-weir,s.(2013).从胰腺内的成体细胞中制造β细胞(makingbetacellsfromadultcellswithinthepancreas.)currdiabrep13,695-703.
[0242]
minami,k.,okuno,m.,miyawaki,k.,okumachi,a.,ishizaki,k.,oyama,k.,kawaguchi,m.,ishizuka,n.,iwanaga,t.,和seino,s.(2005).成年胰腺腺泡细胞产生的胰岛素分泌细胞的谱系追踪和特征(lineagetracingandcharacterizationofinsulin-secretingcellsgeneratedfromadultpancreaticacinarcells.)procnatlacadsciusa102,15116-15121.
[0243]
mohammed,j.s.,wang,y.,harvat,t.a.,oberholzer,j.,和eddington,d.t.(2009).用于胰岛多模式表征的微流控装置(microfluidicdeviceformultimodalcharacterizationofpancreaticislets.)labchip9,97-106.
[0244]
ouziel-yahalom,l.,zalzman,m.,anker-kitai,l.,knoller,s.,bar,y.,glandt,m.,herold,k.,和efrat,s.(2006).成人胰岛细胞的扩增和再分化(expansionandredifferentiationofadulthumanpancreaticisletcells.)biochembiophysrescommun341,291-298.
[0245]
pagliuca,f.w.,millman,j.r.,gurtler,m.,segel,m.,vandervort,a.,ryu,j.h.,peterson,q.p.,greiner,d.,和melton,d.a.(2014).体外培养功能性人胰腺β细胞(generationoffunctionalhumanpancreaticbetacellsinvitro.)cell159,428-439.
[0246]
pan,f.c.,bankaitis,e.d.,boyer,d.,xu,x.,vandecasteele,m.,magnuson,m.a.,heimberg,h.,和wright,c.v.(2013).胰腺器官发生和损伤诱导的兼性修复过程中ptf1a表达细胞多潜能的时空模式(spatiotemporalpatternsofmultipotentialityinptf1a-expressingcellsduringpancreasorganogenesisandinjury-inducedfacultativerestoration.)development140,751-764.
[0247]
pan,f.c.,和wright,c.(2011).胰腺器官发生:从芽到丛再到腺体(pancreasorganogenesis:frombudtoplexustogland.)devdyn240,530-565.
[0248]
qiu,x.,mao,q.,tang,y.,wang,l.,chawla,r.,pliner,h.a.,和trapnell,c.(2017).反向图嵌入解决了复杂的单细胞轨迹问题(reversedgraphembeddingresolvescomplexsingle-celltrajectories.)natmethods14,979-982.
[0249]
ramiya,v.k.,maraist,m.,arfors,k.e.,schatz,d.a.,peck,a.b.,和cornelius,j.g.(2000).利用胰腺干细胞体外生成的胰岛逆转胰岛素依赖型糖尿病(reversalofinsulin-dependentdiabetesusingisletsgeneratedinvitrofrompancreaticstemcells.)natmed6,278-282.
[0250]
rezania,a.,bruin,j.e.,arora,p.,rubin,a.,batushansky,i.,asadi,a.,o'dwyer,s.,quiskamp,n.,mojibian,m.,albrecht,t.,等(2014).利用人多能干细胞体外衍生的胰岛素生成细胞逆转糖尿病(reversalofdiabeteswithinsulin-producingcellsderivedinvitrofromhumanpluripotentstemcells.)natbiotechnol32,1121-1133.
[0251]
rovira,m.,scott,s.g.,liss,a.s.,jensen,j.,thayer,s.p.,和leach,s.d.(2010).成年小鼠胰腺中央/末端导管祖细胞的分离和鉴定(isolationandcharacterizationofcentroacinar/terminalductalprogenitorcellsinadultmousepancreas.)procnatlacadsciusa107,75-80.
[0252]
rukstalis,j.m.,和habener,j.f.(2007).snail2是上皮间质转化的介质,在发育中的内分泌胰腺的祖细胞中表达(snail2,amediatorofepithelial-mesenchymaltransitions,expressedinprogenitorcellsofthedevelopingendocrinepancreas.)geneexprpatterns7,471-479.
[0253]
russ,h.a.,bar,y.,ravassard,p.,和efrat,s.(2008).细胞谱系追踪显示成人β
细胞体外增殖(invitroproliferationofcellsderivedfromadulthumanbeta-cellsrevealedbycell-lineagetracing.)diabetes57,1575-1583.
[0254]
scavuzzo,m.a.,hill,m.c.,chmielowiec,j.,yang,d.,teaw,j.,sheng,k.,kong,y.,bettini,m.,zong,c.,martin,j.f.,等(2018).在胰腺形态发生过程中,在时间上不同的内分泌祖细胞中出现内分泌谱系偏差(endocrinelineagebiasesariseintemporallydistinctendocrineprogenitorsduringpancreaticmorphogenesis.)natcommun9,3356.
[0255]
seaberg,r.m.,smukler,s.r.,kieffer,t.j.,enikolopov,g.,asghar,z.,wheeler,m.b.,korbutt,g.,和vanderkooy,d.(2004).克隆鉴定成年小鼠胰腺中产生神经和胰腺谱系的多能前体(clonalidentificationofmultipotentprecursorsfromadultmousepancreasthatgenerateneuralandpancreaticlineages.)natbiotechnol22,1115-1124.
[0256]
smukler,s.r.,arntfield,m.e.,razavi,r.,bikopoulos,g.,karpowicz,p.,seaberg,r.,dai,f.,lee,s.,ahrens,r.,fraser,p.e.,等(2011).成年小鼠和人类胰腺含有罕见的表达胰岛素的多能干细胞(theadultmouseandhumanpancreascontainraremultipotentstemcellsthatexpressinsulin.)cellstemcell8,281-293.
[0257]
sneddon,j.b.,borowiak,m.,和melton,d.a.(2012).胚胎干细胞来源的祖细胞通过器官匹配的间充质自我更新(self-renewalofembryonic-stem-cell-derivedprogenitorsbyorgan-matchedmesenchyme.)nature491,765-768.
[0258]
sugiyama,t.,benitez,c.m.,ghodasara,a.,liu,l.,mclean,g.w.,lee,j.,blauwkamp,t.a.,nusse,r.,wright,c.v.,gu,g.,等(2013).从纯化的前体细胞重建胰腺发育揭示了胰岛分化所必需的基因(reconstitutingpancreasdevelopmentfrompurifiedprogenitorcellsrevealsgenesessentialforisletdifferentiation.)procnatlacadsciusa110,12691-12696.
[0259]
vandecasteele,m.,leuckx,g.,baeyens,l.,cai,y.,yuchi,y.,coppens,v.,degroef,s.,eriksson,m.,svensson,c.,ahlgren,u.,等(2013).神经生长素3 细胞有助于受损成年小鼠胰腺中的β细胞新生和增殖(neurogenin3 cellscontributetobeta-cellneogenesisandproliferationininjuredadultmousepancreas.)celldeathdis4,e523.
[0260]
wang,d.,cai,c.,dong,x.,yu,q.c.,zhang,x.o.,yang,l.,和zeng,y.a.(2015).通过蛋白c受体表达鉴定多能干细胞(identificationofmultipotentmammarystemcellsbyproteincreceptorexpression.)nature517,81-84.
[0261]
xu,x.,d'hoker,j.,stange,g.,bonne,s.,deleu,n.,xiao,x.,vandecasteele,m.,mellitzer,g.,ling,z.,pipeleers,d.,等(2008).β细胞可以从受损成年小鼠胰腺的内源性祖细胞中产生(betacellscanbegeneratedfromendogenousprogenitorsininjuredadultmousepancreas.)cell132,197-207.
[0262]
yatoh,s.,dodge,r.,akashi,t.,omer,a.,sharma,a.,weir,g.c.,和bonner-weir,s.(2007).亲和纯化的人胰管细胞向β细胞分化(differentiationofaffinity-purifiedhumanpancreaticductcellstobeta-cells.)diabetes56,1802-1809.
[0263]
yu,q.c.,song,w.,wang,d.,andzeng,y.a.(2016).通过蛋白c受体的表达鉴定血管内皮干细胞(identificationofbloodvascularendothelialstemcellsbytheexpressionofproteincreceptor.)cellres26,1079-1098.
[0264]
zhou,f.,li,x.,wang,w.,zhu,p.,zhou,j.,he,w.,ding,m.,xiong,f.,zheng,x.,li,z.,等(2016).以单细胞分辨率追踪造血干细胞形成(tracinghaematopoieticstemcellformationatsingle-cellresolution.)nature533,487-492.
[0265]
baron,m.,veres,a.,wolock,samuell.,faust,aubreyl.,gaujoux,r.,vetere,a.,ryu,jenniferh.,wagner,bridgetk.,shen-orr,shais.,klein,allonm.,等(2016).人类和小鼠胰腺的单细胞转录组图谱揭示了细胞间和细胞内的群体结构(asingle-celltranscriptomicmapofthehumanandmousepancreasrevealsinter-andintra-cellpopulationstructure.)cellsystems3,346-360.e344.
[0266]
enge,m.,arda,h.e.,mignardi,m.,beausang,j.,bottino,r.,kim,s.k.,和quake,s.r.(2017).人类胰腺的单细胞分析揭示了衰老和体细胞突变模式的转录特征(single-cellanalysisofhumanpancreasrevealstranscriptionalsignaturesofagingandsomaticmutationpatterns.)cell171,321-330.e314.
[0267]
gr
ü
n,d.,muraro,mauroj.,boisset,j.-c.,wiebrands,k.,lyubimova,a.,dharmadhikari,g.,vandenborn,m.,vanes,j.,jansen,e.,clevers,h.,等(2016).利用单细胞转录组数据从头预测干细胞特性(denovopredictionofstemcellidentityusingsingle-celltranscriptomedata.)cellstemcell19,266-277.
[0268]
lawlor,n.,george,j.,bolisetty,m.,kursawe,r.,sun,l.,sivakamasundari,v.,kycia,i.,robson,p.,和stitzel,m.l.(2017).单细胞转录组识别人类胰岛细胞特征,并揭示2型糖尿病中细胞类型特异性表达的变化(single-celltranscriptomesidentifyhumanisletcellsignaturesandrevealcell-type
–
specificexpressionchangesintype2diabetes.)genomeresearch27,208-222.
[0269]
muraro,mauroj.,dharmadhikari,g.,gr
ü
n,d.,groen,n.,dielen,t.,jansen,e.,vangurp,l.,engelse,martena.,carlotti,f.,dekoning,eelcoj.p.,等(2016).人类胰腺的单细胞转录组图谱(asingle-celltranscriptomeatlasofthehumanpancreas.)cellsystems3,385-394.e383.
[0270]
segerstolpe,palasantza,a.,eliasson,p.,andersson,e.-m.,andr
é
asson,a.-c.,sun,x.,picelli,s.,sabirsh,a.,clausen,m.,bjursell,m.k.,等(2016).健康和2型糖尿病患者胰岛的单细胞转录组分析(single-celltranscriptomeprofilingofhumanpancreaticisletsinhealthandtype2diabetes.)cellmetabolism24,593-607.
[0271]
wang,d.,wang,j.,bai,l.,pan,h.,feng,h.,clevers,h.,和zeng,y.a.(2020).从常驻的prorc( )祖细胞中长期扩增胰岛类器官(long-termexpansionofpancreaticisletorganoidsfromresidentprocr( )progenitors.)cell180,1198-1211e1119.
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。