1.本发明涉及干细胞诱导分化培养技术领域,特别涉及一种体外高效诱导人类原始生殖细胞培养液以及定向诱导方法和应用。
背景技术:
2.不孕不育已经成为世界上一个重要的健康问题,在所有不孕症的比例中,存在相当比例的生殖细胞分化成熟障碍的患者。由于原始生殖细胞的发现使得生殖细胞发育障碍类疾病研究有了新的研究方向,原始生殖细胞也成为了体外诱导减数分裂发生模型研究中所必须的种子细胞。
3.原始生殖细胞(primordial germ cells,pgcs)是分化为精子和卵子的起始细胞,具有较高的多能性。人pgcs最早出现在第四周(约e24),在外胚层卵黄囊壁附近的尿囊中形成,同小鼠pgcs胚胎期第8天的位置相似,此时人pgcs完成特化。特化后的人pgcs开始迁移,期间pgcs不断增殖并发生一系列的表观遗传修饰的动态变化,其中包括dna甲基化和组蛋白修饰等。在第六周初(约胚胎期第37天),人pgcs迁移并植入早期生殖嵴,此时的pgcs已初步分化,分化后的hpgcs与原始性腺相互作用进入配子发育阶段。
4.原始生殖细胞作为体外诱导减数分裂发生模型研究中所必须的种子细胞,需要将其在体外进行诱导后大量获得,而如何在体外大规模诱导培养原始生殖细胞样细胞成为了干细胞和生殖医学领域研究的重点。
5.现有的诱导原始生殖细胞样细胞的常用体系为含有15%血清替代物的gmem培养基(gk15),但经过该诱导培养体系所得的原始生殖细胞样细胞比例低下,诱导成本较高,难以一次性获得大量的目的细胞。
6.因此急需提供一种可增强将人多能干细胞包括人胚胎干细胞和人诱导多能干细胞定向诱导分化为原始生殖细胞样细胞诱导比例的培养基,以及可行的定向诱导方法。
技术实现要素:
7.有鉴于此,本发明提供了一种体外高效诱导人类原始生殖细胞培养液,该体外高效诱导人类原始生殖细胞培养液能够在不改变转录组水平的前提下大大提高将人胚胎干细胞或人多能诱导干细胞定向诱导分化为原始生殖细胞样细胞的诱导比例,弥补不可改变的体外培养条件的不足,为研究生殖细胞谱系发育和体外减数分裂发生等模型提供大量高质量的种子细胞成为可能。
8.为了实现上述发明目的,本发明提供以下技术方案:
9.本发明的第一个目的是提供一种体外高效诱导人类原始生殖细胞培养液,所述培养液成分包括:在基础培养基中,添加血清替代物、非必须氨基酸、glutamax
tm
添加剂、β-巯基乙醇、n-乙酰半胱氨酸、重组人骨形态发生蛋白4、重组人干细胞因子、重组人白血病抑制因子、重组人表皮生长因子、rock抑制剂。
10.进一步的,所述基础培养基选自gmem培养基;所述血清替代物为knockout
tm sr(主要成为为albumax)。
11.进一步的,所述培养液包括:体积百分比为85%-90%的基础培养基,体积百分比为10%-15%的血清替代物、0.1mm非必须氨基酸、2.0mm glutamax
tm
添加剂、0.1mmβ-巯基乙醇、0.25-1.0mm n-乙酰半胱氨酸、100-200ng/ml重组人骨形态发生蛋白4、50-100ng/ml重组人干细胞因子、50ng/ml重组人白血病抑制因子、50ng/ml重组人表皮生长因子、10μm rock抑制剂。
12.进一步的,所述n-乙酰半胱氨酸用基础培养基溶解制成浓储液后,与其他成分混匀;优选的,所述浓储液浓度为200mm。
13.本发明的第二个目的是提供一种基于前述体外高效诱导人类原始生殖细胞培养液的将人胚胎干细胞定向诱导分化为人类原始生殖细胞的方法,所述方法包括以下步骤:
14.s1:将人多能诱导干细胞消化成单细胞,使用含有体积百分比为85%-90%的基础培养基,体积百分比为10%-15%的血清替代物,0.1mmβ-巯基乙醇,50ng/ml重组人wnt3a蛋白,40ng/ml激活素a的培养基重悬后,进行预诱导,得到新生类中胚层细胞;优选的,预诱导时间为42-46小时,调节新生类中胚层细胞密度为2~5
×
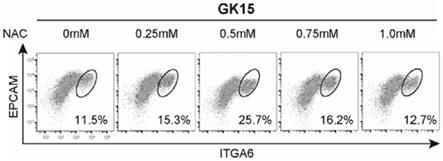
105个细胞/ml;
15.s2:将s1得到的新生类中胚层细胞用权利要求1所述培养液重悬,得到重悬液,将重悬液种于低粘附细胞板中在5%co2、37℃培养箱中继续培养,培养1-3天后,将培养液更换为不含rock抑制剂的培养液继续培养2-4天,直至培养得到拟胚体;优选的,细胞板中重悬液加入量为50ul/孔,密度为3-7
×
103个细胞/孔;
16.s3:从s2得到的拟胚体中分离得到人类原始生殖细胞。
17.进一步的,s1和s2中所述重悬为先将所述培养基或培养液温度调整至37℃。
18.进一步的,s2中所述不含rock抑制剂的培养液包括:体积百分比为85%-90%的gmem(glasgow’s mem),体积百分比为10%-15%的血清替代物、0.1mm非必须氨基酸、2.0mm glutamax
tm
添加剂、0.1mmβ-巯基乙醇、0.25-1.0mm n-乙酰半胱氨酸、100-200ng/m重组人骨形态发生蛋白4、50-100ng/ml重组人干细胞因子、50ng/m重组人白血病抑制因子、50ng/ml重组人表皮生长因子。本发明的第三个目的是提供前述体外高效诱导人类原始生殖细胞培养液在将人胚胎干细胞或人多能诱导干细胞定向诱导分化为人类原始生殖细胞培养液中的用途。
19.进一步的,所述培养液能够在不改变转录组水平的前提下提高人胚胎干细胞定向诱导分化为人类原始生殖细胞的体外诱导分化的比例。
20.本发明至少具有如下优点:
21.本发明提供的一种体外高效诱导人类原始生殖细胞培养液能够大大提升人胚胎干细胞定向诱导分化为人类原始生殖细胞的体外诱导分化的比例。流式检测的结果显示,本发明培养液中梯度加入n-乙酰半胱氨酸后,能够使人类原始生殖细胞的表面标记物cd49f cd326 的比例最高达到25.7%,而传统培养基下作为对照组,同代次的诱导比例仅为11.5%,相比于传统体外诱导培养基的比例呈翻倍增加趋势;本发明培养液能在不改变转录组水平的前提下提高诱导比例,弥补不可改变的体外培养条件的不足。
附图说明
22.图1为人胚胎干细胞h1细胞系在传统gk15培养基以及一种体外高效诱导人类原始生殖细胞培养液中梯度加入n-乙酰半胱氨酸诱导后流式细胞术下人类原始生殖细胞的表面标记物cd49f cd326 细胞的比例;
23.图2为人胚胎干细胞h1细胞系在传统gk15培养基以及一种体外高效诱导人类原始生殖细胞培养液中梯度加入n-乙酰半胱氨酸诱导后人类原始生殖细胞蛋白标记物sox17、tfap2c、blimp1的表达情况,scale bar=50μm。
24.图3为人胚胎干细胞h1细胞系在添加含有0.5mm n-乙酰半胱氨酸的体外高效诱导人类原始生殖细胞培养液前后诱导得到hpgclc的rna-seq差异基因分析的ma散点图,p《0.05,lfc》1或《-1;
25.图4为人诱导多能干细胞dyr0100细胞系在传统gk15培养基以及一种体外高效诱导人类原始生殖细胞培养液中梯度加入n-乙酰半胱氨酸诱导后流式细胞术下人类原始生殖细胞的表面标记物cd49f cd326 细胞的比例;
具体实施方式
26.本发明公开了一种体外高效诱导人类原始生殖细胞培养液以及培养液的制备,本发明提供的体外高效诱导人类原始生殖细胞培养液所用试剂、仪器、细胞系等均可由市场购得,所述人胚胎干细胞购自:中国科学院典型培养物保藏委员会细胞库/干细胞库,细胞名称为h1,目录编号为scsp-301;所述人多能诱导干细胞购自:中国科学院典型培养物保藏委员会细胞库/干细胞库,细胞名称为dyr0100,目录编号为scsp-1301。
27.(1)所述体外高效诱导人类原始生殖细胞培养液成分来源:
28.gmem(glasgow’s mem)培养基:11710035,购自美国gibco公司;
29.血清替代物(赛默飞保密配方):10828028,购自美国gibco公司;
30.非必须氨基酸,mem非必需氨基酸,11140076,购自美国gibco公司;
31.glutamax
tm
添加剂:35050061,购自美国gibco公司;
32.β-巯基乙醇:21985023,购自美国gibco公司;
33.重组人骨形态发生蛋白4:314-bp,购自美国r&d systems公司;
34.重组人干细胞因子:7734-lf,购自美国r&d systems公司;
35.重组人白血病抑制因子:225-sc,购自美国r&d systems公司;
36.重组人表皮生长因子:236-eg,购自美国r&d systems公司;
37.rock抑制剂:具体种类为y27632,hy-10071,购自美国mce公司;
38.n-乙酰半胱氨酸:s5804,购自美国selleck公司。
39.(2)体外高效诱导人类原始生殖细胞培养液的配制:
40.s1:配制n-乙酰半胱氨酸浓储液
41.将称量好的n-乙酰半胱氨酸粉末用适量的gmem(glasgow’s mem)培养基进行溶解,使得浓储液终浓度为200mm,分装后放置于-80℃环境中避光保存;
42.s2:配制体外高效诱导人类原始生殖细胞培养液
43.培养基配方成分为:85%gmem(glasgow’s mem)、15%血清替代物、0.1mm非必须氨基酸、2.0mm glutamax
tm
添加剂、0.1mmβ-巯基乙醇、0.25-1.0mm n-乙酰半胱氨酸、200ng/m
重组人骨形态发生蛋白4、100ng/ml重组人干细胞因子、50ng/m重组人白血病抑制因子、50ng/ml重组人表皮生长因子、10μm rock抑制剂。
44.培养基制备方法为:使用时按照规定量将n-乙酰半胱氨酸浓储液以及其余所有成分按浓度混合均匀。
45.(3)不含rock抑制剂的培养液的配制:
46.85%gmem(glasgow’s mem),15%血清替代物、0.1mm非必须氨基酸、2.0mm glutamax
tm
添加剂、0.1mmβ-巯基乙醇、0.25-1.0mm n-乙酰半胱氨酸、200ng/m重组人骨形态发生蛋白4、100ng/ml重组人干细胞因子、50ng/m重组人白血病抑制因子、50ng/ml重组人表皮生长因子。
47.按照所述体外高效诱导人类原始生殖细胞培养液的相同配制方法配制。
48.实施例1
49.(1)使用传代后4-5天的人胚胎干细胞,加入重组酶tryple在37℃、二氧化碳的体积浓度为5%的环境下消化3分钟,使用pbs进行稀释终止后,1200rpm离心3分钟,弃上清。
50.(2)使用含有85%gmem(glasgow’s mem),15%血清替代物,0.1mmβ-巯基乙醇,50ng/ml重组人wnt3a蛋白,40ng/ml激活素a的培养基中对消化为单细胞的人多能诱导干细胞重悬后,进行预诱导42-46小时,得到新生类中胚层细胞,调节新生类中胚层细胞密度为密度为3.5
×
105个细胞/ml。
51.(3)将人胚胎干细胞来源的新生类中胚层细胞加入体外高效诱导人类原始生殖细胞培养液(0.25mm n-乙酰半胱氨酸)重悬后进行细胞计数,最后调整细胞悬液中细胞密度到1
×
102个细胞/ul,将细胞混悬液加入u型底96孔板中,每孔50μl,即5x103/孔,在5%co2、37℃培养箱中进行培养,每2天换半液,培养2天后,将培养液更换为不含rock抑制剂的培养液继续培养2-4天。
52.(4)将上述培养基诱导的eb球使用胶原酶ⅳ在37℃、二氧化碳的体积浓度为5%的环境下消化10分钟,加入pbs进行稀释终止,1200rpm离心3分钟,弃上清后再加入0.25%胰酶在37℃、二氧化碳的体积浓度为5%的环境下消化3分钟,加入含有10%胎牛血清和90%dmem的培养基进行终止,1200rpm离心3分钟,弃上清后,使用人类原始生殖细胞表面标记物cd49f cd326 在常温环境下染色10分钟,后将染色的单细胞进行流式检测,人类原始生殖细胞的表面标记物cd49f cd326 的比例达到15.3%。
53.(5)从s3得到的拟胚体中分离得到人类原始生殖细胞。
54.实施例2
55.(1)使用传代后4-5天的人胚胎干细胞,加入重组酶tryple在37℃、二氧化碳的体积浓度为5%的环境下消化3分钟,使用pbs进行稀释终止后,1200rpm离心3分钟,弃上清。
56.(2)使用含有85%gmem(glasgow’s mem),15%血清替代物,0.1mmβ-巯基乙醇,50ng/ml重组人wnt3a蛋白,40ng/ml激活素a的培养基中对消化为单细胞的人多能诱导干细胞重悬后,进行预诱导42-46小时,得到新生类中胚层细胞,调节新生类中胚层细胞密度为密度为3.5
×
105个细胞/ml。
57.(3)将人胚胎干细胞来源的新生类中胚层细胞加入体外高效诱导人类原始生殖细胞培养液(0.5mm n-乙酰半胱氨酸)重悬后进行细胞计数,最后调整细胞悬液中细胞密度到1
×
102个细胞/ul,将细胞混悬液加入u型底96孔板中,每孔50μl,即5x103/孔,在5%co2、37
℃培养箱中进行培养,每2天换半液,培养2天后,将培养液更换为不含rock抑制剂的培养液继续培养2-4天。
58.(4)将上述培养基诱导的eb球使用胶原酶ⅳ在37℃、二氧化碳的体积浓度为5%的环境下消化10分钟,加入pbs进行稀释终止,1200rpm离心3分钟,弃上清后再加入0.25%胰酶在37℃、二氧化碳的体积浓度为5%的环境下消化3分钟,加入含有10%胎牛血清和90%dmem的培养基进行终止,1200rpm离心3分钟,弃上清后使用人类原始生殖细胞表面标记物cd49f cd326 在常温环境下染色10分钟,后将染色的单细胞进行流式检测,人类原始生殖细胞的表面标记物cd49f cd326 的比例达到25.7%。
59.(5)从s3得到的拟胚体中分离得到人类原始生殖细胞。
60.实施例3
61.(1)使用传代后4-5天的人胚胎干细胞,加入重组酶tryple在37℃、二氧化碳的体积浓度为5%的环境下消化3分钟,使用pbs进行稀释终止后,1200rpm离心3分钟,弃上清。
62.(2)使用含有85%gmem(glasgow’s mem),15%血清替代物,0.1mmβ-巯基乙醇,50ng/ml重组人wnt3a蛋白,40ng/ml激活素a的培养基中对消化为单细胞的人多能诱导干细胞重悬后,进行预诱导42-46小时,得到新生类中胚层细胞,调节新生类中胚层细胞密度为密度为3.5
×
105个细胞/ml。
63.(3)将人胚胎干细胞来源的新生类中胚层细胞加入体外高效诱导人类原始生殖细胞培养液(0.75mm n-乙酰半胱氨酸)重悬后进行细胞计数,最后调整细胞悬液中细胞密度到1
×
102个细胞/ul,将细胞混悬液加入u型底96孔板中,每孔50μl,即5x103/孔,在5%co2、37℃培养箱中进行培养,每2天换半液,培养2天后,将培养液更换为不含rock抑制剂的培养液继续培养2-4天。
64.(4)将上述培养基诱导的eb球使用胶原酶ⅳ在37℃、二氧化碳的体积浓度为5%的环境下消化10分钟,加入pbs进行稀释终止,1200rpm离心3分钟,弃上清后再加入0.25%胰酶在37℃、二氧化碳的体积浓度为5%的环境下消化3分钟,加入含有10%胎牛血清和90%dmem的培养基进行终止,1200rpm离心3分钟,弃上清后使用人类原始生殖细胞表面标记物cd49f cd326 在常温环境下染色10分钟,后将染色的单细胞进行流式检测,人类原始生殖细胞的表面标记物cd49f cd326 的比例达到16.2%。
65.(5)从s3得到的拟胚体中分离得到人类原始生殖细胞。
66.实施例4
67.(1)使用传代后4-5天的人胚胎干细胞,加入重组酶tryple在37℃、二氧化碳的体积浓度为5%的环境下消化3分钟,使用pbs进行稀释终止后,1200rpm离心3分钟,弃上清。
68.(2)使用含有85%gmem(glasgow’s mem),15%血清替代物,0.1mmβ-巯基乙醇,50ng/ml重组人wnt3a蛋白,40ng/ml激活素a的培养基中对消化为单细胞的人多能诱导干细胞重悬后,进行预诱导42-46小时,得到新生类中胚层细胞,调节新生类中胚层细胞密度为密度为3.5
×
105个细胞/ml。
69.(3)将人胚胎干细胞来源的新生类中胚层细胞加入体外高效诱导人类原始生殖细胞培养液(1.0mm n-乙酰半胱氨酸)重悬后进行细胞计数,最后调整细胞悬液中细胞密度到1
×
102个细胞/ul,将细胞混悬液加入u型底96孔板中,每孔50μl,即5x103/孔,在5%co2、37℃培养箱中进行培养,每2天换半液,培养2天后,将培养液更换为不含rock抑制剂的培养液
继续培养2-4天。
70.(4)将上述培养基诱导的eb球使用胶原酶ⅳ在37℃、二氧化碳的体积浓度为5%的环境下消化10分钟,加入pbs进行稀释终止,1200rpm离心3分钟,弃上清后再加入0.25%胰酶在37℃、二氧化碳的体积浓度为5%的环境下消化3分钟,加入含有10%胎牛血清和90%dmem的培养基进行终止,1200rpm离心3分钟,弃上清后使用人类原始生殖细胞表面标记物cd49f cd326 在常温环境下染色10分钟,后将染色的单细胞进行流式检测,人类原始生殖细胞的表面标记物cd49f cd326 的比例达到12.7%。
71.(5)从s3得到的拟胚体中分离得到人类原始生殖细胞。
72.实施例5
73.采用传统gk15培养基:含有85%gmem(glasgow’s mem),15%血清替代物、0.1mm非必须氨基酸、2.0mm glutamax
tm
添加剂、0.1mmβ-巯基乙醇、200ng/m重组人骨形态发生蛋白4、100ng/ml重组人干细胞因子、50ng/m重组人白血病抑制因子、50ng/ml重组人表皮生长因子、10μm rock抑制剂。)替换实施例1至4中的体外高效诱导人类原始生殖细胞培养液,作为不添加n乙酰半胱氨酸对照组,以实施例1至4步骤(1)~(5)处理方法实验,同代次的诱导比例仅为11.1%。
74.实施例6
75.将实施例1至5步骤(3)所得的拟胚体经过免疫荧光染色(hoechst),在蛋白水平进一步验证后发现,相对于常规gk15培养基,采用本发明体外高效诱导人类原始生殖细胞培养液体外定向诱导人诱多能干细胞后,人类原始生殖细胞蛋白标记物sox17、tfap2c、blimp1的表达增多,即经过该诱导培养所得的原始生殖细胞比例显著提高,与流式分析术的结果一致(图2)。
76.实施例7
77.将实施例2和实施例5步骤(5)所得的人类原始生殖细胞表面标记物cd49f cd326 的细胞进行rna的提取,后进行bulk-seq检测,采用deseq2的方法进行差异分析,发现传统培养基与本发明的培养基所诱导的人原始生殖细胞转录组水平无明显差异(p《0.05,lfc》1或《-1),揭示本发明的培养基能在不改变转录组水平的前提下提高诱导比例,弥补不可改变的体外培养条件的不足,为研究生殖细胞谱系发育和体外减数分裂发生等模型提供大量高质量的种子细胞,即原始生殖细胞成为可能(图3)。
78.实施例8
79.(1)使用传代后4-5天的人多能诱导干细胞,加入重组酶tryple在37℃、二氧化碳的体积浓度为5%的环境下消化3分钟,使用pbs进行稀释终止后,1200rpm离心3分钟,弃上清。
80.(2)使用含有85%gmem(glasgow’s mem),15%血清替代物,0.1mmβ-巯基乙醇,50ng/ml重组人wnt3a蛋白,40ng/ml激活素a的培养基中对消化为单细胞的人多能诱导干细胞重悬后,进行预诱导42-46小时,得到新生类中胚层细胞,调节新生类中胚层细胞密度为密度为3.5
×
105个细胞/ml。
81.(3)将人胚胎干细胞来源的新生类中胚层细胞加入体外高效诱导人类原始生殖细胞培养液(0.25mm n-乙酰半胱氨酸)重悬后进行细胞计数,最后调整细胞悬液中细胞密度到1
×
102个细胞/ul,将细胞混悬液加入u型底96孔板中,每孔50μl,即5x103/孔,在5%co2、
37℃培养箱中进行培养,每2天换半液,培养2天后,将培养液更换为不含rock抑制剂的培养液继续培养2-4天。
82.(4)将上述培养基诱导的eb球使用胶原酶ⅳ在37℃、二氧化碳的体积浓度为5%的环境下消化10分钟,加入pbs进行稀释终止,1200rpm离心3分钟,弃上清后再加入0.25%胰酶在37℃、二氧化碳的体积浓度为5%的环境下消化3分钟,加入含有10%胎牛血清和90%dmem的培养基进行终止,1200rpm离心3分钟,弃上清后,使用人类原始生殖细胞表面标记物cd49f cd326 在常温环境下染色10分钟,后将染色的单细胞进行流式检测,人类原始生殖细胞的表面标记物cd49f cd326 的比例达到5.57%。
83.实施例9
84.(1)使用传代后4-5天的人多能诱导干细胞,加入重组酶tryple在37℃、二氧化碳的体积浓度为5%的环境下消化3分钟,使用pbs进行稀释终止后,1200rpm离心3分钟,弃上清。
85.(2)使用含有85%gmem(glasgow’s mem),15%血清替代物,0.1mmβ-巯基乙醇,50ng/ml重组人wnt3a蛋白,40ng/ml激活素a的培养基中对消化为单细胞的人多能诱导干细胞重悬后,进行预诱导42-46小时,得到新生类中胚层细胞,调节新生类中胚层细胞密度为密度为3.5
×
105个细胞/ml。
86.(3)将人胚胎干细胞来源的新生类中胚层细胞加入体外高效诱导人类原始生殖细胞培养液(0.5mm n-乙酰半胱氨酸)重悬后进行细胞计数,最后调整细胞悬液中细胞密度到1
×
102个细胞/ul,将细胞混悬液加入u型底96孔板中,每孔50μl,即5x103/孔,在5%co2、37℃培养箱中进行培养,每2天换半液,培养2天后,将培养液更换为不含rock抑制剂的培养液继续培养2-4天。
87.(4)将上述培养基诱导的eb球使用胶原酶ⅳ在37℃、二氧化碳的体积浓度为5%的环境下消化10分钟,加入pbs进行稀释终止,1200rpm离心3分钟,弃上清后再加入0.25%胰酶在37℃、二氧化碳的体积浓度为5%的环境下消化3分钟,加入含有10%胎牛血清和90%dmem的培养基进行终止,1200rpm离心3分钟,弃上清后,使用人类原始生殖细胞表面标记物cd49f cd326 在常温环境下染色10分钟,后将染色的单细胞进行流式检测,人类原始生殖细胞的表面标记物cd49f cd326 的比例达到7.45%。
88.实施例10
89.(1)使用传代后4-5天的人多能诱导干细胞,加入重组酶tryple在37℃、二氧化碳的体积浓度为5%的环境下消化3分钟,使用pbs进行稀释终止后,1200rpm离心3分钟,弃上清。
90.(2)使用含有85%gmem(glasgow’s mem),15%血清替代物,0.1mmβ-巯基乙醇,50ng/ml重组人wnt3a蛋白,40ng/ml激活素a的培养基中对消化为单细胞的人多能诱导干细胞重悬后,进行预诱导42-46小时,得到新生类中胚层细胞,调节新生类中胚层细胞密度为密度为3.5
×
105个细胞/ml。
91.(3)将人胚胎干细胞来源的新生类中胚层细胞加入体外高效诱导人类原始生殖细胞培养液(0.75mm n-乙酰半胱氨酸)重悬后进行细胞计数,最后调整细胞悬液中细胞密度到1
×
102个细胞/ul,将细胞混悬液加入u型底96孔板中,每孔50μl,即5x103/孔,在5%co2、37℃培养箱中进行培养,每2天换半液,培养2天后,将培养液更换为不含rock抑制剂的培养
液继续培养2-4天。
92.(4)将上述培养基诱导的eb球使用胶原酶ⅳ在37℃、二氧化碳的体积浓度为5%的环境下消化10分钟,加入pbs进行稀释终止,1200rpm离心3分钟,弃上清后再加入0.25%胰酶在37℃、二氧化碳的体积浓度为5%的环境下消化3分钟,加入含有10%胎牛血清和90%dmem的培养基进行终止,1200rpm离心3分钟,弃上清后,使用人类原始生殖细胞表面标记物cd49f cd326 在常温环境下染色10分钟,后将染色的单细胞进行流式检测,人类原始生殖细胞的表面标记物cd49f cd326 的比例达到13.0%。
93.实施例11
94.(1)使用传代后4-5天的人多能诱导干细胞,加入重组酶tryple在37℃、二氧化碳的体积浓度为5%的环境下消化3分钟,使用pbs进行稀释终止后,1200rpm离心3分钟,弃上清。
95.(2)使用含有85%gmem(glasgow’s mem),15%血清替代物,0.1mmβ-巯基乙醇,50ng/ml重组人wnt3a蛋白,40ng/ml激活素a的培养基中对消化为单细胞的人多能诱导干细胞重悬后,进行预诱导42-46小时,得到新生类中胚层细胞,调节新生类中胚层细胞密度为密度为3.5
×
105个细胞/ml。
96.(3)将人胚胎干细胞来源的新生类中胚层细胞加入体外高效诱导人类原始生殖细胞培养液(1.0mm n-乙酰半胱氨酸)重悬后进行细胞计数,最后调整细胞悬液中细胞密度到1
×
102个细胞/ul,将细胞混悬液加入u型底96孔板中,每孔50μl,即5x103/孔,在5%co2、37℃培养箱中进行培养,每2天换半液,培养2天后,将培养液更换为不含rock抑制剂的培养液继续培养2-4天。
97.(4)将上述培养基诱导的eb球使用胶原酶ⅳ在37℃、二氧化碳的体积浓度为5%的环境下消化10分钟,加入pbs进行稀释终止,1200rpm离心3分钟,弃上清后再加入0.25%胰酶在37℃、二氧化碳的体积浓度为5%的环境下消化3分钟,加入含有10%胎牛血清和90%dmem的培养基进行终止,1200rpm离心3分钟,弃上清后,使用人类原始生殖细胞表面标记物cd49f cd326 在常温环境下染色10分钟,后将染色的单细胞进行流式检测,人类原始生殖细胞的表面标记物cd49f cd326 的比例达到25.8%。
98.实施例12
99.采用传统gk15培养基:含有85%gmem(glasgow’s mem),15%血清替代物、0.1mm非必须氨基酸、2.0mm glutamax
tm
添加剂、0.1mmβ-巯基乙醇、200ng/m重组人骨形态发生蛋白4、100ng/ml重组人干细胞因子、50ng/m重组人白血病抑制因子、50ng/ml重组人表皮生长因子、10μm rock抑制剂。)替换实施例8至11中的体外高效诱导人类原始生殖细胞培养液,作为不添加n乙酰半胱氨酸对照组,以实施例8至11步骤(1)~(5)处理方法实验,同代次的诱导比例仅为5.03%。
100.显然,上述实施例仅仅是为清楚地说明所作的举例,而并非对实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动。这里无需也无法对所有的实施方式予以穷举。而由此所引伸出的显而易见的变化或变动仍处于本发明创造的保护范围之中。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。