一种基于镧系氧氟纳米晶体的mirna载体及其应用
技术领域
1.本发明属于纳米复合材料技术领域,涉及一种药物载体材料,具体涉及一种基于镧系氧氟纳米晶体的mirna载体及其应用。
背景技术:
2.wnt信号通路在所有动物的胚胎发育、组织内稳态和干细胞增殖分化中起着至关重要的作用。然而,该信号的异常激活是多种人类癌症的基础,失调wnt信号通路使转录激活因子β-catenin在细胞质和细胞核中累积,从而促进肿瘤细胞增殖和迁移相关基因的表达。在此过程中,β-catenin共激活因子(包括bcl9)作为wnt信号通路异常激活的一部分,在多种恶性肿瘤中均有过表达,并与β-catenin形成稳定的复合物,促进这些癌基因的表达。wnt信号通路的失调会减少化疗药物和t淋巴细胞的浸润,导致化疗和pd-1/pd-l1检查点封闭免疫治疗的耐药性。抑制肿瘤固有的活性β-catenin信号通路不仅可以抑制肿瘤的发展,而且对化疗和免疫治疗具有增敏作用。
3.激活的wnt通路是调控非癌组织和器官中干细胞/祖细胞再生和维持的共同元件。因此,wnt/β-catenin抑制剂总是具有靶向毒性,目前还没有一种药物被批准应用于临床。为了解决这个问题,在肿瘤中高表达但在肿瘤起源的细胞中不表达的bcl9受到了相当大的关注。据报道,bcl9的致癌作用可以通过sirna/shrna诱导的基因敲除或用改装的bcl9肽治疗来挽救,这两种方法都可以减少增殖、转移和对治疗的耐药性,强调了bcl9在靶向肿瘤治疗中的重要性。
4.micrornas(mirna)是参与多种肿瘤发病机制的基因表达调控因子,有望为抗癌治疗创造新的治疗途径。其中,一个名为mir-30s的mirna家族在很大一部分癌症中低水平表达,可以调节bcl9的表达。更重要的是,已经证实mir-30c可以有效地抑制恶性肿瘤细胞中wnt/β-catenin信号的异常表达。然而,与其他mirna一样,mir-30s也存在两大药理缺陷:核酸酶稳定性差和膜渗透性低,严重限制了其临床应用。目前已经开发了各种用于mirna修饰和递送载体的精细化学物质,并且在改善mirna临床治疗药物的药理学特性方面取得了重大进展。然而,经化学修饰的抗核酸酶mirna总是伴着潜在地脱靶效应和清除颗粒系统的风险。此外,常用的mirnas载体脂质和可生物降解聚合物由于高正电荷而被肝和脾脏迅速清除,以及细胞的非特异性摄取。这些缺陷必然会阻碍mirnas疗法在临床上的广泛应用。因此,需要新颖且临床上可行的递送系统来推进mirnas的发现和开发。
5.纳米颗粒介导的mirnas递送在克服传统递送系统的许多局限性方面带来了希望。将mirnas适当地负载到纳米颗粒上可以显著提高其对核酸酶的抵抗力、膜通透性和生物利用度。事实上,基于纳米颗粒的药物递送系统在治疗实体肿瘤方面特别有吸引力,因为纳米颗粒能够通过内皮泄漏性主动积累,被称为nanoel。近年来的研究表明,稀土掺杂纳米颗粒(ldnp)具有良好的表面相容性和生物相容性,可作为生物分子药物载体。
技术实现要素:
6.本发明的目的在于提供一种基于镧系氧氟纳米晶体的mirna载体,将其对mirna的负载,以解决mirna临床治疗药物存在的生物相容性不佳、mirna结合能力不足、mirna细胞内转运能力不足、实际治疗效果较差等问题。
7.基于上述目的,本技术通过提供一种基于镧系氧氟纳米晶体的mirna载体及其应用来解决该领域中的这种需要。
8.一方面,本发明涉及一种基于镧系氧氟纳米晶体的mirna载体,其包括稀土掺杂的纳米晶体和聚l-赖氨酸,所述聚l-赖氨酸通过配位反应包裹在所述稀土掺杂的纳米晶体表面,所述稀土掺杂的纳米晶体为gdof:45%ce,15%tb。
9.进一步地,本发明提供的基于镧系氧氟纳米晶体的mirna载体中,所述聚l-赖氨酸与所述稀土掺杂的纳米晶体形成了配位键。
10.进一步地,本发明提供的基于镧系氧氟纳米晶体的mirna载体中所述mirna载体颗粒直径为5.2
±
0.4nm。
11.另一方面,本发明提供了一种基于镧系氧氟纳米晶体的mirna载体的制备方法,其包括:采用油胺辅助水热法合成稀土掺杂的纳米晶体,采用ph4.0的盐酸去除所述稀土掺杂的纳米晶体表面的油胺后,在其表面包裹聚l-赖氨酸;所述稀土掺杂的纳米晶体为gdof:45%ce,15%tb。
12.另一方面,本发明提供了一种复合物,包括:基于镧系氧氟纳米晶体的mirna载体表面上负载mirna形成的复合物;以质量比计,所述mirna和基于镧系氧氟纳米晶体的mirna载体的配比为50:1~400:1;优选地,所述mirna和基于镧系氧氟纳米晶体的mirna载体的配比为300:1。
13.另一方面,本发明提供了一种复合物的制备方法,包括:于温度为37℃,将mirna静电吸附30min,负载于基于镧系氧氟纳米晶体的mirna载体表面,以质量比计,所述mirna和基于镧系氧氟纳米晶体的mirna载体的配比为50:1~400:1;优选地,以质量比计,所述mirna和基于镧系氧氟纳米晶体的mirna载体的配比为300:1。
14.进一步地,上述提及的mirna载体包括mir-30c。
15.本发明通过偶联阳离子多赖氨酸与mirna载体静电键合的方式,探索了镧系氧氟纳米晶体(gdof:ce,tb)作为mirna载体对肿瘤的潜在治疗作用。在这项概念验证研究中,示例性地,mir-30c作为mir-30s家族的成员,在结直肠癌中特异性靶向bcl9,在体内外被递送至mc38和hct116细胞,以抑制wnt/β-catenin通路。本发明通过试验证明,本发明提供的基于镧系氧氟纳米晶体的mirna载体对mir-30c进行负载后,在体内有效地抑制了肿瘤的发展,但更重要的是,它在体内有效地加强了化疗和免疫治疗的效果。由此,本发明进一步请求保护所述mirna载体在癌症治疗药物中的应用,所述癌症包括结肠癌;本发明进一步请求保护一种治疗癌症的药物,其作用方式为抑制或阻断wnt/β-catenin通路;本发明进一步请求保护一种化疗或免疫治疗药物增敏剂。
16.与现有技术相比,本发明具有以下有益效果或者优点:
17.与现有技术相比,本发明的主要贡献在于提供了一种基于镧系氧氟纳米晶体的mirna载体,其能实现对mirna的高效负载,且能保护mir-30c在细胞内超过24h。该载体负载抗肿瘤的mirna作为mirna治疗药物在保留mirna功能的同时,仍具有良好的生物相容性。该
载体负载抗肿瘤的mirna后,在体内有效地加强了化疗和免疫治疗。
附图说明
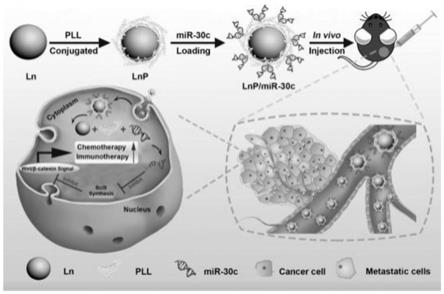
18.图1为lnp纳米颗粒的设计和应用示意图。
19.图2为ln、pll和lnp纳米颗粒表征;(a)ln、pll和lnp的红外光谱图;(b)lnp和ln经聚合物修饰后的浊度;(c)和(d)典型的tem图像,显示ln和lnp的形态和大小;(e)不同时间的lnp和ln的粒径;(f)不同浓度(100、200、300和400μg/ml)的lnp纳米粒子在第1、2和3天的细胞活力;pei25k的浓度12.5ug/ml,pei25k为阳性对照。
20.图3为通过琼脂糖凝胶电泳(age)评估lnp纳米颗粒的基因结合能力;(a)不同w/w比下与lnp/mir-30c和pei25k/mir-30c复合物结合能力的琼脂糖凝胶电泳结果;(b)mirna定量结合能力(n=4);(c)当w/w比为12.5:1时mir-30c与lnp/mir-30c和pei25k/mir-30c复合物解离的琼脂糖凝胶电泳结果;(d)mirna能力的定量解离结果(n=4);(e)不同时间点裸露mir-30c、lnp/mir-30c和pei25k/mir-30c复合物(w/w=12.5:1)血清稳定性的琼脂糖凝胶电泳结果;(f)定量mirna检测血清稳定性(n=4),试验数据通过imagej软件进行定量分析,*p《0.05和**p《0.01。
21.图4为激光共聚焦扫描显微镜分析mir-30c的转染效率。mir-30c用fam标记(绿色),细胞核用dapi标记(蓝色);(a)不同重量比和不同聚合物-基因复合物与mir-30c孵育24h后的荧光共聚焦显微镜图像(比例尺:20μm);(b-c)荧光共聚焦显微镜图像的相对荧光强度。pei25k和lipo2000为阳性对照;*p《0.05,**p《0.01,所有实验均重复三次(每组n=4)。
22.图5为不同重量比的lnp纳米颗粒在mc38细胞内转染24h及mir-30c的递送效率;(a)转染不同复合物后mir-30c的表达;(b)不同复合物转染后bcl9的表达;(c)不同复合物转染后c-myc的表达;(d)不同复合物转染后cyclin d的表达;(e)cyclin d和β-catenin的western blot分析;(f)image j软件进行蛋白质灰度分析;lipo2000为阳性对照,β-actin作为内参;*p《0.05,**p《0.01。
23.图6为在hct116细胞中使用不同重量比的lnp纳米颗粒的细胞内转染24h和mir-30c的递送效率;(a)转染不同复合物后mir-30c的表达;(b)不同复合物转染后bcl9的表达;(c)不同复合物转染后c-myc的表达;(d)不同复合物转染后cyclin d的表达;(e)cyclin d和β-catenin的western blot分析;(f)image j软件进行蛋白质灰度分析。lipo2000为阳性对照;β-actin作为内参蛋白;*p《0.05,**p《0.01。
24.图7为体内lnp/mir-30c纳米颗粒的抑瘤效果;(a)lnp/mir-30c纳米粒治疗不同时间后mc38细胞移植瘤c57小鼠的肿瘤生长曲线;(b)治疗12天后获得的mc38肿瘤的照片;(c)治疗12天后的肿瘤重量;(d)治疗12天后肿瘤组织的h&e染色;(e)β-catenin和cyclin d在皮下肿瘤中的相对蛋白表达;(f)治疗12天后肿瘤组织tunel染色;***p《0.001;标尺:20μm。
25.图8为体内lnp/mir-30c纳米颗粒抑瘤作用和化疗的抑瘤效果;(a)用5-氟尿嘧啶和lnp/mir-30c纳米颗粒治疗不同时间后mc38细胞移植瘤c57小鼠的肿瘤体积;(b)治疗12天后获得的mc38肿瘤的照片;(c)12天时的肿瘤重量,用5-氟尿嘧啶和lnp/mir-30c纳米粒治疗12天后,肿瘤组织进行h&e(d)和tunel(e)分析;(f)β-catenin和cyclin d在皮下肿瘤中的相对蛋白表达;***p《0.001;标尺:20μm。
26.图9为体内lnp/mir-30c纳米颗粒和免疫疗法的抑瘤效果;(a)用pd-l1和lnp/mir-30c纳米粒治疗不同时间后mc38细胞移植瘤c57小鼠的肿瘤体积;(b)治疗12天后获得的mc38肿瘤的照片;(c)12天时的肿瘤重量,pd-l1和lnp/mir-30c治疗12天后肿瘤组织的h&e(d)和tunel(e)图像分析;(f)β-catenin和cyclin d在皮下肿瘤中的相对蛋白表达,*p《0.05,**p《0.01,***p《0.001;标尺:20μm。
27.图10为主要器官的体内生物相容性评价;对给药组小鼠心、肝、脾、肺、肾组织学he染色,比例尺:50μm。
28.图11为免疫印迹实验测定皮下瘤中β-catenin和cyclind条带图;不同处理(1:对照组;2:pd-l1;3:5-氟尿嘧啶(5-fu)组;4:lnp/mir-30c;5:5-fu lnp/mir-30c;6:pd-l1 lnp/mir-30c)。
29.图12为各种复合物体内治疗的生物相容性;(a)不同时间点的小鼠体重;(b)实验结束时的小鼠体重。
30.其中ln为稀土掺杂纳米晶体(gdof:45%ce,15%tb),lnp为表面包裹了聚l-赖氨酸的ln,lnp/mir-30c为lnp负载mir-30c后形成的复合物,pll为聚l-赖氨酸。
具体实施方式
31.下面,结合实施例对本发明的技术方案进行说明,但是,本发明并不限于下述的实施例。
32.下述实施例中,若未经特别说明,则ln为稀土掺杂纳米晶体(gdof:45%ce,15%tb),lnp为表面包裹了聚l-赖氨酸的ln,lnp/mir-30c为lnp负载mir-30c后形成的复合物,pll为聚l-赖氨酸。
33.实施例1
34.本实施例提供了lnp的制备和表征。
35.lnp的制备:ln的合成是游离油胺gdof:45%ce,15%tb,将制备的ln重新分散在pbs(ph=7.4)缓冲盐中。pll与ldn通过聚合物中的氨基以配位键的方式偶联。将5mg的ln溶解在含有10mg pll的10ml pbs缓冲液中。30℃的搅拌下孵育60min后,10000g离心即可收集lnp。
36.lnp的表征:利用红外光谱仪分析ln、pll和lnp的化学结构。用透射电子显微镜观察其形貌。用激光粒度仪测定zeta电位和流体力学尺寸。傅里叶变换红外光谱(ftir)证实了pll与ln的配位键,1659cm-1
处是氨基的红外吸收特征峰明显降低也证明了这一点(见图2a)。然后,本实施例使用一种基于350nm浊度测量的标准方法来对比检测无配体的ln(ln)和pll包被的ln(lnp)的水溶性(见图2b)。当ph为7.4,温度为37℃时,随着纳米颗粒浓度的增加,pbs溶液逐渐变浑浊。在无配体的ln样品中测得较高的浊度值,表明pll赋予ln最佳的亲水性(见图2b)。为了进一步支持pll包被的优势,本实施例用透射电子显微镜(tem)观察ln和lnp的形貌和单分散性,ln样品中存在粒子聚集现象(见图2c)。而lnp纳米颗粒显示出均匀的单分散纳米结构,从100个随机取样的颗粒计算得出直径为5.2
±
0.4nm(见图2d)。此外,还对比测试了lnp与ln的胶体稳定性,其中lnp在37℃的pbs(ph7.4)中孵育1h后保持单分散,而ln在pbs溶液中1h后出现了颗粒聚集(见图2e)。相比于商品化的非病毒载体pei25k和lipo2000,通过mc38细胞的活力测试发现,经优化的亲水性和单分散性的lnp展现出更好
的生物相容性。lnp在高浓度400μg/ml的下培养3d,细胞存活率可达100%以上;与之形成鲜明对比的是,浓度为15μg/ml的pei25k和lipo2000的细胞存活率分别为30%和70%左右,lnp的生物相容性优于商品化的非病毒载体pei25k和lipo2000。
37.实施例2
38.本实施例提供了lnp负载mir-30c的制备和表征。
39.温度为37℃,将mir-30c静电吸附30min,mir-30c负载到纳米粒子lnp上,形成纳米粒子/mir30c复合物。
40.mir-30c复合物的制备:制备mir-30c复合物前,将mir-30c以12000rpm离心10min,溶解于新鲜的depc水中。在等体积的mir-30c溶液(0.264mg/ml)中加入lnp和pll溶液,计算出不同比重的mir-30c复合物。mir-30c复合物是在37℃的hepes环境中(ph=6.84)制备的。通过流体力学粒度分布dls测量了各种mir-30c复合物的粒径和zeta电位。所有配合物均在1ml含2.6μgmir-30c(w/w=12.5w/w)的超纯水中制备,用于差示扫描量热法分析。
41.lnp负载mir-30c的表征:zeta电位的降低证实了mir-30成功负载至lnp上(见表1)。
42.表1,聚合物及聚合物/mirna复合物的多分散性指数
[0043][0044]
值得注意的是,lnp/mir30c的正电荷表明该复合物具有跨膜转运的先天优势。接下来,本实施例通过琼脂糖凝胶电泳对比评估lnp在pei25k上的mirna载量,pei25k是市面上最强的mirna载量的商业非病毒载体(见图3a)。结果显示,lnp显示出与pei25k相似的mirna负载量,在相同的数量级上存在差异(见图3b)。接下来,为了评估mir-30c是否可以从lnp/mir-30c复合物中释放出来,用肝素进行了竞争实验,肝素是一种带负电荷的聚阴离子,可以模拟细胞内的生物大分子进行mir-30c的歧化(见图3c)。作为pei25k/mir-30c复合物,当肝素浓度为60μg/μl时,超过50%的mirna从lnp/mir-30c中释放出来,表明lnp/mir-30c具有与pei25k/mir-30c相似的mirna释放能力(见图3d)。裸露mirna在体外和体内都很容易被核酸酶降解,因此有必要验证lnp/mir-30c对mirna的耐降解性。在37℃的血清中孵育,超过一半的裸露的mir-30c在1小时内被降解,而在lnp/mir-30c中的mir-30c全部保持完好(见图3e)。重要的是,lnp可以保护mir-30c超过24小时,此时至少75%的mir-30c完好无损(见图3f)。
[0045]
实施例3
[0046]
本实施例提供了lnp在细胞内高效转运mir-30c的验证试验。
[0047]
lnp/mir-30c、pei25k/mir-30c和lipo2000/mir-30c的细胞摄取通过监测fam标记的mir-30c的绿色荧光在激光共聚焦显微镜(clsm,fv1200,olympus)上进行评估(见图4)。为了筛选lnp:mir-30c对细胞有效内化的最佳重量比,本实施例首先测试了不同重量比(50:1~400:1)下lnp/mir-30c的细胞摄取。激光共聚焦图像(见图4a)和的绿色荧光强度分析所示(见图4b),重量比为300:1的lnp/mir-30c具有最强的细胞内化作用。此外,与
lipo2000/mir-30c和lnp/mir-30c相比,lnp/mir-30c(重量比300:1)在mc38细胞中也显示出最亮的绿色荧光(见图4c)。这些结果表明,lnp是一种有效的mir-30c载体,是商业非病毒基因载体的最佳替代载体。
[0048]
实施例4
[0049]
本实施例提供了lnp/mir-30c能有效抑制wnt/β-catenin通路的验证试验。
[0050]
bcl9是wnt信号的转录共激活因子,在β-catenin核转位中发挥作用,在肿瘤细胞中总是过表达,从而促进肿瘤进展和治疗耐药。根据本发明的结构设计,细胞内mir-30c能够抑制bcl9的表达,导致β-catenin核转位障碍和随后阻断wnt/β-catenin通路。
[0051]
为了证实这一点,本实施例首先用rt-pcr半定量检测了lnp/mir-30c和lipo2000/mir-30c处理的mc38细胞内mir-30c的表达。与激光共聚焦结果一致(见图5),重量比为300:1的lnp/mir-30c细胞内mir-30c的量最多,甚至超过了最有效的商业非病毒载体之一lipo2000(见图5a)。在lnp/mir-30c处理的细胞中,bcl9的mrna水平在统计学上显著下调(见图5b),结果,wnt下游信号通路中c-myc(见图5c)和cyclind(见图5d)的基因表达相应减少。此外,在蛋白水平上,下调的β-catenin和cyclin d充分说明了wnt/β-catenin信号通路的抑制(见图5e和f)。值得注意的是,lnp/mir-30c显示出比lipo2000/mir-30c更强的wnt阻断作用(见图5b-f),这与lnp增强的mir-30c递送一致(见图5a)。此外,可以从与hct116细胞相关的结果中得出一致的结论,hct116细胞是一种wnt高活性的人结肠癌细胞(见图6)。总之,这些结果为lnp/mir-30c有效抑制wnt/β-catenin途径提供了验证。
[0052]
实施例5
[0053]
本实施例提供了lnp/mir-30c体内抑制wnt/β-catenin通路及肿瘤生长的验证试验。
[0054]
为验证lnp/mir-30c在抑制wnt/β-catenin方面的优异性能,本实施例进一步试验其体内活性。为此,将耐受mc38肿瘤(50-100mm3)的c57bl/6小鼠随机分成两组:pbs(对照组)和lnp/mir-30c组,治疗两周后。如图7a所示,lnp/mir-30c处理的小鼠与pbs处理的对照组相比有显著的肿瘤抑制作用。实验结束时,剥离瘤体并称重(见图7b和c)。pbs处理的小鼠的平均肿瘤重量是lnp/mir-30c处理小鼠的4倍,表明lnp/mir-30c对肿瘤有很强的抑制作用(见图7c)。此外,肿瘤组织的h&e染色再次证实了这一结果(见图7d)。此外,β-catenin和cyclin d蛋白水平的下降表明,这种肿瘤抑制应归因于wnt/β-catenin通路的阻断(见图7e),tunel染色显示凋亡增加再次证明了这一点(见图7f)。
[0055]
实施例6
[0056]
本实施例提供了lnp/mir-30c体内增敏化疗抗肿瘤效应的验证试验。
[0057]
化疗作为局部晚期和转移性癌症的标准治疗方法,是目前应用最广泛的治疗方法。然而,在某些情况下,化疗的临床效果并不令人满意,因为肿瘤经常出现化疗耐药。5-氟尿嘧啶是治疗结肠癌的一线化疗药物,越来越多的证据表明抑制wnt/β-catenin信号通路可以抑制5-氟尿嘧啶(5-fu)化疗的耐药性。
[0058]
为了证实这一点,再次使用mc38移植模型将5-fu和5-fu/lnp/mir-30c联合应用。lnp/mir-30c显著提高了5-fu的抗肿瘤效果(见图8a-c)。lnp/mir-30c可显著提高5-fu的抗肿瘤活性。这一结果通过he染色和tunel染色、组织学进一步证实(见图8d和e)。此外,本实施例还进行了蛋白质印迹分析,以探讨蛋白质水平的变化。如图图8f显示,与单纯5-fu组相
比,lnp/mir30c-5-fu联合组β-catenin和cyclin d的蛋白水平明显降低。lnp/mir-30c联合5-fu具有协同抗肿瘤作用。
[0059]
实施例7
[0060]
本实例提供lnp/mir-30c体内增敏pd-l1检查点封闭免疫治疗的抗肿瘤效果
[0061]
pd1与pd-l1的结合在免疫上抑制了细胞毒性t淋巴细胞(ctl)的抗癌活性,导致肿瘤微环境中的肿瘤免疫逃逸和随后的肿瘤进展。最近的研究表明,免疫检查点封闭抑制性免疫受体pd-l1和pd-1已成为通过释放t淋巴细胞来提高抗肿瘤免疫效率的一种成功的治疗策略。然而,许多癌症患者对pd-1/pd-l1检查点封闭没有反应,这往往是由于t细胞排斥引起的,而t细胞排斥是wnt激活的关键特征。因此,可以考虑,lnp/mir-30c对wnt/β-catenin信号通路的有效阻断可以消除这种抗性,并与pd-l1检查点阻断有协同作用。
[0062]
为了验证这一设想,c57小鼠在mc38结肠癌的同种移植瘤中,分别接受pd1/pdl1抑制剂(ppi)单独或ppi-lnp/mir-30c联合治疗。如图9a-c所示,经过两周的治疗后,与ppi处理的小鼠相比,ppi-lnp/mir-30c联合处理的小鼠显示出更强的肿瘤抑制作用。此外,he和tunel检测结果显示,协同治疗组肿瘤组织密度降低,细胞凋亡明显(见图9d和e)。此外,在蛋白水平上,westernblot灰度值分析表明,协同治疗组的β-catenin和cyclin d水平显著降低(见图9f和图11)。以上结果表明,lnp/mir-30c与pd1/pd-l1检查点阻断免疫治疗有协同作用。
[0063]
实施例8
[0064]
本实施例提供了lnp/mir-30c的体内安全性评估试验。
[0065]
异种移植瘤模型:雌性c57bl/6小鼠购自西安交通大学医学院,3周龄时使用。实验过程按照西安交通大学动物护理委员会的指导方针进行。将mc38细胞(3
×
106)皮下注射至小鼠腹股沟,形成异种移植瘤模型。用游标卡尺测量肿瘤的最短和最长直径,计算公式为:体积(mm3)=1/2
×
长
×
宽2[0066]
抑瘤实验:肿瘤体积达到50mm3左右后,将小鼠随机分为6组,腹腔给药,每两天注射一次。测量小鼠体重和肿瘤体积。最后一个时间点,收集肿瘤进行称重、测量和免疫组织化学分析。
[0067]
为了验证lnp/mir-30c在体内的生物安全性,本实施例对主要内脏器官的h&e进行了综合评价(见图10)。和药物治疗后小鼠体重(见图12)。给药2周后,lnp/mir-30c单独给药组、lnp/mir-30c 5-氟尿嘧啶或pd1/pdl1抑制剂组小鼠体重较对照组(pbs)显著增加,而5-氟尿嘧啶治疗组体重明显下降(p《0.05)(见图12)。对照组、lnp/mir-30c组、pd/pdl1抑制剂组、lnp/mir-30c 5-氟尿嘧啶或pd1/pdl1抑制剂组小鼠的心、肝、脾、肺、肾组织学未见形态学或病理学改变(见图10)。仅5-氟尿嘧啶组出现常见的化疗药物副作用,如肝坏死、脂肪变性、肾坏死、炎症、肺泡壁增厚等。综上所述,这些结果进一步证明了lnp/mir-30c作为化疗或免疫辅助治疗增效剂具有良好的生物相容性和生物安全性。
[0068]
如上所述,即可较好地实现本发明,上述的实施例仅仅是对本发明的优选实施方式进行描述,并非对本发明的范围进行限定,在不脱离本发明设计精神的前提下,本领域普通技术人员对本发明的技术方案做出的各种改变和改进,均应落入本发明确定的保护范围内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。