1.本发明涉及药物技术领域,特别是涉及薏苡素在制备防治弓形虫病药物中的应用。
背景技术:
2.弓形虫(t.gondii)是一种专性细胞内原生动物寄生虫,可以感染几乎所有的温血动物。感染弓形虫后,子孢子或缓殖子侵入肠道上皮并分化为速殖子。速殖子是弓形虫急性感染期的主要致病形式,通过入侵、复制、逸出破坏宿主细胞,如此反复,发展为局部组织的坏死病灶,同时伴有单核细胞为主的急性炎症反应。弓形虫能感染除红细胞以外未死亡的所有有核细胞,机体一旦感染弓形虫,全身细胞有可能都会受到侵害并且可能会伴随全身性临床病症的发生。其中,肝脏和肺脏是弓形虫感染的重要靶器官,可引起急性肝损伤及急性肺损伤。当速殖子受到宿主免疫反应控制时,会分化为缓殖子在宿主体内建立终生感染,然而当宿主的免疫功能缺陷时,缓殖子可以重新分化为速殖子,引起致命性的疾病。并且,在畜牧业方面,弓形虫感染会造成猪死亡或者牛、羊等怀孕家畜流产,给畜牧业带来巨大的经济损失。弓形虫病无论对人类的健康还是畜牧业的发展都具有极大的危害。因此,对于弓形虫病的预防、控制和治疗具有重要意义。
3.目前,临床治疗弓形虫病的一线用药为磺胺类药物和乙胺嘧啶联合用药,但这种治疗具有耐药性以及有严重的副作用,如骨髓抑制、毒性皮炎、肾结石等【姚娜,龚静芝,范益敏,等.弓形虫病治疗药物的研究进展[j].中国畜牧兽医,2020,47(04):1250-1257.】。因此,寻找高效低毒的抗弓形虫药物显得尤为迫切。
技术实现要素:
[0004]
为了解决上述问题,本发明提供了薏苡素在制备防治弓形虫病药物中的应用。本发明利用薏苡素制备的药物可以对弓形虫有很好的防治作用,具有高效、低毒的优势。
[0005]
为了实现上述目的,本发明提供如下技术方案:
[0006]
本发明提供了薏苡素在制备防治弓形虫病药物或试剂中的应用。
[0007]
优选的,防治弓形虫病包括:抑制弓形虫增殖和/或保护弓形虫感染的宿主。
[0008]
优选的,所述抑制弓形虫增殖包括抑制弓形虫速殖子增殖。
[0009]
优选的,所述保护弓形虫感染的宿主包括:降低弓形虫感染后的脾指数、减轻弓形虫感染诱导的肝损伤和/或肺损伤、降低弓形虫感染引起的血清转氨酶的升高和减少肺部炎性细胞的数量中的一种或多种。
[0010]
本发明还提供了一种防治弓形虫病的药物或试剂,所述药物或试剂包括:薏苡素和药学上可接受的辅料。
[0011]
有益效果:
[0012]
本发明提供了薏苡素在制备防治弓形虫病药物中的应用。本发明通过对薏苡素进行体内体外实验,证明薏苡素具有抑制体内外弓形虫速殖子增殖的作用。其中体外药效试
验表明,薏苡素可以显著抑制弓形虫增殖,并且免疫荧光试验进一步观察到薏苡素可以显著抑制细胞内弓形虫增殖,证明薏苡素对弓形虫感染的宿主细胞具有较好的保护作用;体内药效试验表明,薏苡素能够显著抑制小鼠肠系膜淋巴结和腹腔中弓形虫的数量,降低急性弓形虫感染后的脾指数,通过抑制肝脏、肺脏内弓形虫的增殖改善肺损伤以及肝损伤;另外,薏苡素是一种在药食两用的薏苡仁中提取的多酚类化合物,具有高效、低毒的优势。
附图说明
[0013]
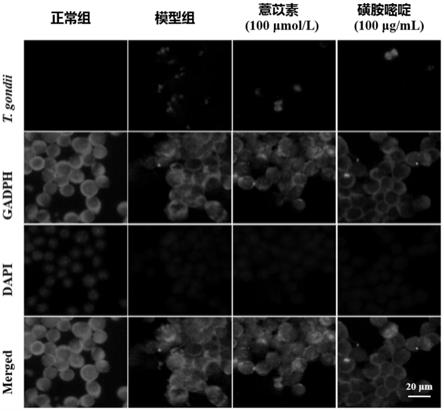
图1为实施例4中的荧光免疫染色结果图,其中t.gondii表示弓形虫染色,gapdh(肌动蛋白)表示细胞质染色;dapi表示细胞核染色;merged表示不同染色图像进行合并。
具体实施方式
[0014]
本发明提供了薏苡素在制备防治弓形虫病药物或试剂中的应用。
[0015]
在本发明中,所述防治弓形虫病优选包括:抑制弓形虫增殖和/或保护弓形虫感染的宿主。
[0016]
在本发明中,所述抑制弓形虫增殖优选包括抑制弓形虫速殖子增殖。本发明通过对薏苡素进行体内体外实验,证明薏苡素具有抑制体内外弓形虫速殖子增殖的作用,并且免疫荧光试验进一步观察到薏苡素可以显著抑制细胞内弓形虫增殖。
[0017]
在本发明中,所述保护弓形虫感染的宿主优选包括:降低弓形虫感染后的脾指数、减轻弓形虫感染诱导的肝损伤和/或肺损伤、降低弓形虫感染引起的血清转氨酶的升高和减少肺部炎性细胞的数量中的一种或多种。本发明通过体外药效试验表明,薏苡素可以显著抑制弓形虫增殖,并且免疫荧光试验进一步的观察到薏苡素可以显著抑制细胞内弓形虫增殖,证明薏苡素对弓形虫感染的宿主细胞具有较好的保护作用;另外,本发明通过体内药效试验表明,薏苡素能够显著抑制小鼠肠系膜淋巴结和腹腔中弓形虫的数量,降低急性弓形虫感染后的脾指数,通过抑制肝脏、肺脏内弓形虫的增殖改善肺损伤以及肝损伤,有望成为抗弓形虫的候选先导化合物。
[0018]
本发明还提供了一种防治弓形虫病的药物或试剂,所述药物或试剂包括:薏苡素和药学上可接受的辅料。本发明对所述薏苡素和辅料的来源没有特殊要求,采用本领域技术人员所熟知市售商品即可。以本发明实施例为例,本发明所述薏苡素优选购自上海源叶生物科技有限公司。
[0019]
为了进一步说明本发明,下面结合实施例及附图对本发明提供的薏苡素在制备防治弓形虫病药物中的应用进行详细地描述,但不能将它们理解为对本发明保护范围的限定。
[0020]
实施例1
[0021]
薏苡素对raw264.7细胞增殖的影响
[0022]
取对数生长期的raw264.7细胞(购买于美国菌种保藏中心(atcc)),以2
×
104个/孔/100μl接种至含有10%胎牛血清fbs的dmem培养基的96孔板中,待细胞密度为50%~60%时,将96孔随机分为6组,每组6孔,6组分别加入0.1%(v/v)dmso溶液、不同浓度的薏苡素(25μmol/l、50μmol/l、100μmol/l和200μmol/l,薏苡素溶解于0.1%(v/v)dmso溶液中)和100μg/ml磺胺嘧啶(磺胺嘧啶的hplc分析纯度≥98%,磺胺嘧啶溶解于0.1%(v/v)dmso溶
液中)在37℃、5%(v/v)co2培养箱继续培养36h后,避光加入10μlmts溶液(promega),继续在37℃、5%co2培养箱继续培养2h。利用multiskan go全波长酶标仪(thermo fisher)测定不同孔中490nm处测吸光度(od值),并计算存活率,其中存活率(%)=药物(薏苡素或磺胺嘧啶)治疗组od/正常组od(未添加薏苡素组或磺胺嘧啶)
×
100%,每个重复实验的数据采用平均值
±
标准差表示,结果见表1。
[0023]
表1 不同处理组对raw264.7细胞增殖的影响
[0024][0025]
注:dmso为0.1%(v/v)dmso溶液处理组;25μmol/l、50μmol/、100μmol/l和200μmol/l均为不同浓度的薏苡素处理组;100μg/ml为100μg/ml磺胺嘧啶处理组;与dmso组相比,
###
表示p《0.001。
[0026]
由表1可知,当薏苡素浓度小于或等于100μmol/l时,对raw 264.7细胞无毒性。当薏苡素的浓度到达200μmol/l时,对raw 264.7细胞增殖有明显抑制作用(p《0.001)。另外,100μg/ml的磺胺嘧啶对raw264.7细胞增殖无明显影响。因此,选择浓度为50μmol/l或100μmol/l的薏苡素和100μg/ml的磺胺嘧啶进行后续实验研究。
[0027]
实施例2
[0028]
体外弓形虫感染模型建立
[0029]
一种与实施例1相似的处理方法,区别在于,将raw264.7细胞以2.8
×
105个/孔/100μl接种至6孔板中,随机分为5组,每组4孔,5组分别为:正常组(未感染 未治疗)、模型组(弓形虫感染 0.1%(v/v)dmso溶液)、薏苡素组(弓形虫感染 100μmol/l或50μmol/l薏苡素治疗)和阳性对照组(弓形虫感染 100μg/ml磺胺嘧啶治疗)。除正常组细胞外,其余组细胞在接种24h后以弓形虫:细胞=5:1的个数比进行感染。感染4h后,分别给予不同的药物治疗,之后将6孔板在37℃、5%co2培养箱继续培养36h,终止培养。终止培养后,收集细胞,用台盼蓝溶液对细胞染色,在倒置生物显微镜下分别对活细胞(无色细胞)和死细胞(蓝色细胞)进行计数。细胞存活率(%)=活细胞数量/(活细胞数量 死细胞数量)
×
100%。每个重复实验的数据采用平均值
±
标准差表示,结果表表2。
[0030]
表2 不同处理组对弓形虫感染raw264.7细胞存活率的影响
[0031][0032]
注:与正常组组相比,
###
表示p《0.001;与模型组组相比,
**
表示p《0.01,
***
表示p《0.001,下表同理。
[0033]
由表2可知,受弓形虫感染的raw264.7细胞的存活率仅为54.48
±
4.02%,给予50
或100μmol/l薏苡素或100μg/ml的磺胺嘧啶治疗后,raw264.7细胞的存活率显著提高至73.92
±
3.67%、86.37
±
3.02%和89.28
±
2.53%,并与模型组相比具有显著性差异(
**
p《0.01;
***
p《0.001)。
[0034]
实施例3
[0035]
一种与实施例2相似的处理方法,区别在于,未设置正常组,raw 264.7细胞以1
×
106个/皿在6cm培养皿中培养,终止培养后,吸走细胞上清dmem培养液,1ml预冷pbs清洗2次,用细胞挂刷收集各组细胞沉淀于1.5ml离心管,使用低温离心机快速离心两次(4℃,14800rpm,10秒),弃上清,沉淀为raw264.7细胞,备用。
[0036]
将不同组的raw264.7细胞沉淀按照sv genomic dna purification system(promega corporation)试剂盒说明提取基因组dna(gdna)。取10ng的gdna,使用表面抗原1(sag1)引物与1
×
10-5
ng sag1竞合物(截短的sag1dna:用限制性内切酶(sac i.sacⅱ)在sag1基因的511和665bps处切割,将154bps的小片段删除,连接大片段之后将质粒转染至大肠杆菌后纯化,作为sag1竞合物,具体方法参见【luo w,seki t,yamashita k,et al.quantitative detection of toxoplasma gondii by competitive polymerase chain reaction of the surface specific antigen gene 1[j].japanese iournal of parasitology 1995,44(3):183-190.】)共扩增:正向:5
′‑
tcggatccccctcttgttgc-3
′
(seq id no.1所示),反向:5
′‑
ctccagtttcacggtacagt-3
′
(seq id no.2所示)。pcr反应条件为:94℃预变性2min,94℃变性30秒、55℃退火30秒、72℃延伸1min,变性-延伸循环共35次后,72℃延伸10min,最后温度降为4℃停止反应。pcr产物在2%琼脂糖凝胶电泳分离,然后用10mg/ml溴化乙锭标记。测定qc-pcr产物sag1 gdna与竞合物sag1条带密度的比值。根据文献报道的方法(luo w,aosai f,ueda m,et al.kinetics in parasite abundance in susceptible and resistant mice infected with an avirulent strain of toxoplasma gondii by using quantitative competitive pcr[j].j parasitol.1997,83(6):1070-1074.)用标准曲线计算弓形虫数量。每组设置3个重复,重复实验的数据采用平均值
±
标准差表示,结果如表3。
[0037]
表3 薏苡素对弓形虫感染raw 264.7细胞中弓形虫速殖子增殖的情况
[0038][0039]
注:与模型组相比,
***
p《0.001。
[0040]
由表3可知,经弓形虫感染后,模型组中弓形虫数为304
±
22.11/ng gdna,薏苡素低剂量组(50μmol/l)和高剂量组(100μmol/l)弓形虫数分别为68.67
±
9.29/ng gdna、53
±
6.56/ng gdna,磺胺嘧啶钠组的弓形虫数为42.67
±
6.11/μg gdna。薏苡素和磺胺嘧啶钠组
对小鼠腹腔内速殖子的抑制率分别为77.41
±
3.06%、82.57
±
2.16%和85.96
±
2.01%(p《0.001)。
[0041]
实施例4
[0042]
一种与实施例2相似的处理方法,区别在于,raw 264.7细胞以3.6
×
104个/孔/200μl在24孔载玻片板中培养,终止培养后,用预冷的100%甲醇溶液固定细胞20min,用0.2%(v/v)tritonx-100渗透5min,然后用5%bsa封闭液孵育30min,然后用anti-t.gondii一抗(购自virostat inc.)和gapdh一抗(购自arigo biolaboratories)在4℃孵育过夜。次日用alexa594驴抗兔igg(h l)(购自thermo fisher scientific)和alexa488羊抗鼠igg(h l)(购自abcam inc.)室温孵育1h,dapi(购自rocheapplied science)染色5min。倒置荧光显微镜观察细胞染色。anti-t.gondii一抗蛋白显示红色荧光,gapdh(肌动蛋白)染色显示绿色荧光,dapi将细胞核染成蓝色。使用imagej软件(wayne rasband,national institutes ofhealth,bethesda,md,usa)对不同染色图像进行合并,结果见图1。
[0043]
由图1可知,模型组细胞内外可观察到大量显红色荧光的速殖子,给予薏苡素或磺胺嘧啶后,速殖子的数量明显减少。
[0044]
由实施例1~4的结果可知,薏苡素对弓形虫感染的raw264.7细胞具有保护作用,并对细胞中弓形虫增殖具有显著抑制作用。
[0045]
实施例5
[0046]
将清洁级雌性balb/c小鼠(6~8周龄,体重20
±
2g,购买于辽宁长生生物技术有限公司)随机分为4组(每组6只):正常组(未感染 未治疗)、模型组(弓形虫感染 0.5wt.%羧甲基纤维素钠溶液治疗)、薏苡素组(弓形虫感染 50mg/kg薏苡素治疗)和阳性对照组(磺胺嘧啶钠,弓形虫感染 100mg/kg磺胺嘧啶钠治疗),其中薏苡素和磺胺嘧啶钠均溶解于0.5wt.%羧甲基纤维素钠溶液。
[0047]
除正常组小鼠外,其余小鼠通过腹腔注射3
×
103个rh株速殖子(由日本千叶大学提供,并由本发明实验室保种)建立急性弓形虫小鼠感染模型。感染4h后,小鼠按组别灌胃给予0.2ml 0.5wt.%羧甲基纤维素钠溶液或薏苡素(50mg/kg/d)或磺胺嘧啶钠组(100mg/kg/d),每日给药一次,持续6天。
[0048]
感染后第6天,收集腹水,观察腹腔内弓形虫速殖子的增殖情况,计算弓形虫抑制率。弓形虫抑制率=(模型组小鼠腹腔内弓形虫速殖子数量-薏苡素组或磺胺嘧啶钠组小鼠腹腔内弓形虫速殖子数量/模型组小鼠腹腔弓形虫速殖子数量)
×
100%。每个重复实验的数据采用平均值
±
标准差表示,结果见表4。
[0049]
表4 薏苡素对弓形虫感染小鼠腹腔中弓形虫速殖子的影响
[0050][0051]
注:与模型组相比,
**
p《0.01,
***
p《0.001。
[0052]
由表4可知,模型组小鼠腹腔内速殖子的数量为(83.77
±
20.72)
×
106个。薏苡素和磺胺嘧啶钠组对小鼠腹腔内速殖子的抑制率分别为98.02
±
0.35%和98.62
±
0.16%(p《0.001)。
[0053]
通过qc-pcr(具体方法同实施例3,区别在于,将raw264.7细胞沉淀替换为小鼠肠系膜淋巴结组织)检测薏苡素对弓形虫感染小鼠肠系膜淋巴结组织中弓形虫的抑制作用。每组设置3个重复,重复实验的数据采用平均值
±
标准差表示,结果见表5。
[0054]
表5 薏苡素对弓形虫感染小鼠肠系膜淋巴结组织中弓形虫速殖子的影响
[0055][0056]
注:与模型组相比,
**
p《0.01,
***
p《0.001。
[0057]
由表5可知,模型组小鼠肠系膜淋巴结组织中弓形虫速殖子的数量为(2.49
±
0.04)
×
104,薏苡素和磺胺嘧啶钠组弓形虫速殖子的数量分别为(4.89
±
0.29)
×
103和(0.89
±
0.09)
×
103。薏苡素和磺胺嘧啶钠组对肠系膜淋巴结组织中弓形虫速殖子的抑制率分别为80.42
±
1.15%和96.42
±
0.34%(p《0.001)。
[0058]
感染后第6天,对不同组小鼠进行分离脾脏并称重,计算脾指数。脾指数(%)=(小鼠脾重量/小鼠体重)
×
100%。每个重复实验的数据采用平均值
±
标准差表示,结果见表6。
[0059]
表6 薏苡素对弓形虫感染小鼠脾脏的影响
[0060][0061]
注:与正常组相比,
###
p《0.001;与模型组相比,
*
p《0.05。
[0062]
由表6可知,与正常组相比,模型组小鼠的脾指数均显著增加(p《0.001),薏苡素和磺胺嘧啶钠处理后可降低弓形虫感染引起的脾指数(p《0.05)。
[0063]
以上结果表明,薏苡素对弓形虫感染小鼠具有保护作用,并可以显著抑制体内弓形虫速殖子的增殖。
[0064]
实施例6
[0065]
通过qc-pcr(具体方法同实施例3,区别在于,将raw264.7细胞沉淀替换为小鼠肝脏组织)检测实施例5中不同处理组小鼠肝脏中弓形虫的数量。每组设置3个重复,重复实验的数据采用平均值
±
标准差表示,结果见表7。
[0066]
表7 薏苡素对弓形虫感染小鼠肝脏中弓形虫速殖子增殖的影响
[0067][0068]
注:与模型组相比,
***
p《0.001。
[0069]
由表7可知,模型组小鼠肝脏中弓形虫数量为(8.39
±
0.45)
×
104个/μg gdna。与模型组比较,薏苡素和磺胺嘧啶钠可显著降低小鼠肝脏中弓形虫数量,分别为(5.17
±
0.77)
×
103个/μg gdna和(2.07
±
0.08)
×
103个/μg gdna。薏苡素和磺胺嘧啶钠组对弓形虫感染小鼠肝脏中弓形虫速殖子抑制率分别为93.84
±
0.92%和97.54
±
0.09%(p《0.001)。
[0070]
实施例5中不同处理组小鼠感染后第6天,脱颈处死小鼠,收集血液,利用丙氨酸转氨酶(alt)试剂盒(购自南京建城生物工程研究所)和天冬氨酸转氨酶(ast)试剂盒(购自南京建城生物工程研究所)检测血清中alt和ast的表达水平。每组设置6个重复,重复实验的数据采用平均值
±
标准差表示,结果见表8。
[0071]
表8 薏苡素对弓形虫感染小鼠血清转氨酶表达的影响
[0072][0073]
注:与正常组相比,
###
p《0.001;与模型组相比,
**
p《0.01,
***
p《0.001。
[0074]
由表8可知,与正常组比较,弓形虫感染后小鼠血清alt和ast水平显著提高。给予薏苡素和磺胺嘧啶钠后能显著降低血清转氨酶水平。以上结果表明薏苡素可以减轻弓形虫感染引起的肝损伤。
[0075]
实施例7
[0076]
通过qc-pcr(具体方法同实施例3,区别在于,将raw264.7细胞沉淀替换为小鼠肺脏组织)检测实施例5中不同处理组小鼠肺脏中弓形虫的数量。每组设置3个重复,重复实验的数据采用平均值
±
标准差表示,结果见表9。
[0077]
表8 薏苡素对弓形虫感染小鼠肺脏中弓形虫速殖子增殖的影响
[0078][0079]
注:与模型组相比,
***
p《0.001。
[0080]
由表9可知,模型组小鼠肝脏中弓形虫数量为(27.41
±
3.97)
×
103个/μggdna。与模型组比较,薏苡素和磺胺嘧啶钠可显著降低小鼠肝脏中弓形虫数量,分别为(4.89
±
0.29)
×
103个/μg gdna和(0.89
±
0.09)
×
103个/μg gdna。薏苡素和磺胺嘧啶钠组对弓形虫感染小鼠肝脏中弓形虫速殖子抑制率分别为82.15
±
1.04%和96.73
±
0.31%(p《0.001)。
[0081]
实施例5中不同处理组小鼠感染后第6天,使用4℃预冷的灭菌pbs溶液进行小鼠支气管肺泡灌洗,每次0.8ml,重复灌洗2次,将支气管肺泡灌洗液(balf)以200
×
g条件下离心10min,收集沉淀,用瑞士-吉姆萨染色(瑞士-吉姆萨染液购自珠海贝索生物技术有限公司)后在显微镜下对嗜酸性细胞、中性粒细胞、巨噬细胞、淋巴细胞进行计数。每组设置5个重复,重复实验的数据采用平均值
±
标准差表示,结果见表10。
[0082]
表10 薏苡素对弓形虫感染小鼠balf中炎性细胞数量的影响
[0083][0084]
注:与正常组相比,
##
p《0.01,
###
p《0.001;与模型组相比,
*
p《0.05,
***
p《0.001。
[0085]
由表10可知,与正常组相比,模型组小鼠balf中细胞总数,包括嗜酸性粒细胞、中性粒细胞、巨噬细胞和淋巴细胞的数量显著增加(分别为p《0.001,p《0.01),经薏苡素和磺胺嘧啶钠治疗后,炎性细胞的数量显著降低。以上结果表明,薏苡素通过抑制炎性细胞的产生来减轻弓形虫感染诱导的肺损伤。
[0086]
综上所述,可得出以下结论:
[0087]
1.本发明通过对薏苡素进行体内体外实验,证明薏苡素具有抑制体内外弓形虫速殖子增殖的作用。
[0088]
2.体外药效试验表明,薏苡素可以显著抑制弓形虫增殖,并且免疫荧光试验进一步的观察到薏苡素可以显著抑制细胞内弓形虫增殖,证明薏苡素对弓形虫感染的宿主细胞具有较好的保护作用。
[0089]
3.体内药效试验表明,薏苡素能够显著抑制小鼠肠系膜淋巴结和腹腔中弓形虫的数量,降低急性弓形虫感染后的脾指数,通过抑制肝脏、肺脏内弓形虫的增殖改善肺损伤以
及肝损伤,有望成为抗弓形虫的候选先导化合物。
[0090]
虽然本发明已以较佳的实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可以做各种改动和修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。