1.本发明涉及医药技术领域,具体是涉及一种基于单链抗体片段的重组融合蛋白、纳米组装体及其制备方法与应用。
背景技术:
2.以免疫检查点阻断抗体为代表的单克隆抗体药物已成为全球生物制药领域的新热点,已上市的pd1/pdl1、ctla4单抗药物正在深刻地改变肿瘤治疗的格局。目前国内已有10余款pd1/pdl1单抗药物被批准用于非小细胞肺癌、黑色素瘤等不同类型肿瘤的治疗。同时,针对t细胞的其它免疫检查点分子(tigit、ox40、lag3、tim3等)以及其他免疫细胞(包括巨噬细胞、自然杀伤细胞等)的单抗药物的研发也在如火如荼地进行。
3.免疫检查点单抗药物展现出巨大的商业价值和广阔的临床应用前景,但不同类型肿瘤以及同种类型肿瘤不同患者对该类免疫疗法的反应差异很大,临床应答率总体偏低。近年来,双特异性抗体,甚至多特异性抗体作为一种有效的策略日益引起重视,被开发出来用于克服单抗药物效价不足的问题。例如,美国食品药品监督管理局2014年批准用于前体b细胞前体急性淋巴性白血病治疗的blinatumomab是一种cd19 x cd3双特异性抗体,其能够同时结合b淋巴母细胞表面的cd19分子和t细胞表面的cd3分子,激活t细胞的同时桥接两种细胞,进而增强t细胞对肿瘤细胞的杀伤。有研究表明,三特异性抗体相较于双特异抗体和单克隆抗体具备更强的肿瘤识别和杀伤能力。例如,法国赛诺菲公司研发的cd3 x cd28 x cd38三特异性抗体不仅具备cd3 x cd38双特异性抗体桥接效-靶细胞和活化t细胞的能力,还能同时提供激活和共刺激信号,阻止t细胞凋亡,进而发挥更强的抗肿瘤效应。双/多特异性抗体虽然有望提高抗体的效价和肿瘤治疗效果,但其结构设计和生产过程相较于单克隆抗体复杂性大幅增加,以基因重组技术制备双特异性抗体为例,在表达双特异抗体时理论上会产生10种以上副产物。虽然研究人员发展出分子设计策略来减少某种副产物的产生,而不能完全消除全部的副产物,这些都对下游工艺开发提出了重大挑战。
4.纳米颗粒作为一类高效的药物递送载体,被广泛应用于改善小分子药物、蛋白质药物、核酸类药物的代谢行为和药效。纳米载体在免疫检查点阻断抗体等抗体类药物的递送上已展现出独特的优势。尤其需要指出的是,将两种或多种单克隆抗体药物固定在纳米粒的表面,不仅能够实现抗体药物的多特异性,还能实现“多价态”(多个抗体分子固定于同一颗粒表面),这可能是“载体化”抗体药物具有更高效抗肿瘤效应的重要原因。
5.如前所述,将多种单抗药物连接在纳米载体表面是一种极具潜力的提高抗体疗效的策略。然而,已报道的固定抗体的方式主要是利用抗体药物分子上的氨基、羧基、巯基等基团将其键合到颗粒表面,但这些方法存在诸多问题,如反应和纯化过程复杂,还会破坏抗体的高级结构或封闭治疗型抗体的抗原识别区,显著降低抗体识别抗原的能力等。
6.单链抗体片段(single-chain variable fragment,scfv)是指通过基因重组技术,人工表达保留了与抗原特异性结合的免疫球蛋白fab片段中简要部分,由一段重链和一
段轻链组成,两链之间通过短多肽铰链连接,scfv既保留了抗原识别和结合的特性,同时其分子小,可以与多肽或蛋白重组成融合蛋白。血清白蛋白等蛋白质被广泛用于药物递送载体的构建,abraxane等载药白蛋白纳米药物已被批准用于恶性肿瘤的治疗。如果将scfv与血清白蛋白等重组成融合蛋白,然后将两种或者多种融合蛋白组装在一起,即可以构建出一种新型的双/多特异性抗体,这类抗体具有多特异性、多价态等特性,有望在肿瘤等疾病中发挥重要作用。
技术实现要素:
7.基于此,本发明的目的之一在于提供重组融合蛋白,该重组融合蛋白可以构建纳米组装体,该纳米组装体可用于至少一种单链抗体片段的递送,发挥单特异性、双特异性或多特异性抗体的功能。
8.一种重组融合蛋白,包括具有疏水区域的蛋白、免疫调节性抗体功能片段,所述具有疏水区域的蛋白、免疫调节性抗体功能片段直接连接或者通过肽接头连接,所述免疫调节性抗体功能片段为单链抗体片段,所述单链抗体片段具有特异性识别和结合抗原的能力。
9.本发明的第二目的是提供一种递送至少一种单链抗体片段的纳米组装体。
10.所述纳米组装体由包括上述至少一种的融合蛋白与疏水性可降解聚酯或其衍生物通过疏水相互作用结合构成,不同种融合蛋白的单链抗体片段不同。
11.本发明的第三目的是提供一种上述的纳米组装体的制备方法,包括以下步骤:
12.(1)将上述融合蛋白与水或水溶液混合,得水相,其浓度为0.5~20mg/ml,优选为5~10mg/ml;
13.将所述疏水性可降解聚酯及其衍生物与有机溶剂混合,其浓度为0.5~10mg/ml,优选范围为1~5mg/ml,得油相;
14.(2)将步骤(1)所述水相和油相制备成水包油的乳剂,优选地,所述水相与油相的体积比为1:1~10:1,优选为5:1~10:1;
15.(3)将所述乳剂分离纯化,得纳米组装体。
16.本发明的第四目的是提供上述融合蛋白在制备递送至少一种单链抗体片段的纳米组装体中的应用。
17.还提供上述的纳米组装体在制备治疗免疫性药物中的应用。
18.与现有技术相比,本发明具有以下有益效果:
19.本发明通过选择疏水性可降解聚酯或其它疏水性分子和特定的具有疏水结构域的蛋白的重组融合蛋白制备形成了能够靶向单个抗原表位或多个抗原表位的多价的纳米组装体。该方法通过简单的物理混合以及调控不同重组融合蛋白混合的比例,即可快速、稳定的制备出含有不同种类及不同比例单链抗体片段的纳米组装体,简便的实现了单链抗体片段的“多价效应”和“多特异性效应”。
20.本发明制备所得的纳米组装体由疏水性的聚酯或其他疏水分子通过疏水相互作用与蛋白的疏水结构域进行缠结组装,具有优异的稳定性,单链抗体片段之间的活性相互不受影响。
21.本发明首次将这种构建得到的纳米组装体用于对肿瘤或自身免疫疾病药物的研
发中。
附图说明
22.图1为使用pcr方法获得小鼠msa基因序列,核酸凝胶电泳表征结果。
23.图2为使用pcr方法鉴定重组质粒转化大肠杆菌核酸凝胶电泳结果。
24.图3为使用选择性培养基筛选mut 酵母重组子结果,对勾标记为mut 酵母。
25.图4为使用pcr方法挑选酵母重组子方法,核酸凝胶电泳鉴定。
26.图5为使用sds-page鉴定重组酵母细胞表达的重组融合蛋白。
27.图6为使用western blot方法鉴定重组酵母细胞表达的重组融合蛋白。
28.图7为使用sds-page方法鉴定哺乳动物细胞系统表达的重组融合蛋白。
29.图8为使用western blot方法鉴定哺乳动物细胞系统表达的重组融合蛋白。
30.图9为使用elisa方法鉴定哺乳动物细胞系统或酵母系统表达的重组融合蛋白生物活性。
31.图10为使用zetasizer设备检测重组蛋白制备的纳米组装体的粒径。
32.图11为重组融合蛋白纳米组装体形貌表征
33.图12为αpd1/α41bb纳米组装体激活t细胞增殖的效果。
34.图13为αpd1/α41bb纳米组装体维持t细胞存活的效果。
35.图14为αpd1/α4-1bb纳米组装体增强t细胞特异性杀伤肿瘤细胞的效果。
36.图15为αpd1/α4-1bb纳米组装体增强t细胞ifn-γ细胞因子分泌的效果。
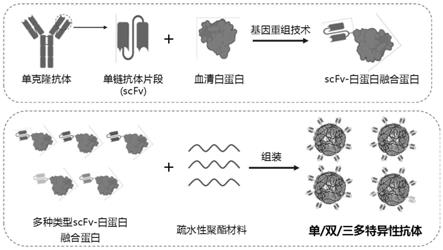
37.图16为本发明融合蛋白、组装体以及应用的原理示意图。
具体实施方式
38.本发明下列实施例中未注明具体条件的实验方法,通常按照常规条件,或按照制造厂商所建议的条件。实施例中所用到的各种常用化学试剂,均为市售产品。
39.除非另有定义,本发明所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不用于限制本发明。
40.本发明的术语“包括”和“具有”以及它们任何变形,意图在于覆盖不排他的包含。例如包含了一系列步骤的过程、方法、装置、产品或设备没有限定于已列出的步骤或模块,而是可选地还包括没有列出的步骤,或可选地还包括对于这些过程、方法、产品或设备固有的其它步骤。
41.在本发明中提及的“多个”是指两个或两个以上。“和/或”,描述关联对象的关联关系,表示可以存在三种关系,例如,a和/或b,可以表示:单独存在a,同时存在a和b,单独存在b这三种情况。字符“/”一般表示前后关联对象是一种“或”的关系。
42.本发明实施方式中涉及一种融合蛋白,包括具有疏水区域的蛋白、连接肽、单链抗体片段。
43.在其中一些实施例中,所述单链抗体片段种类包括但不限于来源于人或小鼠或大鼠等物种的cd137l,cd137,4-1bbl,4-1bb,ox40l,ox40,icosl,icos,cd86,cd80,cd28,lfa3,cd2,ctla4,pdl1,pd1,cd70,cd27,gal9,tim3,cd111,cd96,cd112,cd226,cd115,
cd113,tigit,cd39,cd73,cd47,sirpα,tnfα,il1β,il6,tgfβ,il-10,il-12抗体的单链抗体片段,因此对应地,所述融合蛋白可以靶向cd137l,cd137,4-1bbl,4-1bb,ox40l,ox40,icosl,icos,cd86,cd80,cd28,lfa3,cd2,ctla4,pdl1,pd1,cd70,cd27,gal9,tim3,cd111,cd96,cd112,cd226,cd115,cd113,tigit,cd39,cd73,cd47,sirpα,tnfα,il1β,il6,tgfβ,il-10,il-12的位点,具有竞争性结合靶点、抑制信号通路、激活信号通路、靶向抗原的作用。
44.在其中一些实施例中,所述单链抗体片段由抗体重链可变区vh和抗体轻链可变区vl连接形成,连接构型包括vl-vh-ac;vl-vh-an;vh-vl-ac;vh-vl-an;vl-vh-l-ac;vl-vh-l-an;vh-vl-l-ac;vh-vl-l-an至少一种构型,其中vl是抗体轻链可变区、肽或多肽序列,vh是抗体重链可变区、肽或多肽序列、治疗性蛋白质及其片段,l是连接肽,ac是血清白蛋白序列碳端,an是血清白蛋白氮端。所述vh和vl可以通过连接肽连接,所述连接肽可以是包括但不限于(ggggs)n、(eaaak)n,n为整数的连接肽中的至少一种。
45.在其中一些实施例中,所述蛋白至少具有三个疏水区域,其能与疏水性可降解及其衍生物通过疏水相互作用结合,在本发明中,其为白蛋白,即血清白蛋白,可以是来自人血清白蛋白、牛血清白蛋白、小鼠血清白蛋白、小鼠血清白蛋白、大鼠血清白蛋白、兔血清白蛋白、鸡卵清白蛋白、免疫球蛋白g、蛋白a和蛋白g中的至少一种。
46.在其中一些优选的实施例中,所述蛋白是具有至少三个或四个疏水结构域的来自于人血清白蛋白的蛋白,所述具有疏水区域的蛋白是具有至少五个疏水结构域的来自于人血清白蛋白的蛋白,或上述经过经取代、缺失和/或添加一个或多个氨基酸而疏水结构域完整的蛋白,更优选为,具有六个、七个疏水结构域的来自于人血清白蛋白的蛋白。
47.连接肽(肽接头)可以是常规用于连接多肽的肽段序列,其能够连接两个多肽并将其自然折叠成所期望结构,通常其是具有一段有疏水性和一定伸展性的短肽,在本发明中的目的是可将融合的两种蛋白分开,以缓解二者相互干扰作用。所述肽接头可以是柔性的或刚性的。在某些实施方案中,柔性的肽接头可能是有利的,其能够连接两种蛋白/多肽成分,并且保持其各自的活性和功能。在其中一些实施例中,所述融合蛋白中,疏水区域的蛋白、免疫调节性抗体功能片段由肽接头连接,该肽接头在一些实施例中,例如使用[glyglyglyglyser]n,n为0-4的整数,更优选为1,2,3。当n为0时,即意味着疏水区域的蛋白与免疫调节性抗体功能片段(单链抗体片段)直接连接。
[0048]
本发明的某些实施方案中,基于单链抗体片段的重组融合蛋白的基因载体包括但不限于:pcdna3.1,pcdna3.0,pcdna2.0,pcdna4.0,ppicza,ppiczb,ppiczc载体质粒以及其他类似的能够在酵母或哺乳动物细胞、昆虫细胞、体外表达系统中表达的基因载体。
[0049]
单链抗体片段scfv及其变体序列可以由领域内熟知的数据库imgt中分别查询抗体轻链可变区、抗体重链可变区,经过连接肽连接组成,其中抗体轻链可变区和抗体重链可变区序列,可以是来自同一抗体的轻链可变区和重链可变区,也可是来自不同抗体的轻链可变区和重链可变区组合而成,或来自单域抗体的重链可变区。
[0050]
本发明的一些实施例中,涉及编码上述重组融合蛋白的基因,或含有编码上述重组融合蛋白的基因的质粒载体。
[0051]
在一些实施方案中转化/转染所需核酸至宿主细胞中可用通常的方法,如:电穿孔、脂质体转染、pei转染、慢病毒转染、制备感受态的原生质体等。
[0052]
在一些实施方案中成功转化/转染的细胞,即含有本发明基因构建体的细胞,可通过本领域内熟知的技术进行鉴定,如裂解细胞提取基因组dna进行pcr反应鉴定,或使用免疫亲和如western blot及elisa技术鉴定细胞内或细胞培养上清中的重组融合蛋白his标签及hsa、msa、单链抗体片段kappa链。
[0053]
在一些实施方案中可以通过培养含有本发明基因构建体的宿主,如重组酵母、重组哺乳动物细胞、重组昆虫细胞、重组细菌、转基因动植物等,生产本发明的融合蛋白。具体的培养方法可以用摇瓶、转瓶、生物反应器等。
[0054]
在一些实施方案中重组融合蛋白可以存在于宿主细胞内,也可以是从宿主中分泌出来,优选的是从宿主中分泌出来。分泌所用的信号肽,优选的是酵母α-factor信号肽和天然的il-2信号肽序列,或这两种信号肽的类似物。编码融合蛋白的基因,可以插入至宿主染色体,或以游离质粒形式存在
[0055]
在一些实施方案中含有重组融合蛋白的培养基或细胞可以通过离心的方法收集。重组融合蛋白的分离纯化及浓缩可以用本领域内通用的如盐析、有机试剂沉淀、等电点沉淀、超滤、透析、切向流、液相层析等技术及这些技术的组合。其中液相层析可以用凝胶排阻、亲和、离子交换、疏水、反相等层析技术。
[0056]
上述重组融合蛋白,可以用于制备传递至少一种单链抗体片段的纳米组装体。
[0057]
本发明的一些实施例中,涉及到一种纳米组装体,所述纳米组装体由上述至少一种重组融合蛋白与疏水性可降解聚酯及其衍生物通过疏水相互作用结合构成,不同融合蛋白的单链抗体片段不同。
[0058]
所述纳米组装体,可由多种重组融合蛋白与疏水性材料组成而成,每种不同的重组融合蛋白中的单链抗体片段不同必然不同,但是构成组融合蛋白的具有疏水区域的蛋白可以相同,也可以不相同。这样的纳米组装体用于递送不同单链抗体片段,以便与不同的抗原识别、结合。
[0059]
该纳米组装体的组分另一组分是是疏水性聚合物材料,包括但不限于:与水亲和力差的疏水性脂肪族聚酯、长链脂肪酸和/或疏水性小分子药物。
[0060]
所述疏水性可降解聚酯及其衍生物可是目前已知的可降解的生物材料,也包括将来进一步研发产生的新的可降解的生物材料,其能与上述融合蛋白中的蛋白部分的疏水区域结合。所述聚酯为脂肪族聚酯或其衍生物,或聚乙二醇修饰的脂肪族聚酯或其衍生物。
[0061]
所述疏水性脂肪族聚酯为脂肪族聚酯和/或不同侧基、端基基团修饰的脂肪族聚酯衍生物,聚乙二醇修饰的脂肪族聚酯和/或不同侧基、端基基团修饰的衍生物中的至少一种,且具有生物相容性和生物可降解性。
[0062]
所述脂肪族聚酯包括但不限于聚丙交酯、聚乙交酯、聚(丙交酯-co-乙交酯)和聚己内酯中的至少一种;所述聚乙二醇修饰的脂肪族聚酯包括但不限于聚乙二醇修饰的聚丙交酯、聚乙二醇修饰的聚乙交酯、聚乙二醇修饰的聚(丙交酯-co-乙交酯)和聚乙二醇修饰的聚己内酯中的至少一种。
[0063]
所述脂肪族聚酯为聚丙交酯;所述聚丙交酯为左旋聚丙交酯、右旋聚丙交酯或外消旋聚丙交酯;所述聚丙交酯的端基为酯基、羧基、羟基中的至少一种。
[0064]
所述疏水性材料,聚(丙交酯-co-乙交酯)中la/ga的比例范围为95/5~50/50。
[0065]
所述聚丙交酯为左旋聚丙交酯,所述左旋聚丙交酯的端基为酯基,所述左旋聚丙
交酯的分子量范围为7200~1100000道尔顿,优选为137000~240000道尔顿。
[0066]
在其中一些实施例中,纳米组装体为纳米颗粒,其粒径范围为20~400nm,优选为80~200nm,优选范围为80~150nm。
[0067]
本发明一些实施例中,涉及到一种上述的纳米组装体的制备方法,包括以下步骤:
[0068]
(1)将所述融合蛋白与水或水溶液混合,得水相;将所述疏水性可降解聚酯及其衍生物与有机溶剂混合,得油相;
[0069]
(2)将步骤(1)所述水相和油相制备成水包油的乳剂;
[0070]
(3)将所述乳剂分离纯化,得纳米组装体。
[0071]
在其中一些实施例中,利用微流控、高压均质、超声等方式制备成水包油的乳剂;
[0072]
或将所述乳剂通过旋蒸、冻干、离心、层析、超滤等方式分离纯化,得纳米组装体。
[0073]
在其中一些实施例中,水相中所述融合蛋白浓度为0.5~20mg/ml,优选为5~10mg/ml;
[0074]
油相中疏水性可降解聚酯及其衍生物浓度为0.5~10mg/ml,优选范围为1~5mg/ml。
[0075]
所述水相与油相的体积比为1:1~10:1,优选为5:1~10:1;
[0076]
在其中一些实施例中,所述聚酯与蛋白的重量比为1:0.1~1:30,优选为1:1~1:25,优选为1:2~1:15,更优选为1:3~1:15。
[0077]
所述疏水性材料的溶剂为氯仿、二氯甲烷、乙酸乙酯、甲醇、乙腈的至少一种,优选为二氯甲烷、乙酸乙酯、甲醇,更优选为二氯甲烷、乙酸乙酯。
[0078]
在其中一些实施例中,上述纳米颗粒的制备过程中不含额外的稳定剂。
[0079]
在其中一些实施例中,纳米颗粒可以通过离心、切向流透析(通过切向流装置在切向剪切力的作用下透析)和排除色谱(根据纳米颗粒和游离蛋白的分子量大小)中的至少一种方法分离游离的蛋白和纳米颗粒。
[0080]
在其中一些实施例中,将所述水相和油相制备成水包油的乳剂的方法包括超声乳化或高压均质乳化或微流控。
[0081]
所述重组融合蛋白在水相中的浓度为0.5~20mg/ml,优选为5~10mg/ml;所述聚酯在油相中的浓度为0.5~10mg/ml,优选范围为1~5mg/ml。
[0082]
本发明一些实施方式中,一种上述的纳米组装体作为抗肿瘤治疗药物的应用。
[0083]
在其中一些实施例中,所述抗肿瘤治疗药物为肿瘤免疫治疗药物或肿瘤靶向治疗药物。
[0084]
在其中一些实施例中,本发明所述纳米组装体可由经fda批准的高分子聚酯和白蛋白融合蛋白组装而成,具有优异的生物相容性。
[0085]
在其中一些实施例中,所述纳米组装体可以同时携带多种重组融合蛋白,包括但不限于αher2 scfv-msa、α4-1bb scfv-msa、αcd19 scfv-hsa、αpdl1 scfv-hsa、αtigit scfv-hsa、αpd1 scfv-hsa中的两种或两种以上。
[0086]
本发明所述单链抗体片段重组融合蛋白纳米组装体,通过聚乳酸与重组融合蛋白中白蛋白结构的疏水作用进行组装,形成了具有稳定结构的纳米组装体,其可携带多种靶向相同或不同靶点的单链抗体片段,温和的组装条件不会破坏抗原识别域的结构(参见图16),克服了传统化学键合固定方式会破坏抗体药物的结构、封闭其抗体识别区、显著影响
抗体药物功能、复杂度高、难度高等缺陷,为联合抗体治疗的发展提供了一种全新思路的简便结构设计。
[0087]
本发明制备所得的纳米组装体可由经fda批准的聚酯和天然的血清白蛋白组装而成,具有优异的生物相容性。
[0088]
以下结合具体实施例对本发明作进一步详细的说明。
[0089]
以下实施例中所用到的相关序列。
[0090]
seq id no.1:
[0091]
αher2 scfv-hsa
[0092]
efdiqmtqspsslsasvgdrvtitcrasqdvntavawyqqkpgkapklliysasflysgvpsrfsgsrsgtdftltisslqpedfatyycqqhyttpptfgqgtkveikggggsggggsggggsevqlvesggglvqpggslrlscaasgfnikdtyihwvrqapgkglewvariyptngytryadsvkgrftisadtskntaylqmnslraedtavyycsrwggdgfyamdywgqgtlvtvssggggsdahksevahrfkdlgeenfkalvliafaqylqqcpfedhvklvnevtefaktcvadesaencdkslhtlfgdklctvatlretygemadccakqepernecflqhkddnpnlprlvrpevdvmctafhdneetflkkylyeiarrhpyfyapellffakrykaafteccqaadkaacllpkldelrdegkassakqrlkcaslqkfgerafkawavarlsqrfpkaefaevsklvtdltkvhtecchgdllecaddradlakyicenqdsissklkeccekpllekshciaevendempadlpslaadfveskdvcknyaeakdvflgmflyeyarrhpdysvvlllrlaktyettlekccaaadphecyakvfdefkplveepqnlikqncelfeqlgeykfqnallvrytkkvpqvstptlvevsrnlgkvgskcckhpeakrmpcaedylsvvlnqlcvlhektpvsdrvtkccteslvnrrpcfsalevdetyvpkefnaetftfhadictlsekerqikkqtalvelvkhkpkatkeqlkavmddfaafvekcckaddketcfaeegkklvaasqaalgleqkliseedlnsavdhhhhhh
[0093]
seq id no.2:
[0094]
α4-1bb scfv
[0095]
efemqlvesggglvqpgrsmklscagsgftlsdygvawvrqapkkglewvayisyaggttyyresvkgrftisrdnakstlylqmdslrsedtatyyctidgyggysgshwyfdfwgpgtmvtvssggggsggggsggggsdiqmtqspsllsasvgdrvtlncrtsqnvyknlawyqqqlgeapklliynanslqagipsrfsgsgsgtdftltisslqpedvatyfcqqyysgntfgagtnlelkggsgg
[0096]
seq id no.3:
[0097]
αcd19 scfv-hsa
[0098]
efdiqmtqspaslstslgetvtiqcqasediysglawyqqkpgkspqlliygasdlqdgvpsrfsgsgsgtqyslkitsmqtedegvyfcqqgltyprtfgggtklelkggggsggggsggggsevqlqqsgaelvrpgtsvklsckvsgdtitfyymhfvkqrpgqglewigridpedestkysekfknkatltadtssntaylklssltsedtatyfciyggyyfdywgqgvmvtvssggsggaaargvfrreahkseiahryndlgeqhfkglvliafsqylqkcsydehaklvqevtdfaktcvadesaancdkslhtlfgdklcaipnlrenygeladcctkqepernecflqhkddnpslppferpeaeamctsfkenpttfmghylhevarrhpyfyapellyyaeqyneiltqccaeadkescltpkldgvkekalvssvrqrmkcssmqkfgerafkawavarlsqtfpnadfaeitklatdltkvnkecchgdllecaddraelakymcenqatissklqtccdkpllkkahclsevehdtmpadlpaiaadfvedqevcknyaeakdvflgtflyeysrrhpdysvslllrlakkyeatlekccaeanppacygtvlaefqplveepknlvktncdlyeklgeygfqnailvrytqkapqvstptlveaarnlgrvgtkcctlpedqrlpcvedylsailnrvcllhektpvsehvtkccsgslverrpcfsaltvdetyvpkefkaetftfhsdictlpekekqikkqtalaelvkhkpkataeqlktvmddfaqfldtcckaadkdtcfstegpnlvtrckdalan
leqkliseedlnsavdhhhhhh
[0099]
seq id no.4:
[0100]
αpdl1 scfv-hsa
[0101]
efsyvltqppsvsvapgqtaritcggnnigsksvhwyqqkpgqapvlvvyddndrpsglperfsgsnsgntatltisrveagdeadyycqvwdsssdhvvfgggtkltvlggggsggggsggggsevqllepggglvqpggslrlsceasgstfstyamswvrqapgkglewvsgfsgsggftfyadsvrgrftisrdsskntlflqmsslraedtavyycaipargynygsfqhwgqgtlvtvssggggsdahksevahrfkdlgeenfkalvliafaqylqqcpfedhvklvnevtefaktcvadesaencdkslhtlfgdklctvatlretygemadccakqepernecflqhkddnpnlprlvrpevdvmctafhdneetflkkylyeiarrhpyfyapellffakrykaafteccqaadkaacllpkldelrdegkassakqrlkcaslqkfgerafkawavarlsqrfpkaefaevsklvtdltkvhtecchgdllecaddradlakyicenqdsissklkeccekpllekshciaevendempadlpslaadfveskdvcknyaeakdvflgmflyeyarrhpdysvvlllrlaktyettlekccaaadphecyakvfdefkplveepqnlikqncelfeqlgeykfqnallvrytkkvpqvstptlvevsrnlgkvgskcckhpeakrmpcaedylsvvlnqlcvlhektpvsdrvtkccteslvnrrpcfsalevdetyvpkefnaetftfhadictlsekerqikkqtalvelvkhkpkatkeqlkavmddfaafvekcckaddketcfaeegkklvaasqaalgleqkliseedlnsavdhhhhhh
[0102]
seq id no.5:
[0103]
αpd1 scfv
[0104]
efqvqlvesgggvvqpgrslrlscaasgftfssygmhwvrqapgkglewvaviwydgsnkyyadsvkgrftisrdnskntlylqmnslraedtavyycasngdhwgqgtlvtvssggggsggggsggggseivmtqspatlsvspgeratlscrasqsvssnlawyqqkpgqaprlliygastratgiparfsgsgsgteftltisslqsedfavyycqqynnwprtfgqgtkveikggsgg
[0105]
seq id no.6:
[0106]
αtigit scfv-hsa
[0107]
efdivmtqspdslavslgeratinckssqtvlyssnnkkylawyqqkpgqppnlliywastresgvpdrfsgsgsgtdftltisslqaedvavyycqqyystpftfgpgtkveikggggsggggsggggsevqlqqsgpglvkpsqtlsltcaisgdsvssnsaawnwirqspsrglewlgktyyrfkwysdyavsvkgritinpdtsknqfslqlnsvtpedtavfyctresttydllagpfdywgqgtlvtvssggggsdahksevahrfkdlgeenfkalvliafaqylqqcpfedhvklvnevtefaktcvadesaencdkslhtlfgdklctvatlretygemadccakqepernecflqhkddnpnlprlvrpevdvmctafhdneetflkkylyeiarrhpyfyapellffakrykaafteccqaadkaacllpkldelrdegkassakqrlkcaslqkfgerafkawavarlsqrfpkaefaevsklvtdltkvhtecchgdllecaddradlakyicenqdsissklkeccekpllekshciaevendempadlpslaadfveskdvcknyaeakdvflgmflyeyarrhpdysvvlllrlaktyettlekccaaadphecyakvfdefkplveepqnlikqncelfeqlgeykfqnallvrytkkvpqvstptlvevsrnlgkvgskcckhpeakrmpcaedylsvvlnqlcvlhektpvsdrvtkccteslvnrrpcfsalevdetyvpkefnaetftfhadictlsekerqikkqtalvelvkhkpkatkeqlkavmddfaafvekcckaddketcfaeegkklvaasqaalgleqkliseedlnsavdhhhhhh
[0108]
seq id no.7:t7引物taatacgactcactatagg
[0109]
seq id no.8:bgh引物tagaaggcacagtcgagg
[0110]
seq id no.9:msa f gtccccagtcatcagctcctaggggtgtgtttcgccgag
[0111]
seq id no.10:msa r gactctagaggctaaggcgtctttgcatct。
[0112]
实施例中所用原料及来源:
[0113]
α4-1bb scfv-msa融合蛋白:由重组酵母菌表达,经akta蛋白纯化仪纯化所得。
[0114]
αpd1 scfv-msa融合蛋白:由重组酵母菌表达,经akta蛋白纯化仪纯化所得。
[0115]
αpdl1 scfv-msa融合蛋白:由重组酵母菌表达,经akta蛋白纯化仪纯化所得。
[0116]
αpd-l1 scfv-hsa融合蛋白:由hek 293t细胞表达,经akta蛋白纯化仪纯化所得。
[0117]
αegfr scfv-hsa融合蛋白:由hek 293t细胞表达,经akta蛋白纯化仪纯化所得。
[0118]
αher2 scfv-hsa融合蛋白:由hek 293t细胞表达,经akta蛋白纯化仪纯化所得。
[0119]
αtigit scfv-hsa融合蛋白:由hek 293t细胞表达,经akta蛋白纯化仪纯化所得。
[0120]
b16-f10-ova细胞:实验室自行构建。
[0121]
聚乳酸pla137k,分子量为137000da、封端为酯基的左旋聚乳酸:购自济南岱罡生物科技有限公司。
[0122]
二氯甲烷:购自广州化学试剂厂。
[0123]
无水乙醇:购自国药集团化学试剂有限公司。
[0124]
无蛋白封闭液:购自上海生工生物工程股份有限公司。
[0125]
his-tag antibody(hrp,mouse antibody):购自北京义翘神州生物技术有限公司。
[0126]
elisa显色液:购自北京义翘神州生物技术有限公司。
[0127]
pd-l1抗原:购自北京义翘神州生物技术有限公司。
[0128]
羊抗大鼠igg的hrp抗体:购自北京义翘神州生物技术有限公司。
[0129]
elisa所用聚苯乙烯板:购自美国corning公司。
[0130]
ifn elisa试剂盒:购自深圳达科为生物技术有限公司。
[0131]
annexin v细胞凋亡试剂盒:购自江苏凯基生物科技有限公司。
[0132]
实施例中所用实验仪器及型号公司:
[0133]
超声波细胞破碎仪:vcx130,美国sonics公司。
[0134]
旋转蒸发仪:rv 10 digital v数显型,德国ika公司。
[0135]
微通道反应器:1300 series a2,美国corning公司。
[0136]
纳米粒度及zeta电位仪:nano zse,英国malvern公司。
[0137]
台式微量冷冻离心机:microfuge 20r,美国beckman coulter公司。
[0138]
酶标仪:美国biotek公司。
[0139]
实施例1单链抗体片段融合蛋白基因的设计
[0140]
进入imgt数据库,进入抗体序列查找入口,输入需要查询的抗体靶点,选择抗体,进入氨基酸序列界面,选择vh和vl kappa或lamda段,将两个片段用(ggggs)3连接,得到相应的单链抗体片段肽段序列。
[0141]
其中αher2 scfv、α4-1bb scfv结构为vl-l-vh,αpdl1 scfv、αtigit scfv结构为vh-l-vl。
[0142]
将单链抗体片段与hsa或msa不含信号肽的肽段序列通过(ggggs)3连接,得到相应的单链抗体片段-白蛋白重组融合蛋白肽段序列。
[0143]
将肽段序列通过snapgene或其他类似软件,转化成核苷酸序列,由上海生工公司合成。
[0144]
以上述方法构建了αher2 scfv-hsa,序列如seq id no.1所示;
[0145]
以上述方法构建了α4-1bb scfv,序列如seq id no.2所示;
[0146]
以上述方法构建了αcd19 scfv-hsa,序列如seq id no.3所示;
[0147]
以上述方法构建了αpdl1 scfv,序列如seq id no.4所示;
[0148]
以上述方法构建了αtigit scfv-hsa,序列如seq id no.5所示。
[0149]
实施例2从小鼠cdna文库扩增msa序列
[0150]
用pcr方法从小鼠肝胎cdna文库中获得不带有信号肽编码序列的msa(小鼠血清白蛋白,mouse serum albumin)cdna,所用的引物msa f(seq id no.8)和msa r(seq id no.9)用寡聚核苷酸合成仪合成,下游引物引入xbai酶切位点和保护碱基,划线处为内切酶识别序列。
[0151]
50μl pcr反应体系:2x mix 25μl,dna模板《200ng,msa f(seq id no.8)(10pmol/μl)1μl,msa r(seq id no.9)10pmol/μl)1μl,剩余用ddh2o补足,反应体系可按需求等倍缩小或放大。轻柔混匀后进行pcr,pcr反应条件为94℃热变性1min;94℃变性30s;58℃退火30s;72℃延伸1.5min;共30个循环;再72℃延伸5min。通过1%琼脂糖凝胶检测分析得到预期为1.6kb的条带,如图1所示,胶回收,定量。
[0152]
实施例3双酶切构建scfv-msa酵母系统表达质粒
[0153]
α4-1bb scfv序列由生工公司合成,序列如seq id no.2所示,αpd1 scfv序列由生工公司合成,序列如seq id no.6所示。
[0154]
利用特异性核酸内切酶ecorⅰ和xhoⅰ酶切重组融合蛋白基因序列和pcdna3.1载体,50μl酶切反应体系:重组融合蛋白基因片段和ppiczα质粒1μg,ecorⅰ和xhoⅰ内切酶各1μl,cutsmart buffer 5μl,剩余用ddh2o补足,37℃酶切2h以上(无星号活性最好过夜),65℃20min热失活。琼脂糖凝胶电泳,电泳结果如图2所示,切割目的条带后胶回收。t4 dna ligase连接胶回收后的插入片段与质粒,20μl连接反应体系:t4reaction buffer 2μl,pcdna3.1 dna 10ng,重组融合蛋白dna 40ng,ddh2o to 10μl,t4 dna ligase 1μl,25℃反应20min或16℃过夜连接。
[0155]
实施例4单链抗体片段-白蛋白重组融合蛋白表达质粒转化大肠杆菌并鉴定
[0156]
大肠杆菌感受态dh5α置冰上融化,取50μl感受态大肠杆菌dh5α和20μl连接后质粒,轻轻吹打混匀后冰上静置30min;42℃水浴热击45s后,立刻转移到冰上,静置2min;向离心管中加入200μl无抗性的lb培养基,37℃,200rpm,复苏1h;取20μl菌液涂布至含氨苄抗性的lb平板上,37℃倒置培养12h。
[0157]
使用pcr程序验证单链抗体片段-白蛋白重组融合蛋白表达质粒质粒构建,引物序列如seq id no.6所示,pcr鉴定后采用核酸凝胶电泳表征,如图2所示。pcr鉴定含有目的基因的菌落,送生工公司进行质粒测序,测序结果与预期吻合。
[0158]
实施例5单链抗体片段-白蛋白重组融合蛋白重组酵母菌转化
[0159]
线性化质粒dna并脱磷酸化处理,50μl酶切反应体系为质粒dna 5μg,cutsmart buffer(10x)5μl,pmei 1μl,快速cip 1μl,补充ddh2o至50μl,pcr仪37℃酶切2h以上,65℃热灭活20min。
[0160]
在室温下解冻一管感受态细胞,加3μg线性化的dna载体到感受态细胞中。向dna/细胞混合物中加入1ml溶液ii,通过涡旋或轻弹离心管进行混合。将转化混合物在30℃的水
浴或培养箱中培养1小时。每隔15分钟通过涡旋或轻弹离心管混合转化反应。在42℃的热块或水浴中10分钟来热休克细胞。将细胞分成2管(大约525μl每管)并各加1ml ypd培养基。将细胞在30℃下孵育1小时,以表达zeocin抗性基因。在室温下以3000
×
g离心5分钟使细胞成球。弃上清。每管细胞用500μl溶液iii重悬,并将两管细胞整合到一管。在室温下以3000
×
g离心5分钟使细胞成球。弃上清。细胞用100-150μl溶液iii重悬。用无菌涂布器将整个转化子置于适当的平板上筛选。在30℃下培养3至10天,每次转化应产生约50个菌落。利用通过将菌落同时接种于mdh(碳源为葡萄糖)与mmh(碳源为甲醇)的平板,通过比较菌落大小差异,筛选mut 阳性克隆。如图3中所示,菌落1、2、3、4、5、6在mdh与mmh平板上生长无显著差异,因此认为为mut 阳性克隆。
[0161]
选择6-10个zeocin抗性的毕赤酵母转化子,使用pcr分析插入物的存在情况。参见图4。
[0162]
实施例6 mut
重组酵母的诱导表达(摇瓶培养)
[0163]
挑选单菌落,置于装有25ml bmgy培养基的250ml摇瓶中,于28-30℃250-300rpm培养至od600=2-6(16-18h),取1ml冻存;室温下1500-3000g离心5min,收集菌体,用bmmy重悬菌体,使od600=1.0左右(约100-200ml),开始诱导表达;将所得的菌液置于1l的摇瓶中,用双层纱布或粗棉布封口,放置于20-30℃,转速为250-300rpm的摇床上继续生长;每24h向培养基中添加100%甲醇至终浓度为0.5~1.0%;按时间点分别取菌液样品,取样量为1ml,置于1.5ml ep管中,最大转速离心2~3min,分别收集上清和菌体,分析目的蛋白的表达量和菌液最佳收获时间。时间点一般取:0、6、12、24、36、48、60、72、84和96h。
[0164]
实施例7mut
重组酵母的表达产物纯化和表征
[0165]
将重组酵母表达菌液8000g x 20min离心,收集上清。上清经切向流设备浓缩至适宜体积后,利用binding buffer(磷酸钾缓冲液)置换培养基,以及镍柱保存液。将发酵产物与镍柱于4℃冰箱混合孵育,利用washing buffer(低浓度咪唑)洗涤镍柱5次,洗涤杂蛋白。利用elution buffer(高浓度咪唑)重悬填料,静置20min,待填料沉于管底,收集流出液。对于1l发酵体系,常利用akta蛋白纯化系统进行蛋白的纯化。akta是制备级蛋白纯化层析系统,用于快速安全的进行可放大的蛋白纯化和分离。分离过程包括1)平衡,利用binding buffer(磷酸钾缓冲液)平衡镍柱;2)结合,利用上样杯或自动上样泵进行上样,上样流速控制在0.5-1ml/min;3)洗涤,利用含有20mm咪唑的磷酸盐缓冲液冲洗镍柱10个柱体积,上样流速控制在2ml/min;4)洗脱,利用含有500mm咪唑的磷酸盐缓冲液冲洗镍柱10个柱体积,上样流速控制在2ml/min。收集洗脱液,利用10kda超滤管浓缩,利用sds-page表征蛋白的纯度,如图5所示。
[0166]
利用anti-his-hrp抗体,进行wb实验,检测目的蛋白的表达,如图6所示。
[0167]
实施例8哺乳动物表达系统表达重组融合蛋白
[0168]
αher2 scfv-hsa-pcdna3.1、αegfrviii scfv-hsa-pcdna3.1、αtigit scfv-hsa-pcdna3.1质粒由生工公司合成。18μg质粒与不含血清的f-12k培养基混匀至500μl,54μl pei与不含血清的f-12k培养基混匀至500μl。将f12-k/pei混合液逐滴加入至质粒混合液中,混合均匀,室温孵育10min,期间轻轻弹ep管。孵育完成后,将混合液与约1
×
107cho-k1或hek 293t细胞混合,37℃培养6-8h,更换为无血清的f-12k培养基,培养72h。
[0169]
实施例9哺乳动物表达系统表达融合蛋白的纯化
[0170]
镍柱纯化属于固定化金属离子亲和色谱(immobilized zirconium ion affinity chromatography,imac),具有高载量、高纯化速度、高特异性。过渡金属通过与氨基酸的羧基或氨基形成稳定的螯合物,实现对特定蛋白的纯化。ni柱的洗脱采用竞争洗脱,先用低浓度的咪唑将杂蛋白和结合不牢的蛋白洗去,再用合适浓度的咪唑将目的蛋白洗脱。
[0171]
将细胞转染后72h上清收集浓缩至适宜体积后,利用binding buffer(磷酸钾缓冲液)置换培养基,以及镍柱保存液。将发酵产物与镍柱于4℃冰箱混合孵育,利用washing buffer(低浓度咪唑)洗涤镍柱5次,洗涤杂蛋白。利用elution buffer(高浓度咪唑)重悬填料,静置20min,待填料沉于管底,收集流出液,利用超滤管进行浓缩。利用sds-page技术表征产出的蛋白,结果如图7所示,重组融合蛋白纯化后在100kda分子量位置出现明显的条带,表明重组融合蛋白分子量在110kda附近。
[0172]
实施例10表征哺乳动物系统表达的重组融合蛋白结构
[0173]
(1)结构表征
[0174]
将纯化后的重组融合蛋白,分别稀释10倍、100倍、1000倍,取不同稀释浓度的重组融合蛋白各20μl,使用bca方法检测蛋白样品浓度。
[0175]
根据重组融合蛋白浓度,取20ng样品,与5x sds-loading buffer以4:1比例混合,99℃孵育15min。配制10%聚丙烯酰胺凝胶,每孔上20ng样品,80v电泳2h。
[0176]
取下凝胶置于装有转膜液的槽中,在转移液的培养皿里放入裁好的胶、浸过乙醇的pvdf膜、滤纸和海绵,平衡5min;平放转膜夹,黑色面在下,透明面在上,依次叠放海绵、4张浸泡过转膜液的滤纸、pvdf膜、完成电泳的凝胶、4泡过缓冲液的滤纸和海绵。使用移液管在叠层的滤纸上滚动,除去气泡。将转膜夹安装于转膜架中,置于电泳槽中,加入预冷的转膜液,同时在电泳槽的空隙处放置合适大小的冰盒,连接好电泳槽及电泳仪,进行电泳,恒流模式,300ma,100min。
[0177]
将pvdf膜移至含有封闭液(4%bsa,pbst配制)的平皿中,室温下脱色摇床上摇动封闭2h;
[0178]
将一抗用稀释液(1%bsa,pbst配制)稀释至适当浓度(按照抗体说明书),将一抗稀释液加至培养皿中,室温孵育一抗2h,用pbst在室温下脱色摇床上洗3次,每次10min;在培养皿内加入二抗稀释液(1:5000,1%bsa,pbst配制),放在摇床上,室温下孵育45min后,用pbst在室温下脱色摇床上洗3次,每次10min。加入显影液显影。结果如图6、图8所示,其中重组融合蛋白在his、hsa、protein l的一抗标记下都有分子量大小一致的蛋白印迹,表明重组融合蛋白具有his、hsa、scfv三个结构。
[0179]
实施例11表征哺乳动物系统表达的重组融合蛋白亲和力
[0180]
(2)亲和力表征
[0181]
纯化产物利用elisa表征蛋白的亲和力,人源egfrviii或人源tigit或鼠源4-1bb抗原利用coating buffer稀释为1μg/ml,100μl/孔,37℃孵育4℃过夜孵育包板,pbst清洗三次。利用5%bsa,200μl/孔进行封闭,pbst清洗三次。将αhegfrviii scfv-msa或αhtigit scfv-hsa或α4-1bb scfv-msa蛋白进行bca定量,利用超纯水分别稀释为20μg/ml、10μg/ml、2μg/ml、1μg/ml、0.5μg/ml、0.25μg/ml、0.125μg/ml、0.1μg/ml、0.01μg/ml、0.001μg/ml、0.0001μg/ml、0.00001μg/ml,100μl/孔,37℃孵育2h,pbst清洗六次。利用anti-mouse serum albumin antibody(hrp)作为二抗,pbst清洗六次。利用elisa显色液,避光反应
10min,2m硫酸终止。利用酶标仪检测od450-od630的吸光度,结果如图9所示。
[0182]
实施例12重组融合蛋白纳米组装体的制备
[0183]
将纯化所得α4-1bb-msa、αpd1-msa、αpdl1-msa单链抗体片段重组融合蛋白(由nanodrop one超微量紫外分光光度计定量,以确定浓度)1:1:1混合,用超纯水配制总蛋白浓度为5mg/ml溶液,并配制5mg/ml聚乳酸(pla
137k
)的氯仿溶液。取1ml的5mg/ml单链抗体片段重组融合蛋白水溶液于15ml离心管中,加入100μl的5mg/ml聚乳酸(pla
137k
)氯仿溶液(即单链抗体片段重组融合蛋白与pla
137k
的质量比为10:1),在冰水浴中通过超声波细胞破碎仪进行超声乳化。其中,超声功率为130w,振幅为50%,超声时间为1.5min,超声5s停2s(中断时间不计入超声时间)。超声结束后将乳液转移至100ml圆底烧瓶中,并用超纯水洗出离心管中残余乳液,将洗涤液一并转入100ml圆底烧瓶中,旋转蒸发仪按照真空度200/100/50/30/20mbar依次旋蒸,每个真空度下保持10min。其中,在真空度为30/20mbar时将圆底烧瓶浸入32℃水浴锅中,以充分去除氯仿,并蒸发一定体积的水,以浓缩纳米颗粒溶液的体积。旋蒸结束后收集单链抗体片段重组融合蛋白融合蛋白-聚乳酸纳米颗粒备用。
[0184]
实施例13单链抗体片段重组融合蛋白纳米组装体的粒径表征
[0185]
取100μl实施例13纯化重悬后的颗粒溶液于粒径池中,通过纳米粒度及zeta电位仪测定纳米颗粒的水化直径,测得的纳米颗粒粒径在100~200nm左右,所对应的α4-1bb/αpd1/αpdl1纳米组装体粒径分布图如图10所示,其粒径为200.1nm,pdi分散度为0.19,均一性好。α4-1bb/αpd1的纳米组装体粒径分布图如图10左图所示,其粒径为182.6nm,pdi分散度为0.15,均一性好。
[0186]
实施例14单链抗体片段重组融合蛋白纳米组装体的形貌表征
[0187]
取α4-1bb/αpd1的纳米组装体,利用台式微量冷冻离心机低速(400rcf,4℃)条件下离心5min去除未组装的不溶于水的聚酯,将上清转移至新的ep管中高速(15000rpm,4℃)条件下离心60min分离游离的蛋白和纳米组装体,去除上清中游离的融合蛋白,下层组装体沉淀重悬于1
×
pbs中,将纯化后纳米组装体的浓度稀释至0.1mg/ml,取2μl滴加到硅片上,待水分挥发8h后于扫描电子显微镜下观察。如图11所示,纳米组装体是独立存在的圆球状形貌。
[0188]
实施例15单链抗体片段重组融合蛋白纳米组装体的对t细胞的增殖激活
[0189]
ot1小鼠摘眼球放血后剪开颈动脉使放血充分,摘取脾脏。
[0190]
用注射器柄将脾脏磨碎(尼龙网辅助),将研磨液通过200目尼龙网过滤至15ml离心管中,450g
×
5min离心收集细胞。
[0191]
根据实验需要获取待纯化的细胞到15ml离心管中,300g
×
10min离心,弃上清,收集细胞。
[0192]
每1
×
107细胞加入5μl anti-cd8α微珠,4℃标记15min。加满macs buffer清洗,去除未标记上的微珠,300g
×
10min(450g或800g
×
5min亦可),弃上清,收集细胞。macs buffer重悬细胞,以1
×
108细胞500μl体积进行。将分选柱放在分选器上,将2层200目尼龙网置于分选柱上,用macs buffer对柱体进行润洗,分选柱下面用新的15ml离心管收集。润洗体积500μl。将重悬好的细胞通过2层200目尼龙网加入分选柱中,1.5ml体积的macs buffer对分选柱中的细胞进行清洗,向分选柱中加入1ml macs buffer,然后将分选柱从分选器上取下,放在15ml离心管上,利用配套的推柄将分选柱中的液体迅速推出到15ml离心
管中。
[0193]
用1
×
pbs稀释dmso溶解的cfda-se成为10μm的工作液。在ep管中收集细胞沉淀,用500μl的1
×
pbs充分重悬细胞,加入500μl的10μm cfda-se染色缓冲液,迅速充分混匀。将细胞在37℃细胞培养箱中避光标记10min。用含有10%fbs的pbs洗细胞,3000g
×
2min离心,洗2遍。细胞计数,准备加样。
[0194]
进行anti-cd3抗体包板:用pbs将anti-cd3抗体稀释至5μg/ml,吸取60μl到圆底96孔板中,37℃孵育2h。吸去anti-cd3抗体,并用pbs洗板三次。将纯化得到的cd3
t细胞1
×
106/孔加到包被了anti-cd3抗体的96孔板中,并往培养基中加入1μg/ml的anti-cd28抗体或αpd1/α4-1bb纳米组装体或游离的αpd1/α4-1bb重组融合蛋白或pbs,37℃、5%co2条件下培养72小时,使用流式细胞仪检测细胞的cfse荧光及dapi荧光。cfse荧光结果如图12所示,加入αpd1/α4-1bb纳米组装体的实验组,t细胞出现增殖峰,和cd28抗体阳性对照组效果相似,表明αpd1/α4-1bb纳米组装体具有激活t细胞增殖的功能。
[0195]
dapi荧光流式检测结果如图13所示,加入αpd1/α4-1bb纳米组装体的实验组t细胞72h存活率96%,与cd28抗体的阳性对照组结果相似,加入pbs的组t细胞72h存活率仅约20%。
[0196]
实施例16单链抗体片段重组融合蛋白纳米组装体增强t细胞对肿瘤细胞的杀伤
[0197]
取b16-f10-ova细胞培养至汇合度80%,去上清,加入1ml 1xpbs,清洗一次,弃去上清。向b16-f10-ova细胞中加入500μl 0.25%胰酶,37℃消化2min,加入2ml 1640完全培养基终止消化,800rpm 3min离心,去上清。
[0198]
用适当体积的1640完全培养基重悬b16-f10-ova细胞至密度10万/ml,向24孔板中,每孔加入b16-f10-ova细胞悬液500μl,之后加入ifn-γ至20ng/ml,37℃培养24h。
[0199]
以实施例15中的方法纯化得到ot1-cd3
t细胞,稀释细胞至100万/ml。取上述接种b16-f10-ova细胞的24孔板,弃上清,每孔加入500μl ot1-cd3
t细胞悬液,之后实验组每孔加入αpd1/α4-1bb纳米组装体至融合蛋白浓度为5μg/ml,对照组每孔加入等量游离的融合蛋白,阴性对照组加入相应体积的1xpbs,37℃培养24h。
[0200]
37℃培养24h后弃上清,1ml 1xpbs洗三遍,每孔加入50μl 0.25%胰酶,37℃消化2min,每孔加入1ml 1640完全培养基终止消化,800rpm 3min离心,去上清,得到b16-f10-ova细胞沉淀。每孔细胞用500μl annexin v试剂盒中的binding buffer重悬细胞,加入5μl annexin v和5μl pi试剂,混匀,室温孵育15min,使用流式检测结果。结果如图14所示,加入αpd1/α4-1bb纳米组装体的实验组中,b16-f10-ova细胞早期凋亡和晚期凋亡的比例都出现了明显增加,说明αpd1/α4-1bb纳米组装体增强了ot1-cd3
t细胞对b16-f10-ova肿瘤细胞的杀伤。
[0201]
实施例17单链抗体片段重组融合蛋白纳米组装体增强t细胞细胞因子的分泌
[0202]
按照上述实施例16中的方式,将ot1-cd3
t细胞与b16-f10-ova肿瘤细胞共培养,分别加入αpd1/α4-1bb纳米组装体、游离的αpd1 scfv-msa和α4-1bb scfv-msa融合蛋白、1xpbs,37℃培养24h。
[0203]
收集上清,10000g离心10min,收集上清。得到的培养基分别稀释10倍、100倍。使用ifn-γ检测elisa试剂盒,对上清中的ifn-γ进行检测。结果如图15所示,αpd1/α4-1bb纳米组装体相比游离的融合蛋白,显著的增强了t细胞ifn-γ细胞因子的分泌。
[0204]
以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
[0205]
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。