基于rna甲基化蛋白ythdf2在胃癌细胞的调控应用
技术领域
1.本发明属于生物技术领域,具体涉及基于rna甲基化蛋白ythdf2在胃癌 细胞的调控应用。
背景技术:
2.全球范围内胃癌发病率在恶性肿瘤中居于第5位、病死率居于第3位, 中国胃癌患者占全球胃癌患者的44.2%,这表明胃癌的治疗仍具有巨大的挑战 性。
3.目前,手术仍然是根治胃癌的最主要方式。但是中国的早期胃癌的诊断 率低,约有70%的胃癌患者在就诊时已到进展期,ⅳ期胃癌患者的5年生存率 约为5%-20%,总生存期仅有9-10个月。
4.肿瘤血管生成作为肿瘤发展中的重要标志,对于肿瘤发生、发展、转移 和预后至关重要。在没有血液供应的情况下,肿瘤细胞通过弥散获取一定的 营养,肿瘤的体积较小,处于相对静息的状态;在肿瘤发展过程中,肿瘤细 胞释放促血管生长因子,诱发内皮细胞的移行、增殖、迁移,导致新的血管 在肿瘤周围和内部形成,为肿瘤提供营养,促使肿瘤的侵袭和远端迁移。
5.rna甲基化已被证明在生物学过程和疾病发生发展中发挥重要功能,是目 前临床和生命科学上的研究热点,rna甲基化已被证明参与到肿瘤的发生发展 的过程中。
6.然而,目前在胃癌中少有相关rna甲基化的研究。
7.因此,研究rna甲基化对于胃癌生成的机制具有至关重要的作用,明确 胃癌的潜在分子机制,能够为早期和精确的预防、诊断和治疗胃癌提供方向, 进一步提高胃癌患者的临床诊断效率和预后判断能力。
技术实现要素:
8.本发明的目的在于提供基于rna甲基化蛋白ythdf2在胃癌细胞的调控应 用,以解决上述背景技术中提出的问题。
9.为实现上述目的,本发明提供如下技术方案:基于rna甲基化蛋白ythdf2 在胃癌细胞的调控应用。
10.优选的,通过rna甲基化蛋白ythdf2抑制lncrnapvt1降解促进胃癌细 胞生成。
11.优选的,rna甲基化蛋白ythdf2抑制lncrnapvt1降解促进胃癌血管生 成。
12.优选的,rna甲基化蛋白ythdf2能与lncrnapvt1结合。
13.优选的,所述rna甲基化蛋白ythdf2的存在与lncrnapvt1的表达呈正 相关关系。
14.优选的,所述lncrnapvt1能够促进vegfa的表达,且所述lncrnapvt1 的表达与vegfa的表达呈正相关关系。
15.优选的,胃癌细胞生成包括:胃癌细胞增殖、胃癌细胞迁移、胃癌细胞 血管生成能力。
16.优选的,所述lncrnapvt1具有促进胃癌细胞增殖、促进胃癌细胞迁移、 促进胃癌
细胞血管生成能力。
17.本发明的技术效果和优点:
18.1、本发明证明通过rna甲基化蛋白ythdf2抑制lncrnapvt1降解促进胃癌 细胞生成,在临床中能够早期监控和有效干预,以此来降低胃癌患者的不良 预后发生率及死亡率,具有极大的临床意义;
19.2、本发明证明ythdf2及lncrnapvt1可以作为胃癌诊断和筛查的潜在靶 点,能够为早期和精确的预防、诊断和治疗胃癌提供方向,进一步提高胃癌 患者的临床诊断效率和预后判断能力。
附图说明
20.图1为tcga数据库中ythdf2在胃癌组织中的表达情况。
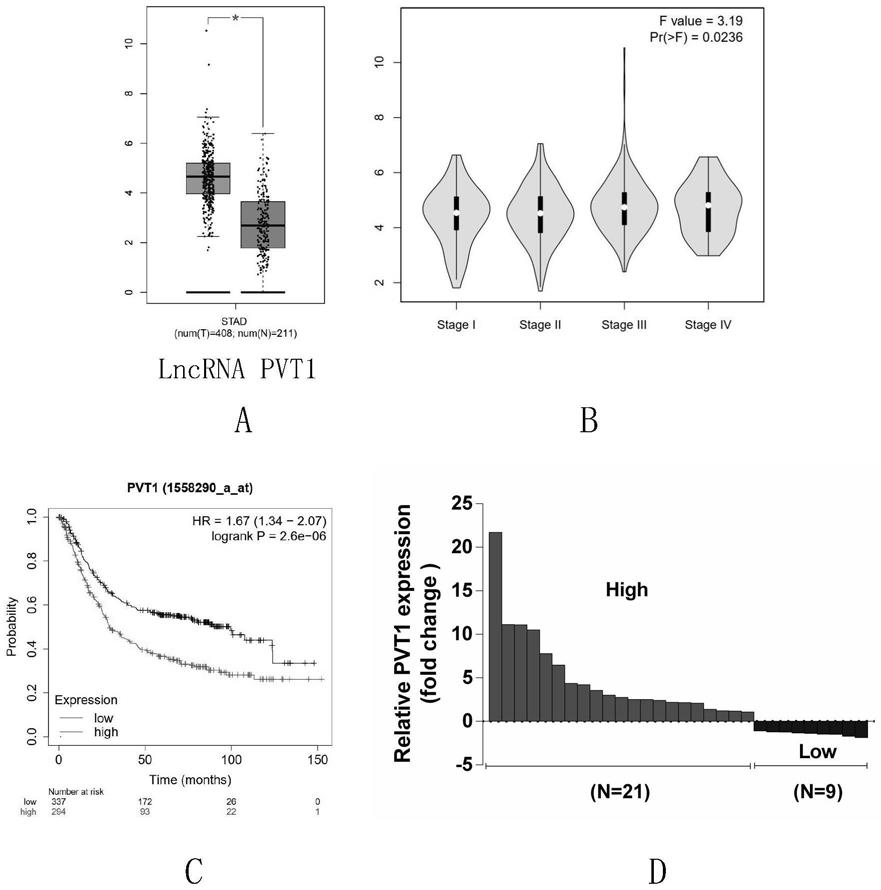
21.图2为本发明所述的lncrnapvt1在胃癌组织中的表达情况及其与胃癌 患者生存期的关系;其中图2a为tcga数据库中lncrnapvt1在胃癌组织中 的表达情况;图2b为lncrnapvt1的表达与胃癌分期的关系;图2c为lncrnapvt1的表达与胃癌患者总生存期的关系;图2d为lncrnapvt1在30对胃癌 组织和癌旁组织中的表达情况。
22.图3为本发明所述的vegfa、cd31、cd34在胃癌组织中的表达情况;其 中图3a为tcga数据库中vegfa在胃癌组织中的表达情况;图3b为tcga数 据库中cd31、cd34在胃癌组织中的表达情况;图3c为胃癌组织和癌旁组织 中cd31、cd34的免疫组化示例图。
23.图4为本发明所述的lncrnapvt1在胃癌细胞系中的表达情况及干扰 lncrnapvt1后的验证;其中图4a为lncrnapvt1在五种胃癌细胞系中的表 达情况;图4b为sirna-pvt1干扰胃癌细胞bgc-823和sgc-7901后lncrnapvt1 的表达情况。
24.图5为本发明所述的lncrnapvt1在体外促进胃癌细胞血管生成;其中 图5a为干扰sirna-pvt1前后胃癌细胞bgc-823和sgc-7901的血管生成情况; 图5b为图5a中的血管数量统计图。
25.图6为本发明所述的lncrnapvt1在体内促进胃癌细胞血管生成。
26.图7为本发明所述的lncrnapvt1促进胃癌细胞增殖;其中图7a为干扰 sirna-pvt1前后胃癌细胞bgc-823生长情况;图7b为干扰sirna-pvt1前后 胃癌细胞sgc-7901生长情况;图7c为干扰sirna-pvt1前后胃癌细胞bgc-823 和sgc-7901的克隆形成情况;图7d为图7c中的克隆形成数统计图。
27.图8为本发明所述的lncrnapvt1促进胃癌细胞迁移;其中图8a为干扰 sirna-pvt1前后胃癌细胞bgc-823和sgc-7901的transwell小室贴壁细胞情 况;图8b为图8a中的贴壁细胞计数统计图。
28.图9为本发明所述的lncrnapvt1促进vegfa表达;其中图9a和9b为lncrnapvt1调控靶基因的二代测序结果;图9c为干扰sirna-pvt1前后胃癌 细胞bgc-823和sgc-7901中vegfa的表达情况。
29.图10为本发明实施例1中lncrna pvt1在斑马鱼体内促进胃癌细胞增殖、 迁移;其中图10左列为卵黄部位的荧光信号,量化后代表增殖,图10右列为 躯干部位的荧光信号,量化后代表迁移。
30.图11为本发明实施例1中lncrnapvt1在斑马鱼体内促进胃癌细胞血管 形成。
31.图12为肿瘤血管生成与肿瘤转移的关系图。
具体实施方式
32.下面将结合本发明实施例中的附图1-12,对本发明实施例中的技术方案 进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例, 而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有 做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
33.在本发明中,vegfa为(血管生成因子)。
34.longnon-codingrna(lncrna)是指长链非编码rna,不具备编码蛋白 的功能,lncrna的长度超过200个核苷酸单位,lncrna虽然不能编码蛋白质, 但却可以通过各种路径调控基因和蛋白质的表达水平,从而调控机体的生理 功能。
35.lncrna的异常表达出现在人类疾病发生和发展的每个阶段。
36.rna甲基化在生物学过程和疾病发生发展中发挥重要功能,并且rna甲基 化参与到肿瘤的发生发展的过程中。
37.有三类分子参与了甲基化过程:writers,erasers,readers。
38.其中:writers介导rna的甲基化修饰过程,能够催化mrna的m6a甲基 化;erasers介导rna的去甲基化修饰过程,能够去除mrna上的m6a甲基化; readers识别rna甲基化位点,并参与mrna的剪接、转运、稳定性和翻译。
39.本发明提供了如图中1-12所示的基于rna甲基化蛋白ythdf2在胃癌细 胞的调控应用。
40.具体的,通过rna甲基化蛋白ythdf2抑制lncrnapvt1降解促进胃癌细 胞生成。
41.具体的,rna甲基化蛋白ythdf2抑制lncrnapvt1降解促进胃癌血管生 成。
42.具体的,rna甲基化蛋白ythdf2能与lncrnapvt1结合。
43.具体的,所述rna甲基化蛋白ythdf2的存在与lncrnapvt1的表达呈正 相关关系。
44.具体的,所述lncrnapvt1能够促进vegfa的表达,且所述lncrnapvt1 的表达与vegfa的表达呈正相关关系。
45.具体的,胃癌细胞生成包括:胃癌细胞增殖、胃癌细胞迁移、胃癌细胞 血管生成能力。
46.具体的,所述lncrnapvt1具有促进胃癌细胞增殖、促进胃癌细胞迁移、 促进胃癌细胞血管生成能力。
47.在本发明中,rna甲基化蛋白ythdf2抑制lncrnapvt1降解促进胃 癌细胞生成。
48.在本发明中,rna甲基化蛋白ythdf2能够识别lncrnapvt1上的甲基化 位点,且rna甲基化蛋白ythdf2能与lncrnapvt1结合并增加lncrnapvt1 的稳定性,进而促进了肿瘤细胞的增殖、迁移和血管生成。
49.如图12所示,肿瘤血管生成作为肿瘤发展中的重要标志,在肿瘤发展过 程中,肿瘤细胞释放促血管生长因子,诱发内皮细胞的移行、增殖、迁移, 导致新的血管在肿瘤周围和内部形成,为肿瘤提供营养,促使肿瘤的侵袭和 远端迁移。
50.如图1所示,与正常胃组织相比,ythdf2在胃癌组织中高表达。
51.如图2所示,lncrnapvt1在胃癌组织中高表达,且lncrnapvt1的表达 与胃癌的分
期呈正相关,与患者的总生存期呈负相关。
52.通过对30对胃癌组织和癌旁组织中lncrnapvt1的表达情况进行检测, 其中21对标本显示lncrnapvt1在胃癌组织中的表达高于癌旁正常组织。
53.如图3所示,vegfa在胃癌组织中高表达,对胃癌组织和癌旁组织进行免 疫组化实验,发现评估血管生成的cd31在胃癌组织中的表达高于癌旁组织, 同时高度糖基化的i型跨膜糖蛋白cd34在胃癌组织中的表达也高于癌旁组 织。
54.如图4-6所示,lncrnapvt1具有促进胃癌细胞血管生成的能力。
55.(1)如图4a-4b所示,在五种胃癌细胞系中检测lncrnapvt1的表达, 选取在胃癌细胞中高表达lncrnapvt1的胃癌细胞bgc-823和sgc-7901进行 后续的研究,利用sirna-pvt1干扰技术在胃癌细胞bgc-823和sgc-7901中 降低lncrnapvt1的表达,qrt-pcr验证干扰成功。
56.(2)如图5a-5b所示,体外matrigel血管生成实验显示,在敲降lncrnapvt1后,胃癌细胞bgc-823和sgc-7901的血管生成能力受到明显抑制。
57.(3)如图6所示,裸鼠动物模型上进行血管载体造模研究显示,胃癌细 胞bgc-823和sgc-7901在敲降lncrnapvt1后,血管生成能力受到明显抑制。
58.如图7所示,lncrnapvt1具有促进胃癌细胞增殖的能力,细胞增殖实验 和克隆形成实验显示,在敲降lncrnapvt1后,胃癌细胞bgc-823和sgc-7901 的增殖能力受到明显抑制。
59.如图8所示,lncrnapvt1具有促进胃癌细胞迁移的能力,细胞迁移实验 显示,在敲降lncrnapvt1后,胃癌细胞bgc-823和sgc-7901的迁移能力受 到明显抑制。
60.如图9所示,lncrnapvt1能够促进vegfa的表达,且所述lncrnapvt1 的表达与vegfa的表达呈正相关关系。
61.lncrnapvt1调控胃癌血管生成靶基因vegfa,将si-nc和si-pvt12# 的胃癌细胞bgc-823做二代测序,测序结果分析发现,在lncrnapvt1调控 的靶基因中,与血管生成相关的基因富集程度最高。
62.进一步在敲降lncrnapvt1的胃癌细胞bgc-823和sgc-7901中检测vegfa 的表达情况,发现lncrnapvt1的表达下调后,胃癌细胞中vegfa的表达也 下降,故,lncrnapvt1能够促进vegfa的表达促进胃癌进展。
63.实施例1、在斑马鱼体内敲降lncrnapvt1。
64.(1)将转染si-nc和si-pvt1的胃癌细胞bgc-823用cm-dii染料进行 染色(cm-dii是一种亲脂性的荧光染料,使细胞呈现红色荧光),收集染色后 的细胞,大约300个细胞注射到48hpf的斑马鱼幼鱼的卵周间隙中。
65.在1dpi时,用体视显微镜从所有移植的幼鱼中筛选出荧光面积相同的幼 鱼。
66.在4dpi时,用体视显微镜进行图像拍摄,拍摄部位包括卵黄和躯干。
67.其中卵黄部位的荧光信号量化后代表增殖,躯干部位的荧光信号量化后 代表迁移。
68.如图10所示,lncrnapvt1表达下调后,胃癌细胞的增殖、迁移能力受 到抑制。
69.(2)为了排除少数的非特异性信号同时也为了获取高分辨率的图像,使 用了共聚焦显微镜,将cm-dii标记的细胞注射到tg(flli1a:egfp)转基因 斑马鱼幼鱼中,其中血管
内皮细胞被egfp标记。
70.在4dpi时,通过多层扫描对移植瘤进行成像。
71.如图11所示,lncrnapvt1表达下调后肿瘤血管密度下降(绿色荧光表 示斑马鱼的血管,红色荧光表示肿瘤细胞)。
72.最后应说明的是:以上所述仅为本发明的优选实施例而已,并不用于限 制本发明,尽管参照前述实施例对本发明进行了详细的说明,对于本领域的 技术人员来说,其依然可以对前述各实施例所记载的技术方案进行修改,或 者对其中部分技术特征进行等同替换,凡在本发明的精神和原则之内,所作的 任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。