慢性肉芽肿病的治疗
1.本发明涉及治疗慢性肉芽肿病的手段和方法。
背景技术:
2.慢性肉芽肿病(chronic granulomatous disease,cgd)包括一组先天性免疫缺陷,该一组先天性免疫缺陷的发病率介于在沙特阿拉伯的1/19230(suliaman等人,(2009)pediatric asthma,allergy&immunology 22,21-26)与在瑞典的1/450000(ahlin等人,(1995)acta paediatr 84,1386-1394)之间。这种疾病在生命早期表现为受影响患者的身体不能保护自身免受细菌和真菌感染。尽管使用抗生素和抗真菌剂进行了终生预防性治疗,但预期寿命仍受到严重影响(kuhns等人,(2010)new engl j med 363(27)2600-10;van den berg等人,(2009)plos one 4(4):e5234)。该疾病的主要原因是由于吞噬细胞nadph(烟酰胺腺嘌呤二核苷酸磷酸)氧化酶复合物内的缺陷,吞噬细胞(粒细胞、单核细胞和巨噬细胞)产生用于病原体灭活的活性氧物质(reactive oxygen species,ros)的能力大大降低或缺乏。nadph氧化酶复合物由六个亚基(gp91phox、p22phox、p40phox、p47phox、p67phox和rac2)组成。在所有cgd患者的约60%中,这种疾病是由x染色体上gp91phox亚基编码基因(cybb)内的突变引起的,因此称为x-cgd。另外约30%的患者存在常染色体隐性ncf1基因(p47phox亚基)改变(p47phox缺陷型cgd),而只有5%的病例是由于p67phox和p22phox中的常染色体隐性突变(roos等人(2003)microbes infect 5:1307-15)。
3.基因疗法是患有单基因病的患者的一种新的治疗选项。目前最先进的基因疗法的原理是将突变基因的功能版本引入到受影响细胞的基因组中。目前的临床方法主要依赖于通过基于腺相关病毒的载体或通过逆转录病毒(γ逆转录病毒或慢病毒)载体递送治疗基因。突变基因(转基因)的功能版本的插入导致了新基因产物的表达,这补偿了天然基因产物的缺失。自从2000年首次临床成功以来,已通过这种基因疗法的基因添加方法获得临床成功的疾病数量一直在持续上升。
4.设计师核酸酶(锌指核酸酶(zinc-finger nuclease,zfn)、转录激活因子样效应核酸酶(transcription activator-like effector nuclease,talen)、成簇的规则间隔短回文重复(clustered regularly interspaced short palindromic repeat,crispr)/cas方法的最新发展允许序列特异性基因修饰(缺失或修复)以及dna的序列特异性插入。已经发现了用于治疗目的的序列特异性基因破坏的临床应用(talen:w.quasim等人,(2015)blood 126:2016;znf:clinicaltrials.gov identifier nct02500849和crispr/cas9:cyranoski d.等人,nature 539,479;clinicaltrials.gov identifier:nct03057912)。目前,仅临床评估了为了治愈b型血友病、mps i和mps ii而进行的锌指核酸酶的序列特异性插入(https://www.sangamo.com/product-pipeline)。
5.目前,cgd的唯一治愈疗法是从人类白细胞抗原(human leukocyte antigen,hla)相同的供体进行同种异体造血干细胞(allogeneic hematopoietic stem cell,hsc)移植。对于高达约75%的非血缘上欧洲血统的患者,可以辨识到hla相同的供体(grager等人,(2014)n engl j med 371:339-48)。对于剩余的25%,基于基因疗法的自体同源hsc校正代
表一种额外的潜在治愈性治疗选项。
6.因此,对于缺乏hla相同的hsc供体的患者,用于cgd的基因疗法是一个合理的选项。从x连锁cgd的女性携带者中得知,nadph氧化酶活性高于20%可能与健康的表型相关联(bjorgvinsdottir等人,(1997)blood 89,41-48;kuhns等人,(2010)n engl j med 363,2600-2610)。因此,约20%napdh氧化酶活性的基因治疗校正水平被认为足以获得临床成功。
7.2004年,苏黎士大学儿童医院(university children's hospital zurich)和法兰克福约翰
·
沃尔夫冈
·
歌德大学医院(johann wolfgang goethe university hospital frankfurt)发起了针对x-cgd患者的第一个临床成功的i/ii期基因疗法试验(nct 00927134;nct 00564759)。在该试验内,两名儿童在苏黎世接受治疗,并且两名成人患者在法兰克福接受治疗。基因疗法载体由ltr驱动的(非自身失活(non-self-inactivating,sin))γ逆转录病毒载体以及作为转基因的编码gp91phox的cdna组成,从而导致了普遍存在的转基因表达。该研究在临床上是成功的,因为所有四名患者都从先前存在的难治性感染中康复(ott等人(2006)nat med 12:401-409;siler等人(2015)curr gene ther 15:416-427;bianchi等人(2009)blood 114:2619-2622)。然而,长期随访显示,有两起严重不良事件(serious adverse event,sae)导致该试验于2010年终止:
8.·
反式激活:在病毒载体已经整合到mds1-evi1基因附近的克隆中,γ逆转录病毒载体的长末端重复序列中存在的增强子序列与mds1-evi1原癌基因的启动子相互作用(evi1反式激活),这导致了这些hsc克隆的选择性优势。这导致了四分之三接受基因疗法治疗的患者中的克隆优势、7号单体基因组不稳定性以及发展出骨髓增生异常综合征(myelodysplastic syndrome,mds)。
9.·
沉默:病毒载体的启动子变得逐渐甲基化,这导致治疗性转基因的表达减少(转基因沉默)并导致了cgd的重新出现。
10.这些sea要求基于慢病毒自失活(self-inactivated,sin)载体以及以下项开发更安全的基因疗法载体:
11.(i)不同的整合模式,例如使用不同的病毒载体,以防止将病毒载体整合到mds1-evi1基因附近,
12.(ii)组织特异性转基因表达,即仅在需要转基因表达的骨髓衍生细胞中,而不在hsc中进行转基因表达,以防止在反式激活的情况下hsc克隆的潜在选择优势,和
13.(iii)防止转基因表达随时间推移而沉默,以促进长期功效。
14.术语和定义
15.术语“慢病毒载体”当在本说明书的上下文中使用时是指来源于慢病毒并适用于人类基因疗法的病毒体或病毒基因组。它包括转基因,该转基因包括编码序列和可在人类患者的细胞中操作的启动子。慢病毒基因疗法是技术人员众所周知的;最近关于该主题的科学出版物包括milone和o'doherty,(2018)leukemia 32,1529-1541;等人,(2006)nature medicine 12,348-353;aiuti等人,(2013),science 341(6148),doi:10.1126/science.1233151)。
16.术语“功能变体”当在本说明书的上下文中使用时是指编码多肽的基因的变体,其中该基因的功能障碍变体或非功能性变体存在于患者体内,但是该功能障碍变体或非功能
性变体在患者体内不具有特定的生物学功能。在受刺激的健康个体的吞噬细胞中,gp91phox蛋白(由cybb基因编码)、p22phox蛋白(由cyba基因编码)、p47phox蛋白(由ncf1基因编码)、p40phox蛋白(由ncf4基因编码)、p67phox蛋白(由ncf2基因编码)一起形成了一种酶复合物,称为nadph氧化酶。这种nadph氧化酶具有催化活性,并且是吞噬细胞产生活性氧物质(ros)所必需的。rac2蛋白(由rac2基因编码)是在细胞刺激时诱导nadph氧化酶复合物形成所需要的。这些基因中的任何基因的突变都可导致错误折叠蛋白的合成或一种基因产物的缺失,这最终导致患者细胞不能形成活性nadph氧化酶复合物并且因此它们不能产生ros,从而导致cgd表型。由基因疗法载体编码的功能性变体能够补充或替代功能障碍变体或非功能变体,并恢复nadph氧化酶功能。
技术实现要素:
17.基于这一背景,本发明的目的是提供用于治疗慢性肉芽肿病中的遗传疾病的有效手段。
18.这个目的通过独立权利要求的主题来实现,其中在从属权利要求中阐述了进一步的有利特征。
19.本发明的第一方面涉及一种用慢病毒载体转导的分离的人造血干细胞(hematopoietic stem cell,hsc)或祖细胞,特别是cd-34阳性造血干细胞,其中干细胞或祖细胞能够分化成骨髓细胞。该慢病毒载体包含
[0020]-编码选自包括gp91phox、p22phox、p40phox、p47phox、p67phox和rac2的组的功能障碍多肽的功能变体的核酸序列;该核酸序列处于以下项的转录控制下,和
[0021]-可在人类细胞中操作的启动子序列,其中该启动子包含由mir223启动子序列(seq id no:1)或基本上由mir223启动子序列(seq id no:1)组成。
[0022]
mir223启动子序列(seq id no:1)
[0023]
acttgtacagcttcacagggctccatgcttagaaggaccccacacttagtttaatgttctgctgtcatcatcttgatattcttaatttttaaataaagggcctatcgttttcattttttactgggccttgcaaattatgtagctggttctgtatgccaggagagaagttggaagtaaaatggtattccaggaccaggaggcattctggcagagtgaaagaacatgtgatttggagtccatggggatgggtttaaatttcagctttccactaatttgctttgtgatactgagtatttccttttatccctcagaggctctgtttctcaattttgactacgggttttttcattagataatgtctcagttctggtattccaggtttccctcaattattctgggaaaacctccttgacccacaggcagagcctagggcagccaggtgctttctactctctctctctctgcagcttggaaagttagtgtctgttgaaggtcagctgggagttggtggaggcagggcagtggcctgctactattgctgcagtagcagaccctttcacaacagcattgttttgtcattttgcatccagatttccgttggctaacctcagtcttatcttcctcatttctgtttcctgttgaagacaccaagggcccttcaaaacacagaagcttcttgctcacggcagaaagcccaattccatctggcccctgcaggttggctcagcactggggaatcagagtcccctccatgaccaaggcaccactccactgacag。
[0024]
在某些实施方式中,提供细胞以用于治疗慢性肉芽肿病,并且所述载体包含编码gp91phox(uniprot号p04839)、p22phox(uniprot号p13498)、p40phox(uniprot号q15080)、p47phox(uniprot号p14598)、p67phox(uniprot号p19878)和/或rac2(uniprot号p15153)的一种或多种功能变体的核酸序列。
[0025]
在某些实施方式中,载体不包含慢病毒启动子/增强子元件。
[0026]
本说明书上下文中的术语“增强子元件”是指短核酸序列,所述短核酸序列可以由激活蛋白结合以增加特定序列,特别是启动子序列发生转录的可能性。
[0027]
载体可以基于或衍生自α-逆转录病毒载体、γ逆转录病毒载体、慢病毒载体、或基于腺相关病毒的载体。在本发明基因疗法载体的某些实施方式中,载体基于或衍生自慢病毒载体。
[0028]
在本发明的基因疗法载体的一个实施方式中,所述载体包含由seq id 02表征的核酸或基本上由由seq id 02表征的核酸组成。
[0029]
seq id no:2:
[0030]
lenti_mir223_p47phox_pre4_kan(uzh1p47cgd)8688bp(在5'至3'方向上以字体表示的序列元件:)
[0031]
小写字体:cmv启动子;加下划线的小写:慢病毒ltr:5’u5;小写斜体:慢病毒前导序列;大写字体:mir223启动子;加下划线的大写:kozak序列;大写斜体:p47phox开放阅读框;加下划线的小写斜体:限制性位点;小写:wpre元件;加下划线的小写斜体:限制性位点;加下划线的小写:慢病毒ltr:3’u3;小写斜体:慢病毒ltr:3’r;小写斜体粗体:慢病毒ltr:3’u5;小写:
[0032]
[0033]
[0034]
[0035]
[0036]
[0037][0038]
干细胞或祖细胞是从患有cgd的患者获得,并用本发明的基因疗法载体转导的。
[0039]
在某些实施方式中,根据本发明的分离的人髓样干细胞或祖细胞是人cd-34阳性细胞。虽然在人cd34 骨髓细胞群中富集了长期繁殖的造血干细胞,但具有正常成年小鼠的长期植入能力的细胞是lin-、c-kit 、sca-1 和cd34-(sato t.,laver j.h.&ogawa m.(1999)blood 94:2548-2554)。人类和小鼠干细胞不仅在表面标记物表达上不同,而且在用于细胞扩增和病毒转导的生长条件(培养基、细胞因子
……
)上也不同。
[0040]
本发明的另一方面涉及一种制造能够分化成单核细胞或巨噬细胞的人祖细胞的方法。该方法包括以下步骤:
[0041]-体外提供从患有cgd的患者获得的cd34 hsc,以及
[0042]-用慢病毒载体转导所述cd34 hsc,所述慢病毒载体包含
[0043]
ο编码选自gp91phox、p22phox、p40phox、p47phox、p67phox和rac2的多肽的功能变体的编码核酸序列;该编码序列处于以下项的转录控制下
[0044]
ο可在人类细胞中,特别是在骨髓细胞中操作的启动子序列,其中所述启动子序列包含mir223启动子序列(seq id no:1)或基本上由mir223启动子序列(seq id no:1)组成。
[0045]
本发明还涉及一种治疗被诊断患有慢性肉芽肿病的患者的方法。
[0046]
该方法包括以下步骤
[0047]-提供从所述患者分离的cd34 hsc,
[0048]-用慢病毒载体转导这种cd34 hsc,所述慢病毒载体包含
[0049]
ο编码选自gp91phox、p22phox、p40phox、p47phox、p67phox和rac2的多肽的功能变体的编码核酸序列;该编码序列处于以下项的转录控制下
[0050]
ο可在人类细胞中,特别是在骨髓细胞中操作的启动子序列,其中所述启动子序列包含mir223启动子序列(seq id no:1)或基本上由mir223启动子序列(seq id no:1)组成
[0051]-向所述患者施用所述cd34 hsc。
[0052]
通过用本发明的载体转导cd34 细胞,患者的编码引起cgd的功能障碍多肽的天然核酸序列被编码功能多肽的“健康”核酸序列所补充。然后将如此转导(和补充)的hsc或祖
细胞转移回患者体内。
[0053]
本发明的载体可用于转导自体cd34 hsc或造血祖细胞,所述细胞能够分化成骨髓细胞,例如单核细胞、巨噬细胞或嗜中性粒细胞。cd34 细胞是从患有遗传疾病的患者获得的。转导的hsc被转移回患者体内,以便进行分裂和分化成骨髓细胞。
[0054]
通过本发明治疗的遗传性疾病是慢性肉芽肿病,并且能够分化成骨髓细胞,特别是单核细胞/巨噬细胞或嗜中性粒细胞的载体或hsc或造血祖细胞包含编码选自包括gp91phox、p22phox、p40phox、p47phox、p67phox和rac2的基因的一种或多种功能变体的核酸序列。hcs或造血祖细胞包含所述载体或由所述载体转导。
[0055]
根据本发明的另一个方面,提供了一种校正骨髓细胞中的cgd表型的方法。该方法包括提供本发明的hcs或造血祖细胞,以及将本发明的hcs或造血祖细胞施用于患有所述疾病的患者。
[0056]
在某些实施方式中,本发明的hcs或造血祖细胞是通过从患有cgd病的患者中获得hcs或造血祖细胞并用如本文所述的载体转导所述hcs或造血祖细胞来提供的。
[0057]
骨髓细胞中的遗传性疾病是cgd,并且从患者获得的hcs或造血祖细胞包含包含编码gp91phox、p22phox、p40phox、p47phox、p67phox和/或rac2的一种或多种功能变体的核酸序列的载体或由所述载体转导。
[0058]
然后将转导的hcs或造血祖细胞转移回患者体内。
[0059]
项目
[0060]
1.一种用慢病毒载体转导的分离的人造血干细胞或骨髓祖细胞,所述慢病毒载体包含
[0061]-编码选自gp91phox、p22phox、p40phox、p47phox、p67phox和rac2的多肽的功能变体的编码核酸序列;所述编码核酸序列处于以下项的转录控制下
[0062]-可在人类细胞中,特别是在骨髓细胞中操作的启动子序列,其中所述启动子序列包含mir223启动子序列(seq id no:1)或基本上由mir223启动子序列(seq id no:1)组成。
[0063]
2.根据项目1所述的分离的人造血干细胞或骨髓祖细胞,其中所述慢病毒载体包含由seq id no:2表征的核酸序列或基本上由由seq id no:2表征的核酸序列组成。
[0064]
3.根据项目1或2中任一项所述的人造血干细胞或骨髓祖细胞,其中所述细胞是cd34阳性造血干细胞。
[0065]
4.一种制备治疗性细胞制剂的方法,所述方法包括以下步骤:
[0066]
a.提供包含造血干细胞的细胞制剂,特别是cd34阳性造血干细胞的制剂,所述造血干细胞分离自患有与基因缺陷相关联的慢性肉芽肿病的患者,所述基因缺陷与编码选自gp91phox、p22phox、p40phox、p47phox、p67phox和rac2的多肽的缺陷基因相关联;
[0067]
b.用慢病毒载体转导所述细胞制剂,所述慢病毒载体包含
[0068]
i.编码选自gp91phox、p22phox、p40phox、p47phox、p67phox和rac2的多肽的功能变体的编码核酸序列;所述编码核酸序列处于以下项的转录控制下
[0069]
ii.可在人类细胞中,特别是在骨髓细胞中操作的启动子序列,其中所述启动子序列包含mir223启动子序列(seq id no:1)或基本上由mir223启动子序列(seq id no:1)组成。
[0070]
5.根据项目1至3中任一项所述的分离的人造血干细胞或骨髓祖细胞,或通过根据
项目4所述的方法获得的细胞制剂,所述分离的人造血干细胞或骨髓祖细胞或所述细胞制剂用于治疗或预防慢性肉芽肿病。
[0071]
6.根据项目5所述的用于治疗或预防慢性肉芽肿病的分离的人造血干细胞或骨髓祖细胞,其中所述细胞是自体同源细胞。
[0072]
本发明通过以下实施例和附图进一步说明,由此可以得出另外的实施方式和优点。这些实施例旨在说明本发明,而非限制其范围。
附图说明
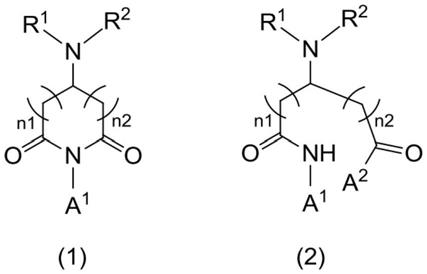
[0073]
图1和图2示出了用于本发明的载体的某些实施方式。
[0074]
图3示出了在γ逆转录基因疗法后mir223驱动的p47phox表达恢复了人粒细胞中的ros产生和大肠杆菌(e.coli)杀伤;
[0075]
图4示出了在慢病毒转导单核细胞后转导患者来源的单核细胞之后,p47phox缺陷型cgd患者的人巨噬细胞中ros产生的恢复;
[0076]
图5在细胞培养4周后,沉默敏感性sffv增强子/启动子(cpg岛)以及人cd34 细胞中p47phox转基因的一部分的dna甲基化。将cd34 细胞用γ逆转录病毒转导并培养四周。将dna分离,用亚硫酸氢钠处理,在pcr反应中扩增,然后测序。每条水平线代表一个测序结果,在所述测序结果中信息含量减少到cpg二核苷酸:空心圆圈=未甲基化的cpg;黑色圆圈=甲基化的cpg。
[0077]
图6在用处于mir223启动子或sffv启动子控制下的编码绿色荧光蛋白(green fluorescent protein,gfp)的慢病毒载体转导健康供体的人hsc,随后在液体细胞培养物中髓样分化为cd11b 细胞之后,mir223驱动的cd11b 细胞中的gfp表达。
实施例
[0078]
本发明特别基于以下令人惊讶的发现:在基因疗法载体中使用mir223启动子有利地克服了已知的反式激活和/或表观遗传失活问题。这在用于常染色体隐性p47phox缺陷型cgd的lv-sin基因疗法载体中表现得尤为明显。值得注意的是,用处于mir223启动子控制下的编码p47phox的慢病毒载体对人hsc进行慢病毒转导以进行p47phox cgd治疗,在先前从未报道过。
[0079]
临床前用于表征转基因表达的载体
[0080]
用γ逆转录病毒载体和慢病毒载体生成了证实高度骨髓特异性转基因表达的数据。所用γ逆转录病毒载体的示例在图1中示出。δlngfr-2a-p47phox融合构建体产生了两种独立的蛋白质(细胞质p47phox和细胞表面上的δlngfr),两者都衍生自一种mrna(v)。所用慢病毒载体的示例在图2中示出。
[0081]
通过限制到髓样细胞的表达来预防hsc中的反式激活
[0082]
动物研究显示的mir223启动子活性的骨髓特异性
[0083]
从p47phox-/-小鼠中分离出谱系阴性骨髓细胞,并用处于mir223启动子控制下的编码p47phox的γ逆转录病毒载体或δlngfr-2a-p47融合构建体转导(图1)。使受体p47-/-小鼠接受致死剂量辐射,并重新静脉内输注转导的骨髓细胞。在重新输注后6周,粒细胞中的p47phox表达和ros产生恢复,表明了转导的骨髓细胞的成功植入。(brendel等人(2013)
hum gene ther methods.24:151-159)。
[0084]
平行地,从gp91phox-/-小鼠分离出谱系阴性骨髓细胞,并用处于mir223启动子控制下的编码gp91phox的lv-sin载体转导。使受体gp91phox-/-小鼠接受致死剂量辐射,并重新静脉内输注转导的骨髓细胞。移植转导的细胞,从而导致这些小鼠的外周粒细胞中的转基因表达和ros产生恢复(brendel等人(2013),出处同上)。
[0085]
转基因表达的分析揭示了由mir223启动子在两个动物实验中赋予的非凡谱系特异性,将转基因表达几乎完全限制在骨髓细胞中(brendel等人(2013),出处同上)。
[0086]
在主要来源的患者材料中通过mir223驱动的转基因表达恢复吞噬细胞功能
[0087]
在上述动物实验中,在对应的动物模型中,mir223驱动的gp91phox表达(慢病毒载体)和mir223驱动的p47phox表达(γ逆转录病毒载体)都恢复了基因疗法治疗后吞噬细胞中的ros产生。
[0088]
在用γ逆转录病毒载体处理hsc并在细胞培养中进行细胞分化后,在人粒细胞中测试ros产生的重建和大肠杆菌杀伤的重建。为了检测活粒细胞中的细胞质p47phox转基因表达,本发明人产生了编码融合构建体的γ逆转录病毒载体,所述融合构建体由通过来自口蹄疫病毒的2a序列与p47phox连接的δlngfr表面标记物组成。这种融合构建体导致在一个翻译过程中由一个mrna转录物合成两种蛋白质:细胞质p47phox蛋白和δlngfr表面标记物。这种共表达允许通过δlngfr表面染色间接检测p47phox(wohlgensinger等人,(2010)gene ther.17:1193-1199)。在所用的γ逆转录病毒载体中,本发明人在组成型活性sffv启动子或mir223启动子的控制下表达这种融合构建体。
[0089]
本发明人用这些γ逆转录病毒载体转导p47phox缺陷型cgd患者的人hsc,随后在细胞培养中将细胞分化为粒细胞。分化是通过对粒细胞cd11b表面标记物表达的facs测量来确认的。检测到δlngfr表面标记物间接表明p47phox表达。
[0090]
在用pma或用大肠杆菌刺激细胞时,通过二氢罗丹明123氧化(dhr)测定检测ros产生。仅在δlngfr阳性细胞中观察到了体外分化的粒细胞中的ros产生(图3)。
[0091]
通过facs分选分离出分化的(cd11b )且δlngfr阳性的粒细胞,以及分化的且δlngfr阴性(非转导的)细胞,并应用于所述的大肠杆菌杀伤测定中(ott等人,(2006)nat med 12:401-409)。在这种测定中,成功的大肠杆菌杀伤导致了od420nm上升。重要的是,通过使用γ逆转录病毒sin p47phox mir223载体,p47phox转基因表达、ros产生和大肠杆菌杀伤被恢复到与γ逆转录病毒sin p47phox载体中相似的量,在所述γ逆转录病毒sin p47phox载体中转基因表达由强组成型活性的sffv启动子驱动(图3)。
[0092]
图3示出了mir223驱动的p47phox表达恢复了人粒细胞中的ros产生和大肠杆菌杀伤。用处于sffv或mir223启动子控制下的δlngfr/p47phox共表达构建体对p47phox cgd患者的谱系阴性hsc进行γ逆转录病毒转导,并分化为cd11b 粒细胞。对表达δlngfr/p47phox的粒细胞进行facs分选,并应用于大肠杆菌杀伤测定中。od420nm的上升表明了大肠杆菌杀伤的恢复。
[0093]
在主要来源的p47phox cgd患者材料中也显示出了吞噬细胞功能的恢复。使用lenti_mir223_p47_wpremut6载体(图2和图4)转导来自p47phox缺陷型cgd患者的单核细胞。将转导的单核细胞分化为巨噬细胞持续7天,从而产生cd14 /cd206 巨噬细胞。通过细胞内facs染色证实了p47phox转基因表达,并在四唑氮兰(nitroblue teterazolium,nbt)
还原测定中证实了pma刺激后的ros产生(图4)。
[0094]
图4示出了p47phox缺陷型cgd患者的人巨噬细胞中ros产生的恢复。从血液中分离出p47phox cgd患者的单核细胞,用lv-sin lenti_mir223_p47_wpremut6载体转导,并分化成巨噬细胞。facs(左)证实了分化成cd14 /cd206 巨噬细胞和p47phox表达的恢复。通过nbt测定证实了pma刺激后ros产生的恢复。黄色箭头:nbt阳性,即产生ros的巨噬细胞,空心箭头:nbt阴性巨噬细胞。
[0095]
防止转基因表达的表观遗传失活
[0096]
体内和细胞培养中表观遗传失活的动力学
[0097]
在第一个暂时成功的临床x-cgd基因疗法研究中,转基因表达由病毒ltr内的γ逆转录病毒启动子/增强子驱动。转基因表达的表观遗传失活在基因疗法后约一年开始,表明在此后的1.5年内基因标记与基因功能之间的差异越来越大(siler等人,(2015)current gene therapy 15:416-427)。所用的γ逆转录病毒载体的ltr内的启动子/增强子的序列对应于各种载体中用作普遍活性启动子的sffv启动子/增强子。在基因疗法治疗后3个月和6个月时,在cgd动物中测试这种sffv启动子对表观遗传修饰的易感性。在小鼠中通过dna甲基化实现的表观遗传sffv启动子失活在三个月后已经可检测到,并且随后随着时间的推移而增加(zhang等人,(2010)mol ther 18:1640-49)。
[0098]
处于非常原始的分化状态的细胞,如胚胎癌细胞系(he等人,(2005)j virol 79:13497-508)、胚胎干细胞(liew等人,(2007)stem cells 25:1521-28)和诱导多能干细胞(induced pluripotent stem cell,ipsc)(hotta&ellis(2008)j cell biochem 105:940-8)因其高dna甲基化活性而为人所知。在转导细胞后的6至12天,已经可检测到p19胚胎癌细胞对慢病毒载体内的sffv启动子的表观遗传失活(zhang等人,(2010),出处同上)。
[0099]
mir223启动子的新颖抗沉默活性
[0100]
发明人在p19细胞和p47phox ipsc细胞系中测试了mir223启动子对dna甲基化的易感性。
[0101]
在慢病毒载体(图2)内,20天后mir223启动子内平均57.1%的cpg和sffv启动子内大于70%的cpg在p19细胞中被甲基化(未发表的数据)。由于p19细胞不能分化为骨髓谱系(吞噬细胞)并且由于mir223启动子是骨髓特异性启动子,所以本发明人在p47phox cgd患者来源的ipsc(ipsc cgd1.1;jiang等人,(2012)stem cells 30:599-611)中测试了它们的处于mir223启动子控制下的编码p47phox的慢病毒载体,因为这些细胞具有高dna甲基化活性并且可增殖为吞噬细胞。
[0102]
以为2的感染复数(moi 2,即两倍于细胞的病毒粒子)将ipsc cgd1.1细胞用处于mir223启动子控制下的编码p47phox的慢病毒载体转导(参见下表1)。
[0103]
从转导后第 13天开始,将ipsc首先增殖为“胚状体”,并进一步增殖成释放单核细胞的“单核细胞工厂”。然后在转导后第 43天开始先收获单核细胞。将收获的单核细胞通过在补充有m-csf的培养基中孵育7天进一步分化为巨噬细胞。
[0104]
在第 16天时在ipsc中并且在第 85天时在收获的单核细胞中,通过qpcr测定每个基因组的平均基因疗法载体拷贝数(vector copy number,vcn)。通过流式细胞术(facs)分析在第 6天、第 10天、第 16天、第 20天在ipsc中,在第 23天在胚状体内的cd133 干细胞中,在 104天在胚状体中的cd38dim/cd34 细胞中,在第 52天在cd14 细胞中,在第 48天在
cd15 细胞中,在第 68天在cd206 细胞中定量p47phox表达。测定每个载体拷贝数的p47phox阳性细胞的百分比和p47phox阳性细胞的facs来源的平均荧光强度(mean fluorescent intensity,mfi),以比较单独细胞群中mir223启动子的活性。
[0105]
不同分化阶段的p47phox表达分析显示,平均在干细胞水平(ipsc、cd133 细胞、cd34 细胞)(n=6)上,几乎检测不到mir223驱动的p47phox表达,其中每个载体拷贝数的p47阳性细胞百分比为0.67 /-0.33(stdev)。在骨髓分化时,p47phox表达强烈增加,其中每载体拷贝数的p47阳性细胞的百分比为5.26 /-0.66。p47phox表达细胞的百分比的这种升高与facs信号强度(mfi)的强烈增加平行,强烈地表明了在从干细胞水平分化为骨髓细胞时mir223启动子的激活。
[0106]
基因疗法介导的从转导的p47phox cgd ipsc产生的粒细胞、单核细胞和巨噬细胞中p47phox产生的恢复导致了ros产生的恢复,如在二氢罗丹明123氧化(dhr)测定和氮蓝四唑还原(nbt)测定中所揭示的。
[0107]
与在ipsc与骨髓细胞(粒细胞、单核细胞、巨噬细胞)之间的各种分化水平上分析mir223启动子活性平行,在转导后第 20天的ipsc中并且在ipsc转导后第 85天分化时从转导的ipsc获得的单核细胞中执行基因疗法载体内mir223启动子和经转导的细胞的基因组内的内源mir223启动子基因的dna甲基化分析。对ipsc和ipsc衍生的单核细胞在用处于沉默敏感性sffv启动子控制下的包含p47phox的载体转导后的分析,用作对照。
[0108]
该分析(表1)揭示,与干细胞水平上的p19细胞平行,在基因疗法载体编码的mir223启动子内,以及在经转导的细胞的基因组中的天然内源性mir223基因启动子内,mir223启动子的绝大多数(》80%)cpg二核苷酸被甲基化。在功能水平上,甲基化的mir223启动子是无活性的,如由p47phox表达分析所示。
[0109][0110]
表1:在ipsc(经诱导的祖干细胞)水平(第 20天)上和在ipsc转导后第 85天ipsc衍生的单核细胞中经基因疗法载体编码的mir223启动子和天然mir223基因启动子的dna甲基化分析。编码沉默敏感性sffv启动子的载体用作对照。mir223启动子dna去甲基化的变化具有统计学意义。
[0111]
令人惊讶的是,本发明人发现在所分析的基因疗法载体中最初甲基化的mir223启动子和天然基因组mir223基因启动子都在髓样分化时被去甲基化(表1)。
[0112]
与启动子活性上升平行,mir223启动子内的cpg二核苷酸甲基化的百分比从87%
下降到31%。
[0113]
在发明人以前的γ逆转录病毒x-cgd(gp91phox缺陷型cgd)临床基因疗法试验中,转基因表达由组成型活性(sffv)启动子驱动。随着时间的推移,基因疗法载体编码的启动子甲基化的逐渐增加在临床上导致了治疗效应的逐渐降低(ott等人,(2006)nat med 12:401-409;siler等人,(2015)curr gene ther 15:416-427)。在这项试验中,组成型活性的启动子在hsc中被甲基化,并导致从骨髓中释放出具有基因疗法载体内的经甲基化的启动子并且因此具有减少的治疗性转基因表达的hsc。
[0114]
利用骨髓特异性mir223启动子作为基因疗法载体内的内部启动子,令人惊讶地观察到的甲基化模式表明该启动子在干细胞水平上是无活性的和被甲基化的。只有在分化时,mir223启动子才被活化和去甲基化。这强烈表明了这种启动子能够提供长期功效。由于从骨髓中释放的衍生自hsc的骨髓细胞的持续通量,在这些新产生的细胞中,mir223启动子在从骨髓中释放之前主动被去甲基化。
[0115]
启动子dna甲基化的动力学
[0116]
在细胞培养实验中,本发明人通过γ逆转录病毒转导在人cd34 骨髓细胞中引入sffv启动子,将细胞培养四周,然后进行dna甲基化的定量。在细胞培养四周后,本发明人无法在人cd34 细胞中检测到显著量的dna甲基化(图5)。
[0117]
据报道,小鼠骨髓中sffv启动子的体内沉默在基因疗法后三个月时变得可检测到,并在接下来的三个月中进一步进展(zhang等人,(2010)出处同上)。
[0118]
据报道,逆转录病毒载体在包括早期植入前胚胎、胚胎干(embryonic stem,es)细胞和胚胎癌(embryonic carcinoma,ec)细胞在内的多能干细胞中立即沉默(pannell d,ellis j.(2001)rev med virol 11:205-217)。胚胎癌细胞系p19已被广泛用于测试基因疗法载体内的启动子对沉默的易感性(knight等人,(2012)j virol 86:9088-95;brendel等人,(2012)gene therapy 19:1018-29;zhang,santilli&thrasher(2017)sci rep.7:10213;zhang等人,(2010)出处同上)。在这种模型中,sffv启动子的沉默一直被报道在12至17天后已经完成。
[0119]
由于p19细胞不能分化,所以这种模型不兼容于测试组织特异性启动子。与此同时,已知逆转录病毒表达在诱导多能干细胞(ipsc)中沉默(maherali等人,(2007)cell stem cell 1:55-70;okita,ichisaka&yamanaka(2007)nature 448:313-317;wernig等人,(2007)nature 448:318-324),所述ipsc具有在细胞培养中分化成任何细胞类型的能力。ipsc是从cgd患者材料产生的。结果表明,这些ipsc具有与在患者材料中发现的相同的遗传缺陷。这些细胞可以分化为成熟的单核细胞和巨噬细胞,并且与来自非cgd ipsc的单核细胞和巨噬细胞不同,cgd ipsc衍生的单核细胞和巨噬细胞表现为不产生活性氧物质(ros),这与来自cgd患者的单核细胞和巨噬细胞是一样的(jiang等人,(2012)stem cells 30:599-611)。
[0120]
在将sffv启动子逆转录病毒导入cgd ipsc后,sffv启动子在20天内在cgd ipsc中沉默,所述sffv启动子在10个月后开始的临床x-cgd试验中在人骨髓中体内沉默,在3至6个月后在小鼠骨髓中沉默,并且在12至17天后在p19细胞中沉默(等人,(2018)matters;doi.:10.19185/matters.201805000005)。在具有sffv启动子的cgd ipsc的分化后,sffv启动子驱动的转基因表达在终末分化的单核细胞和巨噬细胞中强烈减少。这表明
1)ipsc具有强启动子沉默活性,2)sffv启动子一旦被沉默,就在ipsc分化为单核细胞时保持沉默(等人,(2018)matters;doi.:10.19185/matters.201805000005)。ipsc已被用于体系的开发,所述体系防止广泛存在的活性启动子如sffv启动子的沉默。这些防沉默体系主要基于绝缘子的使用(sanchez-hernandez等人,(2018)mol ther nucleic acids 13:16-28)或关于普遍存在的染色质开放元件(ubiquitous chromatin opening element,ucoe)的使用(pfaff等人,(2013)stem cells 31:488-99;ackermann等人,(2014)biomaterials 35:1531-42;hoffmann等人,(2017)gene ther.24:298-307)。
[0121]
总之,ipsc是分析基因疗法载体甲基化的相关模型,但是这种模型从未用于分析组织特异性启动子对沉默的易感性。
[0122]
组织特异性mir223启动子对沉默的易感性的分析
[0123]
为了分析mir223启动子对沉默的易感性,本发明人利用了ipsc,所述ipsc是从患有p47phox缺陷型cgd的患者开发出的(p47phox cgd ipsc)并且能够分化为显示cgd表型的单核细胞和巨噬细胞(jiang等人,(2012)stem cells 30:599-611)。
[0124]
用本发明人的基因疗法载体(uzh1p47cgd)或用处于sffv启动子的组成型活性和抗沉默性版本控制下的编码p47phox的慢病毒载体(lenti ucoe 1662fwd sffv p47)慢病毒转导(第 1天)p47phox cgd ipsc。首先将转导的ipsc分化为胚状体(eb),然后进一步分化为单核细胞和巨噬细胞。通过qpcr在转导后第 16天在ipsc中以及在第 85天在单核细胞中测定每个细胞的平均载体拷贝数(vcn)。在转导后在第 23天在胚状体中的cd133阳性干细胞中,在第 104天在胚状体中的cd38dim/cd34 细胞(其为与hsc相当的细胞)中,在低 52天在单核细胞中,以及在第 68天在巨噬细胞中监测转基因表达。在p47phox蛋白的细胞内染色结合cd34、cd38、cd14和cd206表面染色后,通过facs分析检测p47phox表达。为了校正转导效率的差异,将p47phox阳性细胞的百分比除以vcn。
[0125]
p47phox转基因表达:
[0126]
在ipsc中和在ipsc衍生的hsc同源物,即胚状体内的cd38
dim
/cd34
高
细胞(从现在起在此上下文中称为“hsc”)中,本发明人的基因疗法载体uzh1p47cgd内的mir223启动子导致了如通过信号强度所测量的明显较弱的p47phox转基因表达,以及较低的每载体拷贝数的p47phox阳性细胞百分比。相比之下,在分化的单核细胞和巨噬细胞中,信号强度和每载体拷贝数的p47phox阳性细胞百分比在经转导的细胞中更高(参见下表2)。
[0127][0128]
表2:显示了通过每载体拷贝数的p47phox阳性细胞百分比(cvn)和通过流式细胞术来源的平均荧光信号强度(mfi)表征的,在ipsc和ipsc衍生的细胞群中的p47phox转基因表达。人p47phox阴性ipsc经慢病毒转导并通过胚状体增殖为单核细胞和巨噬细胞。在ipsc中并在ipsc衍生的单核细胞中测定平均载体拷贝数(vcn)。监测cd133 干细胞、胚状体中的hsc样cd34 细胞、单核细胞和巨噬细胞中的转基因表达。在细胞内染色后通过facs分析检测p47phox表达。通过计算每vcn的p47阳性细胞百分比,将p47phox阳性细胞百分比归一化成转导效率。如通过p47phox阳性细胞百分比和mfi所揭示的,mir223驱动的p47phox表达在cd133 细胞和cd34 细胞中表现为边际表达并且在分化后表达增加。
[0129]
重要的是,mir223启动子驱动的p47phox表达导致干细胞中的低背景信号(阳性细胞百分比/vcn)以及表达强度(mfi)。干细胞中的低背景信号指示了uzh1p47cgd基因疗法载体的优异安全性特性。
[0130]
将健康供体的人hsc用处于sffv或mir223启动子控制下的编码gfp的慢病毒载体转导,之后在液体细胞培养中分化为cd11b阳性骨髓细胞。通过facs分析来分析gfp在人hsc衍生的cd11b阳性细胞中的表达。gfp阳性人hsc衍生的骨髓细胞的检测(图6,未公开的数据)与0.05的载体拷贝数(cvn)一致,并显示了如cgd基因疗法治疗所需要的mir223启动子在人hsc衍生的骨髓细胞中的转基因表达活性。
[0131]
ros产生的重建:
[0132]
在用pma(单核细胞)或pma fmlp(巨噬细胞)刺激后,通过dhr氧化和通过nbt还原测定监测单核细胞和巨噬细胞中的ros产生。在dhr测定中,非荧光的二氢罗丹明在被ros氧化后变成荧光的。通过facs分析检测荧光信号强度。相应地,在facs分析中,向右偏移指示ros产生的恢复。在nbt测定中,深蓝色甲臜沉淀的形成指示ros产生。来自未经转导的cgd ipsc的单核细胞/巨噬细胞用作阴性对照。作为阳性对照的是从cgd ipsc获得的单核细胞/巨噬细胞,它们是用处于sffv启动子的普遍活性和抗沉默性版本(lenti ucoe1662fwd sffv p47)的控制下的编码p47phox的载体转导的。
[0133]
通过本发明人的基因疗法载体uzh1p47cgd进行的mir223驱动的p47phox表达导致了ros产生的重建,并因此导致了cgd表型的校正,如在dhr测定和nbt测定两者中所可视化的。
[0134]
ipsc模型中的沉默(dna甲基化)分析:
[0135]
本发明人利用p47-/-ipsc来测试其基因疗法载体(uzh1p47cgd)的甲基化以及ipsc分化为吞噬细胞后的转基因表达活性。将p47phox阴性ipsc进行慢病毒转导并增殖为单核细胞。从转导的ipsc(第 20天)和ipsc衍生的单核细胞(第 97天)中分离出dna。对于dna甲基化分析,将分离的dna暴露于亚硫酸氢钠,亚硫酸氢钠仅将未甲基化的胞嘧啶转化为尿嘧啶。随后的pcr扩增将尿嘧啶转化为胸苷。原始序列与亚硫酸氢盐转化后的序列的比较揭示了dna甲基化,即通过测序在所有甲基化的序列中检测到胞嘧啶,而在未甲基化的序列中检测到胸苷。
[0136]
在用处于mir223控制下的编码p47phox的基因疗法载体(uzh1p47cgd)转导后,在ipsc中和在ipsc衍生的单核细胞中进行dna甲基化分析。甲基化分析涵盖了整个mir223启动子序列,以及p47phox转基因的一部分。此外,本发明人分析了ipsc基因组的天然mir223基因启动子序列的dna甲基化。
[0137]
重要的是,在ipsc中,病毒编码的mir223启动子以及天然的mir223启动子都在20天内几乎完全甲基化。因此,在cd133 ipsc和ipsc衍生的cd34 cd38-干细胞中,p47phox转基因表达极低(参见上表1)。
[0138]
无论是在ipsc水平上还是在单核细胞中,基因疗法载体编码的mir223启动子序列与天然mir223启动子之间的甲基化程度都没有显著差异。令人惊讶地并且与用sffv启动子获得的结果(等人,(2018)matters;doi.:10.19185/matters.201805000005)不同,本发明人发现在ipsc分化为终末分化的细胞时,病毒和天然mir223启动子两者的甲基化都显著下降,从而表明了在分化(表1)以及因此活化(表2)后的主动去甲基化。外推至长期体内情况,这一发现表明了mir223启动子的长期活性,因为在休眠hsc中被沉默,mir223启动子预期在hsc活化和分化后变得有活性。如前所述,开发了基于ucoe的体系,该体系可防止sffv或chim启动子的沉默(zhang,santilli&thrasher(2017)sci rep 7:10213)。但是嵌入到逆转录病毒基因疗法载体中的ucoe体系具有改变也存在于hsc中的逆转录病毒整合位点附近的dna的dna甲基化的风险。在所有后果中,这种活性可能在hsc中活化基因疗法载体整合位点附近的癌基因。与ucoe体系不同,载体uzh1p47cgd内的mir223启动子适应于干细胞中的周围甲基化模式,并且只有在分化后才会变得被去甲基化,这是一个重要的安全特征。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。