1.本发明涉及植物基因功能研究技术领域,尤其涉及一种沉默或敲低连翘幼果中基因表达的方法。
背景技术:
2.在传统的基因功能研究方法中,对植物物种构建稳定的植物突变体系,对于研究基因功能是必要的。在此过程中,首先需要对待转基因植物进行植物组织培养,在愈伤组织时期使用农杆菌将不同的转基因载体转化入植物细胞,主要包括稳定表达载体,以crispr-cas9为主的基因编辑载体等,或者使用物化处理方法使植物产生基因突变等。目前,只有拟南芥以及烟草和其它的一些植物物种才可以产生稳定的植物转化体系。对于多年生植物来说相对较难,因为大多数多年生植物转化效率偏低、并且多年生的特性使得植物组织培养时间较长,成本高、某些表型具有滞后性,例如生殖器官的某些表型,需要植物较为漫长营养期结束进入生殖期后才可观察到,可见传统的通过改变基因组信息的方式并不适合研究多年生植物。目前存在通过改变转录水平的基因功能研究方法,常见的有rna干扰(rnai)、人工microrna介导的基因沉默等,但是它们只适合转化效率较高的植物,且都需要稳定的植物转化,既费时又不适合高通量研究,所以目前适用于多年生植物基因功能研究的方法极少。
技术实现要素:
3.本发明的目的在于提供一种沉默或敲低连翘幼果中基因表达的方法,在连翘幼果中通过转录后基因沉默的方式将连翘果实中的基因沉默,使其表达量降低,为连翘果实病毒诱导基因沉默体系构建奠定基础。
4.为了实现上述发明目的,本发明提供以下技术方案:
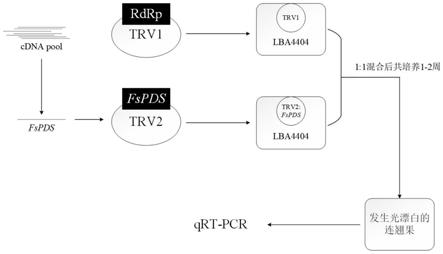
5.本发明提供了一种沉默或敲低连翘幼果中基因表达的方法,包括以下步骤:
6.用高渗溶液对连翘幼果预处理;
7.将待检测的目的基因构建入烟草脆裂病毒第二亚基因组,得重组载体ptrv2:fstg;将所述重组载体转化入根癌农杆菌获得转化有ptrv2:fstg的重组农杆菌;将转化有ptrv2:fstg的重组农杆菌的菌体与基础侵染液混合,得转化有ptrv2:fstg的农杆菌侵染液;
8.将烟草脆裂病毒第一亚基因组载体ptrv1与根癌农杆菌混合振荡培养;获得转化有ptrv1的重组农杆菌;将转化有ptrv1的重组农杆菌的菌体与基础侵染液混合,得转化有ptrv1的重组农杆菌侵染液;
9.将转化有ptrv1的重组农杆菌侵染液与转化有ptrv2:fstg的重组农杆菌侵染液混合制备转化液;
10.将预处理后的连翘幼果放入转化液中振荡培养2~3周。
11.优选的,所述高渗溶液为包括20~30%(w/v)蔗糖的1/2ms溶液;所述高渗溶液的
ph为5.5~6.5;所述预处理的时间为3~7h。
12.优选的,所述目标基因为连翘番茄红素去饱和酶基因,所述连翘番茄红素去饱和酶基因的核苷酸序列为seq id no.1。
13.优选的,所述ptrv1与农杆菌gv3101振荡培养的培养基为lb培养基,添加40~60mg/l卡那霉素和40~60mg/l利福平。
14.优选的,所述烟草脆裂病毒第一亚基因组载体ptrv1与农杆菌gv3101振荡培养的温度为26~30℃,时间为8~16h,转速为200~240rpm。
15.优选的,所述基础侵染液为包括有90~110μm乙酰丁香酮、65~85μmtriton-x100和1.5~3.5%(w/v)蔗糖的1/2ms培养基。
16.优选的,所述转化有ptrv1的农杆菌侵染液与转化有ptrv2:fstg的农杆菌侵染液的od
600
独立为0.05~0.15。
17.优选的,所述转化有ptrv1的农杆菌与转化有ptrv2:fstg的农杆菌的混合体积比为1:1~2。
18.优选的,所述连翘高渗溶液预处理幼果放入转化液振荡培养的温度为19~23℃,相对湿度为45~60%,转速为40~80rpm。
19.优选的,所述连翘高渗溶液预处理幼果放入转化液振荡培养的日照周期为光照14~18h,黑暗6~10h,光照强度为350~450μmol/m2·
s。
20.本发明提供了一种沉默或敲低连翘幼果中基因表达的方法,在连翘幼果中成功地通过转录后基因沉默的方式将连翘果实中的番茄红素去饱和酶基因沉默,使其表达量降低,产生光漂白表型,为连翘果实病毒诱导基因沉默体系构建奠定基础。将连翘番茄红素去饱和酶基因构建入载体中,以作为视觉指示基因,可以更好地观察沉默后出现的表型;使用农杆菌将其转化入连翘果实中,并在强光与震荡下进行共培养,目的是让pds基因沉默后的表型更加明显;与传统的改变基因组信息与转录组水平的方法相比,不需要稳定的转化体系的构建,可通过无性繁殖保持沉默,可以沉默大多数植物部位,具有效率高,范围广,速度快的特点,对于多年生植物中具有延后性表型来说,可以从活体植物中直接收取相应部位并使用无性繁殖的方式进行培育,在培育的过程中即可进行基因沉默,若是研究营养期相应表型,则可以直接使用幼苗进行试验,并且该体系也可以应用于植物组织培养。
附图说明
21.图1为沉默或敲低连翘幼果中基因表达流程图;
22.图2连翘幼果pds基因表达量对比示意图(ck表示未进行病毒侵染的对照幼果中pds基因的表达量;mock表示有病毒侵染病毒中没有目标序列的对照幼果中pds基因的表达量;treated表示使用有目标序列的病毒侵染后的幼果中pds基因的表达量)。
具体实施方式
23.本发明提供了一种沉默或敲低连翘幼果中基因表达的方法,包括以下步骤:
24.用高渗溶液对连翘幼果预处理;
25.将待检测的目的基因构建入烟草脆裂病毒第二亚基因组,得重组载体ptrv2:fstg;将所述重组载体转化入根癌农杆菌获得转化有ptrv2:fstg的重组农杆菌;将转化有
ptrv2:fstg的重组农杆菌的菌体与基础侵染液混合,得转化有ptrv2:fstg的农杆菌侵染液;
26.将烟草脆裂病毒第一亚基因组载体ptrv1与根癌农杆菌混合振荡培养;获得转化有ptrv1的重组农杆菌;将转化有ptrv1的重组农杆菌的菌体与基础侵染液混合,得转化有ptrv1的重组农杆菌侵染液;
27.将转化有ptrv1的重组农杆菌侵染液与转化有ptrv2:fstg的重组农杆菌侵染液混合制备转化液;
28.将预处理后的连翘幼果放入转化液中振荡培养2~3周。
29.在本发明中,对连翘幼果采取共培养方式处理,将连翘幼果清洗干净拍照。
30.在本发明中,所述预处理连翘幼果的高渗溶液优选为包括蔗糖的1/2ms溶液,所述高渗溶液中蔗糖的浓度优选为20~30%(w/v),进一步优选为22~28%(w/v),再进一步优选为24~26%(w/v);所述高渗溶液的ph优选为5.5~6.5,进一步优选为5.8~6.2;所述预处理的时间优选为3~7h,进一步优选为4~6h,再进一步优选为4.5~5.5h。在本发明中,预处理的具体方式为连翘幼果浸泡于高渗溶液中。
31.在本发明中,将待检测的目的基因构建入烟草脆裂病毒第二亚基因组,制备重组载体ptrv2:fstg,所述目标基因优选为连翘番茄红素去饱和酶基因,连翘番茄红素去饱和酶基因进一步优选为核苷酸序列为seq id no.1。
32.在本发明中,将烟草脆裂病毒第一亚基因组载体ptrv1与根癌农杆菌gv3101混合振荡培养,获得转化有ptrv1的重组农杆菌,所述ptrv1与农杆菌振荡培养的培养基优选为添加卡那霉素和利福平的lb培养基;所述培养基中卡那霉素的浓度优选为40~60mg/l,进一步优选为45~55mg/l,再进一步优选为48~52mg/l;所述培养基中利福平的浓度优选为40~60mg/l,进一步优选为45~55mg/l,再进一步优选为48~52mg/l。
33.在本发明中,所述烟草脆裂病毒第一亚基因组载体ptrv1与农杆菌gv3101振荡培养的温度优选为26~30℃,进一步优选为27~29℃;时间优选为8~16h,进一步优选为10~14h,再进一步优选为11~13h;转速优选为200~240rpm,进一步优选为210~230rpm,再进一步优选为215~225rpm。
34.在本发明中,将转化有ptrv1的重组农杆菌的菌体与基础侵染液混合,得转化有ptrv1的重组农杆菌侵染液;将转化有ptrv2:fstg的重组农杆菌的菌体与基础侵染液混合,得转化有ptrv2:fstg的农杆菌侵染液。在本发明中,所述转化有ptrv2:fstg的重组农杆菌的菌体通过离心获得,所述离心的转速优选为4500~5500rpm,进一步优选为4800~5200rpm,再进一步优选为5000rpm;时间优选为5~15min,进一步优选为8~12min,再进一步优选为10min。所述基础侵染液优选为包括有90~110μm乙酰丁香酮、65~85μm triton-x100和1.5~3.5%(w/v)蔗糖的1/2ms培养基;所述乙酰丁香酮浓度优选为90~110μm,进一步浓度优选为95~105μm,更进一步优选为100μm;所述triton-x100浓度优选为65~85μm,进一步优选为70~80μm,更进一步优选为75μm;所述蔗糖浓度优选为1.5~3.5%(w/v),进一步优选为2~3%(w/v),更进一步优选为2.5%(w/v)。
35.在本发明中,所述转化有ptrv1的农杆菌侵染液与转化有ptrv2:fstg的农杆菌侵染液的od
600
均优选为0.05~0.15,进一步优选为0.08~0.12,更进一步优选为0.1。
36.在本发明中,将转化有ptrv1的重组农杆菌侵染液与转化有ptrv2:fstg的重组农
杆菌侵染液混合制备转化液,转化有ptrv1的农杆菌侵染液与转化有ptrv2:fstg的农杆菌侵染液的混合体积比优选为1:1~2,进一步优选为1:1.2~1.8,再进一步优选为1:1.4~1.6。
37.在本发明中,连翘高渗溶液预处理幼果放入转化液振荡培养的温度优选为19~23℃,进一步优选为20~22℃;相对湿度优选为45~60%,进一步优选为46~48%;转速优选为40~80rpm,进一步优选为50~70rpm,再进一步优选为55~65rpm。
38.在本发明中,连翘高渗溶液预处理幼果放入转化液振荡培养的日照周期优选为光照14~18h,黑暗6~10h,进一步优选为光照15~17h,黑暗7~9h;光照强度优选为350~450μmol/m2·
s,进一步优选为380~420μmol/m2·
s,再进一步优选为390~410μmol/m2·
s。
39.在本发明中,连翘高渗溶液预处理幼果放入转化液振荡培养的溶液每24h更换一次。
40.在本发明中,所述预处理后连翘幼果放入转化液中振荡培养时间优选为2~3周,进一步优选为15~20天,再进一步优选为16~18天;在连翘幼果振荡之后,出现光漂白现象,选取出现疑似沉默效果的果实进行rna提取并进行qrt-pcr分析。
41.下面结合实施例对本发明提供的技术方案进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
42.实施例1
43.对连翘幼果采取共培养方式处理,将连翘幼果清洗干净拍照,再用含25%(w/v)蔗糖的1/2ms溶液(ph5.8)的高渗溶液预处理5h。将连翘pds基因通过转录组数据筛选出来,序列如seq id no.1所示;使用bamh1与xba1酶消化ptrv2,凝胶纯化后,将fspds-insert(seq id no.1)使用同源重组酶与线性化载体连接,产生的重组载体转化为大肠杆菌dh5a细胞(中国全式金)pcr使用f-pdsbos和r-pdsbos引物通过检测相应的ptrv2确认是否含有pds的插入物的存在。所述f-pdsbos的核苷酸序列如seq id no.2所示,所述r-pdsbos的核苷酸序列如seq id no.3所示。空载trv2的pcr产物的预期尺寸为0bp,而trv2-fspds的pcr产物的预期尺寸为309bp。之后将重组载体测序,以检测目的片段是否正确插入,得重组载体ptrv2:fspds;将所述重组载体的质粒通过热激法(42℃,90s)转化入根癌农杆菌gv3101获得转化有ptrv2:fspds的重组农杆菌,培养至od
600
为0.6,离心,获得菌体与基础侵染液(含有100μm乙酰丁香酮、75μmtriton-x100和2.5%(w/v)蔗糖的1/2ms培养基)混合,调节od
600
为0.1。将烟草脆裂病毒第一亚基组载体ptrv1的质粒通过热激法(42℃,90s)与根癌农杆菌gv3101置于含有50mg/l卡那霉素和50mg/l利福平的lb培养基中,28℃,220rpm振荡培养12h,得到转化有ptrv1的重组农杆菌,培养至od
600
为0.6,离心,获得菌体与基础侵染液含有100μm乙酰丁香酮、75μmtriton-x100和2.5%(w/v)蔗糖的1/2ms培养基混合,调节od
600
为0.1。将转化有ptrv1的重组农杆菌侵染液与转化有ptrv2:fspds的重组农杆菌侵染液1:1混合为转化液。将高渗溶液预处理的连翘幼果放入配置好转化液的培养瓶中,60rpm摇床中培养,溶液每24h更换一次。温度21℃,相对湿度50%,光照强度400μmol/m2·
s,日照周期为光照16h,黑暗处理8h。18天后,连翘幼果出现光漂白现象,选取出现疑似沉默效果的果实进行rna提取并进行qrt-pcr分析。
44.实施例2
45.对连翘幼果采取共培养方式处理,将连翘幼果清洗干净拍照,再用含20%(w/v)蔗
糖的1/2ms溶液(ph5.5)的高渗溶液预处理3h。将连翘pds基因通过转录组数据筛选出来,序列如seq id no.1所示;使用bamh1与xba1酶消化ptrv2,凝胶纯化后,将fspds-insert(seq id no.1)使用同源重组酶与线性化载体连接,产生的重组载体转化为大肠杆菌dh5a细胞(中国全式金)pcr使用f-pdsbos和r-pdsbos引物通过检测相应的ptrv2确认是否含有pds的插入物的存在。所述f-pdsbos的核苷酸序列如seq id no.2所示,所述r-pdsbos的核苷酸序列如seq id no.3所示。空载trv2的pcr产物的预期尺寸为0bp,而trv2-fspds的pcr产物的预期尺寸为309bp。之后将重组载体测序,以检测目的片段是否正确插入,得重组载体ptrv2:fspds;将所述重组载体的质粒通过热激法(42℃,90s)转化入根癌农杆菌gv3101获得转化有ptrv2:fspds的重组农杆菌,培养至od
600
为0.6,离心,获得菌体与基础侵染液含有90μm乙酰丁香酮、65μmtriton-x100和1.5%(w/v)蔗糖的1/2ms培养基混合,调节od
600
为0.05。将烟草脆裂病毒第一亚基组载体ptrv1的质粒通过热激法(42℃,90s)与根癌农杆菌gv3101置于含有40mg/l卡那霉素和40mg/l利福平的lb培养基中,26℃,200rpm振荡培养8h,得到转化有ptrv1的重组农杆菌,培养至od
600
为0.6,离心,获得菌体与基础侵染液(含有90μm乙酰丁香酮、65μmtriton-x100和1.5%(w/v)蔗糖的1/2ms培养基)混合,调节od
600
为0.05。将转化有ptrv1的重组农杆菌侵染液与转化有ptrv2:fspds的重组农杆菌侵染液1:2混合为转化液。将高渗溶液预处理的连翘幼果放入配置好转化液的培养瓶中,40rpm摇床中培养,溶液每24h更换一次。温度19℃,相对湿度45%,光照强度350μmol/m2·
s,日照周期为光照14h,黑暗处理10h。14天后,连翘幼果出现光漂白现象,选取出现疑似沉默效果的果实进行rna提取并进行qrt-pcr分析。
46.实施例3
47.对连翘幼果采取共培养方式处理,将连翘幼果清洗干净拍照,再用含30%(w/v)蔗糖的1/2ms溶液(ph6.5)的高渗溶液预处理7h。将连翘pds基因通过转录组数据筛选出来,序列如seq id no.1所示;使用bamh1与xba1酶消化ptrv2,凝胶纯化后,将fspds-insert(seq id no.1)使用同源重组酶与线性化载体连接,产生的重组载体转化为大肠杆菌dh5a细胞(中国全式金)pcr使用f-pdsbos和r-pdsbos引物通过检测相应的ptrv2确认是否含有pds的插入物的存在。所述f-pdsbos的核苷酸序列如seq id no.2所示,所述r-pdsbos的核苷酸序列如seq id no.3所示。空载trv2的pcr产物的预期尺寸为0bp,而trv2-fspds的pcr产物的预期尺寸为309bp。之后将重组载体测序,以检测目的片段是否正确插入,得重组载体ptrv2:fspds;将所述重组载体的质粒通过热激法(42℃,90s)转化入根癌农杆菌gv3101获得转化有ptrv2:fspds的重组农杆菌,培养至od
600
为0.6,离心,获得菌体与基础侵染液含有110μm乙酰丁香酮、85μmtriton-x100和3.5%(w/v)蔗糖的1/2ms培养基混合,调节od
600
为0.15。将烟草脆裂病毒第一亚基组载体ptrv1的质粒通过热激法(42℃,90s)与根癌农杆菌gv3101置于含有60mg/l卡那霉素和60mg/l利福平的lb培养基中,30℃,240rpm振荡培养16h,得到转化有ptrv1的重组农杆菌,培养至od
600
为0.6,离心,获得菌体与基础侵染液(含有110μm乙酰丁香酮、85μmtriton-x100和3.5%(w/v)蔗糖的1/2ms培养基)混合,调节od
600
为0.15。将转化有ptrv1的重组农杆菌侵染液与转化有ptrv2:fspds的重组农杆菌侵染液1:1.5混合为转化液。将高渗溶液预处理的连翘幼果放入配置好转化液的培养瓶中,80rpm摇床中培养,溶液每24h更换一次。温度23℃,相对湿度60%,光照强度450μmol/m2·
s,日照周期为光照18h,黑暗处理6h。21天后,连翘幼果出现光漂白现象,选取出现疑似沉默效果的果
实进行rna提取并进行qrt-pcr分析(ptrv1和ptrv2载体由中国山西农业大学生命科学学院王德福副教授)。
48.由图2可知,利用本发明所述的沉默或敲低连翘幼果中基因表达的方法侵染连翘果实后,果实中的pds基因表达量显著降低,说明连翘果实中的vigs基因沉默体系构建成功;传统基因敲除技术需要构建转基因体系,即使得到转基因植株也要4年以后才能开花,对于果实性状相关基因功能研究非常不利,本发明所述方法则有快速、方便和组织特异性强的特点。
49.以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
