一种alb融合蛋白的表达方法及其应用
技术领域
1.本发明属于分子生物学技术领域,尤其涉及一种alb融合蛋白的表达方法及其应用。
背景技术:
2.人诱导多能干细胞(ipsc)可以被分化为各种类型的细胞,包括肝样细胞(iheps)。由于人ipsc可以无限扩增的特性,为药物筛选,肝脏毒性测试,以及用于细胞替代疗法的再生医学提供数量无限的肝脏细胞。不过,现有分化方案获得的iheps与成人肝细胞在成熟度方面仍有些差距,并且分化而来的iheps群体中细胞不均一,含有不同分化阶段的iheps以及其他的细胞类型,因此,建立携带肝细胞谱系特异的荧光蛋白或其他报告基因的ipsc尤为重要。alb为编码人血白蛋白的基因,是肝脏细胞特异性表达的基因,且表达量非常高。因此,通过给alb添加融合蛋白,包括各类报告基因,可以标记ipsc分化而来的iheps。但是采用何种alb融合蛋白的表达方法,可以具有更好的效果,分选获得纯度较高的肝细胞,且对肝细胞代谢不造成干扰,目前还未见有相关文献报道。
技术实现要素:
3.针对以上技术问题,本发明公开了一种alb融合蛋白的表达方法及其应用,通过一个步骤给人alb基因添加了一个或多个融合蛋白,可以稳定、高效表达,且对肝细胞代谢不造成干扰。
4.对此,本发明的技术方案为:一种alb融合蛋白的表达方法,其包括:利用核酸酶切割基因组,在人多能干细胞或肝脏细胞alb基因终止密码子前通过基因共表达连接元件给alb基因同时添加2个融合蛋白基因;所述融合蛋白基因为报告基因、功能基因、基因片段、细胞表面蛋白、或报告基因、功能基因、基因片段、细胞表面蛋白中两种或以上的组合;所述报告基因为荧光蛋白基因、细胞表面抗原、荧光素酶基因、氯霉素乙酰转移酶基因、β-半乳糖苷酶基因、分泌性人胎盘碱性磷酸酶基因或pet报告基因;使用人多能干细胞,通过定向分化技术分化为肝脏细胞(iheps)。即构建细胞株,将人ipscs分化成iheps。
5.其中,细胞表面蛋白:细胞表面表达的各类蛋白的总称,包括但不限于各类细胞表面抗原,各类细胞表面配体或受体等。
6.采用此技术方案,这些报告基因可以帮助我们优化ipsc定向分化为肝脏细胞分化方案,通过流式细胞术或磁珠分选获得高纯度iheps。此外,如前所述,alb为肝细胞中表达量非常高的蛋白,且基本局限在肝细胞内表达,通过给alb添加功能性的融合蛋白,可在肝细胞内或肝细胞表面特异地表达相关蛋白,使肝细胞获得或恢复相关功能。可以用来开发肝遗传病基因疗法,或使外源肝细胞获得免疫豁免功能或其他新的功能。此技术方案在alb终止密码子前通过基因连接元件给alb同时添加了2个报告基因。
7.进一步优选的,在alb终止密码子前通过2a连接元件给alb同时添加2个报告基因,不干扰内源alb的表达,没有引入其他任何筛选基因(如抗性基因或荧光标记基因等),还可以获得包含单个报告基因细胞系。进一步的,这两个报告基因为非同类报告基因。进一步的,所添加的报告基因和内源alb表达为融合蛋白,且和内源alb表达同步。其中,报告基因也可替换为功能基因或基因片段,用于在肝细胞中特异性表达相关功能基因或基因片段编码的蛋白或多肽,治疗某些肝脏疾病。
8.作为本发明的进一步改进,所述核酸酶为锌指核酸酶(zfn),转录激活因子样效应物核酸酶(talen),或规律间隔成簇短回文重复序列(crispr)cas系统;进一步优选为规律间隔成簇短回文重复序列(crispr)cas9系统。
9.作为本发明的进一步改进,所述的alb融合蛋白的表达方法,其包括如下步骤:步骤s1,设计crispr/cas9 sgrna序列,使切割位点位于alb终止密码子附近;将其克隆到crispr载体中,构建alb crispr-cas9载体;其中,优选的,crispr识别位点的序列如seq id no.1,即aatgtgatgttataagcctaagg。
10.进一步的,所述crispr/cas9 sgrna的序列如seq id no.1;所述crispr/cas9 sgrna的合成引物为alb-g1-top引物和alb-g1-bottom引物,所述alb-g1-top引物的序列如seq id no.2,所述alb-g1-bottom引物的序列如seq id no.3;步骤s2,按左同源臂(lha)-基因共表达连接元件感兴趣的基因或dna片段-右同源臂(rha)的结构构建供体质粒;步骤s3,构建alb-感兴趣的基因或dna片段细胞株:将步骤s2得到的供体质粒载体与靶向alb的crispr-cas9载体一起转染至目的细胞,转染后24-48小时后加入嘌呤霉素处理;24小时后撤掉嘌呤霉素换新鲜培养基,待细胞长到30-60%汇合率时进行单细胞克隆;通过有限稀释法获得单个细胞来源的克隆后,进行挑取,利用junction pcr鉴定克隆;步骤s4,ipsc定向分化为iheps:通过三个阶段定向分化将人ipscs分化成iheps,第一阶段利用培养基s1处理24小时,之后2天使用培养基s1培养,获得definitive endoderm(de)细胞;第二阶段是将de细胞诱导为肝母细胞(hepatoblasts),这一阶段使用培养基s2培养7天;第三阶段采用培养基s3培养7天或以上。
11.采用此技术方案,crispr/cas9切割位点在alb终止密码子附近,插入目的基因在终止密码子位置,最大限度的保留了内源alb序列,对内源alb表达影响最小。而供体质粒的简洁,又可以大大提升同源重组效率。使用本方案敲入基因后,预期的基因组序列是可控的,即可以精准控制插入碱基的序列以及位置,而且基因敲入效率高,而非像非依赖同源重组的方式敲入容易产生碱基插入或缺失,会产生一定的风险。
12.作为本发明的进一步改进,所述功能基因为pd-l1基因。
13.作为本发明的进一步改进,所述基因连接元件为2a肽或ires序列;优选地,基因连接元件为2a肽,再优选地,2a肽为p2a。
14.作为本发明的进一步改进,所述感兴趣的基因或dna片段为mcherry和/或cd8;所述p2a的序列如seq id no.8,mcherry的序列如seq id no.9,cd8的序列如seq id no.10;左同源臂alb-lha的序列如seq id no.11,右同源臂alb
‑ꢀ
rha的序列如seq id no.12。
15.作为本发明的进一步改进,步骤s2采用如下步骤构建供体质粒:
步骤s201,使用lha-pf引物和lha-pr引物扩增出lha-sali,使用rha-pf引物和rha-pr引物扩增出sphi-rha-hindiii;其中lha-pf引物的序列如seq id no.4,lha-pr引物的序列如seq id no.5,rha-pf引物的序列如seq id no.6,rha-pr引物的序列如seq id no.7;步骤s202,分别通过合成或亚克隆方式扩增出2a-mcherry和2a-cd8,同时在5
‘
和3’分别引入sali和sphi酶切位点;步骤s203,将lha-sali利用ta克隆的方法插入至pmd18-t多克隆位点区域;随后,利用酶切连接的方法分别将mcherry和/或cd8 以及rha连接到pmd18-t,获得alb-mcherry质粒和/或alb-cd8质粒;包含mcherry或cd8的供体质粒。
16.采用此技术方案,通过给alb添加荧光蛋白报告基因mcherry,可以使得多能干细胞分化为肝细胞后,mcherry和alb共表达,这样可非常真实地帮助我们找到并定位alb 肝细胞,观测和检测alb 肝细胞亚群在分化细胞中的比例;可以利用facs检测或分选alb细胞群,无需额外的实验操作,细胞消化后可以直接上机检测;而且mcherry可以在荧光显微镜下直接观察并,因此,可以通过实时观测以优化多能干细胞向肝样细胞定向分化的方案,同时,mcherry可以帮助我们选择合适3d分化培养方案。
17.另外,通过给alb添加细胞表面抗原cd8,可以轻松使用macs分选ipsc来源的肝细胞,相对于facs分选方法,这种方法对细胞基本没有创伤。
18.作为本发明的进一步改进,步骤s3中,将1-6 ug alb-mcherry,1-6 ug alb-cd8供体质粒载体与2-5 ug 靶向alb的crispr-cas9载体一起转染至ipsc细胞,然后铺板到12孔板,转染后24-48小时后加入0.1-0.75 ug/ml 嘌呤霉素处理。
19.作为本发明的进一步改进,步骤s3中,鉴定目的片段整合的引物为f1引物和r1引物,未修饰的基因组扩增产物为340 bp,正确插入的基因组为1117 bp;鉴定mcherry整合的引物为f2引物和r2引物;鉴定 cd8整合的引物为f3引物和r2引物;其中,所述f1引物的序列如seq id no.13,所述r1引物的序列如seq id no.14;所述f2引物的序列如seq id no.15,所述r2引物的序列如seq id no.16;所述f3引物的序列如seq id no.17,所述r3引物的序列如seq id no.18。
20.作为本发明的进一步改进,步骤s4,所述培养基s1含有rpmi1640 activin a 20-120 ng/ml 和 wnt3α 15-70 ng/ml;所述培养基s2含有80% knockout dmem (ko-dmem)、20% knockout serum replacement (ksr)、0.5% glutamax、1% non-essential amino acids (neaa)、0.1 mm beta-mercaptoethanol和1% dmso;所述培养基s3含有hepatozyme-sfm或hepatocyte culture medium (hcm)、1% glutamax、5-20 μm hydrocortisone 21-hemisuccinate sodium salt (hcc)、5-20 ng/ml hgf、10-50ng/ml osm、5-30 um alk5抑制剂和20-80 um腺苷酸环化酶激活剂。
21.作为本发明的进一步改进,步骤s4还包括通过流式细胞术或磁珠分选alb 肝细胞。
22.本发明还公开了如上任意一项所述的alb融合蛋白的表达方法的应用,用于从人多能干细胞生产肝脏细胞,开展肝遗传病治疗,或使移植用的外源肝细胞获得免疫豁免功能的药物中。
23.与现有技术相比,本发明的有益效果为:第一,采用本发明的技术方案,利用crispr/cas9 切割基因组,高效地将报告基因或其他功能基因和alb目标基因连接在一起,并且报告基因或功能基因可以和目的基因共表达。通过将报告基因或功能基因和alb共表达,从而可以在肝细胞,或类肝细胞中表达特定的报告基因或功能蛋白。
24.第二,通过给alb添加荧光蛋白报告基因mcherry,可以使得多能干细胞分化为肝细胞后,mcherry和alb共表达,这样可非常真实地帮助我们找到并定位alb 细胞,观测和检测alb 肝细胞亚群在分化细胞中的比例;利用facs检测或分选alb细胞群,无需额外的实验操作,细胞消化后可以直接上机检测或分选;另外,mcherry可以在荧光显微镜下直接观察,因此,可以通过实时观测以优化多能干细胞向肝样细胞定向分化的方案;也可以非常真实地帮助我们在开发3d分化方案时,找出高分化效率的实验方案。
25.第三,采用本发明的技术方案,cd8可以帮助我们在体外实验中利用磁珠或流式分选出肝细胞;也可以帮助我们从人肝嵌合动物体内分离出ipsc来源的肝细胞。
26.第四,利用不同的功能基因的类别及功能,通过发明的本方案,可以使肝细胞获得额外的功能。并且,可以通过仅仅一次转染,使肝细胞同时表达2种或2种以上的融合蛋白,这将为增强肝细胞或者多能干细胞来源的肝细胞功能提供一种有效方案。特别地,可以将pd-l1基因和alb共表达,可以使上述肝细胞或类肝细胞获得免于被免疫细胞攻击的能力。
附图说明
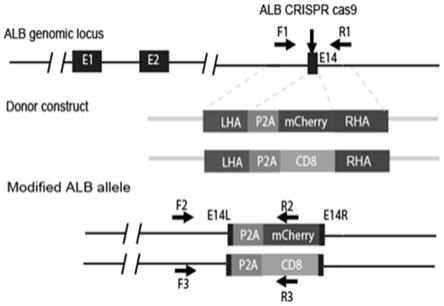
27.图1是本发明实施例的供体质粒的结构示意图。
28.图2是本发明实施例的alb融合基因插入的示意图。
29.图3是本发明实施例的alb融合基因插入的鉴定图,其中,(a)为通过junction pcr筛选目的克隆的结果图,(b)为测序峰图;(c)为免疫荧光染色图,(d)为核型分析图。
30.图4是本发明实施例的 ipsc定向分化为iheps的示意图。
31.图5是本发明实施例的 ipsc定向分化第三阶段的mcherry同步表达的结果图;其中(a)为光镜下的细胞形态,(b)为 荧光显微镜下观察的细胞表达mcherry。
32.图6是本发明实施例的ipsc定向分化的第三阶段的流式分析结果图。
33.图7是本发明实施例的 ipsc定向分化第三阶段的iheps pas染色结果阳性图。
34.图8是本发明实施例的ipsc定向分化的免疫荧光分析图。
35.图9是发明实施例的pcr确认单细胞来源的克隆中是否有mcherry或cd8整合结果图。
36.图10是发明实施例的mcherry阳性、cd8阳性、二者双阳性的克隆占总筛选克隆(16个)的比例分析图。
具体实施方式
37.下面对本发明的较优的实施例作进一步的详细说明。
38.一种alb融合蛋白的表达方法,通过一个步骤给人alb基因添加了一个或多个融合蛋白。这类融合蛋白可以是报告基因(包括但不限于荧光蛋白基因,细胞表面抗原,荧光素酶基因,氯霉素乙酰转移酶基因,β-半乳糖苷酶基因,分泌性人胎盘碱性磷酸酶基因,pet报
告基因等),也可以是功能基因。融合蛋白和alb由2a连接肽连接,融合蛋白插入位置为alb终止密码子前。在alb终止密码子前通过2a连接元件给alb同时添加了2个报告基因,但并不干扰内源alb的表达,且这两个报告基因为非同类报告基因,没有引入其他任何筛选基因(如抗性基因或荧光标记基因等)。
39.作为进一步优选的实施例,如下提供了一步法构建2个报告基因(mcherry和cd8)和alb融合表达的方法,其中mcherry为荧光蛋白基因,便于观测alb表达水平;cd8为细胞表面标记物,便于通过磁珠分选或流式分选ipsc来源的肝细胞,具体包括如下步骤:1、设计并构建crispr/cas9及供体质粒:1)设计crispr/cas9 sgrna序列,使切割位点位于alb终止密码子附近。
40.具体地,sgrna序列为:aatgtgatgttataagcctaagg(如seq id no.1),合成引物alb-g1-top:caccgaatgtgatgttataagccta(如seq id no.2);引物alb-g1-bottom: aaactaggcttataacatcacattc(如seq id no.3);然后克隆到crispr载体中,构建alb crispr-cas9载体。
41.2)设计供体质粒:如图1所示,供体质粒的结构为:左同源臂(lha)-2a肽序列-感兴趣的基因或dna片段-右同源臂(rha)。
42.在本实验中,2a肽为p2a,感兴趣的基因为mcherry和cd8;所述p2a的序列如seq id no.8,mcherry的序列如seq id no.9,cd8的序列如seq id no.10;左同源臂alb-lha的序列如seq id no.11,右同源臂alb
‑ꢀ
rha的序列如seq id no.12。
43.3)供体质粒构建根据图1设计质粒载体,在alb终止密码子前插入p2a-mcherry、p2a-cd8,如图2所示,使用引物lha-pf和lha-pr扩增出lha-sali;其中lha-pf引物的序列为:cgtgaaacacaagcccaaggcaac(如seq id no.4),lha-pr引物的序列为gtcgactaagcctaaggcagcttgacttgcag(如seq id no.5);使用rha-pf和rha-pr扩增出sphi-rha-hindiii;其中,rha-pf引物的序列为gcatgccatcacatttaaaagcatctcagg(如seq id no.6),rha-pr引物的序列为:aagctttctttctcttattctcatggtaggc(如seq id no.7)。
44.分别通过合成或亚克隆方式扩增出2a-mcherry和2a-cd8,同时在5
‘
和3’分别引入sali和sphi酶切位点。然后将lha-sali利用ta克隆的方法插入至pmd18-t多克隆位点区域。随后,利用酶切连接的方法分别将mcherry或cd8 以及rha连接如pmd18-t,获得包含mcherry或cd8的供体质粒,即alb-mcherry和alb-cd8质粒。
45.2、构建alb-mcherry细胞株将1-6 ug alb-mcherry, 1-6 ug alb-cd8供体质粒载体与2-5 ug 靶向alb的crispr-cas9载体一起转染至50-150万人ipsc细胞,然后铺板到12孔板,转染后24-48小时后加入0.1-0.75 ug 嘌呤霉素处理。24小时后撤掉嘌呤霉素换培养基mtesr1 10 μm y27632,待细胞长到30-60%汇合率时可进行单细胞克隆。通过有限稀释法获得单个细胞来源的克隆后,手工挑取,利用junction pcr鉴定克隆。
46.鉴定目的片段整合的引物为f1引物和r1引物;未修饰的基因组扩增产物为340 bp,正确插入的基因组为1117 bp;其中,所述f1引物的序列为ggggacaactatgtccgtgagcttc
(如seq id no.13),所述r1引物的序列为tcggtgctggtctatatggctcttg(如seq id no.14)。
47.鉴定mcherry整合的引物为f2引物和r2引物;其中,所述f2引物的序列为ttatagcggtatgcctgagcc(如seq id no.15),所述r2引物的序列为agccgtacatgaactgaggg(如seq id no.16)。
48.鉴定 cd8整合的引物为f3引物和r3引物;其中,所述f3引物的序列为aaactcagtgcacttgttgagc(如seq id no.17),所述r3引物的序列为tcttcggttcctgtggttgc(如seq id no.18)。
49.如图3a)所示,通过junction pcr筛选目的克隆,f2/r2阳性,f3/r3阴性且f1/r1扩增出大片段的为mcherry纯合整合;f2/r2阳性,f3/r3阴性且f1/r1扩增出小片段为mcherry杂合整合。同理分析出cd8整合情况。当f2/r2、f3/r3都为阳性的为alb一对等位基因各整合入一个p2a-mcherry序列和一个p2a-cd8序列,测序峰图如图3b)所示。
50.在本实验中,选择了同时整合18号双allele mcherry/cd8整合克隆(alb
mcherry/cd8 ipsc)作为目的克隆进行后续鉴定和分化实验。
51.3、alb
mcherry/cd8 ipsc细胞株鉴定通过免疫荧光染色,如图3c)所示,我们确认alb
mcherry/cd8 ipsc表达多能性标记物ssea-4,oct4,nanog,tra-1-60;如图3d)所示,核型正常。
52.4、ipsc定向分化为iheps通过三个阶段定向分化将人ipscs分化成iheps,如图4所示;1)第一阶段,利用第一阶段培养基s1(rpmi1640 activin a(20-120 ng/ml)) wnt3α(15-70 ng/ml)处理24小时(记为d0),之后2天使用s1培养基培养,获得definitive endoderm(de)细胞。
53.2)第二阶段,将de细胞诱导为肝母细胞(hepatoblasts),这一阶段使用第二阶段培养基s2(80% knockout dmem (ko-dmem), 20% knockout serum replacement (ksr), 0.5% glutamax, 1% non-essential amino acids (neaa), 0.1 mm beta-mercaptoethanol和1% dmso)培养7天。
54.3)第三阶段,使用第三阶段培养基s3培养7天或以上。s3培养基含有hepatozyme-sfm, 1% glutamax,5-20 μm hydrocortisone 21-hemisuccinate sodium salt (hcc),5-20 ng/ml hgf,10-50ng/ml osm,5-30 um alk5抑制剂和20-80 um腺苷酸环化酶激活剂。
55.第三个阶段后,iheps中相对成熟肝细胞群体高表达alb、mcherry同步表达,如图5所示;进一步通过流式分析发现93.9%的iheps为mcherry阳性,如图6所示,证明该分化方案可以获得高纯度的肝脏细胞。同时,这些iheps pas染色结果阳性,如图7所示,说明这些iheps具有合成糖原的能力。如图8所示,免疫荧光证实这些iheps表达肝细胞特异性蛋白(alb,asgr1),肝药酶(cyp3a4,cyp2c9),转运体(mrp2,ntcp)等。
56.对单细胞来源的克隆中是否有mcherry或cd8整合进行了pcr确认,结果如图9所示,如图10所示,柱形图显示mcherry阳性,cd8阳性,或二者双阳性的克隆占总筛选克隆(16个)的比例,可见单个基因敲入的效率达到62.5%,双基因敲入到alb一对等位基因的比例为31.25%。另外,为了验证本实施例的敲入效率,查阅文献,发现同样使用非同源重组依赖的基因敲入方案,在人多能干细胞中基因敲入的效率仅1.7% (doi: 10.1093/nar/gkw064)。
57.上述实验通过特定方法检测报告基因,可以确认贴壁细胞群体中alb阳性细胞的
位置,也可以在细胞消化后检测alb 细胞的比例,或分选alb 细胞。在本实施例的方案中,通过检测mcherry表达,比如通过免疫荧光或facs的方法,可以定位、检测或者分选asgr1 细胞。进一步的,报告基因为荧光蛋白基因mcherry,检测或分选方式可以采用免疫荧光或流式细胞仪,检测或分选方法简单。
58.通过上述实施例可见,可以利用报告基因纯化alb 肝细胞的方法。具体来讲,通过流式细胞术或磁珠分选alb 肝细胞;利用报告基因优化多能干细胞定向分化为各谱系细胞。具体来讲,ipsc分化为肝样细胞;利用报告基因优化多能干细胞定向分化为肝细胞的2d或3d培养方法。本实施例中,给alb添加报告基因,所添加的报告基因和内源alb表达为融合蛋白,且和内源alb表达同步。该alb融合蛋白表达的方法可以用于表达报告基因,也可以用于在疾病细胞内或疾病个体肝脏中表达功能基因或表达细胞表面蛋白,该功能基因或细胞表面蛋白表达受alb启动子调控。该方法中的报告基因也可替换为功能基因或基因片段,用于在肝细胞中特异性表达相关功能基因或基因片段编码的蛋白或多肽,治疗某些肝脏疾病。
59.另外,在本实施例的基础上,在选择基因修饰工具时,切割alb终止密码子处位点,也可以选择锌指核酸酶(zfn),转录激活因子样效应物核酸酶(talen)。给alb添加的报告基因,也可以选择其他的报告基因或功能基因或功能基因片段,包括但不限于包括但不限于荧光蛋白基因、细胞表面抗原、荧光素酶基因、氯霉素乙酰转移酶基因、β-半乳糖苷酶基因、分泌性人胎盘碱性磷酸酶基因、pet报告基因等。给alb添加dna序列时,可以添加pd-l1基因或任何其他功能基因。培养基hepatozyme-sfm可以更换为hepatocyte culture medium (hcm)。
60.以上内容是结合具体的优选实施方式对本发明所作的进一步详细说明,不能认定本发明的具体实施只局限于这些说明。对于本发明所属技术领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干简单推演或替换,都应当视为属于本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
