一种dna水解酶及其制备方法
技术领域
1.本发明涉及生物技术领域,尤其涉及一种dna水解酶及其制备方法。
背景技术:
2.随着分子生物学的快速发展和普遍应用,新成立的生物医药公司如雨后春笋般的迅速成长。在涉及生产及制备与人的健康有密切相关产品的生物医药公司,如制药、食品及疫苗,政府相关部门对其生产,制备的流程及所用的原料等都有着严格的要求和标准。
3.就像是在进行蛋白纯化的过程中,需要对核酸进行降解,这就需要运行到dna水解酶。dna水解酶的本质是蛋白质,是由氨基酸合成的,现在国内使用的dna水解酶大部分都是直接从牛的胰腺组织中提取的,目前,国内使用的dna水解酶大部分都是由国外进口采用生化方法从牛胰腺脏中提取的。
4.但是,牛毕竟是一种动物,体内含有的病毒可能会含于提取的水解酶中,比如疯牛病就是一种人畜共患的病毒,而且直接从牛胰腺组织中分离提取,提取步骤复杂,原料成本高,提取工程中酶容易失活,不适合大规模制备,随着生物医药科技的发展,对安全的dna水解酶的需求会越来大。
5.有鉴于此,特提出本发明。
技术实现要素:
6.本发明的第一目的是提供一种dna水解酶,本发明所提供的重组dna水解酶,能够用于蛋白纯化过程中的核酸的降解,酶活性好,安全性能高,降解效率显著提升。
7.本发明的第二目的是提供上述水解酶的制备方法,该制备方法通过重组的方法制备dna水解酶,不需要任何介质,就可直接生成dna水解酶,过程简单、产量高、价格低廉,适用于推广应用。
8.为了实现上述目的,本发明特采用以下技术方案:
9.本发明提供了一种dna水解酶,水解酶的氨基酸序列如seq id no:1所示。
10.本发明所提供的水解酶是通过重组的方法设计氨基酸序列,然后构建了表达dna水解酶的重组表达载体,得到的dna水解酶的基因工程菌具有很好的蛋白表达能力,表达的dna水解酶能够用于蛋白纯化过程中核酸的降解,并且降解能力强、酶活稳定性好。
11.优选地,上述水解酶还包括标签,所述标签添加于所述水解酶的氮端,所述标签出于各种目的而附着在蛋白质上,例如以便容易纯化、帮助蛋白质的正确折叠、防止蛋白质沉淀、改变层析特性、修饰蛋白质或者标记蛋白质或给蛋白质贴标签,本发明中,所述标签为sumo标签。
12.本发明还提供了编码上述水解酶的核酸。
13.本发明还提供了上述水解酶的制备方法,其包括如下步骤:
14.设计水解酶氨基酸序列,构建重组表达载体;
15.构建所述水解酶表达的基因工程菌;
16.进行所述水解酶的纯化。
17.优选地,上述的制备方法中,构建所述水解酶的基因工程菌的方法包括如下步骤:
18.所述水解酶的载体转化感受态细胞;
19.将转化后细胞进行培养;
20.进行降温并诱导、离心收集菌体。
21.优选地,上述的制备方法中,所述水解酶的纯化包括如下步骤:
22.将基因工程菌进行重悬、菌体破碎、离心后得到粗酶液,利用亲和层析对所述粗酶液进行纯化、洗脱后得到目标蛋白,利用凝胶过滤层析技术精制蛋白。
23.优选地,所述克隆培养时的温度为30-37℃,所述克隆培养时的转速为200-250rpm。
24.优选地,所述克隆培养时的温度为37℃,所述克隆培养时的转速为220rpm。
25.优选地,所述降温的温度为10-25℃,所述降温的时间为0.5-1.5h。
26.优选地,所述降温的温度为16℃,所述降温的时间为1h。
27.优选地,所述诱导的时间为18-22h,所述诱导后离心的转速为7500-8500rpm,所述诱导后离心的时间为3-8min。
28.优选地,所述诱导的时间为20h,所述诱导后离心的转速为8000rpm,所述诱导后离心的时间为5min。
29.优选地,所述超声破碎时采用功率为300w,超声的时间是5s,超声的间隔为5s。
30.本发明与现有技术相比,至少有以下优异之处:
31.(1)本发明所提供的dna水解酶能用于蛋白纯化过程中核酸的降解等。
32.(2)本发明所提供的水解酶的制备方法过程简单,产量高,价格低廉,适用于推广应用。
附图说明
33.通过阅读下文优选实施方式的详细描述,各种其他的优点和益处对于本领域普通技术人员将变得清楚明了。附图仅用于示出优选实施方式的目的,而并不认为是对本发明的限制。而且在整个附图中,用相同的参考符号表示相同的部件。在附图中:
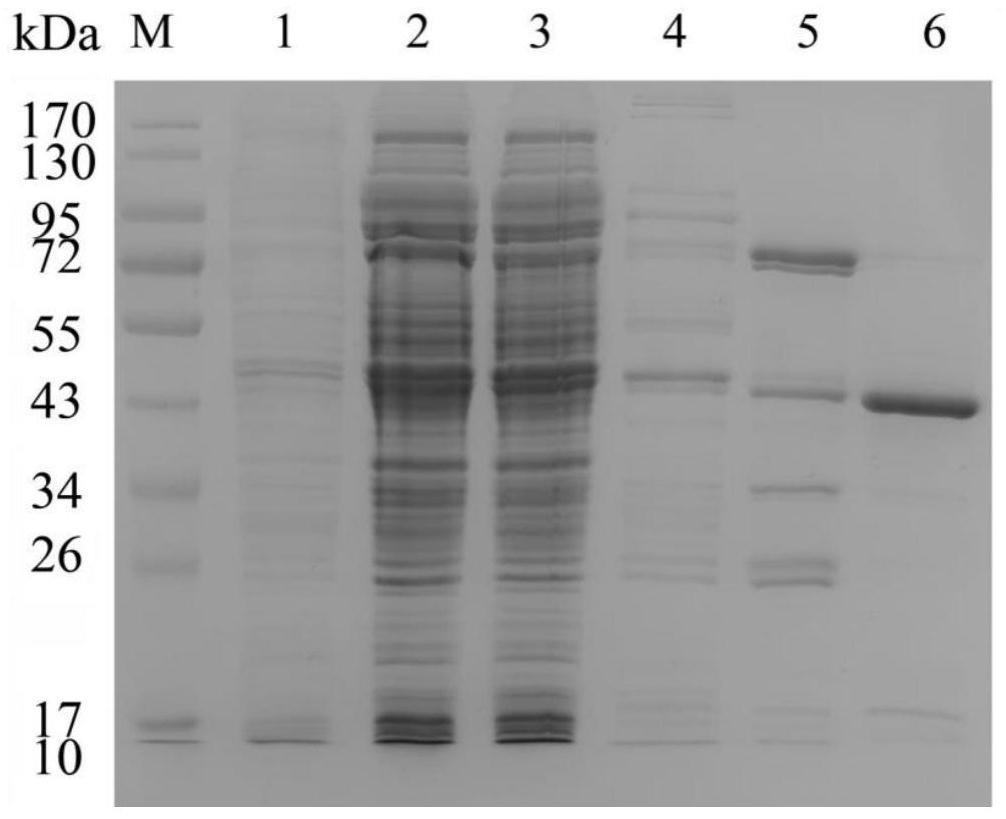
34.图1为本发明实施例所提供的ni柱纯化电泳图;
35.其中,1:pellet of cell lysate为破菌离心后沉淀;2:supernatant of cell lysate为破菌离心后上清液;3:flow through为ni柱纯化后流穿组分;4:wash with 20mm imidazole为20mm咪唑洗脱组分;5:elute fraction with 50mm imidazole为50mm咪唑洗脱组分;6:elute fraction with 250mm imidazole为250mm咪唑洗脱组分;m为marker;
36.图2为本发明实施例所提供的suprerdex75凝胶柱纯化电泳图;
37.其中,1:dnase 1-1 before loading onto superdex(10/300)为纯化前样品;5-14:elute fraction of peak 1为洗脱样品;
38.图3为本发明实施例所提供的suprerdex75凝胶柱纯化色谱图;
39.图4为本发明实施例所提供的dnasei酶切电泳图;
40.其中,1:不添加dnasei水解酶;2:10-1
μg dnasei水解酶;3:10-2
μgdnasei水解酶;4:10-3
μg dnasei水解酶;5:10-4
μg dnasei水解酶;6:10-5
μg dnasei水解酶。
具体实施方式
41.下面将结合实施例对本发明的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限制本发明的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
42.实施例1
43.本实施例提供了一种dna水解酶,该水解酶的氨基酸序列如seq id no:1所示。
44.本发明所述的水解酶包括了标签,标签融合于所述水解酶的氮端,所述标签出于各种目的而附着在蛋白质,例如以便容易纯化,帮助蛋白质的正确折叠,防止蛋白质沉淀,改变层析特性,修饰蛋白质或者标记蛋白质或给蛋白质贴标签。
45.本发明的标签为sumo标签,sumo标签是一种小分子泛素样修饰蛋白,是泛素类多肽链超家族的重要成员之一。在一级结构上,sumo与泛素只有18%的同源性,然而两者的三级结构及其生物学功能却十分相似。研究发现sumo可以作为重组蛋白表达的融合标签和分子伴侣,不但可以进一步提高融合蛋白的表达量,且具有抗蛋白酶水解以及促进靶蛋白正确折叠,提高重组蛋白可溶性等功能。此外sumo还可用于完整地切除标签蛋白,得到天然蛋白。因为sumo蛋白水解酶能识别完整的sumo标签蛋白序列,并能高效地把sumo从融合蛋白上切割下来。
46.本发明还提供了一种核酸,其编码了上述的水解酶。
47.核酸通常是rna或dna。核酸可以是单链或双链的。当将核酸与另一个核酸序列置于功能关系中时,核酸是“有效连接的”。例如,如果启动子或增强子影响编码序列的转录,那么启动子或增强子有效地连接至所述编码序列。当其连入载体时优选采用dna核酸。核酸可以经过密码子优化以在期望的宿主细胞中获得更为高效的表达。
48.获得dna水解酶包括如下步骤:
49.1、构建dna水解酶重组表达载体;
50.首先设计dna水解酶氨基酸序列,然后由基因公司经过密码子优化后构建到pet28a( )的ncoi和xhoi位点,如此便构建了dna水解酶重组表达载体。
51.术语中“载体”是指可将多聚核苷酸插入其中的一种核酸运载工具。当载体能使插入的多核苷酸编码的蛋白获得表达时,载体称为表达载体。载体可以通过转化,转导或者转染导入宿主细胞,使其携带的遗传物质元件在宿主细胞中获得表达。载体是本领域技术人员公知的,包括但不限于:质粒;噬菌粒;柯斯质粒;人工染色体,例如酵母人工染色体(yac)、细菌人工染色体(bac)或p1来源的人工染色体(pac);噬菌体如λ噬菌体或m13噬菌体及动物病毒等。可用作载体的动物病毒包括但不限于,逆转录酶病毒(包括慢病毒)、腺病毒、腺相关病毒、疱疹病毒(如单纯疱疹病毒)、痘病毒、杆状病毒、乳头瘤病毒、乳头多瘤空泡病毒(如sv40)。在一些实施方式中,本发明所述载体中包含基因工程中常用的调控元件,例如增强子、启动子、内部核糖体进入位点(ires)和其他表达控制元件(例如转录终止信号,或者多腺苷酸化信号和多聚u序列等)。
52.2、构建dna水解酶表达的基因工程菌;
53.将dna水解酶表达载体重组质粒转化到感受态细胞bl21(de3)plyss,挑取含有重组质粒的bl21(de3)plyss克隆接种至5ml的lb培养基中,在克隆培养时,其温度为35-37℃、
转速为200-250rpm,为了达到较好的效果,本实施例选择在37℃、220rpm的条件下培养过夜,然后按1:100的体积比例转接到500l的lb培养基中,在37℃、220rpm的条件下放大培养,培养至od600为0.5后进行降温处理,所述降温的温度为10-25℃、时间为0.5-1.5h,本实施例为了达到较好的效果,选择降温至16℃、降温1h,然后当od600为0.8时加入0.1mm的iptg进行诱导离心,所述诱导的时间为18-22h,所述诱导后离心的转速为7500-8500rpm,所述诱导后离心的时间为3-8min,本实施例为了保证制备的基因工程菌的效果,选择在诱导20h后,在8000rpm下离心5min收集菌体,在-80℃下保存。
54.3、dna水解酶的纯化
55.将表达的dna水解酶菌泥以20%的破菌液悬浮菌体后,采用功率为300w,时间为5s,间隔为5s的方式对悬浮菌液进行超声菌体破碎,在离心后经过0.45μm的滤膜后获得粗酶液,然后采用ni柱亲和层析进行纯化。
56.本发明采用的是akta系统装配5ml histrap hp进行层析的,具体流程为滤膜过滤样品以5ml/min流速上样,然后采用结合缓冲液(50mm tris、500mm nacl、1mm tcep、10mm mgcl2、ph 8.0)冲洗直至未结合蛋白完全洗脱,接着分别采用20mm和50mm的咪唑各洗脱杂蛋白4个柱体积,然后再用250mm的咪唑洗脱目标蛋白,结果如图1所示。
57.然后运用凝胶过滤层析技术精制蛋白,具体流程为:将ni柱洗脱蛋白浓缩后,将样品上样至suprerdex75凝胶柱,然后采用平衡缓冲液(50mm tirs、150mm nacl、10%glycerol、ph 7.5)以1ml/min流速分离蛋白,如图2、图3所示。
58.实验例1
59.将上述实施例所制得的dna水解酶进行酶切实验:在10mm的tris-hcl(ph7.5、at 25℃)、2.5mm的mgcl2和0.1mm的cacl2的条件下,添加10-1
μg的质粒dna,然后分别添加10-2
μg、10-3
μg、10-4
μg、10-5
μg的dnasei水解酶后反应5min,跑琼脂糖电泳,结果如图4所示。
60.通过上述实验例1可知,通过本发明所制备的dna水解酶在10-4
μg条件下完全降解添加的底物质粒dna。
61.最后,可以理解的是,以上实施方式仅仅是为了说明本发明的原理而采用的示例性实施方式,然而本发明并不局限于此。对于本领域普通技术人员而言,在不脱离本发明的原理和实质的情况下,可以做出各种变型和改进,这些变型和改进也视为本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。