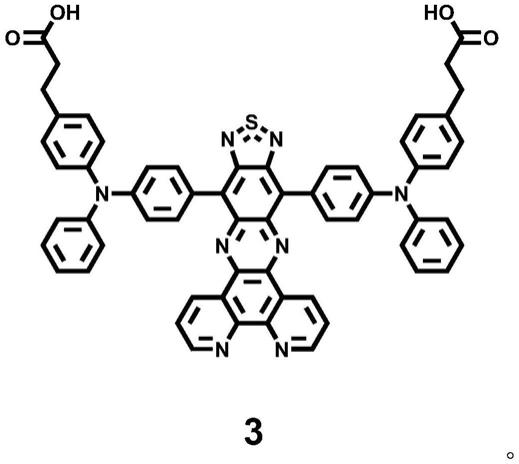
光治疗的nir-ii小分子、化合物、配合物及其制备方法和应用
技术领域
1.本发明专利涉及生物医学荧光成像应用技术领域,尤其是指光治疗的nir-ii小分子、化合物、配合物及其制备方法和应用。
背景技术:
2.化疗作为最方便、最有前途的治疗方法之一,在过去的几年中成功地提高了癌症患者的生存率。自从顺铂首次应用于肿瘤治疗以来,人们逐渐致力于探索过渡金属配合物的潜在治疗应用。其中,新一代抗癌候选化合物-有机钌(ii/iii)配合物因其有趣的光学性质以及与细胞dna和蛋白质的强相互作用而备受关注。然而,天然或获得性耐药性以及非特异性分布带来的严重的系统毒性极大地阻碍了治疗过程。nami-a作为第一个临床批准的钌配合物,被发现能与dna,rna和血清白蛋白的组氨酸残基结合,但由于其低疗效而最终失败。
3.光热疗法(ptt)或光动力疗法(pdt)等新的治疗模式与化疗具有协同作用,可以提高整体治疗效果,同时将副作用降到最低。因此,具有多种光物理性质和生物活性的ru(ii)多吡啶配合物是将这些治疗模式结合起来的最佳候选药物。此外,由于荧光的存在,ru(ii)多吡啶配合物具有多种光物理性质和生物活性。ru(ii)多吡啶配合物[ru(phen)2dppz]
2
和[(bpy)2ru(tpphz)ru(bpy)2]
4
在可视化药物传递和图像引导治疗方面具有巨大的潜力。然而,存在的ru(ii)配合物的发射波长主要位于强反射的可见光区(390-780nm)。因此,它不能用于体内生物成像,并且将ru(ii)配合物转化为治疗平台仍然是一个挑战。此外,为了优化ru(ii)配合物的溶解性、药代动力学、毒性和生物分布,人们采用了纳米载体,包括硒、金纳米材料、二氧化硅、碳纳米管,但纳米系统的粒径、复杂性以及较差的代谢和生物降解性一直是人们关注的主要问题。
[0004]
因此,开发一种具有较好的光稳定性和光热转换效率,无毒,生物相容性好,易被生物体吸收和代谢,对肿瘤细胞有明显细胞毒作用,具有近红外二区荧光发射的小分子显得尤为重要。
技术实现要素:
[0005]
本发明旨在至少在一定程度上解决现有技术中存在的技术问题之一,由此,在本发明的第一方面,本发明提供一种光治疗的nir-ii小分子,所述光治疗的nir-ii小分子如式3所示:
[0006][0007]
在本发明的第二方面,本发明提供一种光治疗的nir-ii化合物,所述光治疗的nir-ii化合物的结构如式4所示,
[0008][0009]
其中,r1、r2分别独立地选自-nh-peg-och3、叶酸、irgd、creka、寡肽ppshtpt中的一种;
[0010]
优选地,所述光治疗的nir-ii化合物的结构如式h7-peg
2k
所示,
[0011][0012]
在本发明的第三方面,本发明提供一种光治疗的nir-ii配合物,所述光治疗的nir-ii配合物的结构如式5所示,
[0013][0014]
r1、r2分别独立地选自-nh-peg-och3、叶酸、irgd、creka、寡肽ppshtpt中的一种;r3选自ru、ir中的一种;n、a分别独立地取自1、2、3、4;m取自cl、so4;r3选自ru、ir中的一种;n取自1、2、3、4;m取自cl、so4;
[0015]
优选地,所述光治疗的nir-ii配合物的结构如式hl-peg
2k
所示,
[0016][0017]
在本发明的一个或多个实施例中,所述光治疗的nir-ii配合物在水中自组装形成纳米颗粒,所述纳米颗粒的平均粒径为125~130nm,优选地,所述纳米颗粒的平均粒径为127.15nm。
[0018]
在本发明的一个或多个实施例中,所述光治疗的nir-ii配合物的荧光发射波长为1028nm。
[0019]
在本发明的第四方面,本发明提供一种本发明第一方面所述的光治疗的nir-ii小分子和/或本发明第二方面所述的光治疗的nir-ii化合物和/或本发明第三方面所述的光治疗的nir-ii配合物在近红外二区的肿瘤成像中的应用。
[0020]
在本发明的第五方面,本发明提供一种本发明第一方面所述的光治疗的nir-ii小分子和/或本发明第二方面所述的光治疗的nir-ii化合物和/或本发明第三方面所述的光治疗的nir-ii配合物在制备抗肿瘤药物中的应用。
[0021]
在本发明的第六方面,本发明提供一种本发明第一方面所述的光治疗的nir-ii小分子的制备方法,所述的光治疗的nir-ii小分子由化合物1制备得到,所述化合物1制备所述的光治疗的nir-ii小分子的反应式如下所示:
[0022][0023]
化合物1制备所述的光治疗的nir-ii小分子包括如下步骤:
[0024]
步骤1):取化合物1、4,7-二溴-5,6-二硝基苯并噻二唑、k2co3、pd(pph3)4,加入反应容器,在氮气保护下,于100~130℃油浴中搅拌反应,反应结束后,将混合物冷却并用水稀释,用ea提取,纯化,得到紫红色化合物2;
[0025]
步骤2):取步骤1)得到的化合物2加入dcm、甲醇和水的混合溶剂中,再加入95(w/w)%氯化铵和锌粉,置于反应容器中,在20~30℃下反应1~3h,过滤,用dcm洗涤滤饼,滤液旋转干燥得到黄色粗品;
[0026]
步骤3):取1,10-菲咯啉-5,6-二酮和所述步骤2)得到的黄色粗品溶于醋酸中,加入到反应容器中,在110~130℃油浴中回流3~6h,然后冷却、浓缩,得到残留物,提纯,得到绿色固体化合物,即为h7;
[0027]
步骤4):在0℃下取h7溶于dcm中,缓缓加入1ml tfa,将上述混合物加入到反应容器中,在室温下保存30min,浓缩,即得到化合物3,即为所述光治疗的nir-ii小分子;
[0028]
优选地,所述步骤1)中,化合物1,4,7-二溴-5,6-二硝基苯并噻二唑、k2co3、pd(pph3)4的摩尔比为1:3.2:0.1;
[0029]
优选地,所述步骤2)中,化合物2、氯化铵、锌粉的摩尔比为0.028:1:3.32;dcm、甲醇与水的体积比为1:1:1。
[0030]
在本发明的第七方面,本发明提供一种本发明第二方面所述的光治疗的nir-ii化合物的制备方法,其特征在于,所述光治疗的nir-ii化合物的由权利要求1所述光治疗的nir-ii小分子制备得到,所述光治疗的nir-ii小分子制备光治疗的nir-ii化合物的反应式如下所示:
[0031][0032]
优选地,所述光治疗的nir-ii化合物由本发明第一方面所述的治疗的nir-ii小分子在可调控位点修饰多肽、蛋白、聚乙二醇、核酸适配体或叶酸及其衍生物得到;
[0033]
优选地,所述光治疗的nir-ii小分子制备光治疗的nir-ii化合物包括如下步骤:取-nh-peg-och3或叶酸或irgd或creka或寡肽ppshtpt、dipea、hatu,加入至所述光治疗的nir-ii小分子的dmso溶液中,20~30℃下搅拌5~8h,纯化,即得到光治疗的nir-ii化合物;
[0034]
优选地,-nh-peg-och3或叶酸或irgd或creka或寡肽ppshtpt、dipea、hatu的摩尔比为0.028:1:3.32。
[0035]
在本发明的第八方面,本发明提供一种本发明第三方面所述的光治疗的nir-ii配合物的制备方法,其特征在于,所述光治疗的nir-ii配合物的由本发明第二方面所述的光治疗的nir-ii化合物制备得到,所述光治疗的nir-ii化合物制备光治疗的nir-ii配合物的反应式如下所示:
[0036][0037]
所述光治疗的nir-ii化合物制备光治疗的nir-ii配合物包括如下步骤:将所述光治疗的nir-ii化合物、ru(bpy)2cl2或ru(ii)-bis(4,4'-dimethyl-2,2'-bipyridine)或ru(phen)2cl2、ru(dppz)2cl2或cis-[ir(2,2
′‑
bipyridine)2d2]pf6置于反应容器中,加入40~60(v/v)%甲醇,80~100℃回流8~10小时,反应完后,浓缩反应液得到残渣,纯化残渣,得到所述光治疗的nir-ii配合物;
[0038]
优选地,所述光治疗的nir-ii化合物与ru(bpy)2cl2或ru(ii)-bis(4,4'-dimethyl-2,2'-bipyridine)或ru(phen)2cl2或ru(dppz)2cl2或cis-[ir(2,2
′‑
bipyridine)2d2]pf6的摩尔比为1:8。
[0039]
本发明的有益效果在于:
[0040]
1、本发明提供一种可在1000nm以上荧光发射的协同光治疗的nir-ii小分子、化合物、配合物,其为具有最大发射波长超过1000nm的全新化合物,并且在1000nm以上具有较好的量子产率(qy=0.42%),无毒,生物相容性好,易被生物体吸收和代谢;
[0041]
2、本发明提供一种上述光治疗的nir-ii小分子、化合物、配合物在近红外二区的肿瘤成像中的应用。
[0042]
3、本发明提供一种上述光治疗的nir-ii小分子、化合物、配合物在制备抗肿瘤药物中的应用。
[0043]
4、本发明提供一种上述光治疗的nir-ii小分子、化合物、配合物的制备方法,其合成路线简单,反应效率高,收率高,具有较高的工业应用前景
附图说明
[0044]
图1为hl-peg
2k
的maldi-tof-ms表征;
[0045]
图2为hl-peg
2k
的高效液相色谱表征;
[0046]
图3为h7-peg
2k
和hl-peg2k在水溶液(10μm)中的吸光度和荧光发射;
[0047]
图4为hl-peg
2k
和icg在h2o、fbs和pbs中光稳定性;
[0048]
图5为hl-peg
2k
的光稳定性;
[0049]
图6为hl-peg
2k
对u87细胞的细胞毒性;
[0050]
图7为hl-peg
2k
的光热转换效率;
[0051]
图8为hl-peg
2k
的细胞凋亡和细胞周期试验;其中,(a)不同处理组(对照组、激光照射、hl-peg2k(60μm)、hl-peg2k(60μm) 激光照射和顺铂(60μm))处理u87 mg细胞的am和pi(比例尺:200μm)染色;(b)流式细胞术分析对照组、激光照射、hl-peg2k(60μm)、hl-peg2k(60μm)处理的u87 mg细胞凋亡;(c)流式细胞术的定量分析结果;(d)流式细胞仪分析对照组、激光照射、hl-peg2k(60μm)、hl-peg2k(60μm)加激光照射和顺铂(60μm)处理的u87 mg细胞的细胞周期;
[0052]
图9为hl-peg
2k
处理u87细胞的活死细胞染色;
[0053]
图10为hl-peg
2k
处理u87细胞后j-聚集体的测定;
[0054]
图11为hl-peg
2k
处理u87细胞后nadh的测定;
[0055]
图12为hl-peg
2k
处理u87细胞后的免疫印迹分析;
[0056]
图13为hl-peg
2k
在胶质瘤模型小鼠中的荧光成像和cptt。(a)卧位(808nm,90mw cm-2
,1000lp,30ms)的hl-peg2k在皮下/原位胶质瘤模型中的近红外图像及其定量信号强度;(b)hl-peg2k在仰卧位(808nm,90mw cm-2
,1000lp,30ms)的近红外图像及其定量信号强度;(c)和(d)具有代表性的红外照片和hl-peg2k溶液在808nm激光(1w cm2)照射下对u87 mg荷瘤小鼠的体内加热曲线;(e)u87 mg小鼠模型切除肿瘤重量;(f)分别用pbs、激光(1w cm2,5min)、顺铂(200μl,2mg/kg pt)和hl-peg2k(200μl,2mg/kg ru)照射808nm激光(1w cm2,5min)后的小鼠平均重量;(g)分别用pbs、激光(1w cm2,5min)、顺铂(200μl,2mg/kg pt)和hl-peg2k(200μl,2mg/kg ru)照射808nm激光(1w cm2,5min)后的小鼠相对肿瘤体积;
[0057]
图14为hl-peg
2k
的生物相容性分析;
[0058]
图15为hl-peg
2k
在不同ph缓冲液中的荧光信号;
[0059]
图16为hl-peg
2k
在胶质瘤模型鼠中主要器官的荧光成像;
[0060]
图17为治疗过程中的小鼠照片;
[0061]
图18为在预定时间内采集小鼠血液的hl-peg
2k
荧光强度;
[0062]
图19为hl-peg
2k
的tem图像和dls;
[0063]
图20为hl-peg
2k
的光热曲线;
[0064]
图21为ir-26(ir系列染料),h7-peg
2k
,hl-peg
2k
在二氯甲烷中的量子产率。
具体实施方式
[0065]
下面将结合实施例对本发明的方案进行解释。本领域技术人员将会理解,下面的实施例仅用于说明本发明,而不应视为限定本发明的范围。实施例中未注明具体技术或条件的,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。以下实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行,使用的方法如无特别说明,均为本领域公知的常规方法,使用的耗材和试剂如无特别说明,均为市场购得。除非另有说明,本文中所用的专业与科学术语与本领域熟练人员所熟悉的意义相同。此外,任何与所记载内容相似或均等的方法或材料也可应用于本发明中。
[0066]
以下实施例1~3为光治疗的nir-ii小分子(化合物3)的合成方法,反应式如下所示:
[0067]
实施例1:化合物2的合成
[0068]
化合物2的制备方法包括如下步骤:
[0069]
在化合物1、4,7-二溴-5,6-二硝基苯并噻二唑(296.7mg,0.77mmol)和k2co3(342mg,2.5mmol)的溶液中,加入pd(pph3)4(89.3mg,0.077mmol),在氮气保护下,115℃油浴中搅拌。反应结束后,将混合物冷却并用水(100ml)稀释,用ea(50ml
×
3)提取,通过常规操作进一步纯化,得到紫红色化合物2(160mg,产率20%)。1h nmr(400mhz,cdcl3)δ7.45
–
7.39(m,4h),7.33(dd,j=20.2,12.8hz,5h),7.25
–
7.09(m,17h),4.24
–
4.18(m,4h),2.97(t,j=7.8hz,4h),2.65(t,j=7.8hz,4h),1.06
–
0.96(m,4h),0.07(s,18h).
13
c nmr(101mhz,cdcl3)δ173.1,153.2,149.8,146.7,144.8,142.3,137.0,130.2,129.6,129.5,127.8,
126.2,125.8,124.3,122.1,120.4,62.8,36.0,30.4,17.3,1.4.
[0070]
实施例2:化合物h7的合成
[0071]
化合物h7的制备方法包括如下步骤:
[0072]
将实施例1得到的化合物2(80mg,0.076mmol)加入5mldcm和5ml甲醇中,加入95(w/w)%氯化铵(146mg,2.73mmol.)和锌粉(594mg,9.08mmol.)。该混合物在25℃下反应2h,然后过滤,用20mldcm洗涤滤饼,滤液旋转干燥得到黄色粗品(80mg),直接用于后续合成。1,10-菲咯啉-5,6-二酮(20mg,0.09mmol)和上述粗品溶于5ml醋酸中,在120℃油浴中回流4h,然后在旋转蒸发器下冷却和浓缩,得到残留物。通过对上述残渣的提纯,得到了理想的绿色固体化合物h7(35mg,收率39.3%)。1h nmr(400mhz,cdcl3)δ9.23-9.21(m,4h),8.00(d,j=8.4hz,4h),7.70(dd,j=7.7,4.6hz,2h),7.39-7.29(m,12h),7.28-7.25(m,4h),7.21-7.19(m,4h),7.12(t,j=6.8hz,2h),4.20(t,j=7.8hz,4h),2.97(t,j=7.8hz,4h),2.65(t,j=7.8hz,4h),0.99(t,j=7.8hz,4h),0.04(s,18h).
13
c nmr(101mhz,cdcl3)δ173.1,153.0,152.9,149.4,148.3,147.5,145.6,142.1,137.3,136.2,134.4,134.1,129.5,129.4,129.2,128.1,127.9,125.6,125.2,124.6,123.6,121.1,62.8,36.1,30.5,17.3,1.4.
[0073]
实施例3:光治疗的nir-ii小分子化合物3的合成
[0074]
化合物h7-peg
2k
的制备方法包括如下步骤:
[0075]
将1ml的tfa缓慢加入2ml的实施例2得到的h7(10mg,8.54mmol)的dcm溶液中,在0℃下,将上述混合物在室温下保存30min。粗品经浓缩后即得到化合物3,即为光治疗的nir-ii小分子。
[0076]
以下实施例4为以h7-peg2k为示例说明光治疗的nir-ii化合物的合成方法
[0077]
反应式如下所示:
[0078][0079]
实施例4:化合物h7-peg
2k
的合成
[0080]
在实施例3所得的光治疗的nir-ii小分子(10mg,10.3μmol)的250μl二甲基亚砜溶液中加入nh
2-peg-ome(61.8mg,30.9μmol,m.w.2000,ponsure biotechnology),dipea (13.3mg,103.2μmol),hatu(39.2mg,103.2μmol)。上述溶液在25℃下搅拌6h,然后用amicon ultra-0.5ml 3.5k(洗6次)纯化。得到绿色化合物h7-peg2k,收率83%(42.2mg)。h7-peg2k的纯度采用高效液相色谱柱(thermo science hypersil gold c8)进行分析。1h nmr(400mhz,cdcl3)δ9.32(d,j=8.2hz,2h),9.25(s,2h),8.07(d,j=8.7hz,4h),7.79(s,3h),7.42
–
7.30(m,12h),7.24(m,j=8.1hz,6h),7.14(t,j=6.8hz,2h),6.59(s,2h),3.66(m,354h),3.40(s,6h),3.04
–
2.96(t,4h),2.61
–
2.52(t,4h),2.27
–
2.20(t,4h).
[0081]
以下实施例5为以hl-peg
2k
为示例说明光治疗的nir-ii配合物的合成方法
[0082]
反应式如下所示:
[0083][0084]
实施例5:hl-peg
2k
的合成
[0085]
hl-peg
2k
的制备方法包括如下步骤:
[0086]
称取实施例3制备得到的化合物h7-peg
2k
(10mg,2.03μmol)、ru(bpy)2cl2(7.8mg,16.21μmol)置于单口烧瓶中,加入2ml 50(v/v)%甲醇,90℃回流8~10小时,浓缩去除溶剂,残渣用hplc纯化得到hl-peg
2k
(5.8mg,产率53%)。图1为hl-peg
2k
的maldi-tof-ms表征。图2为hl-peg
2k
的高效液相色谱表征。图3为h7-peg
2k
和hl-peg2k在水溶液(10μm)中的吸光度和荧光发射。测得hl-peg
2k
的最大发射波长为1028nm,并拖尾至1400nm。由此证明了上述纳米颗粒具有近红外二区发射特性,可以用于近红外二区的成像研究。图15为hl-peg
2k
在不同ph缓冲液中的荧光信号。图19为hl-peg
2k
的tem图像和dls;图20为hl-peg
2k
的光热曲线;图21为ir-26,h7-peg
2k
,hl-peg
2k
在二氯甲烷中的量子产率。hl-peg
2k
在水溶液中的量子产率为0.42%
[0087]
实施例6
[0088]
以下实验为实施例5得到的hl-peg
2k
的光稳定性试验。
[0089]
hl-peg
2k
的光稳定性试验。
[0090]
具体步骤如下:
[0091]
将hl-peg
2k
、icg(吲哚菁绿)分别溶解在fbs、h2o和pbs中。用808nm激光(180mw cm2)连续照射60min,用imagej软件计算荧光强度,比较各组的时间依赖性荧光强度。
[0092]
图4为hl-peg
2k
和icg在h2o、fbs和pbs中光稳定性比较图。由图可知,808nm激光持续照射不同介质中的hl-peg
2k
纳米颗粒及icg一小时,激光功率密度为0.09w/cm2,icg在pbs、水及胎牛血清中的荧光信号发生明显的衰减,而hl-peg
2k
纳米颗粒的荧光信号保持良好。上述结果表明所制备的hl-peg
2k
较icg具有优越的光稳定性。图5为hl-peg
2k
的光稳定性结果图。
[0093]
实施例7
[0094]
以下实验为实施例5得到的hl-peg
2k
对u87细胞的细胞毒试验。
[0095]
hl-peg
2k
对u87细胞的细胞毒试验。
[0096]
具体步骤如下:
[0097]
u87 mg细胞接种于96孔板上,在细胞培养箱中培养12h,然后分别用含有hl-peg
2k
、顺铂的细胞培养液更换细胞培养液。24h后用cck-8比色法分别测定hl-peg
2k
、激光照射下hl-peg
2k
、顺铂处理下细胞培养的存活率。
[0098]
图6为hl-peg
2k
、激光照射下hl-peg
2k
、顺铂对u87细胞的细胞毒试验比较结果图。由图可知,hl-peg
2k
的细胞毒性显著低于顺铂。
[0099]
实施例8
[0100]
以下实验为实施例5得到的hl-peg
2k
的光热性质。
[0101]
hl-peg
2k
的光热性质。
[0102]
具体步骤如下:
[0103]
取hl-peg
2k
样品300μl置于ep管中,用808nm激光对其进行持续照射,待其温度达到恒温时,撤去激光光源,此过程同时用光热相机记录样品的温度,每隔30s记录一次,并绘制升温冷却曲线。同时测试该样品的紫外吸收发射曲线,记录808nm下的吸光度a808。光热转换效率(η)通过下列方程计算得到:
[0104][0105]
其中,hs可以通过hs=mc/τ公式计算得到,m指测试样品的质量,c指水的比热容,τ是冷却系数,可以通过冷却曲线与温度的关系拟合得到,δtmax是指最高温度与环境温度的差值,qs为纯水的散热量,因纯水样品升温不明显,此处可以忽略不计。a808为该样品在808nm处的吸光度。将上述结果代入公式即可得到hl-peg
2k
的光热转换效率。图7为hl-peg
2k
的光热转换效率。由图可知,hl-peg
2k
的光热转化效率为41.77%。
[0106]
实施例9
[0107]
以下实验为实施例5得到的hl-peg
2k
的细胞凋亡和细胞周期试验。
[0108]
hl-peg
2k
的细胞凋亡和细胞周期试验。
[0109]
具体步骤如下:
[0110]
用含60μm hl-peg
2k
和60μm顺铂的新型dmem培养液,在有或无808nm激光照射的条件下,以1w cm2激光功率密度照射u87 mg细胞5min,在细胞培养箱中孵育12h,用含60μmhl-peg
2k
和60μm顺铂的新型dmem培养液培养24h。然后收集细胞并保存在pbs中。用annexin v-fitc/pi凋亡试剂盒(中国多科学公司)和pi细胞周期染色试剂盒(中国多科学公司)分别对上述细胞进行染色,用beckman cytexpert流式细胞仪检测细胞凋亡和细胞周期。图8为hl-peg
2k
的细胞凋亡和细胞周期试验。其中,(a)不同处理组(对照组、激光照射、hl-peg
2k
(60μm)、hl-peg2k(60μm) 激光照射和顺铂(60μm))处理u87 mg细胞的am和pi(比例尺:200μm)染色;(b)流式细胞术分析对照组、激光照射、hl-peg
2k
(60μm)、hl-peg
2k
(60μm)处理的u87 mg细胞凋亡;(c)流式细胞术的定量分析结果;(d)流式细胞仪分析对照组、激光照射、hl-peg
2k
(60μm)、hl-peg
2k
(60μm)加激光照射和顺铂(60μm)处理的u87 mg细胞的细胞周期。
[0111]
实施例10
[0112]
以下实验为实施例5得到的hl-peg
2k
处理u87细胞后的活死细胞染色实验。
[0113]
hl-peg
2k
处理u87细胞后的活死细胞染色实验。
[0114]
具体步骤如下:
[0115]
用测定缓冲液洗涤细胞,用60μm hl-peg2k和60μm顺铂处理24h,激光照射808nm。
然后将所有样本的细胞培养物分块,用多聚甲醛进一步固定细胞10min。随后,用含钙黄绿素-am/pi试剂盒的100μl工作液对细胞进行温和洗涤和染色。u87 mg细胞在细胞培养箱(37℃)中培养30min后,用倒置荧光显微镜(美国奥林巴斯)检测活/死细胞。图9为不同处理组(对照组、激光照射、顺铂(60μm)、hl-peg
2k
(60μm)和hl-peg
2k
(60μm) 激光照射)处理u87细胞后的活死细胞染色比较结果图。
[0116]
实施例11
[0117]
以下实验为实施例5得到的hl-peg
2k
处理u87细胞后的线粒体膜电位测定。
[0118]
hl-peg
2k
处理u87细胞后的线粒体膜电位测定。
[0119]
具体步骤如下:
[0120]
u87 mg细胞分别用60μm hl-peg
2k
和60μm顺铂处理24h后,分别用功率密度为1w/cm2的808nm激光照射5min,收集细胞样本,用pbs洗涤,再用jc-1暗处理0.5h。随后,用火花荧光微板仪(tecan)检测上述细胞样品中代表jc-1单体的绿色荧光和代表j-聚集体的红色荧光的强度。通过计算各组的红色/绿色荧光强度下降率,进一步得到基质金属蛋白酶(mmp)。图10为不同处理组(对照组、激光照射、顺铂(60μm)、hl-peg
2k
(60μm)和hl-peg
2k
(60μm) 激光照射)处理u87细胞后j-聚集体的测定比较结果图。
[0121]
实施例12
[0122]
以下实验为实施例5得到的hl-peg
2k
处理u87细胞后细胞内nadh的测定。
[0123]
hl-peg
2k
处理u87细胞后细胞内nadh的测定。
[0124]
具体步骤如下:
[0125]
u87 mg细胞经60μm hl-peg2k和60μm顺铂处理24h后,在有无808nm、功率密度为1w cm-2的激光照射下照射5min后,分别注入细胞裂解液中等量的nad /nadh检测试剂(beyotime,china)。在25℃下保存10min,用火花荧光微板仪测定荧光强度。图11为不同处理组(对照组、激光照射、顺铂(60μm)、hl-peg
2k
(60μm)和hl-peg
2k
(60μm) 激光照射)处理u87细胞后nadh的测定比较结果图。
[0126]
实施例13
[0127]
以下实验为实施例5得到的hl-peg
2k
处理u87细胞后的免疫印迹分析。
[0128]
hl-peg
2k
处理u87细胞后的免疫印迹分析。
[0129]
具体步骤如下:
[0130]
每组细胞培养用冷的pbs洗3次,然后加入100μl的裂解缓冲液。将裂解液在冰中孵育半小时,以12000
×
g离心25min提取蛋白,并用bca法测定其含量。然后将蛋白质样本加载到凝胶上进行分离。然后将凝胶转移到滤膜上,最后用5%的脱脂牛奶封闭滤膜,并与下列抗体孵育:β-actin(1:10000,中国蛋白质技术公司),bax(1:10000,蛋白质技术公司,中国),bcl-2(1:2500,蛋白质技术公司,中国),c-caspase-3(1:1000,美国)和相应的二抗(1:10000,蛋白质技术公司,中国)。然后用增强型ecl试剂处理薄膜,并在漂洗后进一步显影。图12为不同处理组(对照组、激光照射、hl-peg2k(60μm)、hl-peg2k(60μm) 激光照射和顺铂(60μm))处理u87细胞后的免疫印迹分析。
[0131]
实施例14
[0132]
以下实验为实施例5得到的hl-peg
2k
在小鼠体内的荧光成像。
[0133]
hl-peg
2k
在小鼠体内的荧光成像。
[0134]
具体步骤如下:
[0135]
用戊巴比妥钠溶液(50mg/kg)麻醉u87 mg肿瘤模型小鼠,麻醉后固定在激光照射下,尾静脉注射hl-peg
2k
探针(200μl,2mg/kg ru),在808nm激光(90mw cm2)照射下,用不同的波长滤光片(1000nm和1250nm)俯卧位在预定时间点进行nir-ii成像。图13为hl-peg
2k
在胶质瘤模型小鼠中的荧光成像和cptt。其中,(a)卧位(808nm,90mw cm-2,1000lp,30ms)的hl-peg2k在皮下/原位胶质瘤模型中的近红外图像及其定量信号强度;(b)hl-peg2k在仰卧位(808nm,90mw cm-2
,1000lp,30ms)的近红外图像及其定量信号强度;(c)和(d)具有代表性的红外照片和hl-peg2k溶液在808nm激光(1w cm2)照射下对u87 mg荷瘤小鼠的体内加热曲线。
[0136]
实施例15
[0137]
以下实验为实施例5得到的hl-peg
2k
在活体nir-ii图像引导下的cptt。
[0138]
hl-peg
2k
在活体nir-ii图像引导下的cptt。图13(e)u87 mg小鼠模型切除肿瘤重量;(f)分别用pbs、激光(1w cm2,5min)、顺铂(200μl,2mg/kg pt)和hl-peg2k(200μl,2mg/kg ru)照射808nm激光(1w cm2,5min)后的小鼠平均重量;(g)分别用pbs、激光(1w cm2,5min)、顺铂(200μl,2mg/kg pt)和hl-peg2k(200μl,2mg/kg ru)照射808nm激光(1w cm2,5min)后的小鼠相对肿瘤体积。图17为治疗过程中的小鼠照片。图16为hl-peg
2k
在胶质瘤模型鼠中主要器官的荧光成像;图18为在预定时间内采集小鼠血液的hl-peg
2k
荧光强度。
[0139]
具体步骤如下:
[0140]
将u87 mg小鼠随机分为5组(n=4):(a)对照组,(b)808nm激光组,(c)顺铂注射组(200μl,2mg/kg pt),(d)hl-peg
2k
注射组(200μl,2mg/kg ru),(e)hl-peg2k注射组(200μl,2mg/kg ru),给予808nm激光照射。(b)、(e)组在注射后12h用功率密度为1w/cm2的808nm激光连续照射肿瘤5min。在整个治疗期间(22d),每隔4d用数字卡尺分别测量小鼠肿瘤的长度和宽度。并按下列公式计算肿瘤体积(mm3)。肿瘤体积=长
×
宽2/2。从上述肿瘤模型中分离出脏器,用组织固定液固定,he染色分析。
[0141]
图14为hl-peg
2k
的生物相容性分析。通过静脉注射进行急性毒性试验。分别给予pbs(200μl)、hl-peg
2k
(200μl,2mg/kg ru)、顺铂(200μl,2mg/kg pt),每组3只。治疗7d后处死小鼠,he染色观察组织病理学改变。pbs或hl-peg
2k
组未见明显炎性病变或损伤,而顺铂组可见肾小管上皮细胞水肿,胞浆疏松或空泡化。此外,还分析了生化指标以评估肝和肾的毒性。各组alp、alt、ast、t-bil无显著性差异,但顺铂组bun(反映肾功能不全的敏感指标)较对照组降低约6.49倍,提示顺铂引起严重肾功能不全。而hlpeg
2k
治疗组未见异常指标。注射后3d,分别以1mg/kg ru和2mg/kg ru处理icr小鼠,每组3只,每2d记录一次体重,与对照组比较差异无统计学意义(p》0.05)。研究表明,hl-peg2k具有不可忽略的毒性和良好的药代动力学特性。
[0142]
尽管上面已经示出和描述了本发明的实施例,可以理解的是,上述实施例是示例性的,不能理解为对本发明的限制,本领域的普通技术人员在本发明的范围内可以对上述实施例进行变化、修改、替换和变型,均应包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。