1.本发明涉及药物递送载体、使用所述药物递送载体来制备药物制剂的方法、以及由此制备的药物制剂。具体地,本发明的药物递送载体包含穿膜肽修饰的阳离子脂质体和阳离子材料,其中穿膜肽修饰的阳离子脂质体包含与聚乙二醇磷脂共价键合的穿膜肽。使用本发明的药物递送载体能够制备共递送多种治疗剂的药物制剂,所述药物制剂的粒径介于50nm至300nm,稳定性好,能够将多种治疗剂同时递送至相同的病灶部位,使多种治疗剂发挥协同的治疗作用,显著提高了治疗效果。
背景技术:
2.穿膜肽(cell-penetrating peptide,cpp)是一种生理条件下带正电荷的短肽,能够共价或非共价连接基因、多肽和蛋白质等药物分子,并将药物分子递送至细胞内或携载药物分子穿透生物膜屏障。但是,单个穿膜肽携载药物分子的能力非常有限,这导致穿膜肽与药物分子所形成的复合物粒径较大且稳定性差。
3.此外,现有技术中递送药物分子(如,基因、多肽和蛋白质等药物分子)的载体如脂质体存在不易穿透生物膜屏障、递送效率低而且疗效不理想等问题。在脂质体的研究领域,如何改善脂质体穿透生物膜屏障的能力,并利用脂质体同时包载多种不同的治疗药物,更高效地递送多种药物分子至相同的病灶部位,发挥多种药物的协同作用、提高疾病的治疗效果仍然是一个巨大的挑战。
4.因此,本领域仍需要新的利用穿膜肽的药物递送载体,用于共递送多种治疗剂,并在多种治疗剂同时递送至相同的病灶部位后,治疗剂发挥协同作用来提高治疗效果。
5.发明概述
6.本发明人通过锐意研究,开发了一种新的利用穿膜肽的药物递送载体,其包含穿膜肽修饰的阳离子脂质体和阳离子材料,其中穿膜肽修饰的阳离子脂质体包含与聚乙二醇磷脂共价键合的穿膜肽,所述阳离子材料选自带正电的多聚氨基酸、聚乙烯亚胺(pei)、penetratin或penetratin的衍生物、聚酰胺-胺(pamam)。
7.在一个实施方案中,本发明的药物递送载体中的穿膜肽是具有下述氨基酸序列的penetratin或penetratin的亲脂性衍生物:
8.rx1ikiwfx2x3rrmkwkk(seq id no:1)
9.其中,x1、x2和x3独立地选自天然来源的氨基酸谷氨酰胺(glutamine,q)、天冬酰胺(asparagine,n)、丙氨酸(alanine,a)、缬氨酸(valine,v)、亮氨酸(leucine,l)、异亮氨酸(isoleucine,i)、脯氨酸(proline,p)、苯丙氨酸(phenylalanine,f)、色氨酸(tryptophan,w)、甲硫氨酸(methionine,m)和非天然来源的氨基酸α-氨基丁酸(α-aminobutyric acid)、α-氨基戊酸(α-aminopentanoic acid)、α-氨基己酸(α-aminohexanoic acid)、α-氨基庚酸(α-aminoheptanoic acid)。例如,本发明的药物递送载体中的一些穿膜肽是将penetratin第2位谷氨酰胺(q)和/或第8位谷氨酰胺(q)和/或第9位天冬酰胺(n)突变为疏水性氨基酸的penetratin衍生物。
10.在一个实施方案中,本发明的药物递送载体中的穿膜肽修饰的阳离子脂质体包含如下膜材料:
11.(i)阳离子脂质,包括但不限于:1,2-二-o-十八烯基-3-三甲基铵丙烷(dotma);二甲基双十八烷基铵(ddab);1,2-二油酰基-3-三甲基铵-丙烷(dotap);1,2-二油酰基-3-二甲基铵-丙烷(dodap);1,2-二酰氧基-3-二甲基铵丙烷;1,2-二烷氧基-3-二甲基铵丙烷;双十八烷基二甲基氯化铵(dodac)、1,2-二肉豆蔻酰氧基丙基-1,3-二甲基羟乙基铵(dmrie)和2,3-二油酰氧基-n-[2(精胺甲酰胺)乙基]-n,n-二甲基-1-丙烷三氟乙酸铵(dospa)及其组合。优选为dotma、dotap、dodac和dospa。最优选为dotap;
[0012]
(ii)非阳离子脂质,包括但不限于:1,2-二-(9z-十八酰基)-sn-甘油基-3-磷酸乙醇胺(dope)、1,2-二油酰基-sn-甘油基-3-磷酸胆碱(dopc)、1,2-二硬脂酰基-sn-甘油-3-磷酸胆碱(dspc)、1,2-二棕榈酰基-sn-甘油-3-磷酸胆碱(dppc)、1,2-二棕榈酰基-sn-甘油-3-磷酸乙醇胺(dppe)、1,2-二肉豆蔻酰基-sn-甘油-3-磷酸乙醇胺(dmpe)、2-二油酰基-sn-甘油-3-磷酸-(1
’-
rac-甘油)(dopg)及其组合。优选为dope和/或dopc。最优选为dope;
[0013]
(iii)胆固醇;和
[0014]
(iv)聚乙二醇化(peg化)的磷脂和与cpp共轭的聚乙二醇磷脂,所述磷脂例如是磷脂酰胆碱、磷脂酰乙醇胺、磷脂酰肌醇和鞘磷脂,优选地,所述peg化磷脂是例如聚乙二醇-二硬脂酰基磷脂酰乙醇胺(peg-dspe)和其衍生物甲氧基-聚乙二醇-二硬脂酰基磷脂酰乙醇胺(mpeg-dspe)),所述与cpp共轭的聚乙二醇磷脂是例如penetratin/penetratin衍生物-peg-dspe。
[0015]
在本发明中,未经穿膜肽修饰的阳离子脂质体有时也简称为阳离子脂质体(缩写为cls),其包含上述膜材料(i)、(ii)和(iii)。
[0016]
在一些实施方案中,膜材料(i):(ii):(iii):(iv)的摩尔比为约20-40:20-40:20-40:1-20,且与cpp共轭的聚乙二醇磷脂占膜材料(iv)中的约20%-80%摩尔比。在一些具体的实施方案中,膜材料(i):(ii):(iii):(iv)的摩尔比为约27.0-31.6:27.0-31.6:31.6-39.6:1-10,且与cpp共轭的聚乙二醇磷脂占膜材料(iv)中的约20%-80%摩尔比。
[0017]
在一些具体的实施方案中,本发明的药物递送载体中的穿膜肽修饰的阳离子脂质体包含如下膜材料:(i)dotap;(ii)dope;(iii)胆固醇;(iv)mpeg
2000-dspe和
89w
penetratin-peg
3400-dspe,且膜材料(i):(ii):(iii):(iv)的摩尔比为约20-40:20-40:20-40:1-20,且
89w
penetratin-peg
3400-dspe占膜材料(iv)中的约20%-80%摩尔比。在一些实施方案中,膜材料(i):(ii):(iii):(iv)的摩尔比为约27.0-31.6:27.0-31.6:31.6-39.6:1-10,且
89w
penetratin-peg
3400-dspe占膜材料(iv)中的约20%-80%摩尔比。在一些实施方案中,本发明的药物递送载体中的阳离子脂质体由如下膜材料组成:(i)dotap;(ii)dope;(iii)胆固醇;(iv)mpeg
2000-dspe和
89w
penetratin-peg
3400-dspe,且膜材料(i):(ii):(iii):(iv)的摩尔比为约28.5:28.5:38:5,
89w
penetratin-peg
3400-dspe占膜材料(iv)中的约20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%摩尔比。
[0018]
在另一个方面,本发明提供了一种用于共递送多种治疗剂的药物制剂,所述多种治疗剂包含至少一种非核酸治疗剂和至少一种核酸治疗剂,其是使用本发明的药物递送载
体制备的。
[0019]
在一个实施方案中,通过将药物递送载体中包含的阳离子材料和至少一种核酸治疗剂混合形成阳离子材料-至少一种核酸治疗剂的物理复合物;
[0020]
通过将阳离子脂质体的膜材料和至少一种非核酸治疗剂制备包载了至少一种非核酸治疗剂的脂质体;
[0021]
将所述阳离子材料-至少一种核酸治疗剂的物理复合物与所述包载了至少一种非核酸治疗剂的脂质体混合制备脂质复合物;
[0022]
将所述脂质复合物进行穿膜肽修饰来制备所述药物制剂,例如将所述脂质复合物与聚乙二醇化(peg化)磷脂和与穿膜肽共轭的聚乙二醇磷脂混合进行穿膜肽修饰来制备所述药物制剂。
[0023]
在一个实施方案中,通过将药物递送载体中包含的阳离子材料和至少一种核酸治疗剂混合形成阳离子材料-至少一种核酸治疗剂的物理复合物;
[0024]
通过将穿膜肽修饰的阳离子脂质体的所有膜材料和至少一种非核酸治疗剂制备包载了至少一种非核酸治疗剂的脂质体;
[0025]
将所述阳离子材料-至少一种核酸治疗剂的物理复合物与所述包载了至少一种非核酸治疗剂的脂质体混合制备所述药物制剂。
[0026]
对欲递送的至少一种非核酸治疗剂没有特别的限定,包括但不限于化疗剂,例如,铂类药物(例如,顺铂、卡铂、奥沙利铂)、紫杉烷类药物(例如,紫杉醇、多西他赛(dtx))、依托泊苷、伊立替康、培美曲塞、吉西他滨、美法伦、卡莫司汀(bcnu)、阿霉素(dox)、硼替佐米、甲氨蝶呤、伊马替尼、博来霉素、长春花生物碱类(例如,长春花碱)。
[0027]
对欲递送的至少一种核酸治疗剂也没有特别的限定,包括但不限于质粒dna、rna如小干扰rna(sirna)、mirna、有义rna、反义寡核苷酸(aso)、适配体(aptamers)、核酶等的核酸治疗剂,例如,所述核酸治疗剂是针对脑部疾病例如脑部肿瘤(例如,脑胶质瘤)的rna,如,针对c-myc的sirna。
[0028]
在一个实施方案中,所述药物制剂中的非核酸治疗剂(例如,化疗药)与阳离子脂质体中的阳离子脂质(例如,dotap)的摩尔比为约1:1500至2000:1,例如,约1:1200、1:1000、1:500、1:200、1:100、1:5、5:1、100:1、200:1、500:1、1000:1、1200:1、1400:1、1600:1、1800:1;优选地约1:1000至2000:1,进一步优选地约1:500至500:1。
[0029]
在一个实施方案中,所述药物制剂中的阳离子材料(例如,寡聚精氨酸、pei、penetratin或penetratin的衍生物、pamam)和核酸治疗剂的电荷比介于1:1至30:1,例如,1:1、5:1、10:1、15:1、20:1、25:1、30:1。
[0030]
在一个实施方案中,所述药物制剂中的阳离子脂质体与核酸治疗剂的电荷比介于1:1至30:1,例如,2:1、3:1、4:1、5:1、6:1、8:1、10:1、12:1。
[0031]
在一个实施方案中,所述药物制剂对非核酸治疗剂(例如,化疗药)的载药量为:非核酸治疗剂(例如,化疗药)占药物制剂的约0.01%-40%(w/w),优选约0.02%-25%(w/w)。在一个具体的实施方案中,所述药物制剂对多西他赛(dtx)的载药量为0.04%w/w。
[0032]
在一个实施方案中,所述药物制剂中的阳离子材料(例如,寡聚精氨酸、pei、penetratin或penetratin的衍生物、pamam)和欲递送的核酸治疗剂的电荷比介于1:1至30:1,优选5:1;且阳离子脂质体与核酸治疗剂的电荷比介于1:1至30:1,优选4:1。
[0033]
在一个实施方案中,本发明的药物制剂具有介于50nm至300nm的粒径,优选具有介于80nm至150nm的粒径,且稳定性好,能够对所包含的多种治疗剂提供更好的保护,也更有利于将sirna和药物递送至病变部位的深部组织。
[0034]
在又一个方面,提供了本发明的药物制剂的制备方法,包括
[0035]
(a)将本发明的药物递送载体中包含的阳离子材料和至少一种核酸治疗剂混合形成阳离子材料-至少一种核酸治疗剂的物理复合物;
[0036]
(b)使用阳离子脂质体的膜材料和至少一种非核酸治疗剂制备包载了至少一种非核酸治疗剂的脂质体;
[0037]
(c)将所述阳离子材料-至少一种核酸治疗剂的物理复合物与所述包载了至少一种非核酸治疗剂的脂质体混合制备脂质复合物;和
[0038]
(d)将所述脂质复合物用聚乙二醇化(peg化)磷脂和与穿膜肽共轭的聚乙二醇磷脂修饰。
[0039]
备选地,提供了本发明的药物制剂的制备方法,包括
[0040]
(a)将本发明的药物递送载体中包含的阳离子材料和至少一种核酸治疗剂混合形成阳离子材料-至少一种核酸治疗剂的物理复合物;
[0041]
(b)使用穿膜肽修饰的阳离子脂质体的所有膜材料和至少一种非核酸治疗剂制备包载了至少一种非核酸治疗剂的脂质体;
[0042]
(c)将所述阳离子材料-至少一种核酸治疗剂的物理复合物与所述包载了至少一种非核酸治疗剂的脂质体混合制备所述药物制剂。
[0043]
使用本发明的药物递送载体制备的药物制剂能够例如通过口腔、鼻腔、眼、呼吸道、消化道、生殖道、局部植入、注射或输注(经由硬膜外、动脉内、关节内、囊内、心内、脑室内、颅内、皮内、肌内、眶内、眼内、腹膜内、脊柱内、胸骨内、鞘内、静脉内、蛛网膜下、被膜下、皮下、气管、直肠、舌下等途径)施用,用于治疗和/或预防疾病。
[0044]
除非另外限定,否则本文中所用的全部技术与科学术语具有如本发明所属领域的普通技术人员通常理解的相同含义。本文所提及的全部出版物、专利申请、专利和其他参考文献通过引用的方式完整地并入本文作为参考。此外,本文中所述的材料、方法和例子仅是说明性的并且不意在是限制性的。本发明的其他特征、目的和优点将从本说明书及附图并且从后附的权利要求书中显而易见。
[0045]
附图简述:
[0046]
图1:阳离子材料/sirna复合物的琼脂糖凝胶电泳结果。左侧为r8(8聚精氨酸)与sirna不同电荷比(图中的数值表示正电荷/负电荷的比例)的琼脂糖凝胶电泳照片,右侧为penetratin与sirna不同电荷比(图中的数值表示正电荷/负电荷的比例)的琼脂糖凝胶电泳照片。
[0047]
图2:阳离子材料/sirna复合物的琼脂糖凝胶电泳结果。左侧为cls与sirna不同电荷比(图中的数值表示正电荷/负电荷的比例)的琼脂糖凝胶电泳结果,右侧为pei与sirna不同电荷比(图中的数值表示正电荷/负电荷的比例)的琼脂糖凝胶电泳结果。
[0048]
图3:pamam与sirna不同电荷比(图中的数值表示正电荷/负电荷的比例)的琼脂糖凝胶电泳结果。
[0049]
图4:r8与sirna不同电荷比(图中横坐标的数值表示正电荷/负电荷的比例)的粒
径结果。
[0050]
图5:r8与sirna不同电荷比(图中横坐标的数值表示正电荷/负电荷的比例)的电势结果。
[0051]
图6:penetratin与sirna不同电荷比(图中横坐标的数值表示正电荷/负电荷的比例)的粒径结果。
[0052]
图7:penetratin与sirna不同电荷比(图中横坐标的数值表示正电荷/负电荷的比例)的电势结果。
[0053]
图8:pei与sirna不同电荷比(图中横坐标的数值表示正电荷/负电荷的比例)的粒径结果。
[0054]
图9:pei与sirna不同电荷比(图中横坐标的数值表示正电荷/负电荷的比例)的电势结果。
[0055]
图10:cls与sirna不同电荷比(图中横坐标的数值表示正电荷/负电荷的比例)的粒径结果。
[0056]
图11:cls与sirna不同电荷比(图中横坐标的数值表示正电荷/负电荷的比例)的电势结果。
[0057]
图12:pamam与sirna不同电荷比(图中横坐标的数值表示正电荷/负电荷的比例)的粒径结果。
[0058]
图13:pamam与sirna不同电荷比(图中横坐标的数值表示正电荷/负电荷的比例)的电势结果。
[0059]
图14:cls/阳离子材料/sirna复合物的粒径。第一组:cls/sirna复合物,cls/pei/sirna脂质体复合物,pei/sirna复合物;第二组:cls/sirna复合物,cls/penetratin/sirna脂质体复合物,penetratin/sirna复合物;第三组:cls/sirna复合物,cls/pamam/sirna脂质体复合物,pamam/sirna复合物。
[0060]
图15:cls/阳离子材料/sirna复合物放置过程中的粒径变化。
[0061]
图16:显示了表面修饰有不同比例穿膜肽的药物制剂的细胞摄取定量评价结果,其中,lipo2000组为市售基因转染试剂阳离子脂质体lipofectamine 2000与sirna的非共价复合物。
[0062]
图17:显示了细胞对使用实施例7表2中所示的不同配方的穿膜肽修饰的脂质体膜材料制备的药物制剂的摄取情况。
[0063]
图18:显示了组分(iv)占穿膜肽修饰的脂质体膜材料的1%、5%、8%、10%摩尔份数的脂质体药物制剂的粒径。
[0064]
图19:显示了r8与sirna电荷比为1:1的情况下,细胞对cls与sirna不同电荷比制备的cls/r8/sirna脂质体复合物的摄取。
[0065]
图20:显示了使用不同寡聚精氨酸的药物制剂对luc-u87细胞的转染效果的定性评价和定量评价结果。
[0066]
图21:显示了包载sirna的药物制剂对bend.3细胞和u87细胞的促凋亡效果评价和细胞毒性评价结果。
[0067]
图22:显示了各化疗药物和基因药物的半数抑制浓度ic
50
值测定结果。
[0068]
图23:显示了基因药物联用不同化疗药物的体外抗肿瘤药效学评价结果。
[0069]
图24:显示了基因药物和不同化疗药物联用的联合指数和剂量减少指数结果。
[0070]
图25:显示了基因药物联用不同化疗药物的体外抗肿瘤药效学筛选结果。
[0071]
图26:显示了基因药物联用化疗药物多西他赛(dtx)的本发明药物制剂的体外抗肿瘤药效学结果。
[0072]
图27:显示了细胞膜荧光探针did标记的载体包载fam-sirna后被u87细胞和calu-3细胞摄取的结果。
[0073]
图28:显示了基因药物联用化疗药物多西他赛(dtx)的本发明药物制剂对u87细胞的促凋亡能力评价结果。
[0074]
图29:基因药物联用化疗药物多西他赛(dtx)的本发明药物制剂抗u87脑原位瘤的药效学评价结果。
[0075]
图30:基因药物联用化疗药物多西他赛(dtx)的本发明药物制剂抗u87脑原位瘤的药效学实验中的动物体重曲线。
[0076]
发明详述:
[0077]
本发明提供了一种新型的药物递送载体,其包含穿膜肽修饰的阳离子脂质体和阳离子材料,其中所述阳离子材料选自带正电的多聚氨基酸、pei、penetratin或penetratin的衍生物、pamam。在使用所述药物递送载体制备包含至少一种非核酸治疗剂和至少一种核酸治疗剂的药物制剂的过程中,药物递送载体中包含的阳离子材料对核酸治疗剂进行一次压缩(compact),药物递送载体中包含的阳离子脂质体对阳离子材料-至少一种核酸治疗剂的物理复合物进行二次压缩,使得阳离子材料-至少一种核酸治疗剂的物理复合物的粒径均显著减小、稳定性显著提高,且脂质体表面修饰的具有穿膜功能的穿膜肽帮助药物制剂穿透受试者体内的生物膜屏障。
[0078]
本发明的药物递送载体具有很强的携载多种药物、递送多种药物以及组织穿透的能力,且组织毒性低,可通过多种施用途径将多种药物分子高效递送至受试者体内的目标部位,克服因受试者的生物膜屏障导致的多种药物难以到达目标部位的技术问题,增强联合使用多种药物治疗疾病的有效性、且具有良好的生物安全性。本发明因此还提供了使用所述药物递送载体制备的用于共递送多种治疗剂的药物制剂。
[0079]
本发明的药物递送载体的各种特征在下面进行了讨论。
[0080]
如本文中所用,术语“约”旨在是指定值的
±
10%的调整。例如,术语“约5%”旨在包含4.5%至5.5%的范围。
[0081]
如本文中所用,术语“包含”或“包括”意指包括所述的要素、整数或步骤,但是不排除任意其他要素、整数或步骤。
[0082]
如本文中所用,术语“阳离子材料”意指选自带正电的多聚氨基酸、pei、penetratin或penetratin的衍生物、pamam的阳离子材料。
[0083]
i.表面修饰有穿膜肽的脂质体的膜材料:
[0084]
如本文所用的术语“脂质体”是指由脂质双层组成的人工制备的囊泡。不限制本发明中被穿膜肽修饰的脂质体的类型,可以是能够形成脂质囊泡并包载药物的任何脂质体。
[0085]
如本文所用的术语“脂质”是指疏水或两性小分子,例如,但不限于脂肪酸、磷脂、甘油酯、甘油磷脂、鞘脂、糖脂或聚酮化合物(polyketide)。
[0086]
在一些实施方案中,本发明的表面修饰有穿膜肽的阳离子脂质体包含如下膜材
料:
[0087]
(i)阳离子脂质:
[0088]
脂质体包含一种或多种阳离子脂质。如本文中所用,术语“阳离子脂质”是在选择的ph(例如生理ph)下具有净正电荷的脂质。许多阳离子脂质是商业可获得的。用于脂质体中的特别合适的阳离子脂质包括国际专利公开wo 2010/053572和wo 2012/170930中描述的那些阳离子脂质,所述两篇专利文献均以引用的方式并入本文作为参考。
[0089]
对脂质体中包含的阳离子脂质没有特别的限制,只要是在选择的ph(例如生理ph)下具有净正电荷的脂质均可使用,例如但不限于:1,2-二-o-十八烯基-3-三甲基铵丙烷(dotma);二甲基双十八烷基铵(ddab);1,2-二油酰基-3-三甲基铵-丙烷(dotap);1,2-二油酰基-3-二甲基铵-丙烷(dodap);1,2-二酰氧基-3-二甲基铵丙烷;1,2-二烷氧基-3-二甲基铵丙烷;双十八烷基二甲基氯化铵(dodac)、1,2-二肉豆蔻酰氧基丙基-1,3-二甲基羟乙基铵(dmrie)和2,3-二油酰氧基-n-[2(精胺甲酰胺)乙基]-n,n-二甲基-1-丙烷三氟乙酸铵(dospa)及其组合。优选的阳离子脂质为dotma、dotap、dodac和dospa。最优选的阳离子脂质为dotap。
[0090]
(ii)非阳离子脂质:
[0091]
脂质体包含一种或多种非阳离子脂质。如本文中所用,术语“非阳离子脂质”指任何中性、两性离子或阴离子脂质。如本文中所用,术语“阴离子脂质”指在选择的ph,例如生理ph下携带净负电荷的许多脂质物质中的任一种。
[0092]
对脂质体中包含的非阳离子脂质没有特别的限制,可使用任何中性、两性离子或阴离子脂质,例如但不限于:1,2-二-(9z-十八酰基)-sn-甘油基-3-磷酸乙醇胺(dope)、1,2-二油酰基-sn-甘油基-3-磷酸胆碱(dopc)、1,2-二硬脂酰基-sn-甘油-3-磷酸胆碱(dspc)、1,2-二棕榈酰基-sn-甘油-3-磷酸胆碱(dppc)、1,2-二棕榈酰基-sn-甘油-3-磷酸乙醇胺(dppe)、1,2-二肉豆蔻酰基-sn-甘油-3-磷酸乙醇胺(dmpe)、2-二油酰基-sn-甘油-3-磷酸-(1
’-
rac-甘油)(dopg)及其组合。优选的非阳离子脂质为dope和/或dopc。最优选的非阳离子脂质为dope。
[0093]
(iii)胆固醇:
[0094]
胆固醇是构成哺乳动物细胞膜的一种重要组成成分,占细胞膜脂类的20%以上。术语“胆固醇”在本文中以最广意义使用并且涵盖胆固醇衍生物。研究表明,温度高时,胆固醇能阻止细胞膜双分子层的无序化;温度低时,胆固醇又可干扰细胞膜双分子层的有序化,阻止液晶的形成,保持细胞膜双分子层的流动性。
[0095]
考虑到胆固醇在脂质体膜双分子层中的重要性,本发明的阳离子脂质体也包含胆固醇。
[0096]
(iv)peg化磷脂和与cpp共轭的聚乙二醇磷脂
[0097]
脂质体包含peg化磷脂和与cpp共轭的聚乙二醇磷脂。在本文中,peg化磷脂不包含连接有cpp的聚乙二醇磷脂。
[0098]
peg化磷脂是将磷脂共价键合一个或多个聚乙二醇分子(peg)而形成。peg化磷脂包括但不限于长度高达10kda的聚乙二醇链,例如,1kda、2kda、3kda、4kda、5kda、6kda、7kda、8kda、9kda、10kda、以及它们之间的任何值的聚乙二醇链,其与磷脂共价键合。所述磷脂可以是合成的、半合成的或天然的磷脂,例如是磷脂酰胆碱、磷脂酰乙醇胺、磷脂酰肌醇
和鞘磷脂。在一些实施方案中,所述peg化磷脂是例如聚乙二醇-二硬脂酰基磷脂酰乙醇胺(peg-dspe)和其衍生物甲氧基-聚乙二醇-二硬脂酰基磷脂酰乙醇胺(mpeg-dspe),其中peg的分子量为1kda-10kda之间的任何值。
[0099]
与cpp共轭的聚乙二醇磷脂是将cpp共价键合至聚乙二醇磷脂而形成。
[0100]
本发明中使用的cpp不仅包括野生型多肽penetratin(氨基酸序列:rqikiwfqnrrmkwkk(seq id no:2)),还包括其一系列亲脂性衍生物,例如,将penetratin第2位谷氨酰胺(q)和/或第8位谷氨酰胺(q)和/或第9位天冬酰胺(n)突变为疏水性氨基酸的penetratin衍生物。在一些实施方案中,penetratin亲脂性衍生物是中国发明专利申请cn201710414334.7中公开的那些衍生物,所述衍生物已被证明经结膜囊内滴眼给药后,可促进药物穿过诸多眼部吸收屏障(角膜、结膜、巩膜等)进入眼内,甚至将其携带的基因、多肽和蛋白质等生物大分子药物递送至眼后段的视网膜部位。中国发明专利申请cn201710414334.7中公开的penetratin亲脂性衍生物的氨基酸序列此处引述如下:
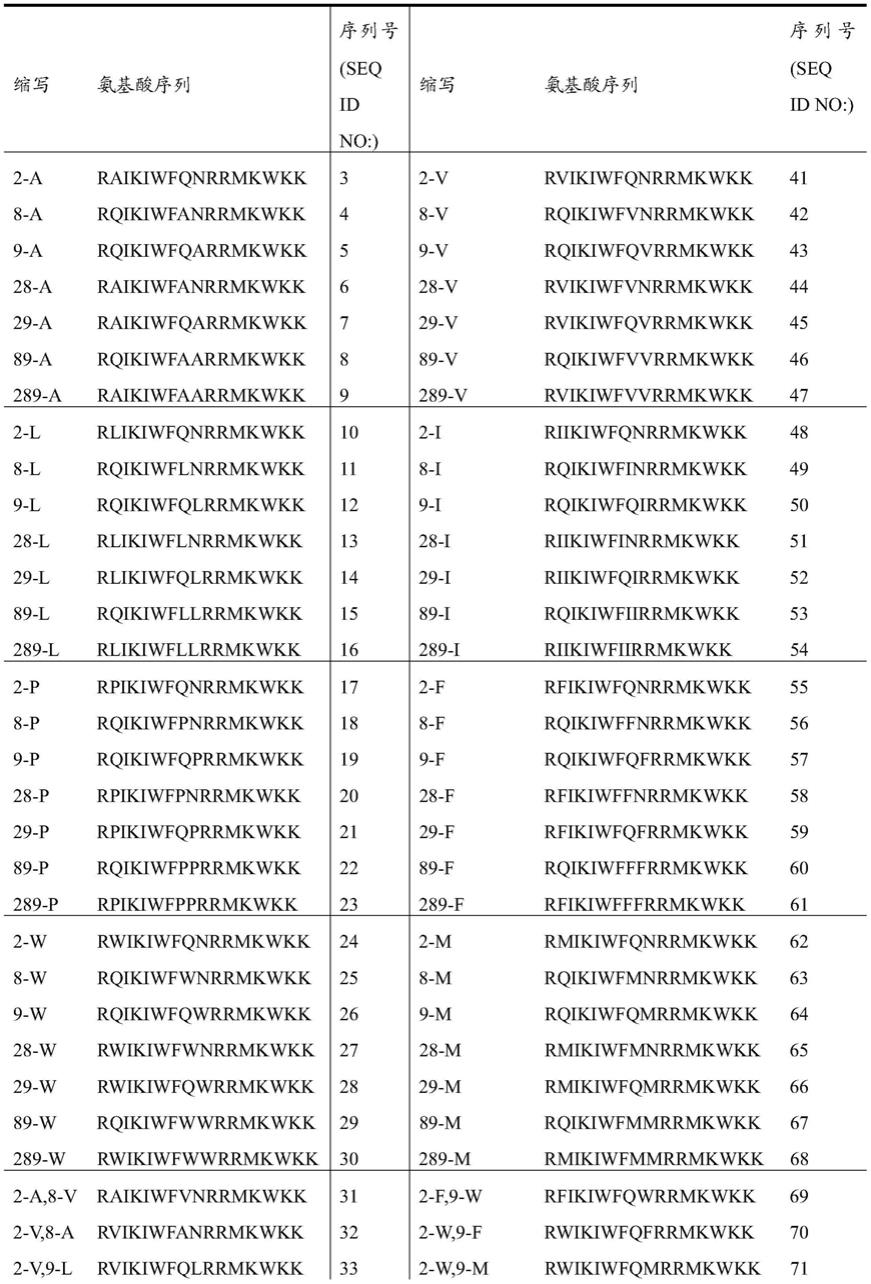
[0101]
表1:penetratin衍生物的氨基酸序列
[0102]
[0103][0104]
根据本发明,cpp是通过与聚乙二醇磷脂共价键合而被连接至作为脂质体的脂质双层的一部分的化合物。在本文中,术语“作为脂质体的脂质双层的一部分”旨在表明cpp-peg-磷脂中的所述磷脂被整合到脂质双层中的事实。所述磷脂可以是合成的、半合成的或天然的磷脂,例如是磷脂酰胆碱、磷脂酰乙醇胺、磷脂酰肌醇和鞘磷脂。
[0105]
cpp-peg-磷脂中的聚乙二醇链包括但不限于长度高达10kda的聚乙二醇链,例如,1kda、2kda、3kda、4kda、5kda、6kda、7kda、8kda、9kda、10kda、以及它们之间的任何值的聚乙二醇链,其两端分别与磷脂和与cpp共价键合。在一些实施方案中,所述与cpp共轭的聚乙二醇磷脂是例如penetratin/penetratin衍生物-peg-dspe,其中peg的分子量为1kda-10kda之间的任何值。
[0106]
本发明将cpp修饰在阳离子脂质体的表面,旨在增强药物递送载体在组织中的穿透能力,由此帮助携带多种药物分子的脂质体到达目标部位,从而发挥疾病的治疗和/或预防效果。
[0107]
在一些实施方案中,穿膜肽修饰的脂质体膜材料(iv)中peg化磷脂和与cpp共轭的聚乙二醇磷脂中的聚乙二醇链长不相等,且与cpp共轭的聚乙二醇磷脂中的聚乙二醇链较peg化磷脂中的聚乙二醇链更长,例如,更长0.5kda-5kda之间,优选地更长0.75kda-4kda之间,更优选地更长1kda-2kda之间的任何值。在一个实施方案中,穿膜肽修饰的脂质体膜材料(iv)中peg化磷脂的聚乙二醇链长分别是约1kda、2kda、3kda,与cpp共轭的聚乙二醇磷脂的聚乙二醇链长分别是约2.5kda、3.5kda、4.5kda。
[0108]
在一些实施方案中,本发明的表面修饰有穿膜肽的阳离子脂质体的膜材料(i):(ii):(iii):(iv)的摩尔比为约20-40:20-40:20-40:1-20,且与cpp共轭的聚乙二醇磷脂占膜材料(iv)中的约20%-80%摩尔比,对应于占总的穿膜肽修饰的脂质体膜材料中的约2%-8%摩尔比。在一些实施方案中,膜材料(i):(ii):(iii):(iv)的摩尔比为约27.0-31.6:27.0-31.6:31.6-39.6:1-10,且与cpp共轭的聚乙二醇磷脂占膜材料(iv)中的约20%-80%摩尔比,对应于占总的穿膜肽修饰的脂质体膜材料中的约2%-8%摩尔比。
[0109]
在一些具体的实施方案中,本发明的药物递送载体中的阳离子脂质体包含如下膜材料:(i)dotap;(ii)dope;(iii)胆固醇;(iv)peg-dspe(例如,mpeg
2000-dspe)和penetratin/penetratin衍生物-peg-dspe(例如,
89w
penetratin-peg
3400-dspe),且膜材料(i):(ii):(iii):(iv)的摩尔比为约20-40:20-40:20-40:1-20,且penetratin/penetratin衍生物-peg-dspe(例如,
89w
penetratin-peg
3400-dspe)占膜材料(iv)中的约20%-80%摩尔比。在一些实施方案中,膜材料(i):(ii):(iii):(iv)的摩尔比为约27.0-31.6:27.0-31.6:31.6-39.6:1-10,且penetratin/penetratin衍生物-peg-dspe(例如,
89w
penetratin-peg
3400-dspe)占膜材料(iv)中的约20%-80%摩尔比。在一些实施方案
中,本发明的药物递送载体中的阳离子脂质体由如下膜材料组成:(i)dotap;(ii)dope;(iii)胆固醇;(iv)mpeg
2000-dspe和
89w
penetratin-peg
3400-dspe,且膜材料(i):(ii):(iii):(iv)的摩尔比为约28.5:28.5:38:5,
89w
penetratin-peg
3400-dspe占膜材料(iv)中的约20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%摩尔比。
[0110]
ii.阳离子材料
[0111]
本发明的药物递送载体中包含的阳离子材料用于压缩核酸治疗剂。所述阳离子材料选自带正电的多聚氨基酸、聚乙烯亚胺(pei)、penetratin或penetratin的衍生物、聚酰胺-胺(pamam)。
[0112]
在一些实施方案中,所述阳离子材料是带正电的多聚氨基酸,其是在选择的ph(例如生理ph)下具有净正电荷的多聚氨基酸。对多聚氨基酸中氨基酸残基的聚合度没有特别的限制,例如聚合度为2-50的带正电的多聚氨基酸(即,带正电的多聚氨基酸具有2-50个氨基酸残基),例如聚合度为6-12的精氨酸和/或赖氨酸,任选地在所述聚合度为2-50的带正电的多聚氨基酸中间插有1-20个(例如1-6个)生理条件下不带电荷的氨基酸残基。带正电的多聚氨基酸可以是线性或环形,且氨基酸残基的构型包括l型和d型。优选地,所述带正电的多聚氨基酸是聚合度为6-12的多聚精氨酸,其中所述多聚精氨酸的空间结构包括线性和环形,多聚精氨酸的构型包括l型和d型。
[0113]
在一些实施方案中,带正电的多聚氨基酸是寡聚精氨酸(oligo-arginine),包括线性的多肽,例如6聚精氨酸(氨基酸序列为rrrrrr,r6(seq id no:85))、8聚精氨酸(氨基酸序列为rrrrrrrr,r8(seq id no:86))、10聚精氨酸(氨基酸序列为rrrrrrrrrr,r10(seq id no:87))、12聚精氨酸(氨基酸序列为rrrrrrrrrrrr,r12(seq id no:88)),以及环化的多肽,例如环化的6聚精氨酸(c-r6)、环化的8聚精氨酸(c-r8)、环化的10聚精氨酸(c-r10)、环化的12聚精氨酸(c-r12),以及不同构型的多肽,例如l型寡聚精氨酸和d型寡聚精氨酸如6聚d-精氨酸(氨基酸序列为rrrrrr,d-r6)、8聚d-精氨酸(氨基酸序列为rrrrrrrr,d-r8)、10聚d-精氨酸(氨基酸序列为rrrrrrrrrr,d-r10)、12聚d-精氨酸(氨基酸序列为rrrrrrrrrrrr,d-r12)。
[0114]
以下描述了使用本发明的药物递送载体来制备共递送多种治疗剂的药物制剂的方法,并描述了药物制剂的特征。
[0115]
通过使用本发明的药物递送载体,能够制备出cpp修饰在阳离子脂质体的表面、在组织中的穿透能力强的共递送多种治疗剂的药物制剂。
[0116]
在一个实施方案中,本发明的药物制剂的制备方法为:
[0117]
(1)称取上述本发明的脂质体的膜材料,其中膜材料(i):(ii):(iii):(iv)摩尔比为约20-40:20-40:20-40:1-20,且与cpp共轭的聚乙二醇磷脂占膜材料(iv)中的约20%-80%摩尔比,对应于占总的穿膜肽修饰的脂质体膜材料中的约2%-8%摩尔比,以及至少一种非核酸治疗剂。
[0118]
(2)将膜材料(i):(ii):(iii):(iv),以及至少一种非核酸治疗剂加入有机溶剂中溶解,然后蒸发除去有机溶剂,获得均匀的干燥脂质膜。
[0119]
(3)将所得的干燥脂质膜用含水溶液水化完全后,使用微型挤出器挤出脂质体(过核孔膜的顺序依次是200nm、100nm和50nm)。
[0120]
(4)将阳离子材料(例如,带正电的多聚氨基酸、pei、penetratin或penetratin的
衍生物、pamam)与至少一种核酸治疗剂在合适的溶液中混合并孵育,获得阳离子材料-至少一种核酸治疗剂的物理复合物。
[0121]
(5)以一定的摩尔比或电荷比混合上述(3)获得的脂质体和上述(4)获得的阳离子材料-至少一种核酸治疗剂的物理复合物,得到脂质体复合物形式的包含至少一种非核酸治疗剂和至少一种核酸治疗剂的药物制剂。
[0122]
又在一个实施方案中,本发明的药物制剂的制备方法为:
[0123]
(1)称取上述本发明的脂质体的膜材料,其中膜材料(i):(ii):(iii):(iv)摩尔比为约20-40:20-40:20-40:1-20,且与cpp共轭的聚乙二醇磷脂占膜材料(iv)中的约20%-80%摩尔比,对应于占总的穿膜肽修饰的脂质体膜材料中的约2%-8%摩尔比。
[0124]
(2)将膜材料(i):(ii):(iii),以及至少一种非核酸治疗剂加入有机溶剂中溶解,然后蒸发除去有机溶剂,获得均匀的干燥脂质膜。
[0125]
(3)将所得的干燥脂质膜用含水溶液水化完全后,使用微型挤出器挤出脂质体(过核孔膜的顺序依次是200nm、100nm和50nm)。
[0126]
(4)将阳离子材料(例如,带正电的多聚氨基酸、pei、penetratin或penetratin的衍生物、pamam)与至少一种核酸治疗剂在合适的溶液中混合并孵育,获得阳离子材料-至少一种核酸治疗剂的物理复合物。
[0127]
(5)以一定的摩尔比或电荷比混合上述(3)获得的脂质体和上述(4)获得的阳离子材料-至少一种核酸治疗剂的物理复合物,然后与膜材料(iv)混合并孵育,获得本发明的药物制剂。
[0128]
对欲递送的至少一种非核酸治疗剂没有特别地限定,所述非核酸治疗剂包括广泛类型的递送至受试者的化合物,包括但不限于:抗感染药如抗生素和抗病毒药;镇痛药和镇痛药组合;食欲抑制药;驱蠕虫药;抗关节炎药;平喘药;抗惊厥药;抗抑郁药;抗糖尿病药;止泻药;抗组胺药;抗炎药;抗偏头痛制剂;止恶心药;抗肿瘤药;抗震颤麻痹药;止痒药;抗精神药;退热药;解痉药;抗胆碱能药;拟交感神经药;黄嘌呤衍生物;心血管制剂包括钾通道阻滞剂、钙通道阻滞剂、β-阻滞剂、α-阻滞剂和抗心律失常药;抗高血压药;利尿药和抗利尿药;血管舒张药包括全身神经、心神经、周围神经和脑神经、中枢神经系统的兴奋剂、血管抑制药;咳嗽和感冒制剂,包括减充血药;激素,如雌二醇和其它固醇类,包括皮质类固醇;催眠药;免疫抑制药;肌肉松弛药;副交感神经阻滞药;精神兴奋剂;镇静药和安定药。本发明的药物递送载体可以递送例如处于离子化的、非离子化的、游离碱、酸加成盐等所有形式的药物,可以递送高分子量或低分子量药物。
[0129]
对欲递送的至少一种核酸治疗剂也没有特别的限定,包括但不限于质粒dna、rna如小干扰rna(sirna)、mirna、有义rna、反义寡核苷酸(aso)、适配体(aptamers)、核酶等的核酸治疗剂,例如,所述核酸治疗剂是针对脑部疾病例如脑部肿瘤(例如,脑胶质瘤)的rna,如,针对c-myc的sirna。
[0130]
本发明的药物制剂可通过口腔、鼻腔、眼、呼吸道、消化道、生殖道、局部植入、注射或输注(经由硬膜外、动脉内、关节内、囊内、心内、脑室内、颅内、皮内、肌内、眶内、眼内、腹膜内、脊柱内、胸骨内、鞘内、静脉内、蛛网膜下、被膜下、皮下、气管、直肠、舌下等途径)施用。
[0131]
可使用本领域已知的医学设备来施用本发明的药物制剂。例如,在一个实施方案
中,可用无针头皮下注射设备,例如美国专利号5,399,163中公开的设备来施用本发明的药物制剂。
[0132]
在一个实施方案中,使用本发明的药物递送载体制备了共递送化疗药物和核酸药物sirna的药物制剂,由此发挥协同地治疗癌症的作用。
[0133]
化学疗法直到现在仍是最常用的癌症治疗之一。但是,由于化疗药物主动靶向分裂细胞(癌细胞的一个特征),健康的分裂细胞如血细胞、以及肠、口腔和毛发中的细胞也受影响,化疗药物因此会产生很强的副作用。科学家一直致力于改善化疗药物的施用和组合,以最小化这些副作用。
[0134]
另外,核酸治疗剂在治疗疾病(例如,癌症)的用途中引起了极大的关注。尽管它们在癌症治疗中具有潜能,但是由于核酸治疗剂可能容易受到环境中普遍存在的酶的攻击而降解,另外,核酸自身不能进入细胞,并且现有递送系统仅具有低的递送效率。
[0135]
使用本发明的药物递送载体能够最小化化疗药物的副作用,以及高效地使核酸治疗剂进入细胞,且核酸治疗剂不易受到环境中普遍存在的酶的攻击。
[0136]
在一个实施方案中,将本发明的共递送化疗药物和核酸药物sirna的药物制剂经鼻给药,由鼻脑通路将化疗药物和核酸药物sirna高效递送进入脑部,所述化疗药物和核酸药物sirna被脑部肿瘤细胞摄取后能够借助穿膜肽和阳离子脂质体的表面正电荷实现内涵体逃逸,将化疗药物和核酸药物sirna释放到细胞质中,发挥化学杀伤和基因治疗脑部肿瘤(例如,脑胶质瘤)的作用。
[0137]
本领域技术人员公知,脑部特殊的生理结构及功能上的复杂性,特别是血脑屏障的存在以及某些药物自身的理化性质,使治疗药物通常难以达到脑组织。然而,经鼻入脑的给药途径为脑部疾病的治疗提供了可行性的思路,药物经鼻腔入脑的直接通路有两条,一条是嗅神经通路,这是经鼻入脑绕过血脑屏障最直接的方法,药物经鼻黏膜吸收,经嗅神经摄取后,通过轴突运输至嗅球,进一步抵达嗅脑的过程。第二条是鼻黏膜上皮通路,药物穿过基膜进入固有层,进一步到达周围嗅神经,进而转运至中枢神经系统,最终实现在脑部的蓄积。由于经鼻入脑给药具有无创伤性,因此患者的顺应性良好(agrawal m等人,nose-to-brain drug delivery:an update on clinical challenges and progress towards approval of anti-alzheimer drugs,journal of controlled release,2018,281:139-177)。另一方面,脑部肿瘤例如脑胶质瘤是一种中枢神经系统恶性肿瘤,发病率高,生存率低,对人类健康的危害极大,但临床预后并不乐观,主要体现在手术复发、化疗耐药等,且由于存在血脑屏障、血脑肿瘤屏障,全身给药后药物入脑量非常少,因此,一直以来人们都在致力寻找一种有效的药物治疗方式。
[0138]
本发明的共递送化疗药物和核酸药物sirna的药物制剂经鼻给药后,能够将化疗药物和核酸药物sirna同时递送至脑部,协同地发挥对脑部肿瘤的治疗作用。另外,由于可通过经鼻给药途径实现药物的脑内递送,本发明的药物制剂有利于提高患者的顺应性。
[0139]
描述以下实施例以辅助对本发明的理解。不意在且不应当以任何方式将实施例解释成限制本发明的保护范围。
实施例
[0140]
实施例1.阳离子脂质体的制备
[0141]
称取摩尔比为28.5:28.5:38:5的膜材料,即3.5mg的dotap(上海艾韦特医药科技有限公司,132172-61-3)、3.72mg的dope(上海艾韦特医药科技有限公司,4004-05-1)、2.59mg的胆固醇(sigma-aldrich,c8667)和2.46mg的mpeg
2000-dspe(上海艾韦特医药科技有限公司,147867-65-0)。
[0142]
将所述量的dotap、dope、胆固醇置于50ml圆底烧瓶中,加入1ml氯仿,溶解作为脂质膜材料的所述dotap、dope、胆固醇,即16.67μmol的cls含有5μmol的dotap,5μmol的dope,6.67μmol的胆固醇,将所得溶液通过旋转蒸发仪(上海申生科技有限公司,r201l)除去氯仿,获得均匀的干燥脂质膜。
[0143]
将所得的干燥脂质膜用1ml 5%的葡萄糖水溶液通过37℃水浴超声水化约10分钟。待脂质膜水化完全后,使用微型挤出器(hamilton,81320)挤出脂质体(过核孔膜的顺序依次是200nm、100nm和50nm),获得了未经穿膜肽修饰的阳离子脂质体(文中也称为cls)。
[0144]
将所制得的阳离子脂质体与2.46mg的mpeg
2000-dspe(溶于水)混合后置于55℃孵育半小时,获得了包含mpeg
2000-dspe的阳离子脂质体。
[0145]
实施例2.阳离子材料对基因药物的压缩作用
[0146]
琼脂糖凝胶电泳实验常用于测定药物递送载体中包含的阳离子材料对药物如核酸的包载能力。在本实施例中,制备了r8/sirna复合物、penetratin/sirna复合物,cls/sirna复合物,pei/sirna复合物,pamam/sirna复合物,通过琼脂糖凝胶电泳实验分别测定了r8、penetratin、cls、聚乙烯亚胺(polyethylenlmlne,pei,分子量为25000)和3代聚酰胺-胺(pamam)对核酸的包载能力。
[0147]
将33μg的sirna(在本实施例中,使用的是针对c-myc的小干扰rna,下文中缩写为sirna,其有义链(5'-3')为aacguuagcuucaccaacadtdt(seq id no:79),反义链(5'-3')为uguuggugaagcuaacguudtdt(seq id no:80))溶于125μl的depc处理水中制备20μm的sirna溶液。
[0148]
将寡聚精氨酸r8(上海昕浩生物科技有限公司)、penetratin(上海昕浩生物科技有限公司)、实施例1制备得到的cls、pei(西格玛奥德里奇(上海)贸易有限公司)、pamam(威海晨源分子新材料有限公司)分别溶于纯水,与sirna按照一定电荷比混合,涡旋30s,置于37℃条件下孵育30分钟后得到r8/sirna复合物、penetratin/sirna复合物、cls/sirna复合物、pei/sirna复合物、pamam/sirna复合物。
[0149]
将上述制备的r8/sirna复合物、penetratin/sirna复合物、cls/sirna复合物、pei/sirna复合物、pamam/sirna复合物分别小心加入琼脂糖凝胶加样孔中,并设置游离sirna对照组,进行电泳。电泳结束后,用gelred工作液(biotium inc.)避光泡染30分钟,在紫外302nm波长条件下进行凝胶成像。结果如图1-图3所示。
[0150]
将上述制备的r8/sirna复合物、penetratin/sirna复合物、cls/sirna复合物、pei/sirna复合物、pamam/sirna复合物分别进行粒径测定和ζ电势测定。采用动态光散射技术直接测量粒径。采用ζ电势分析仪,在23℃使用5v/cm的电场强度、0.4cm的电极间距在水中测量ζ电势。结果如图4-图13所示。
[0151]
由于r8的一个氨基氮带一个正电荷,sirna的一个磷酸根带一个负电荷,1μm的r8含8μm的氨基氮,即1μm的r8含8μm的正电荷,1μm的sirna含有42μm的磷酸根,即1μm的sirna含42μm的负电荷,r8与sirna的电荷比=(r8的μm值
×
8)/(sirna的μm值
×
42)=0.19
×
r8(μ
m)/sirna(μm)。
[0152]
由于penetratin的一个氨基氮带一个正电荷,sirna的一个磷酸根带一个负电荷,1μm的penetratin含7μm的氨基氮,即1μm的penetratin含7μm的正电荷,1μm的sirna含有42μm的磷酸根,即1μm的sirna含42μm的负电荷,penetratin与sirna的电荷比=(penetratin的μm值
×
7)/(sirna的μm值
×
42)=0.17
×
penetratin(μm)/sirna(μm)。
[0153]
由于dotap的一个氨基氮带一个正电荷,sirna的一个磷酸根带一个负电荷,16.67μm的cls含5μm的dotap,即1μm的cls含0.3μm的正电荷,1μm的sirna含42μm的负电荷,cls与sirna的电荷比=(cls的μm值
×
0.3)/(sirna的μm值
×
42)=0.007
×
cls(μm)/sirna(μm)。
[0154]
由于pei的一个氨基氮带一个正电荷,其重复结构单体中每2个碳原子就连接有含氮原子的伯胺和仲胺,即pei中每43分子量对应一个n原子,sirna的一个磷酸根带一个负电荷,sirna的平均分子量为13300,1m的sirna含有42m的磷酸根,即sirna中每317分子量对应一个磷酸根,pei与sirna的电荷比=(pei的质量mg)/(sirna的质量mg)
×
(317/43)=7.37
×
pei(mg)/sirna(mg)。
[0155]
由于pamam的一个氨基氮带一个正电荷,sirna的一个磷酸根带一个负电荷,根据文献中的公式,pamam与sirna的电荷比=1.53
×
pamam(mg)/sirna(mg)。
[0156]
实施例3.使用阳离子脂质体二次压缩后的粒径和电势表征
[0157]
使用实施例2中制备的penetratin/sirna复合物、pei/sirna复合物和pamam/sirna复合物分别与cls制备脂质体复合物。具体而言,取8μl penetratin/sirna复合物、pei/sirna复合物和pamam/sirna复合物分别与2.67μl的16.67μm实施例1制备的阳离子脂质体cls混合,涡旋30s,置于37℃条件下孵育30分钟,得到脂质体复合物cls/penetratin/sirna、cls/pei/sirna和cls/pamam/sirna。在所述脂质体复合物cls/penetratin/sirna、cls/pei/sirna和cls/pamam/sirna中,以sirna的电荷数为基准,阳离子脂质体cls与sirna的电荷比固定为4(由于dotap的一个氨基氮带一个正电荷,sirna的一个磷酸根带一个负电荷,16.67μm的cls含5μm的dotap,即1μm的cls含0.3μm的正电荷,1μm的sirna含42μm的负电荷,cls与sirna的电荷比=(cls的μm值
×
0.3)/(sirna的μm值
×
42)=0.007
×
cls(μm)/sirna(μm))。
[0158]
将上述制备的脂质体复合物cls/penetratin/sirna、cls/pei/sirna和cls/pamam/sirna分别进行粒径测定,并观察脂质体复合物在放置过程中的粒径变化。结果见图14和图15。
[0159]
结果表明,在制备cls/阳离子材料/sirna脂质体复合物过程中,经过cls的二次压缩,比单纯的cls/sirna复合物和阳离子材料/sirna复合物的粒径均显著减小。因此cls/阳离子材料/sirna脂质体复合物比单纯的cls/sirna复合物和阳离子材料/sirna复合物更加稳定,能够对sirna和药物提供更好的保护,也更有利于将sirna和药物递送至病变部位的深部组织。
[0160]
实施例4.阳离子脂质体和阳离子材料包载基因药物的药物制剂的制备
[0161]
将4mg的带正电的多聚氨基酸,为寡聚精氨酸r8(上海昕浩生物科技有限公司)作为阳离子材料溶于depc处理水(大连美仑生物技术有限公司,ma0018)中制备4mg/ml寡聚精氨酸r8溶液,将33μg的sirna(在本实施例中,使用的是针对c-myc的小干扰rna,下文实施例中也缩写为sirna,其有义链(5'-3')为aacguuagcuucaccaacadtdt(seq id no:79),反义链
(5'-3')为uguuggugaagcuaacguudtdt(seq id no:80))溶于125μl的depc处理水中制备20μm的sirna溶液。
[0162]
将寡聚精氨酸r8溶液与sirna溶液按照电荷比为5的比例等体积混合(由于r8的一个氨基氮带一个正电荷,sirna的一个磷酸根带一个负电荷,1μm的r8含8μm的氨基氮,即1μm的r8含8μm的正电荷,1μm的sirna含有42μm的磷酸根,即1μm的sirna含42μm的负电荷,r8与sirna的电荷比=(r8的μm值
×
8)/(sirna的μm值
×
42)=0.19
×
r8(μm)/sirna(μm)),涡旋30s,置于37℃条件下孵育30分钟得到r8/sirna复合物。
[0163]
通过将上述制备的r8/sirna复合物和cls混合来制备cls/r8/sirna脂质复合物。具体而言,取8μl r8/sirna复合物(即,4μl sirna溶液和4μl r8溶液制备而得)与2.67μl16.67μm实施例1制备的阳离子脂质体cls混合,涡旋30s,置于37℃条件下孵育30分钟,得到脂质复合物cls/r8/sirna。在所述脂质复合物cls/r8/sirna中,以sirna的电荷数为基准,阳离子脂质体cls与sirna的电荷比固定为4(由于dotap的一个氨基氮带一个正电荷,sirna的一个磷酸根带一个负电荷,16.67μm的cls含5μm的dotap,即1μm的cls含0.3μm的正电荷,1μm的sirna含42μm的负电荷,cls与sirna的电荷比=(cls的μm值
×
0.3)/(sirna的μm值
×
42)=0.007
×
cls(μm)/sirna(μm))。
[0164]
类似地,制备了在所述sirna的有义链5'修饰有羧基荧光素(fam)的fam-sirna溶液和cls/r8/fam-sirna复合物。
[0165]
实施例5.表面修饰的脂质体药物制剂的配制
[0166]
对脂质体药物制剂使用穿膜肽进行表面修饰,获得表面修饰的药物制剂。
[0167]
i.穿膜肽-peg-磷脂的制备:
[0168]
由dspe-聚乙二醇马来酰亚胺(dspe-peg
3400-马来酰亚胺)(laysan bio,146-123)与末端修饰有半胱氨酸的penetratin衍生物(
89w
penetratin-cys)经一步反应制备得到穿膜肽-peg-dspe。
[0169]
具体而言,将20mg dspe-peg
3400-马来酰亚胺溶于1ml n,n-二甲基甲酰胺中,在搅拌状态下向其中加入溶于10ml磷酸缓冲溶液(10mm,ph7.2)介质中的18mg 89w
penetratin-cys,在25℃的条件下继续搅拌过夜使反应完全。反应结束后,将所得混合物在冰浴条件下置于纯水中透析2天,冷冻干燥得到白色絮状物,为
89w
penetratin-peg
3400-dspe。
[0170]
其中,所述多肽
89w
penetratin是penetratin的一种衍生物,具体氨基酸序列为rqikiwfwwrrmkwkk(文中89w表示对penetratin第8位谷氨酰胺和第9位天冬酰胺进行了色氨酸突变的产物)。穿膜肽-peg-dspe中的穿膜肽也可以使用其他penetratin衍生物,具体可参见中国发明专利申请cn201710414334.7。
[0171]
为了便于与聚乙二醇末端基团反应,穿膜肽
89w
penetratin或其他penetratin衍生物的n-端或c-端可以额外添加一个半胱氨酸残基(cysteine,c)。
[0172]
ii.表面修饰的脂质体药物制剂的配制:
[0173]
对于占穿膜肽修饰的脂质体总摩尔数为5%的mpeg
2000-dspe和
89w
penetratin-peg
3400-dspe,分别配制了
89w
penetratin-peg
3400-dspe的摩尔数占mpeg
2000-dspe和
89w
penetratin-peg
3400-dspe的摩尔数为0%、20%、40%、60%、80%、100%的混合物。即,
89w
penetratin-peg
3400-dspe摩尔数分别占总的穿膜肽修饰的脂质体膜材料摩尔数的0%、1%、2%、3%、4%、5%。
[0174]
将实施例4所制得的cls/r8/fam-sirna复合物分别与
89w
penetratin-peg
3400-dspe的摩尔数占mpeg
2000-dspe和
89w
penetratin-peg
3400-dspe的摩尔数为0%、20%、40%、60%、80%、100%的混合物混合后置于55℃孵育半小时,获得表面修饰有0%、1%、2%、3%、4%、5%比例的穿膜肽的脂质体药物制剂,即89w-cls/r8/fam-sirna。
[0175]
实施例6.定量评价细胞对表面修饰有不同比例穿膜肽的药物制剂的摄取
[0176]
将u87细胞(人神经胶质瘤细胞,购自atcc)培养于dmem完全培养基(添加10%fbs和1%青霉素-链霉素)中。取生长状态良好的u87细胞重悬于dmem完全培养基中,按5
×
105个细胞/孔接种到6孔板中,每孔1ml,接种后每天更换新鲜培养液一次,培养2~3天后进行实验。
[0177]
弃去培养液后,无菌pbs洗u87细胞三次,加入1ml实施例5制备的表面修饰有不同比例的穿膜肽的脂质体药物制剂(包载fam标记的sirna)的无血清dmem培养基,37℃、5%co2条件下孵育4h。孵育结束后弃去培养液,用含0.02mg/ml肝素钠的pbs缓冲溶液洗去吸附在孔上或细胞表面的正电性物质。用胰酶将细胞消化下来,重悬于200μl无菌pbs缓冲溶液中,吹打均匀后对每个样品计数细胞,取104个细胞进行流式细胞术检测。使用无血清dmem培养基孵育的细胞作为阴性对照组。所有实验均一式三份实施,结果如图16所示(平均值
±
sd,n=3,*p《0.05,*表示两组之间在统计学上有显著性差异;**p《0.01,***p《0.001,**和***表示两组之间在统计学上有非常显著的差异)。图16横坐标上的“0%、1%、2%、3%、4%、5%”分别表示表面修饰有0%、1%、2%、3%、4%、5%比例的穿膜肽的脂质体药物制剂,即89w-cls/r8/sirna。
[0178]
由图16可见,
89w
penetratin-peg
3400-dspe摩尔数占总的穿膜肽修饰的脂质体膜材料摩尔数的2%、3%、4%时,细胞对表面修饰有所述比例穿膜肽的药物制剂的摄取效果优于市售的基因转染试剂lipo2000。
[0179]
实施例7.定量评价细胞对使用不同配比的穿膜肽修饰的脂质体膜材料制备的药物制剂的摄取
[0180]
将u87细胞(人神经胶质瘤细胞,购自atcc)培养于dmem完全培养基(添加10%fbs和1%青霉素-链霉素)中。取生长状态良好的u87细胞重悬于dmem完全培养基中,按5
×
105个细胞/孔接种到6孔板中,每孔1ml,接种后每天更换新鲜培养液一次,培养2~3天后进行实验。
[0181]
按照实施例5所述方法制备穿膜肽修饰的脂质体膜材料配比如表2所示的药物制剂(包载fam标记的sirna)。
[0182]
表2.穿膜肽修饰的脂质体膜材料的不同配比(以摩尔份数表示,%)
[0183][0184]
将培养的u87细胞弃去培养液后,无菌pbs洗三次。每孔分别加入含有配方1、配方2、配方3制备的脂质体药物制剂的1ml无血清dmem培养基中,37℃、5%co2条件下孵育4h。孵
育结束后弃去培养液,用含0.02mg/ml肝素钠的pbs缓冲溶液洗去吸附在孔上或细胞表面的正电性物质。用胰酶将细胞消化下来,重悬于200μl无菌pbs缓冲溶液中,吹打均匀后对每个样品计数细胞,取104个细胞进行流式细胞术检测。使用无血清dmem培养基孵育的细胞作为阴性对照组。所有实验均一式三份实施,结果如图17所示(平均值
±
sd,n=3,*p《0.05,*表示两组之间在统计学上有显著性差异;**p《0.01,***p《0.001,**和***表示两组之间在统计学上有非常显著的差异)。
[0185]
由图17可见,使用配方1、配方2、配方3制备的脂质体药物制剂均能够被细胞摄取,与对照组比较存在显著性差异,并且其中细胞对使用配方2制备的脂质体药物制剂的摄取效果最佳。
[0186]
实施例8.使用组分(iv)不同配比的穿膜肽修饰的脂质体膜材料制备的药物制剂的粒径
[0187]
按照实施例5所述方法,在穿膜肽修饰的脂质体膜材料的组分(i):组分(ii):组分(iii)的摩尔比为3:3:4时,制备组分(iv)的配比如表3所示的脂质体药物制剂(包载fam标记的sirna)。
[0188]
表3.组分(iv)的不同配比(以摩尔份数表示,%)
[0189][0190]
获得了组分(iv)占穿膜肽修饰的脂质体膜材料的1%、5%、8%、10%摩尔份数的脂质体药物制剂。对所述脂质体药物制剂进行粒径测定。粒径测定结果如图18所示。图18横坐标上的“1%、5%、8%、10%”分别表示组分(iv)占穿膜肽修饰的脂质体膜材料的1%、5%、8%、10%摩尔份数的药物制剂。
[0191]
由图18可见,当组分(iv)占穿膜肽修饰的脂质体膜材料的1%-10%摩尔份数时,药物制剂的粒径在100nm-200nm之间;且随着组分(iv)占穿膜肽修饰的脂质体膜材料的摩尔份数的提高,粒径呈现增大的趋势。
[0192]
实施例9.定量评价细胞对使用阳离子脂质体/sirna的不同电荷比制备的药物制剂的摄取
[0193]
将u87细胞(人神经胶质瘤细胞,购自atcc)培养于dmem完全培养基(添加10%fbs和1%青霉素-链霉素)中。取生长状态良好的u87细胞重悬于dmem完全培养基中,按5
×
105个细胞/孔接种到6孔板中,每孔1ml,接种后每天更换新鲜培养液一次,培养2~3天后进行实验。
[0194]
按照实施例5所述方法,将寡聚精氨酸r8溶液与20μm的fam-sirna溶液按照电荷比为5的比例等体积混合,涡旋30s,置于37℃条件下孵育30分钟得到复合物r8/fam-sirna。取8μl r8/fam-sirna复合物,与制备的阳离子脂质体cls按照脂质体与fam-sirna的电荷比为
2、4、6、8、10、12的比例混合,涡旋30s,获得阳离子脂质体/sirna的不同电荷比的cls/r8/fam-sirna复合物。
[0195]
进一步地,按照实施例5所述方法,获得表面修饰有3%穿膜肽的脂质体药物制剂,即89w-cls/r8/fam-sirna复合物。
[0196]
将培养的u87细胞弃去培养液后,无菌pbs洗三次。每孔分别加入含有阳离子脂质体/sirna的电荷比为2、4、6、8、10、12的药物制剂的1ml无血清dmem培养基,37℃、5%co2条件下孵育4h。孵育结束后弃去培养液,用含0.02mg/ml肝素钠的pbs缓冲溶液洗去吸附在孔上或细胞表面的正电性物质。用胰酶将细胞消化下来,重悬于200μl无菌pbs缓冲溶液中,吹打均匀后对每个样品计数细胞,取104个细胞进行流式细胞术检测。使用无血清dmem培养基孵育的细胞作为阴性对照组。所有实验均一式三份实施,结果如图19所示(平均值
±
sd,n=3,*p《0.05,*表示两组之间在统计学上有显著性差异;**p《0.01,***p《0.001,**和***表示两组之间在统计学上有非常显著的差异)。
[0197]
由图19可见,使用阳离子脂质体/sirna的电荷比为2、4、6、8、10、12制备的药物制剂均能够被细胞摄取,与对照组比较存在显著性差异,并且其中细胞对使用阳离子脂质体/sirna的电荷比为4时制备的脂质体药物制剂的摄取效果最佳。
[0198]
实施例10.包含不同结构类型阳离子材料的药物制剂对luc-u87细胞的转染效果的定性和定量评价
[0199]
选用r8、r10、r12、c-r8、c-r10和c-r12等寡聚精氨酸作为不同结构类型带正电的多聚氨基酸,以所述寡聚精氨酸分别与sirna的电荷比为5,cls与luc-sirna的电荷比为4,按照实施例5制备含有不同寡聚精氨酸的表面修饰有3%比例穿膜肽的脂质体药物制剂,其中使用的luc-sirna有义链(5'-3')为gcugcacucuggcgacauutt(seq id no:83);反义链(5'-3')为aaugucgccagagugcagctt(seq id no:84)。
[0200]
取生长状态良好的u87细胞(购自atcc)按5
×
104个细胞/孔分别接种到48孔板中,接种后每天换液一次,培养2~3天后进行实验。弃去dmem完全培养基后,无菌pbs洗三次,分别加入包载400nm luc-sirna的脂质体药物制剂的无血清dmem培养基,37℃、5%co2条件下孵育4h,然后弃去药液,加入dmem完全培养基继续孵育24小时(文中也称为luc-u87细胞),用含0.02mg/ml肝素钠的pbs缓冲溶液洗去正电性吸附物质,加入萤火虫萤光光素酶底物,在小动物活体荧光/生物发光成像系统(ivis spectrum)内测定荧光强度。利用小动物活体光学成像系统的目的区域(region of interest,roi)定量圈选功能进行定性分析。结果见图20所示。
[0201]
此实施例是为了探究不同结构类型带正电的多聚氨基酸的基因沉默效果,由图20可以发现,改变脂质体药物制剂中的寡聚精氨酸的聚合度和结构对基因的沉默作用没有显著影响。
[0202]
实施例11.包载sirna的递送载体对bend.3细胞和u87细胞的促凋亡能力评价:
[0203]
取dmem培养基中对数期生长状态良好的bend.3细胞和u87细胞(均购自atcc)按5
×
104/孔的浓度分别铺于12孔板中,在37℃、5%co2条件下培养至细胞单层铺满板底。
[0204]
弃去培养液,无菌pbs缓冲液洗3次后,加入400μl含400nmol/l sirna的实施例5制备的药物制剂(89w-cls/r8/sirna),即,寡聚精氨酸与sirna的电荷比为5,cls与sirna的电荷比为4,表面修饰有3%比例
89w
penetratin-peg
3400-dspe的药物制剂,细胞培养箱中孵育
6h后,弃去药液,无菌pbs缓冲液洗3次后,加入完全培养基1ml继续培养18h,之后收集细胞,先用pbs清洗,无edta的胰酶消化1分钟,dmem培养液终止消化后收集细胞至离心管中,按照细胞凋亡检测试剂盒(南京凯基生物科技发展有限公司,kga108)的步骤对细胞进行双染,然后用流式细胞分析仪检测。使用无血清dmem培养基孵育的细胞作为阴性对照组。所有实验均一式三份实施,结果如图21中的小图a和b所示(平均值
±
sd,n=3,*p《0.05,*表示两组之间在统计学上有显著性差异;**p《0.01,***p《0.001,**和***表示两组之间在统计学上有非常显著的差异)。
[0205]
结果表明,本发明设计的递送载体能够特异性促进肿瘤细胞u87的凋亡,而对正常细胞bend.3细胞的生长没有较大的影响。
[0206]
实施例12.各化疗药物和基因药物的半数抑制浓度ic
50
值测定:
[0207]
化疗药物的半数抑制浓度ic
50
值的测定需要制备密度为3
×
104个/ml的u87单细胞悬液并接种于96孔板,每孔体积100μl,边缘孔用无菌pbs缓冲溶液填充,移入co2培养箱(37℃,5%co2,饱和湿度)培养24h,弃去原培养基,更换为200μl含化疗药,即卡莫司汀(bcnu,大连美仑生物技术有限公司,mb130),多西他赛(dtx,大连美仑生物技术有限公司,mb1081),吉西他滨(gemcitabine,大连美仑生物技术有限公司,mb5386),伊马替尼(imatinib,大连美仑生物技术有限公司,mb2031),顺铂(cisplatin,大连美仑生物技术有限公司,mb1055)和阿霉素(dox,大连美仑生物技术有限公司,mb1087),或不含化疗药的培养基进行细胞培养。48h后每孔加10μl cck-8溶液(上海碧云天生物技术有限公司,c0042),37℃继续孵育2h后于酶标仪(biotek,powerwave xs)490nm波长处测定各孔od值。
[0208]
基因药物的半数抑制浓度ic
50
值的测定需要制备密度为1
×
105个/ml的u87单细胞悬液并接种于24孔板,每孔体积500μl,移入co2培养箱(37℃,5%co2,饱和湿度)培养24h,弃去原培养基,加入400μl含sirna的实施例5制备的脂质体制剂(89wp-cls/r8/sirna),其中,寡聚精氨酸与sirna的电荷比为5,cls与sirna的电荷比为4,表面修饰有3%比例
89w
penetratin-peg
3400-dspe的脂质体药物制剂,6h后弃去药液,将细胞重新消化,以3000个细胞/孔的浓度接种在96孔板中,加入新鲜的dmem完全培养基(添加10%fbs和1%青-链霉素)继续培养。48h后每孔加10μl cck-8溶液,37℃继续孵育2h后于酶标仪490nm波长处测定各孔od值。
[0209]
细胞存活率(%)=(od
s-od
blank
)/(od
control-od
blank
)
×
100%。公式中ods为给药组的吸光度,od
control
为空白对照组的吸光度(孔中仅添加细胞、dmem完全培养基和cck-8),od
blank
为空白孔吸光度(孔中仅添加dmem完全培养基和cck-8)。所有实验均一式三份实施,实验结果用graphpad prism软件分析,结果如图22所示。
[0210]
结果表明,化疗药物bcnu,dtx,gemcitabine,imatinib,cisplatin和dox的半数抑制浓度ic
50
值分别是92.04μm,15.52nm,0.11μm,41.59μm,5.62μm和0.17μm。基因药物sirna的半数抑制浓度ic
50
值为90.99nm。
[0211]
实施例13.基因药物联用不同化疗药物的体外抗肿瘤药效评价:
[0212]
制备密度为1
×
105个/ml的u87单细胞悬液并接种于24孔板,每孔体积500μl,移入co2培养箱(37℃,5%co2,饱和湿度)培养24h,弃去原培养基,加入400μl含sirna的实施例5制备的脂质体制剂(89wp-cls/r8/sirna),即,寡聚精氨酸与sirna的电荷比为5,cls与sirna的电荷比为4,表面修饰有3%比例
89w
penetratin-peg
3400-dspe的脂质体药物制剂,6h
后弃去药液,将细胞重新消化,以3000个细胞/孔的浓度接种在96孔板中,加入新鲜的dmem完全培养基(添加10%fbs和1%青-链霉素)继续培养12h后,将培养基更换为含有不同化疗药物(bcnu,dtx,gemcitabine,imatinib,cisplatin和dox)的完全培养基继续培养(基因药物和化疗药物的摩尔浓度比为两者的半数抑制浓度ic
50
值之比)。48h后每孔加10μl cck-8溶液,37℃继续孵育2h后于酶标仪490nm波长处测定各孔od值。
[0213]
细胞存活率(%)=(od
s-od
blank
)/(od
control-od
blank
)
×
100%。公式中ods为给药组的吸光度,od
control
为空白对照组的吸光度(孔中仅添加细胞、dmem完全培养基和cck-8),od
blank
为空白孔吸光度(孔中仅添加dmem完全培养基和cck-8)。所有实验均一式三份实施,结果如图23所示。
[0214]
将实验结果进一步用compusyn软件分析,旨在获得具有基因药物和不同化疗药物联用的联合指数和剂量减少指数,计算结果如图24所示。
[0215]
由图24可见,不同化疗药物bcnu、dtx、gemcitabine、imatinib、cisplatin和dox分别与基因药物sirna协同发挥降低细胞存活率的作用。特别是化疗药物dtx、gemcitabine、cisplatin和dox与基因药物的联合指数小于1,剂量减少指数大于1,表明具有发挥协同作用的较佳联合治疗效果。而化疗药物bcnu和imatinib与基因药物的联合指数大于1,剂量减少指数小于1,表明尽管具有发挥协同作用的效果,但用于联合治疗中的剂量减少不如化疗药物dtx、gemcitabine、cisplatin和dox。由此将化疗药物dtx、gemcitabine、cisplatin和dox列入进一步实验的范围,以筛选出在特定的总给药剂量下,与基因药物联用的最佳化疗药物。
[0216]
实施例14.基因药物联用不同化疗药物的体外抗肿瘤药效学筛选:
[0217]
制备密度为1
×
105个/ml的u87单细胞悬液并接种于24孔板,每孔体积500μl,移入co2培养箱(37℃,5%co2,饱和湿度)培养24h,弃去原培养基,加入400μl含sirna的实施例5制备的脂质体制剂(89wp-cls/r8/sirna),即,寡聚精氨酸与sirna的电荷比为5,cls与sirna的电荷比为4,表面修饰有3%比例
89w
penetratin-peg
3400-dspe的脂质体药物制剂,6h后弃去药液,将细胞重新消化,以3000个细胞/孔的浓度接种在96孔板中,加入新鲜的dmem完全培养基(添加10%fbs和1%青-链霉素)继续培养12小时后,将培养基更换为含有不同化疗药物(dtx、gemcitabine、cisplatin和dox)的dmem完全培养基继续培养(基因药物和化疗药物的浓度比为两者的半数抑制浓度ic
50
值之比,基因药物和化疗药物的浓度之和为200nm)。48h后每孔加10μl cck-8溶液,37℃继续孵育2h后于酶标仪490nm波长处测定各孔od值。
[0218]
细胞存活率(%)=(od
s-od
blank
)/(od
control-od
blank
)
×
100%。公式中ods为给药组的吸光度,od
control
为空白对照组的吸光度(孔中仅添加细胞、dmem完全培养基和cck-8),od
blank
为空白孔吸光度(孔中仅添加dmem完全培养基和cck-8)。所有实验均一式三份实施,实验结果用graphpad prism软件分析,结果如图25所示(平均值
±
sd,n=3,*p《0.05,*表示两组之间在统计学上有显著性差异;***p《0.001,***表示两组之间在统计学上有非常显著的差异;ns表示两组之间在统计学上没有显著性差异)。
[0219]
结果表明,当基因药物和化疗药物的浓度比为两者的半数抑制浓度ic
50
值之比,基因药物和化疗药物的浓度之和为200nm时,基因药物与化疗药物dtx联用对细胞存活率具有最大的抑制作用,表明具有最佳的体外抗肿瘤效果。基于此结果,在特定的总给药剂量下,
将基因药物与化疗药物dtx联用以用于后期实验研究。
[0220]
实施例15.阳离子脂质体和带正电的多聚氨基酸包载基因药物和化疗药物的药物制剂的制备:
[0221]
如实施例1所述类似地,称取膜材料,即3.5mg的dotap、3.72mg的dope、2.59mg的胆固醇,加入4μg的dtx原料药(大连美仑生物技术有限公司,mb1081),一同溶解在氯仿中,将所得溶液通过旋转蒸发仪(上海申生科技有限公司,r201l)除去氯仿,将所得的干燥脂质膜用1ml 5%的葡萄糖水溶液通过37℃水浴超声水化约10分钟。待脂质膜水化完全后,使用微型挤出器(hamilton,81320)挤出(过核孔膜的顺序依次是200nm、100nm和50nm),获得了包载dtx的cls(cls/dtx)。
[0222]
如实施例4所述类似地,将制备的r8/sirna复合物和cls/dtx制备脂质体复合物cls/dtx/r8/sirna。
[0223]
如实施例5所述类似地,将所制得的cls/dtx/r8/sirna复合物分别与
89w
penetratin-peg
3400-dspe的摩尔数占mpeg
2000-dspe和
89w
penetratin-peg
3400-dspe的总摩尔数为60%的混合物混合后置于55℃孵育半小时,获得表面修饰有3%比例的穿膜肽的脂质体药物制剂,即89wp-cls/dtx/r8/sirna,其中,基因药物sirna和化疗药物dtx的摩尔浓度比例为两者ic
50
值之比(即,约为6),且基因药物sirna的摩尔浓度约为6.20μm,化疗药物dtx的摩尔浓度为1.03μm。
[0224]
实施例16.基因药物联用化疗药物多西他赛(dtx)的体外抗肿瘤药效学评价:
[0225]
制备密度为5
×
104个/ml的u87单细胞悬液并接种于24孔板,每孔体积500μl,移入co2培养箱(37℃,5%co2,饱和湿度)培养24h,弃去原培养基,分别加入400μl含sirna的实施例15制备的脂质体制剂89wp-cls/dtx/r8/sirna或cls/dtx/r8/sirna、或加入400μl 89wp-cls/r8/sirna dtx,即,寡聚精氨酸与sirna的电荷比为5,cls与sirna的电荷比为4,表面修饰有3%比例
89w
penetratin-peg
3400-dspe的脂质体药物制剂。所述89wp-cls/r8/sirna dtx的制备为将89wp-cls/r8/sirna和dtx物理混合而得。基因药物sirna和化疗药物dtx的摩尔浓度比例均为两者ic
50
值之比。6h后弃去药液,将细胞重新消化,以3000个细胞/孔的浓度接种在96孔板中,加入新鲜的dmem完全培养基(添加10%fbs和1%青-链霉素)继续培养。48h后每孔加10μl cck-8溶液,37℃继续孵育2h后于酶标仪490nm波长处测定各孔od值。
[0226]
细胞存活率(%)=(ods-odblank)/(odcontrol-odblank)
×
100%。公式中ods为给药组的吸光度,odcontrol为空白对照组的吸光度(孔中仅添加细胞、dmem完全培养基和cck-8),odblank为空白孔吸光度(孔中仅添加dmem完全培养基和cck-8)。所有实验均一式三份实施,实验结果用graphpad prism软件分析,结果如图26所示。(平均值
±
sd,n=3,ns表示两组之间在统计学上没有显著性差异)。
[0227]
结果如图26所示,脂质体制剂89wp-cls/dtx/r8/sirna中dtx的半数抑制浓度ic
50
值是8.9nm;脂质体制剂cls/dtx/r8/sirna中dtx的半数抑制浓度ic
50
值是24.7nm;脂质体制剂89wp-cls/r8/sirna与dtx联用时dtx的半数抑制浓度ic
50
值是10.3nm。由此可见,在dtx仅作用6小时时,sirna和dtx的在本发明的脂质体制剂中的联用能够显著降低dtx的半数抑制浓度,具备更高效的肿瘤抑制效果。
[0228]
实施例17.探究did细胞膜荧光探针标记的载体包载fam-sirna后被细胞摄取的情况:
[0229]
如实施例1所述类似地,称取膜材料,按试剂盒说明书所述加入did细胞膜荧光探针(大连美仑生物技术有限公司,mb6190),制备did细胞膜荧光探针标记的cls,即cls/did。将33μg的fam标记的sirna(在本实施例中,使用的是针对c-myc的sirna,其有义链(5'-3')为fam-aacguuagcuucaccaacadtdt,即,5'修饰有fam;反义链(5'-3')为uguuggugaagcuaacguudtdt)溶于125μl的depc处理水中制备20μm的fam-sirna溶液,制备did和/或fam荧光标记的各药物制剂。
[0230]
将u87细胞(人神经胶质瘤细胞,购自atcc)或者calu-3细胞(人肺腺癌细胞,购自atcc)培养于dmem完全培养基(添加10%fbs和1%青-链霉素)中。取生长状态良好的u87细胞或者calu-3细胞重悬于dmem完全培养基中,按5
×
105个细胞/孔接种到6孔板中,每孔1ml,接种后每天更换新鲜培养液一次,培养2~3天后进行实验。
[0231]
将培养的u87细胞或者calu-3细胞弃去培养液后,无菌pbs洗三次。每孔分别加入含有1μm sirna的不同荧光标记的药物制剂的1ml无血清dmem培养基,37℃、5%co2条件下孵育4h。孵育结束后弃去培养液,用含0.02mg/ml肝素钠的pbs缓冲溶液洗去吸附在孔上或细胞表面的正电性物质。用胰酶将细胞消化下来,重悬于200μl无菌pbs缓冲溶液中,吹打均匀后对每个样品计数细胞,取104个细胞进行流式细胞术检测。实验中设置与空白的无血清dmem培养基孵育的细胞作为阴性对照组;另外,设置了两组阳性对照组,分别为只含有fam的89wp-cls/r8/fam-sirna,以及只含有did的89wp-cls/did;还设置了如下制剂组:89wp-cls/did/r8/sirna组、cls/did/r8/fam-sirna组、89wp-cls/did/r8/fam-sirna组。所有实验均一式三份进行。所有制剂的给药体积为均为1ml,其中sirna的浓度约为1μm,dtx的浓度约为0.1667μm(dtx和sirna的摩尔浓度比为ic
50
值之比,即6),寡聚精氨酸与sirna的电荷比为5,cls与sirna的电荷比为4,表面修饰有3%比例
89w
penetratin-peg
3400-dspe。结果如图27所示(平均值
±
sd,n=3,***p《0.001,***表示两组之间在统计学上有非常显著的差异)。
[0232]
由图27中的结果可见,89wp-cls/did/r8/fam-sirna药物制剂在u87细胞和calu-3细胞中的摄取呈现更强的did和fam双荧光阳性结果,因此,嵌入在脂质体膜上的荧光探针did和包裹在脂质体中的sirna是以脂质复合物的形式共同入胞的,并非以游离的形式被摄取。由于化疗药物dtx与荧光探针did理化性质相近,由此推测共包载基因药物和化疗药物的药物制剂89wp-cls/dtx/r8/sirna被细胞摄取时,基因药物sirna和化疗药物dtx也是以脂质复合物的形式被共同摄取而入胞的。
[0233]
实施例18.基因药物联用dtx化疗药物对u87细胞的促凋亡能力评价:
[0234]
取dmem培养基中对数期生长状态良好的u87细胞(购自atcc)按5
×
104/孔的浓度分别铺于12孔板中,在37℃、5%co2条件下培养至细胞单层铺满板底。
[0235]
弃去培养液,无菌pbs缓冲液洗3次后,分别加入400μl含150nmol/l sirna的实施例15制备的脂质体制剂89wp-cls/dtx/r8/sirna、cls/dtx/r8/sirna、实施例5制备的脂质体制剂89wp-cls/r8/sirna、以及89wp-cls/r8/sirna和dtx的物理混合物,即各制剂的给药体积为400μl,其中sirna的浓度稀释为150nmol/l,寡聚精氨酸与sirna的电荷比为5,cls与sirna的电荷比为4,表面修饰有3%比例
89w
penetratin-peg
3400-dspe,dtx和sirna的摩尔浓度比为ic
50
值之比即6,细胞培养箱中孵育6h后,弃去药液,无菌pbs缓冲液洗3次后,加入完全培养基1ml继续培养18h,之后收集细胞,先用pbs清洗,无edta的胰酶消化1分钟,dmem培养液终止消化后收集细胞至离心管中,按照细胞凋亡检测试剂盒(南京凯基生物科技发展
有限公司,kga108)的步骤对细胞进行双染,然后用流式细胞分析仪检测。使用无血清dmem培养基孵育的细胞作为阴性对照组。所有实验均一式三份实施,结果如图28所示(平均值
±
sd,n=3,**p《0.01,***p《0.001,**和***表示两组之间在统计学上有非常显著的差异)。
[0236]
结果表明,本发明设计的共递送基因药物和化疗药物的药物制剂能够显著提高肿瘤细胞u87的凋亡率,具备更高效的肿瘤抑制效果。
[0237]
实施例19.基因药物联用dtx化疗药物的抗u87脑原位瘤的药效学评价:
[0238]
取对数生长期的u87细胞,计数,用pbs缓冲液重悬细胞。每只balb/c裸鼠(上海西普尔-必凯试验动物有限公司,中国)接种6
×
105个u87细胞(分散于5μl pbs缓冲液中)。将裸鼠用7%水合氯醛麻醉,脑立体定位仪固定,采用微量注射器将细胞接种于纹状体部位(前囟向前0.6mm,向右1.8mm,纵深3mm),构建u87原位脑瘤模型。
[0239]
按照前述实施例所述方法,分别制备脂质体药物制剂,即cls/dtx/r8/sirna,89wp-cls/r8/sirna,89wp-cls/dtx/r8/sirna,以及89wp-cls/r8/sirna dtx的物理混合物。
[0240]
在u87脑原位瘤接种后将小鼠随机分为6组(n=10):生理盐水组、dtx组、cls/dtx/r8/sirna组、89wp-cls/r8/sirna组、89wp-cls/dtx/r8/sirna组、89wp-cls/r8/sirna dtx组。接种u87肿瘤细胞后第5天开始鼻腔给药,给药剂量为0.66mg/kg sirna(cls/dtx/r8/sirna组、89wp-cls/r8/sirna组、89wp-cls/dtx/r8/sirna组、89wp-cls/r8/sirna dtx组),6.66μg/kg dtx(dtx组、cls/dtx/r8/sirna组、89wp-cls/dtx/r8/sirna组、89wp-cls/r8/sirna dtx组),其中所有给药制剂中,寡聚精氨酸与sirna的电荷比为5,cls与sirna的电荷比为4,表面修饰有3%比例89wpenetratin-peg
3400-dspe,dtx和sirna的摩尔浓度比为ic
50
值之比即6。每天给药一次,共给药22次,记录小鼠体重及生存期,绘制体重变化曲线及生存曲线,结果如图29、图30所示(**p《0.01,***p《0.001,**和***表示两组之间在统计学上有非常显著的差异)。
[0241]
结果表明,生理盐水组、dtx组、cls/dtx/r8/sirna组、89wp-cls/r8/sirna组、89wp-cls/r8/sirna dtx组的中位生存期分别为20天、21天、27天、27天和28.5天,89wp-cls/dtx/r8/sirna组则成功将中位生存时间延长到33.5天,并且生存曲线与其他各组均没有交叉,实现了最显著的抗脑胶质瘤效果,这些数据证实了89wp-cls/dtx/r8/sirna能够将药物递送至脑部肿瘤,发挥抗肿瘤效果,其独特递送优势可以转化为更高的治疗功效。
[0242]
尽管已经出于说明本发明的目的显示了某些代表性实施方案和细节,但是本领域技术人员显而易见的是可以对它们进行多种变化和修改而不脱离主题发明的范围。在这个方面,本发明范围仅由以下权利要求限定。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。