1.本发明属于光学成像技术领域,属于造影剂领域,更具体地属于能够以对应于极远红外的1000nm-1700nm波长范围发射的有机造影剂领域。
2.本发明涉及氮杂氟硼荧荧光团化合物在1000nm至1700nm的光学窗口中作为造影剂的用途。本发明还涉及包含所述荧光团化合物和药学上可接受的赋形剂和/或溶剂的组合物在包括注射系统和所述荧光团或所述组合物的试剂盒中作为造影剂的用途,并且还涉及一种体外或体内识别生物靶标(诸如健康或肿瘤细胞、蛋白质、dna、rna、脂质或任何其他动物或植物生物靶标部分)的方法。
3.在描述中,方括号([])之间的参考文献是指实施例末尾的参考文献表。
背景技术:
[0004]
随着900nm至1700nm检测范围的高灵敏度相机的出现,光学成像正在经历新的热潮,所述范围对应于称为nir ii或swir(短波红外)的极远红外。该检测范围在光学成像中特别有趣,因为它在理论上允许观察位于组织更深处的荧光信号(与nir i成像相比),并且/或者具有更高的分辨率和灵敏度。由于组织在该光学范围的较低自发荧光,这些在bruns等人、carr等人和thimsen等人[1]的文章中有所描述的观察结果是可能的。
[0005]
在1000nm以下,许多有机分子被描述为造影剂,包括花青、alexa、atto、氟硼荧、dylight、若丹明、荧光素、吲哚菁绿等的范围。此外,还有诸如qdot的无机化合物可用于这些光学范围内的光学成像。与低于1000nm的光学范围相比,1000nm至1700nm光学范围内的“可见”化合物具有在提高分辨率和检测深度的光学范围内发射的优点。
[0006]
随着这些新型相机和各种适用于1000nm至1700nm波长的光学工具(诸如镜头)的出现,开发适用的造影剂变得必要。
[0007]
因此,确实需要找到可与这些新工具一起使用的造影剂,从而大大提高观察到的图像质量,更易于识别靶细胞(例如肿瘤),并扩大多荧光分析的检测范围。
[0008]
申请人的功劳是,她发现了一类名为氮杂氟硼荧的荧光团化合物,该荧光团化合物能够在1000nm至1700nm的检测范围内单独发射、封装或接枝到感兴趣的分子(例如抗体或生物配体)或感兴趣的细胞(例如巨噬细胞或干细胞)。
[0009]
根据本发明的造影剂的使用还允许跟踪生物靶标在管内、体外、体内或离体的分布。
[0010]
通过阅读以下由附图说明的示例,其他优点对于本领域技术人员将变得显而易见,所述示例以例示的方式给出而非限制性的。
技术实现要素:
[0011]
本发明涉及式i的荧光团化合物在1000nm至1700nm范围内的光学窗口中作为造影剂的用途:
[0012][0013]
其中,
[0014]-r1、r2、r3和r4是相同或不同的,表示任选地被选自卤素、-nrcrd、-ord、肼、-cf3和-cn中的至少一个基团取代的c5-c7芳基或杂芳基基团,
[0015]-r1、r2、r3和r4中的至少一者为被-nrcrd基团和任选地选自卤素、-ord、肼、-cf3和-cn的基团取代的c5-c7芳基基团,
[0016]-r5和r6是相同或不同的,表示氢、卤素、包含醛、酮、羧酸或酯官能团的c1-c15基团、腈、-so3na、任选地被酮、酯或芳族基团取代的乙烯基基团、被烷基或芳族基团取代的亚胺、任选被烷基或芳族基团取代的炔烃基团、sph、芳族硫属元素化物(seph、teph)、酰胺、任选地被选自卤素、-nrcrd、-ord、肼、-cf3和-cn中的至少一个基团取代的c5-c7芳基或杂芳基基团,
[0017]-任选地,r3和r5和/或r4和r6共价键合并一起形成任选地被选自卤素、-nrcrd、-ord、肼、-cf3和-cn中的至少一个基团取代的c5-c7芳基或杂芳基基团,
[0018]-rc和rd是相同或不同的,表示氢或直链或支链c1-c3烷基链,
[0019]-ra和rb是相同或不同的,表示:
[0020]
·
卤素,优选地选自包括氟和氯的组,
[0021]
·
c1-c50脂族或杂脂族、直链或支链、饱和或不饱和基团,任选地含有一个或多个芳族或杂芳族基团,任选地含有一个或多个选自o、n、p和/或s的杂原子,优选地呈选自季铵、硫酸根、磺酸根和膦酸根官能团的一种或多种亲水性官能团的形式
[0022]
·
c1-c50脂族或杂脂族、直链或支链、饱和或不饱和基团,任选地含有一个或多个芳族或杂芳族基团,任选地含有一个或多个选自o、n、p和/或s的杂原子,优选地呈选自胺、羧酸、n-羟基琥珀酰亚胺型活化酯、五氟苯基、四氟苯基、方酸酯以及更具体地方酸二乙酯、马来酰亚胺、硫醇、异硫氰酸酯、异氰酸酯、噁二唑基甲基砜、叠氮化物、取代或未取代的四嗪、三唑、反式环辛烯、环辛炔以及更具体地二苯并环辛炔、双环壬炔和pph2aucl配合物的一种或多种生物共轭官能团的形式,
[0023]
·
经由c1-c50脂族或杂脂族、直链或支链、饱和或不饱和基团共价偶联的生物载体,任选地含有一个或多个选自o、n、p和/或s的杂原子,优选地呈一个或多个如上定义的生物共轭官能团的形式,
[0024]
·
用于治疗目的的金属配合物,由螯合剂和金属形成,
[0025]
·
射电金属配合物,由螯合剂和射电金属形成,或者
[0026]
·
流体动力学直径小于10nm的分子、环状或线性肽、抗体、抗体片段、纳米抗体、亲和体、适体、短dna或rna序列、糖、多糖、氨基酸、维生素、amd3100分子、psma配体、类固醇(例如孕酮)、脂肪酸(例如c4-c36)、多胺(例如c4-c14)、多酚、dna碱基或咖啡因衍生物。
[0027]
有利地,荧光团化合物可以为盐或药学上可接受的盐的形式。
[0028]
在本发明的上下文中,“光学窗口”意指波长范围。根据本发明的用作造影剂的荧光团可以在1000nm至1700nm、优选地1000nm至1300nm、甚至更优选地1000nm至1100nm范围内的光学窗口中发射。
[0029]“生物靶标”意指健康或病理的细胞、细胞器、动物或植物细胞的成分(诸如蛋白质、脂质、dna/rna),以及抗体、细胞外基质的成分或生物流体的成分。
[0030]“造影剂”意指人为地增加对比度从而允许解剖结构(例如,器官)或病理结构(例如,肿瘤)的可视化的分子或物质,所述解剖结构天然地为低对比度或无对比度的,因此在其环境中将难以区分。在本发明的上下文中,造影剂在1000nm至1700nm的范围内发射,属于极远红外,也称为nir ii或swir。
[0031]“氟硼荧”是包含硼-二吡咯亚甲基单元的化合物,主要被称为强紫外线吸收染料,具有发射窄荧光和高量子产率的特性。它们都来源于4,4-二氟-4-硼-3a,4a-二氮杂-对称引达省:
[0032][0033]“氮杂氟硼荧”意指在8位含有氮原子的氟硼荧化合物:
[0034][0035]
出于本发明的目的,“脂族”意指非芳族基团。脂族基团可以为环状的。脂族基团可以为饱和的,诸如己烷,或不饱和的,诸如己烯和己炔。开链基团(无论是直链还是支链的)不包含任何类型的环,因此是脂族的。脂族基团可以为饱和的,由单键(烷烃)连接,或不饱和的,带有双键(烯烃)或三键(炔烃)。“杂脂族”基团为具有一个或多个杂原子的脂族基团,最常见的杂原子为氧、氮、磷和硫。
[0036]
术语“衍生物”是指通过一种或多种化学反应由母体化合物制成的化合物或分子。
[0037]
一般来说,术语“取代的”或“未取代的”(无论其是否在术语“最终”或“任选地”之后)以及本发明的化学式中所含的取代基是指给定结构中的氢自由基被指定取代基自由基替代。当给定结构中的多于一个位置可以被多于一个选自给定组的取代基替代时,该取代基在每个位置处可以相同或不同。如此处所用,术语“取代的”旨在包括有机化合物的所有允许的取代基。
[0038]
如此处所用,术语“烷基”是指直链和支链烷基基团。类似的约定适用于其他通用术语,诸如“烯基”、“炔基”等。示例性烷基基团包括但不限于甲基、乙基、正丙基、异丙基、烯丙基、正丁基、仲丁基、异丁基、叔丁基、正戊基、仲戊基、异戊基、叔戊基、正己基、仲己基等,
其也可以携带一个或多个取代基。烯基基团包括但不限于乙烯基、丙烯基、丁烯基、1-甲基-2-丁烯基-2-1-基等。代表性炔基基团包括但不限于乙炔基、2-丙炔基(炔丙基)、1-丙炔基等。
[0039]
如本文所用,术语“任选地含有一个或多个杂原子”是指主链中携带或已包含选自o、n、p和s的杂原子的基团。
[0040]
一般来讲,如此处使用的术语“不饱和的”是指其分子结构含有一个或多个碳-碳双键或三键的基团。
[0041]
一般来讲,如本文所用的术语“芳族基团”、“芳环或杂环”或“芳基”或“杂芳基”是指单环或多环不饱和的、稳定的、取代或未取代的烃基,优选地具有3-14个碳原子,含有至少一个满足h
ü
ckel芳香性规则的环。芳族基团的示例是但不限于苯基、茚满基、茚基、萘基、菲基和蒽基。
[0042]
一般来讲,如本文所用的“环状”是指在主链或侧链上的被取代或未取代且任选地含有一个或多个杂原子的3-8元环状片段。这样的杂芳基基团的示例包括但不限于以下:吡啶基、噻唑基、噻唑基、噻吩基、呋喃基、吡咯基、吡唑基、咪唑基、三唑基、四唑基、苯并呋喃基、苯并氮杂基、硫杂萘基、吲哚基、二氢吲哚基、喹啉基、异喹啉基、苯并咪唑基、四氢喹啉基、四氢异喹啉基、三嗪基、噻蒽、异苯并呋喃基、色烯基、呫吨基、吩噻噁基(phenoxanthinyl)、异噻唑基、异噁唑基、吡嗪基、哒嗪基、吲哚嗪基、异吲哚基、吲唑基、嘌呤基、喹啉基、酞嗪基、萘啶基、喹喔啉基、喹唑啉基、噌嗪基、蝶啶基、咔唑基、β-咔啉基、菲啶基、吖啶基、嘧啶基、菲咯啉基、吩嗪基、吩噻嗪基、呋咱基、吩噁嗪基、异苯并二氢吡喃基、苯并二氢吡喃基、咪唑烷基、咪唑啉基、吡唑烷基、吡唑啉基、吡唑啉基、二氢吲哚基、异二氢吲哚基、噁唑烷基、苯并三唑基、苯并异噁唑基、羟吲哚基、苯并噁唑啉基、苯并噻吩基、苯并噻唑基、靛红基(isatinyl)、二氢吡啶基、嘧啶基、s-三唑啉基、噁唑基和硫代呋喃基。
[0043]
通常,术语“独立地”是指这些术语所提及的取代基、原子或基团彼此独立地选自变量表(这意味着它们可以相同或不同)的事实。
[0044]
本文所用的术语“卤素”是指选自氟、氯、溴和碘的原子,优选氟和氯。
[0045]“生物共轭官能团”被定义为允许本发明的化合物共价连接到感兴趣的分子、更具体地感兴趣的生物分子、优选地生物载体的化学官能团。这样的官能团的示例如下但不限于:胺、羧酸、n-羟基琥珀酰亚胺型活化酯、五氟苯基、四氟苯基、方酸官能团以及更具体地方酸二乙酯、马来酰亚胺、硫醇、异硫氰酸酯、异氰酸酯、噁二唑基甲基砜、叠氮化物、取代或未取代的四嗪、三唑、反式环辛烯、环辛炔型官能团以及更具体地二苯并环辛炔、双环壬炔和pph2aucl配合物。
[0046]“生物载体”意指任何封装系统,或任何允许识别经由生物共轭官能团共价偶联或不偶联的特定生物靶标的配体。
[0047]
所谓“螯合剂”意指具有永久地固定离子、更具体地金属阳离子以形成配合物的特性的任何化学物质。这可包括多胺家族的螯合剂,无论是否为环状。
[0048]“射电金属”意指发射例如γ或β 辐射诸如镓-68或氟-18、或β或α辐射诸如镥-177或锕-225的放射性金属。
[0049]“用于治疗目的的金属配合物”意指其本身或在通过外部或内部刺激激活后包含具有治疗特性的原子的任何配合物。它可以为例如选自以下的配合物:pr2m(m=ru(ii)、os
(ii)、ru(iii)、au(i)或(iii)、pt(ii)、pt(iv)、pd(ii)、ir(iii)、cu(i)、cu(ii))(r=烷基、芳基、杂芳基,优选三氮杂磷代金刚烷)、碳烯-m(m=ru(ii)、os(ii)、ru(iii)、au(i)或(iii)、pt(ii)、pt(iv)、ir(iii)、cu(i)、cu(ii))、苯基吡啶-m(m=au(iii)、pt(ii)、ru(ii)、ir(iii)、re(v)、au(ii)、pt(iv)、pd(ii)、ir(iii)、cu(ii)、ir(iii)、re(v)、re(iii)、cu(ii))、聚吡啶(m=au(iii)、pt(ii)、ru(ii)、ir(iii)、re(v)、re(iii)、cu(ii)、os(ii))、s-m(m=au(i)、au(iii)、cu(i)、cu(ii)、ti(iv)、zr(iv))、炔烃au(i)、二硫代氨基甲酸酯-m(m=au(i)、au(iii)、cu(i)、cu(ii))、喹啉-m(m=ga、fe)、η3-芳烃-m(m=ru(ii)、os(ii)、cr(vi)、mo(iii))、茂金属-m(m=fe(ii)、fe(iii)、ti(iv)、ti(iii)、zr(iv)、ir(iii)、rh(iii)、cr(vi)、ta(iii)、os(ii))、salen和salan-m(m=au(iii)、ti(iv)、zr(iv)、cu(ii)、pt(ii)、pd(ii))、丙二酸衍生物-m(m=pt(ii)、ti(iv))、乙二胺-m(m=pt(ii)、pd(ii)、cu(ii)、au(iii)、ru(ii)、os(ii))、苯甲醛亚胺-m(m=ru(ii)、rh(iii)、ir(iii))。
[0050]
类似地,“射电金属配合物”意指任何含有放射性金属原子的配合物。配合物可以由选自dtpa、nota、nodaga、dota、dotaga、p-ncs-bn-dota、p-ncs-bn-nota、dfo、sarcophagine、bridged cyclam、salan、salen、hbed、联吡啶型聚吡啶、三联吡啶、菲咯啉、膦或二膦聚吡啶、碳烯、芳烃、环戊二烯、炔烃、硫醇盐、苯基吡啶、苯基三唑的衍生物的螯合剂以及选自ga68、ga67、alf18、in111、zr89、sc43、sc44、sm153、cu61、cu64、co55、co57、tb152、tb157、ru103、ru97、ru95、os191、au198、au199、ti45、pt195、pt193、pd100、re186、re188的射电金属构成。它可以例如具有dota或nodaga型以及选自ga68和in111的射电金属以获得可在pet/spect和光学成像中检测的双峰探针,或者选自lu177、y90、ac225、pb212、bi212、eb109、yt161、sc47、cu67、tb161、os191、pt195、pt193、au199、pd103、re186、re188、sm153以用于治疗诊断应用;诸如dotaga-111
in。
[0051]
如本领域技术人员所理解的那样,所有数字,包括那些表示成分的量、特性诸如分子量、反应条件等的数字,均为近似值,并且应理解为在所有情况下都可能被术语“约”修饰。这些值可根据使用以下描述的教导内容的本领域技术人员所寻求的特性而变化。还应理解,这些值含有由在其相应的测试测量中发现的标准偏差必然导致的固有可变性。
[0052]
本领域技术人员还将容易地认识到,当成员以相同方式分组在一起时,例如在马库什组中,本发明不仅涵盖所列出的整个组,而且涵盖该组的单独的每个成员和主组的所有可能子组。此外,出于所有实践目的,本发明不仅涵盖主组,而且涵盖不存在一个或多个组成员的主组。因此,本发明提供了对所述组的一个或多个成员的明确排除。因此,储备条件可以适用于任何公开的类别或实施方案,由此可以从这些类别或实施方案中排除一个或多个所述要素、种类或实施方案,例如当用于明确的否定限制中时。
[0053]
如本文所用,术语“异构体”是指可以一种或多种几何、光学、对映异构、非对映异构、差向异构、阻转、立体异构、互变异构、构象或特定异头异构形式存在的化合物。仅限于顺式和反式的异构体;e型和z型;c型、t型和r型;c型、t型和r型;内型和外型;r型、s型和meso型;d型和l型;d型和l型;( )和(-);酮形式、烯醇形式和烯醇化物形式;顺式和反式;顺错和反错形式;α型和β型;直立和平伏形式;船型、椅型、扭船型、贝壳型和半椅型;以及它们的组合的示例在下文中统称为“异构体”(或“异构体形式”)。在本公开中,术语“异构体”不包括构造不同且由不同线性式描述的结构异构体或构造异构体[2]。
[0054]
有利地,荧光团化合物可选自式i的化合物,其中r1、r2、r3和r4相同或不同。r1、r2、
r3和r4可以独立地表示c5-c7芳基或杂芳基基团。r1、r2、r3和r4可以独立地任选地被选自卤素、-nrcrd、-ord、肼、-cf3和-cn中的至少一个基团取代。
[0055]
荧光团化合物可选自式i的化合物,其中r1、r2、r3和r4中的至少一者为被-nrcrd基团和任选地选自卤素、-ord、肼、-cf3和-cn的基团取代的c5-c7芳基基团。优选地,当其为c6芳基基团时,-nrcrd基团处于对位。
[0056]
有利地,荧光团化合物选自式i的化合物,其中r5和r6相同或不同。r5和r6可以独立地表示氢、卤素、包含醛、酮、羧酸或酯官能团的c1-c15基团、腈、-so3na、任选地被酮、酯或芳族基团取代的乙烯基基团、被烷基或芳族基团取代的亚胺、任选被烷基或芳族基团取代的炔烃基团、sph、芳族硫属元素化物(seph、teph)、酰胺、任选地被选自卤素、-nrcrd、-ord、肼、-cf3和-cn中的至少一个基团取代的c5-c7芳基或杂芳基基团。优选地,r5和r6为氢或-so3na。
[0057]
有利地,荧光团化合物选自式i的化合物,其中rc和rd相同或不同。rc和rd可以独立地表示氢或直链或支链c1-c3烷基链。优选地,-nrcrd选自包括-nh2、-nme2、-net2、-npr2的组,优选-nme2。
[0058]
有利地,r3和r5和/或r4和r6可共价键合并一起形成任选地被选自卤素、-nrcrd、-ord、肼、-cf3和-cn中的至少一个基团取代的c5-c7芳基或杂芳基基团。
[0059]
有利地,荧光团化合物可选自式i的化合物,其中r5和r6为氢。
[0060]
有利地,荧光团化合物可选自式i的化合物,其中r1和r2是相同或不同的,表示被-nrcrd基团和任选地选自卤素、-ord、肼、-cf3和-cn的基团取代的c5-c7芳基基团。优选地,荧光团化合物可选自式i的化合物,其中r1和/或r2表示被-nrcrd基团取代、优选在对位取代的苯基基团。
[0061]
有利地,荧光团化合物可选自式i的化合物,其中ra和rb相同或不同。ra和rb可以表示卤素,优选氟或氯。
[0062]
有利地,荧光团化合物可选自式i的化合物,其中ra和rb相同或不同。ra和rb可以表示c1-c50、优选c2-c30脂族或杂脂族、直链或支链、饱和或不饱和基团,任选地含有一个或多个芳族或杂芳族基团,任选地含有一个或多个选自o、n、p和/或s的杂原子,优选地呈选自季铵、硫酸根、磺酸根和膦酸根官能团的一种或多种亲水性官能团的形式。
[0063]
有利地,荧光团化合物可选自式i的化合物,其中ra和rb相同或不同。ra和rb可以表示c1-c50、优选c5-c30脂族或杂脂族、直链或支链、饱和或不饱和基团,任选地含有一个或多个芳族或杂芳族基团,任选地含有一个或多个选自o、n、p和/或s的杂原子,优选地呈选自胺、羧酸、n-羟基琥珀酰亚胺型活化酯、五氟苯基、四氟苯基、方酸酯以及更具体地方酸二乙酯、马来酰亚胺、硫醇、异硫氰酸酯、异氰酸酯、噁二唑基甲基砜、叠氮化物、取代或未取代的四嗪、三唑、反式环辛烯、环辛炔以及更具体地二苯并环辛炔、双环壬炔和pph2aucl配合物的一种或多种生物共轭官能团的形式。
[0064]
有利地,荧光团化合物可选自式i的化合物,其中ra和rb相同或不同。ra和rb可以表示经由包含如上定义的生物共轭官能团的基团共价偶联的生物载体。
[0065]
有利地,荧光团化合物选自式i的化合物,其中ra和或rb是相同或不同的,包含
10
bsh(na2b
12h11
sh或硼卡钠,富含硼10),用于在硼疗法(硼中子俘获疗法,或bnct)中获得治疗诊断学活性。
[0066]
有利地,荧光团化合物可选自式i的化合物,其中ra和rb相同或不同。ra和rb可以表示用于治疗目的的金属配合物,优选地选自以下配合物:式pr2m,其中m为选自包括ru(ii)、os(ii)、ru(iii)、au(i)或(iii)、pt(ii)、pt(iv)、pd(ii)、ir(iii)、cu(i)、cu(ii)的组的金属,并且r为c1-12烷基、芳基、杂芳基,优选三氮杂磷代金刚烷;碳烯-m,其中m为选自包括m=ru(ii)、os(ii)、ru(iii)、au(i)或(iii)、pt(ii)、pt(iv)、ir(iii)、cu(i)、cu(ii)的组的金属;苯基吡啶-m,其中m为选自包括au(iii)、pt(ii)、ru(ii)、ir(iii)、re(v)、re(iii)、cu(ii)的组的金属;聚吡啶-m,其中m为选自由au(iii)、pt(ii)、ru(ii)、ir(iii)、re(v)、re(iii)、cu(ii)、os(ii)组成的组的金属;s-m,其中m为选自由au(i)、au(iii)、cu(i)、cu(ii)、ti(iv)、zr(iv)组成的组的金属;炔烃-au(i);二硫代氨基甲酸酯-m,其中m为选自包括au(i)、au(iii)、cu(i)、cu(ii)的组的金属;喹啉-m,其中m为选自包括ga、fe的组的金属;η3-芳烃-m,其中m为选自包括ru(ii)、os(ii)、cr(vi)、mo(iii)的组的金属;茂金属-m,其中m为选自包括fe(ii)、fe(iii)、ti(iv)、ti(iii)、zr(iv)、ir(iii)、rh(iii)、cr(vi)、ta(iii)、os(ii)的组的金属;salen和salan-m,其中m为选自由au(iii)、ti(iv)、zr(iv)、cu(ii)、pt(ii)、pd(ii)组成的组的金属;丙二酸衍生物-m,其中m为选自由pt(ii)、ti(iv)组成的组的金属;乙二胺-m,其中m为选自由pt(ii)、pd(ii)、cu(ii)、au(iii)、ru(ii)、os(ii)组成的组的金属;苯甲醛亚胺-m,其中m为选自由ru(ii)、rh(iii)、ir(iii)组成的组的金属。
[0067]
有利地,荧光团化合物可选自式i的化合物,其中ra和rb相同或不同。ra和rb可以表示由螯合剂和射电金属形成的射电金属配合物。配合物可以由选自dtpa、nota、nodaga、dota、dotaga、p-ncs-bn-dota、p-ncs-bn-nota、dfo、sarcophagine、bridged cyclam、salan、salen、hbed、联吡啶、三联吡啶、菲咯啉、膦或二膦、碳烯、芳烃、环戊二烯、炔烃、硫醇盐、苯基吡啶、苯基三唑的衍生物的螯合剂以及选自ga68、ga67、alf18、in111、zr89、sc43、sc44、sm153、cu61、cu64、co55、co57、tb152、tb157、ru103、ru97、ru95、os191、au198、au199、ti45、pt195、pt193、pd100、re186、re188的射电金属构成。它可以例如具有dota或nodaga型以及选自ga68和in111的射电金属以获得可在pet/spect和光学成像中检测的双峰探针,或者选自lu177、y90、ac225、pb212、bi212、eb109、yt161、sc47、cu67、tb161、os191、pt195、pt193、au199、pd103、re186、re188、sm153以用于治疗诊断应用。
[0068]
有利地,荧光团化合物可选自式i的化合物,其中ra和rb是相同或不同的,选自小分子(意指流体动力学直径小于10nm的分子,诸如金团簇或金属配合物)、环状或线性肽(诸如αvβ3整联蛋白靶向c(rgdfk)或神经纤毛蛋白靶向atwlppr)、抗体(例如抗cd44型)、靶向膜或细胞内受体的抗体片段或纳米抗体、亲和体、适体、短dna或rna序列、糖(例如硫葡糖或全乙酰化硫葡糖)或多糖、氨基酸、维生素(例如叶酸型)、amd3100型配体、psma配体、类固醇、脂肪酸、多胺(例如精胺、亚精胺、尸胺或腐胺型)、多酚(例如白藜芦醇)、dna碱基、咖啡因衍生物、孕酮。
[0069]
有利地,荧光团化合物可选自式i的化合物,其中ra和rb是相同或不同的,选自卤素,优选氟。
[0070]
有利地,荧光团化合物可选自式i的化合物,其中ra和rb是相同或不同的,选自下式的亲水性基团:
[0071][0072]
在本技术中,符号表示所示基团与分子的连接点。例如,它可以为与b(硼原子)的连接点。
[0073]
有利地,荧光团化合物可选自式i的化合物,其中ra和rb是相同或不同的,选自包含下式的生物共轭官能团的基团:
[0074][0075][0076]-nh2和-si(ome)3。
[0077]
优选地,生物共轭官能团可选自n-羟基琥珀酰亚胺、共轭异硫氰酸酯、四嗪、方酸二乙酯、马来酰亚胺、噁二唑基甲基砜、五氟苯基、叠氮化物、pph2aucl配合物和nh2官能团。
[0078]
有利地,荧光团化合物可选自式i的化合物,其中ra和/或rb含有共价偶联的生物载体并具有例如下式:
[0079][0080]
有利地,荧光团化合物可选自式i的化合物,其中ra和rb是相同或不同的,选自pph
2-au(i)、pph
2-pt(ii)、pph
2-pt(iv)、苯基吡啶-au(iii)。
[0081]
有利地,荧光团化合物可选自式i的化合物,其中ra和rb是相同或不同的,选自dota-in(iii)、dotaga-in(iii)、nodaga-cu(ii)、nodaga-ga(iii)。
[0082]
有利地,荧光团化合物可选自式i的化合物,其中ra和rb是相同或不同的,选自环状或线性肽(例如αvβ3整联蛋白靶向c(rgdfk)或神经纤毛蛋白靶向atwlppr)、抗体(例如抗cd44型)、靶向膜或细胞内受体的抗体片段或纳米抗体、短dna或rna序列、糖(例如硫葡糖或全乙酰化硫葡糖)或多糖、氨基酸、维生素(例如叶酸型)、amd3100型配体、psma型配体、类固醇(例如孕酮)、脂肪酸(例如c4-c36)、多胺(例如精胺、亚精胺、尸胺或腐胺型)、多酚(例如白藜芦醇)、dna碱基、咖啡因衍生物(例如咖啡因)。
[0083]
有利地,荧光团化合物可选自式i的化合物,其中可以相同或不同的ra和rb选自环状或线性肽(αvβ3整联蛋白靶向c(rgdfk)或神经纤毛蛋白靶向atwlppr)、抗体(例如抗cd44型)、靶向膜或细胞内受体的抗体片段、短dna或rna序列、糖(例如硫葡糖或全乙酰化硫葡糖)或多糖、氨基酸、维生素(例如叶酸型)、amd3100配体、类固醇(例如孕酮)、脂肪酸(例如c4-c36)、多胺(例如精胺、亚精胺、尸胺或腐胺型)、多酚(例如白藜芦醇)、dna碱基、咖啡因衍生物(例如咖啡因)。
[0084]
有利地,荧光团化合物可选自式i的化合物,其中ra和rb是相同或不同的,选自下式的基团:
[0085][0086]
有利地,荧光团化合物可选自式i的荧光团化合物,其中r5和r6为h,r1和r2为并且r3和r4分别为式ii中的并且r3和r4分别为式ii中的
[0087]
其中,
[0088]-ra、rb、rc、rd具有上文给出的定义,
[0089]-re和rf是相同或不同的,表示氢、卤素、-nrcrd、-ord、肼、-cf3和-cn中的至少一种。
[0090]
有利地,荧光团化合物可选自式i或ii的化合物,其中rc和rd为-ch3。
[0091]
有利地,荧光团化合物可选自式ii的化合物,其中re和rf为h或-ome,优选地处于对
位。
[0092]
有利地,荧光团化合物可包含在还包含药学上可接受的赋形剂和/或溶剂的组合物中。这可以是本领域技术人员可放入组合物中以改变其ph、渗透压、粘度或溶解度的任何药学上可接受的赋形剂。示例包括nacl(0.9%的水溶液)、5g/l葡萄糖溶液、ppi水或缓冲溶液诸如pbs或其他药学上可接受的缓冲液。
[0093]
有利地,组合物可具有4至10、优选地6至8或6.8至7.6的ph。优选地,组合物的ph为7.4。
[0094]
有利地,组合物中的荧光团化合物的浓度在0.1μmol/l至1000μmol/l、优选地1μmol/l至100μmol/l或10μmol/l至40μmol/l的范围内(这些值特别与体外检测相容),或者在小鼠中在4nmol/kg至300μmol/kg、优选地40nmol/kg至12.5μmol/kg、或约1μmol/kg至1.5μmol/kg的范围内(这些值特别与体内检测相容)。
[0095]
有利地,荧光团化合物可以被封装。在本发明的上下文中,“封装的”意指任何生物相容的物体,其能够将若干种荧光团化合物分组在一起并可能保护它们,并且将它们引导至感兴趣的靶标,诸如脂质纳米颗粒、纳米制剂(特别是基于多糖的纳米制剂)、碳纳米管、胶束。例如,荧光团化合物可以被封装在亲脂性制剂中,所述亲脂性制剂包括如gravier等人的出版物[3]中所述的脂质体、如等人的出版物[4]中所述的脂质胶囊或garcia等人的出版物[5]中所述的疏水性纳米畴诸如多糖纳米制剂。
[0096]
有利地,荧光团化合物可以共价连接至纳米颗粒。偶联可经由带有如上定义的生物共轭官能团的ra或rb基团进行。可共价连接至式i或ii的化合物的纳米颗粒可以为大小低于10kda的小纳米颗粒或脂质纳米颗粒的类型。这些可以是例如金纳米团簇或脂质体。
[0097]
本发明还涉及一种包括注射系统和组合物的试剂盒,所述组合物包含如上定义的式i或ii的荧光团化合物和药学上可接受的赋形剂和/或溶剂。
[0098]
本发明还涉及一种用于体外识别生物靶标(诸如健康或肿瘤细胞、蛋白质、dna、rna)的方法,该方法至少包括以下步骤:
[0099]-用包含如上定义的式i或ii的荧光团化合物的组合物标记采集或培养的样品的细胞,
[0100]-光学窗口中的荧光测量包括1000nm至1700nm的范围,以及
[0101]-识别靶细胞。
[0102]
有利地,在根据本发明的体外识别方法中,组合物中的荧光团浓度在0.1μmol/l至1000μmol/l、优选地1μmol/l至100μmol/l或10μmol/l至40μmol/l的范围内。
[0103]
有利地,样品细胞的标记通过包含荧光团的组合物的注射或喷雾来进行。
[0104]
有利地,包括在1000nm至1700nm的区间内的光学窗口中的荧光测量通过本领域技术人员已知的并且能够测量所述荧光的任何方式进行。这可以为例如共聚焦显微镜检查法或落射荧光流式细胞术、通过荧光反射(2d或3d)或甚至通过用于辅助外科手术或适于多孔板的读数的光学探针进行的光学成像。
[0105]
本发明还涉及一种用于体内识别生物靶标(诸如健康或肿瘤细胞、蛋白质、dna、rna)的方法,该方法至少包括以下步骤:
[0106]-通过用包含如上定义的式i或ii的荧光团化合物的组合物注射或喷雾来标记受试者的细胞,
[0107]-光学窗口中的荧光测量包括1000nm至1700nm的范围,以及
[0108]-识别靶细胞。
[0109]
有利地,在根据本发明的体内识别方法中,组合物中的荧光团浓度在小鼠中在4nmol/kg至300μmol/kg、优选地40nmol/kg至12.5μmol/kg、或约1μmol/kg至1.5μmol/kg的范围内。
[0110]
有利地,样品细胞的标记通过包含荧光团的组合物的注射或喷雾来进行。
[0111]
有利地,包括在1000nm至1700nm的区间内的光学窗口中的荧光测量通过本领域技术人员已知的并且能够测量所述荧光的任何方式进行。这可以为例如落射荧光或共聚焦显微镜检查法、流式细胞术、通过荧光反射(2d或3d)或甚至通过便携式光学探针(诸如用于辅助外科手术或适于读板器的那些)进行的光学成像。
[0112]
本文所用的体内模型基于小鼠。有利地,在根据本发明的方法中,体内施用的组合物中的荧光团浓度在小鼠中在4nmol/kg至300μmol/kg、优选地40nmol/kg至12.5μmol/kg、或约1μmol/kg至1.5μmol/kg的范围内。任何其他施用可以根据种间转换进行,如例如reagan-shaw等人的文章[6]中所述。
[0113]
以非限制性的方式,我们可以提及与本发明相关的优点:
[0114]-提高观察到的图像的质量,提高图像分辨率(与nir成像相比),
[0115]-更易于识别肿瘤细胞,包括在体内观察肿瘤,
[0116]-生物靶标的深层组织检测,
[0117]-可以体外或体内监测生物靶标在管中的分布,
[0118]-增加可用于多标记分析的波长范围,
[0119]-在多个标记中扩展荧光化合物的范围,
[0120]-实现在1000nm以上的光学范围(称为swir或极远红外)内的成像,
[0121]-还允许将该成像技术与光声成像相结合,
[0122]-减少组织的散射和自体荧光。
[0123]
此外,根据本发明,光学造影剂可单独使用,或偶联到感兴趣的分子,或封装在纳米制剂中。
附图说明
[0124]
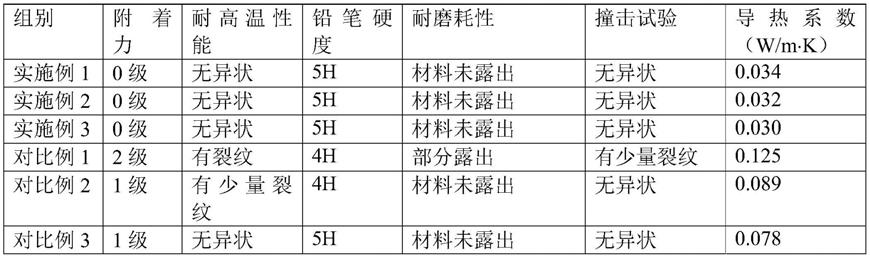
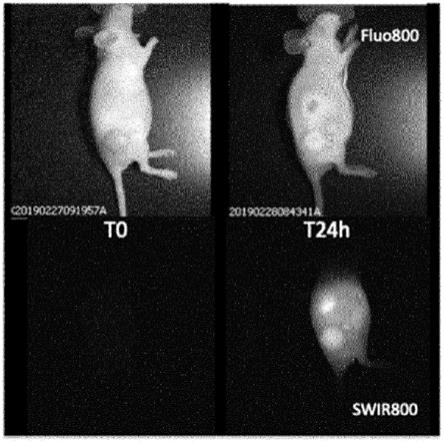
图1示出了在注射氮杂氟硼荧(ag22)之前和24小时后的右后腿中具有u87mg肿瘤的小鼠。上图在nir成像中记录:fluo800对应于780nm处的激发和830nm-900nm之间的收集。下图在830nm(swir800)处激发,并且使用1064nm长通滤波器(这意味着在1064和1700nm之间)收集发射。
[0125]
图2示出了化合物ag22和ag04的发射光谱。
[0126]
图3从左到右示出了右后腿中具有u87mg肿瘤的小鼠:注射ag66化合物之前、5小时后和48小时后。
具体实施方式
[0127]
实施例
[0128]
实施例1:根据本发明的造影剂的合成
[0129]
材料和方法
[0130]
除非另有说明,否则反应在标准大气压下在工业级carlo erba溶剂中进行。需要无水条件的实验在氩气下进行。无水溶剂购自carlo erba,未稳定并使用mb-sps-800(mbraun)或puresolv-md-5干燥。所有商业试剂均购自或acros并且按原样使用,无需任何纯化。tota-boc(boc-1-氨基-4,7,10-三氧杂-13-三癸胺)购自iris biotech并且
10
b-bsh购自反应监测在0.2mm厚的60f254硅胶板上通过hplc-ms和薄层色谱进行,通过uv(254nm)显示。色谱柱纯化在工业硅胶、40-63μm、230-400目、上进行。
[0131]
在bruker 500avance iii或bruker 600avance iii hd(配备有双共振宽带探针)上记录nmr光谱(1h,
13
c)。化学位移以ppm表示,并且相对于tms(1h,
13
c)给出,以残留溶剂信号作为参比。在thermo ltq orbitrap xl esi-ms光谱仪上记录高分辨率质谱。nmr和质量分析在plateforme d'analyse chimique et de synth
è
se mol
é
culaire de l'universit
é
de bourgogne(pacsmub)进行。
[0132]
hplc-ms分析在配备有二极管阵列检测器(thermo-dionex dad 3000-rs)的thermo-dionex ultimate 3000仪器(泵 20℃的自动进样器 25℃的柱温箱)和配备有phenomenex色谱柱(2.6μm,c18,lc 50x2.1mm色谱柱)的简单msq plus四极杆质谱仪上进行。用于表征的梯度如下(梯度a):
[0133][0134]
半制备型hplc纯化在配备有2个lc-20at泵、spd-20a uv/vis检测器、frc-10a馏分收集器、sil-10ap采样器和cbm-20a控制单元的shimadzu hplc仪器上进行。所用的色谱柱是shim-pack gist 5μm c18 10x250mm色谱柱,所用的梯度如下:
[0135][0136]
化合物ag22
[0137][0138]
将18μl n,n-二甲基炔丙胺(156μmol,2eq)在氩气(shlenk玻璃器皿)下溶解于2ml thf(四氢呋喃)中。然后添加乙基溴化镁(0.17ml,170μmol,2.2eq)并将该混合物回流45分钟,使其回到室温,然后经由套管转移到装有氮杂氟硼荧前体(50mg,78μmol,1eq)的shlenk玻璃器皿中。然后将该混合物在氩气下回流搅拌45分钟,然后通过添加2ml etoh停止反应。通过减压蒸发去除溶剂。将形成的粗产物溶解于10ml acoet中,然后添加10ml蒸馏水。在分液漏斗中搅拌并沉降后,将有机相搁置一旁,用10ml acoet萃取水相两次。合并有机相,用10ml两倍稀释的nahco3水溶液洗涤两次,并在无水mgso4上干燥。过滤所得溶液,通过减压蒸发去除溶剂。通过硅胶色谱柱纯化残余物(洗脱液:98/2dcm/meoh
→
100%meoh),以分离呈紫色闪光粉末的ag22(51.1mg,66.3μmole,85%)。
[0139]1h nmr(cdcl3,500mhz)δ(ppm):8.18(d;3j=8.9hz;4h);8.05(d;3j=9.0hz;4h);6.97(d;3j=9.0hz;4h);6.77(d;3j=8.9hz;4h);6.77(s;2h);3.86(s;6h);3.27(s;4h);3.08(s;12h);2.26(s;12h)。
[0140]
13
c nmr{1h}(cdcl3,150mhz)δ(ppm):160.8;156.5;150.8;143.0;142.4;132.0;130.6;125.6;121.0;115.6;113.4;112.0;55.4;48.0;42.3;40.2。
[0141]
hr-ms(esi)(da):m/z c
48h52
bn7o2[m h]
计算值770.42755;实测值770.43559。
[0142]
分析型hplc(梯度a):tr=4.46min。
[0143]
化合物ag24
[0144][0145]
将ag22(30mg,39μmol,1eq)溶解于3ml dcm(二氯甲烷)中。然后添加碘甲烷(1.5ml,大量过量),并且将反应介质在室温下搅拌1小时。然后减压去除溶剂,并且将所得的粗产物溶解于10ml h2o/dcm混合物(1/1)中。用dcm(3
×
5ml)萃取水相,然后在第二步中用水(8
×
10ml)萃取所得的有机相。蒸发回收的水相,并且通过hplc(梯度a)纯化所形成的
沉淀物。将所得的固体冷冻干燥,得到呈蓝绿色固体的纯ag24(17.8mg,17.2μmol,44%)。
[0146]1h nmr(dmso,500mhz)δ(ppm):8.24(d;3j
he-hf
=8.9hz;4h);8.10(d;3j
hb-hc
=9.0hz;4h);7.22(s;2h);7.11(d;3j
hb-hc
=9.0hz;4h);6.86(d;3j
he-hf
=8.9hz;4h);4.00(s;4h);3.87(s;6h);3.07(s;12h);2.78(s;18h)。
[0147]
hr-ms(esi)(da):m/z=c
50h58
bn7o
22
[m]
2
计算值399.73670;实测值399.73869。
[0148]
分析型hplc(梯度a):tr=4.49min。
[0149]
化合物ag38
[0150][0151]
将ag22(250mg,0.32mmol,1eq)溶解于50ml thf和8ml h2o中。添加nahco3(137mg,1.63mmol,5.1eq),然后添加4-溴乙基苯甲酸(144mg,0.67mmol,2.1eq)。将反应混合物在室温下搅拌过夜。然后添加90ml et2o和90ml h2o,并且分离有机相和水相。用et2o(6
×
60ml)洗涤水相以去除剩余的痕量4-溴乙基苯甲酸。然后通过在旋转蒸发器(35℃的浴)中蒸发水,将水相减少至其初始体积的1/3。然后添加10ml盐酸(3m)。然后将烧瓶的内容物离心。去除上清液,将沉淀悬浮在15ml et2o中并再次离心。重复该操作3次,然后将所得的沉淀溶解于meoh中并在旋转蒸发器(35℃浴)上蒸发至干,获得呈黑色片状粉末的纯ag38(336mg,0.28mmol,85%)。
[0152]1h nmr(dmso,500mhz)δ(ppm):8.30(d;3j=8.9hz;4h);8.12(d;3j=9.0hz;4h);7.95(d;3j=8.3hz;4h);7.43(d;3j=8.3hz;4h);7.28(s;2h);7.08(d;3j=9.0hz;4h);6.88(d;3j=8.9hz;4h);4.24(s;4h);3.96(s;4h);3.74(s;6h);3.08(s;12h);2.76(s;12h)。
[0153]
分析型hplc(梯度a):tr=4.50min。
[0154]
化合物ag57
[0155][0156]
将ag22(75mg;0.097mmol,1eq)在氩气下溶解于250ml烧瓶中的60ml无水thf中。然后添加4-溴乙基苯甲酸(23mg;0.106mmol,1.1eq),并且将该混合物在回流条件下搅拌过夜。冷却后,去除上清液,用thf(3
×
15ml)、乙醚(2
×
15ml)和戊烷(2
×
15ml)洗涤所形成的沉淀物。合并所有上清液并在减压下去除溶剂。通过硅胶色谱柱(8:2甲苯/meoh
→
100%meoh)纯化所得残余物,以分离呈黑色片状粉末的ag57(20.7mg,0.021mmol,22%)。
[0157]1h nmr(dmso,500mhz)δ(ppm):8.36(d;3j=8.9hz;4h);8.07(d;3j=9.0hz;4h);7.98(d;3j=8.3hz;2h);7.24(d;3j=8.3hz;2h);7.00(d;3=9.0hz;4h);6.96(s;2h);6.82(d;3j=8.9hz;4h);3.84(s;2h);3.75(s;6h);3.39(s;2h);3.25(s;2h);3.06(s;12h);2.58(s;6);2.24(s;6h)。
[0158]
分析型hplc(梯度a):4.48min。
[0159]
化合物ag46
[0160][0161]
将ag38(250mg,0.209mmol,1eq)溶解于100ml烧瓶中的10ml无水dmf(二甲基甲酰胺)中。将hbtu(208mg,0.548mmol,2.6eq)溶解于10ml无水dmf中,然后添加到反应混合物中。然后添加341μl(1.959mmol,9.3eq)dipea(二异丙基乙胺),并且将混合物在室温下搅拌1小时。将109.2mg(0.618mmol,2.9eq)2-氨基乙基马来酰亚胺盐酸盐溶解于10ml无水dmf中,然后添加到反应介质中,再将反应介质在室温下搅拌过夜,蒸发至干,然后通过半制备型hplc(25%acn梯度
→
100%程序30min)纯化,以分离呈绿色固体的纯ag46(151mg,0.133mmol,63%)。
[0162]1h nmr(meod,500mhz)δ(ppm):8.36(d;3j=8.9hz;4h);8.19(d;3j=8.9hz;4h);7.72(d;3=8.2hz;4h);7.39(d;3j=8.2hz;4h);7.22(s;2h);7.18(d;3j=8.9hz;4h);7.09
(d;3j=8.9hz;4h);6.76(s;4h);4.18(s;4h);3.87(s;4h);3.76(s;6h);3.71(dd;3j=6.3hz;3j=4.6hz;2h);3.52(dd;3j=6.3hz;3j=4.6hz;2h);3.20(s;12h);2.84(s;12h)。
[0163]
13
c nmr(dmso,150mhz):171.1;165.6;160.9;158.6;158.3;158.1;157.8;155.9;151.0;142.1;141.6;136.0;134.6;132.5;132.0;130.4;130.1;127.6;124.3;119.8;116.7;116.0;114.7;113.7;112.1;64.6;55.4;54.0;49.1;37.7;37.1。
[0164]
hr-ms(esi)(da):m/z c 76
h 78
bn
11 o
82
[m]
2
计算值641.80585,实测值641.80752。
[0165]
hplc分析(梯度a):tr=4.56min。
[0166]
化合物ag49
[0167][0168]
将ag46(120mg;79μmol;1eq)溶解于10ml烧瓶中的2ml acn(乙腈)中。然后添加42mg(166μmol;2.5eq)bsh,并且将反应在40℃下搅拌48小时。将反应混合物转移到falcons管中并离心。去除上清液,再次用acn(3
×
15ml)、dcm(1
×
15ml)、et2o(2
×
15ml)和戊烷(2
×
15ml)洗涤沉淀,分离呈蓝色沉淀物的ag49(62mg,41.9μmol,53%)。
[0169]1h nmr(dmso,500mhz)δ(ppm):8.65-8.63(m;1h);8;48-8.42(m;1h);8.33-8.30(m;4h);8.13-8.11(m;4h);7.82-7.75(m;4h);7.39-7.36(m;4h);7.28-7.27(m;2h);7.09-7.07(m;4h);7.00-6.99(m;1h);6.89-6.85(m;4h);4.17(t;3j=17.9hz;4h);3.97-3.90(m;4h);3.74-3.73(m;6h);3.62(dd;3j=8.0hz;4j=3.1hz;2h);3.59-3.55(m;2h);3.54-3.48(m;4h);3.07(s;12h);3.03(d;3j=8.5hz;1h);2.99(d;3j=8.5hz;1h);2.78-2.73(m;13h);1.03(bs;11h)。
[0170]
hr-ms(esi)(da):m/z c
76h90b10b12n11
na
2
o8s
2
[m 2na]
2
计算值746.90622,实测值746.90811。
[0171]
hplc分析(梯度a):tr=5.32min。
[0172]
化合物ag58
[0173][0174]
将ag35-3(35mg;0.029mmol;1eq)溶解于50ml烧瓶中的3ml dmf中。然后引入溶解于3ml dmf中的25mg hbtu(2-(1h-苯并三唑-1-基)-1,1,3,3-四甲基脲六氟磷酸酯,六氟磷酸苯并三唑四甲基脲)(0.067mmol;2.3eq),之后引入40μl dipea(0.232mmol,8eq)。在氩气下将反应在室温下搅拌30分钟。将h2n-ch
2-ch-(so
3-)2(tba或四丁基铵盐)(61μl,0.030mmol,1.1eq)在3ml dmf中的0.5m溶液添加到反应介质中,然后将其在室温下搅拌1小时。然后将在3ml dmf中的14mg(0.030mmol,1.1eq)tota-boc添加到溶液中,将其在室温下再搅拌1小时。将反应混合物蒸发至干,溶解于30ml acn中,然后添加15ml hcl(3m)。将反应在40℃下搅拌2小时。将反应粗产物蒸发至干并通过半制备型hplc(梯度25%
→
100%,程序40min)纯化,冷冻干燥,得到呈绿色粉末的纯ag58(7mg,5μmol,18%)。
[0175]1h nmr(dmso,500mhz)δ(ppm):8.69(t;3j=4.4hz;1h);8.50(t;3j=5.5hz;1h);8.23(d;3j=8.9hz;4h);8.12(d;3j=9.0hz;4h);7.94(d;3j=8.3hz;2h);7.90(d;3j=8.3hz;2h);7.63(d;3j=8.3hz;2h);7.60(bs;3h);7.56(d;3j=8.3hz;2h);7.18(s;2h);6.98(d;3j=8.9hz;4h);6.87(d;3j=8.9hz;4h);4.60(s;2h);4.28(s;2h);3.95(t;3j=4.4hz;2h);3.80(s;2h);3.72(t;3j=4.9hz;1h);3.63(s;6h);3.51-3.41(m;12h);3.33(dd;3j=12.4hz;3j=6.6hz;4h);3.07(s;12h);3.06-3.01(m;4h);2.85-2.82(m;2h);2.72(s;6h);1.79-1.73(m;4h);1.60-1.55(m;2h)。
[0176]
hr-ms(esi)(da):m/z c
76h93
bn
10o13s22
[m]
2
计算值714.32235,实测值714.32560。
[0177]
hplc分析(梯度a):tr=4.32min。
[0178]
化合物ag60
[0179][0180]
将ag57-3(21mg;0.021mmol;1eq)溶解于2ml dmf中。将20mg(0.052mmol;2.5eq)hbtu溶解于2ml中,然后添加到ag57-3溶液,之后添加32μl(0.160mmol;8.6eq)dipea。在氩气下将反应混合物在30℃下搅拌。30分钟后,添加10mg(0.024mmol;1.1eq)tota-boc,并且将溶液在30℃下搅拌1.5小时。减压去除溶剂,通过硅胶色谱柱(洗脱液:100%dcm
→
50/50dcm/meoh)纯化所得残余物,使tota中间产物作为黑色固体分离。
[0181]
然后,在氩气下的25ml烧瓶中,将先前的中间产物溶解于4ml无水dcm中。添加碘甲烷(1ml,大量过量),并且将反应在室温下搅拌1小时。减压去除溶剂,并且将所得残余物溶解于20ml acn中。添加10ml hcl水溶液(3m),并且将反应在40℃下搅拌2小时。将反应介质蒸发至干并通过半制备型hplc(20%acn梯度
→
100%,30min)纯化,然后冻干过夜以分离呈蓝色固体的纯ag60(4mg,2.4μmol,14%)。
[0182]1h nmr(acn,500mhz)δ(ppm):8.21-8.19(m;2h);8.18-8.15(m;2h);8.11-8.08(m;4h);7.89(t;3j=8.6hz;2h);7.86(s;1h);7.52(bs;3h);7.36(d;3j=8.0hz;1h);7.32(d;3j=8.1hz;1h);7.04-7.01(m;4h);7.00(d;3j=8.7hz;2h);6.89-6.86(m;4h);4.01(s;1h);3.86(s;1h);3.85(s;1h);3.81(s;1h);3.80(s;3h);3.76(s;3h);3.66(q;j=5.5hz;2h);3.60-3.58(m;4h);3.57-3.55(m;6h);3.53(t;3j=5.8hz;2h);3.44(quin;3j=6.4hz;3h)3.35(s;1h);3.08(s;12h);2.83(s;5h);2.70(s;3h);2.66(s;3h);2.60(s;3h);1.90-1.85(m;3h);1.83-1.78(m;2h)。
[0183]
hr-ms(esi)(da):m/z c
67h85
bn9o
63
[m]
3
计算值374.22331,实测值374.22292。
[0184]
hplc分析(梯度a):tr=4.18min。
[0185]
化合物ag47
[0186][0187]
在10ml烧瓶中,将2-氨基乙基马来酰亚胺盐酸盐(10.3mg;58μmol;1eq)溶解于2ml acn中。然后添加
10
b-bsh(12.3mg;58μmol;1eq),并且将反应在室温下搅拌1小时。将反应粗产物蒸发至干,以分离呈白色固体的ag47(23mg;58μmol;1eq)。
[0188]
化合物ag66
[0189][0190]
在100ml烧瓶中,将ag38(200mg;178μmol;1eq)溶解于16ml dmf中。将hbtu(158mg;406μmol;2.3eq)溶解于16ml中,然后添加到反应中,之后添加dipea(248μl;800μmol;8eq)。在氩气下将反应在室温下搅拌30分钟。将ag47(72mg;186μmol;1.05eq)溶解于16ml dmf中并添加到反应介质中。将反应在室温下搅拌1小时。在添加前将tota-boc(78mg;186μmol;1.05eq)溶解于16ml dmf中。1小时后,将烧瓶的内容物转移到分液漏斗中,并且添加100ml dcm和50ml h2o。分离两相,用dcm(3
×
50ml)萃取水相。合并有机相,用盐水(1
×
100ml)洗涤并蒸发至干。将所得的粗产物溶解于40ml acn中,并且添加15ml hcl(3m)。将混合物在40℃下搅拌2小时,将粗产物蒸发至干,然后通过半制备型hplc(梯度a)纯化。将所得产物在cl-离子交换树脂(ira 410)上运行,以分离呈绿色沉淀物的ag66(33mg;21μmol;12%)。
[0191]1h nmr(acn-d3/d2o,600mhz,343k)δ(ppm):8.19(d,3j=8.2hz;4h);8.07(d 3
j=8.3hz,4h);7.68-7.64(m,4h);7.35-7.22(m;10h);7.11(s,2h);7.01-6.99(m,4h);4.10(s;2h);3.95(s;2h);3.78(s,2h);3.65-3.63(m,8h),3.55-3.52(m,12h);3.50-3.48(m,3h);
3.42-3.38(m,2h),3.35-3.32(m,2h),3.04-3.02(m,2h);2.99-2.96(m,1h);2.92-2.88(m,1h);2.74(s,6h);2.66(s,6h),1.85(p,3j=5.9hz,2h);1.80-1.76(m,2h);1.21(bs;11h)。
[0192]
13
c nmr(acn-d3/d
2 o,125mhz,343k)δ(ppm):28.1;30.3;30.4;38.9;39.4;39.8;41.1;41.1;43.3;43.4;45.3;51.7;56.4;56.6;57.4;67.4;67.5;70.1;70.3;71.1;71.2;71.2;71.2;71.3;71.4;88.2;115.9;119.1;125.8;129.4;129.6;129.6;129.9;131.3;131.4;132.5;132.6;134.1;134.3;134.4;137.7;138.1;138.2;142.3;144.5;147.9;159.2;163.3;169.6;169.6;180.4;181.9。
[0193]
11
b nmr(acn-d3/d2o,193mhz,343k):-9.39(bs,aza-bodipy);-14.59(bs,bsh);-16.20(s,bsh);-19.10(bs,bsh)。
[0194]
10
b nmr(acn-d3/d2o,64mhz,343k):-9.08(bs,aza-bodipy);-16.27(s,bsh);-17.28(s,bsh)。
[0195]
hr-ms(esi)(da):m/z c
80h10711b10b12n11
o9s
[m]
计算值1528.96140,实测值1528.96362。
[0196]
hplc分析(梯度a):tr=4.53min。
[0197]
实施例2:小动物荧光成像过程
[0198]
根据当前的伦理建议,将五周龄的雌性nmri nu/nu小鼠分成5只一组,随意进食和饮水,并在12:00至12:00提供日/夜照明。
[0199]
在6周龄时,将u87mg肿瘤细胞(3百万/100μl)皮下注射到右下肢:在注射过程中通过气体麻醉使动物镇静。在肿瘤发展期间(这意味着约3周)将动物放回笼中。
[0200]
当肿瘤达到约100mm3或更大时,将含有ag22化合物的溶液(25μg/小鼠至50μg/小鼠)静脉注射到置于气体麻醉下的动物的尾静脉中。然后在外部成像阶段期间唤醒动物。对于每个成像会话,将动物置于气体麻醉下,进行成像,然后将动物放回笼子。
[0201]
在830nm激发下进行成像,然后使用1064nm和1700nm之间的长通滤波器收集荧光信号。
[0202]
我们在注射ag22化合物之前和24小时后观察到(图1)右后腿具有u87mg肿瘤的小鼠。上图用nir成像记录。fluo800对应于780nm的激发和830nm和900nm之间的收集。下图在830nm(swir800)处激发,并且使用1064nm长通滤波器收集发射。
[0203]
用化合物ag66重复该实验。
[0204]
我们分别从左到右观察右后腿上具有u87mg肿瘤的小鼠:注射ag66化合物之前、5小时后和48小时后。
[0205]
因此,可以在1000nm至1700nm的波长范围内观察到根据本发明的化合物:这些波长有助于以更好的分辨率进行深入检测。
[0206]
根据本发明的化合物还允许递送小化合物,诸如硼配合物。
[0207]
参考文献表
[0208]
[1]bruns等人,nat biomed eng.2017;doi:10.1038/s41551-017-0056/carr等人,proc natl acad sci u s a.2018 115(17):4465-70/thimsen等人,nanophotonics 2017;6(5):1043-1054)。
[0209]
[2]pac,1996,68,2193(basic terminology of stereochemistry(iupac recommendations 1996)),第2205页。
[0210]
[3]gravier等人,mol pharm.2014;doi:10.1021/mp500329z.,第3134页。
[0211]
[4]等人,nanomedicine.2013;doi:10.1016/j.nano.2012.08.005,第376页。
[0212]
[5]garcia等人,biomater sci.2018;doi:10.1039/c8bm00396c,第1755页。
[0213]
[6]reagan-shaw等人,faseb j,2007,第22卷,第660页,doi:10.1096/fj.07-9574lsf。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。