一种抗cd16和ca125抗原的双特异性抗体
技术领域
1.本发明公开了一种多肽,更具体地,公开了一种抗体,属于免疫学领域。
背景技术:
2.ca125 (cancer antigen 125)卵巢癌相关抗原发现于1981年,是卵巢上皮性类癌的相关性抗原。由胚胎期上皮细胞分泌,正常情况下不分泌或极少分泌,但是当卵巢发生恶性病变时,即使临床上没有表现或病理上难以识别时,ca125值也会升高,因而是较好的卵巢癌诊断及筛查指标,并与卵巢癌的转移及预后有密切关系。ca125最初是由bast等通过卵巢细胞系ovca433免疫原介导鼠源性单克隆抗体oc125应答,继而识别并确认其存在。ca125抗原为相对分子质量达200 ku的糖蛋白,兼有膜结合型与游离型两种态性,是迄今为止研究最全面的卵巢癌血清标志物之一。90%进展期的卵巢癌患者血清中的ca125浓度都会呈现不同程度的升高。
3.尽管卵巢癌患者首选手术或化疗等方法,但其预后仍不十分理想。 肿瘤复发,尤其是腹腔内复发,以及化疗耐药,往往是影响预后的重要因素。目前,卵巢癌新的治疗方案,特别是生物治疗技术发展迅速,且已部分应用于离体和体内研究及临床试验中。卵巢癌生物治疗包括细胞因子、单克隆抗体、转基因疗法等多种形式。在诸多途径中,卵巢癌相关抗原ca125单克隆抗体疗法较为引人瞩目。目前ca125单克隆抗体治疗卵巢癌的技术包括抗原抗体复合物介导人体免疫应答和放射性元素与抗肿瘤药物靶向性诱导两类。抗原抗体复合物介导免疫是依靠激发机体内源性抗肿瘤反应,达到清除病灶、自我修复调控的目的。应用于该技术中最具代表性的抗体为抗ca125/抗t细胞表面分子双特异性抗体 (bsab)和鼠源性单克隆抗体b43.13。抗ca125/抗 t细胞表面分子双特异性抗体通过与卵巢癌细胞表面ca125抗原结合,继而以抗t细胞表面分子表位识别诱导t细胞,产生t细胞针对肿瘤组织的细胞毒作用,将病灶杀灭。除此之外,该疗法还能激发机体自身产生和维持较长时间的主动免疫状态。目前抗ca125/抗t细胞表面分子bsab虽然表现出优异的治疗效果,但是仍有较多问题亟待解决,比如详细的体内药物代谢动力学特征尚不明确;制备工艺人源化水平较低且毒副反应较明显;bsab、肿瘤及t淋巴细胞的特异性和亲和力方面均需进一步提高;抗体fc片段功能仍需改良;抗体肿瘤组织渗透性不高,由此带来了体内肿瘤定位不强、非目的清除率较高的技术问题。鼠源性单克隆抗体b43.13则通过结合ca125抗原形成免疫复合物,启动经典的独特型免疫应答,其作用机制为人源的抗鼠抗体激活抗独特型链式反应,进而引起针对ca125的多克隆抗体体液免疫应答。此免疫应答疗法耐受性好,无不良反应或非依从等暂停用药情况,但无法始终保持人体对肿瘤细胞的敏感应答状态,亦不能克服肿瘤免疫逃逸机制。放射性元素与抗肿瘤药物靶向性诱导技术是另外一种ca125单克隆抗体治疗技术。卵巢癌肿瘤细胞减灭术后,残留癌细胞仍在腹腔内种植。一般情形下,这类种植细胞或细胞簇临床不易发现,化疗耐药率高,但其在放射免疫破坏下却相当脆弱。基于该特点,卵巢癌放射免疫疗法发展迅猛。目前的放射免疫疗法主要选择含抗ca125表位的鼠源性单克隆抗体,同位素标记后,靶向定位及放疗。多项试验证实,放射元素标记后,ca125单克隆抗
体与其抗原的亲和性并不减弱。然而,传统的单克隆抗体直接放射标记法缺陷较多,尤其是网状内皮系统中放射毒性蓄积及实体瘤疗效欠佳。网状内皮系统蓄积,极大地削弱了同位素标记抗体靶向定位率。至于实体瘤放射免疫疗效欠佳,一般归咎为肿瘤组织摄取浓度低于最适放疗浓度,血浆清除率低及骨髓毒性等。
4.基于ca125在临床诊断方面所表现出的突出特性以及在肿瘤治疗领域的巨大应用前景,研发出针对ca125的特异性结合抗体,改善临床诊断和治疗效率成为现有技术的迫切需求。但是基于传统抗体的一些缺点,例如亲和力不高,免疫识别效率低下,对于一些隐蔽程度较高的抗原难以达到理想的结合和中和效果。双特异性抗体是近几年发展起来的一种抗体技术,可以同时识别2种不同的抗原。自然杀伤细胞(natural killer,nk cells)是机体具有细胞毒性的免疫细胞之一,表达cd56和cd16,在肿瘤的免疫治疗中发挥抗肿瘤效应。nk细胞可以在未致敏的情况下,具有很强的杀伤肿瘤细胞和病毒感染性细胞的活性。一个nk细胞可以裂解体积超过其几倍的肿瘤细胞。最近的研究表明,与活化的t淋巴细胞不同,nk细胞更倾向于杀伤肿瘤干细胞[ames e,canter rj,grossenbacher sk,et al. nk cells preferentially target tumor cells with a cancer stem cell phenotype. the journal ofimmunology,2015,195(8):4010-4019]。nk细胞在肿瘤的免疫治疗中发挥抗肿瘤效应的重要机制之一就是adcc作用。而cd16分子就是nk细胞启动adcc效应过程中不可或缺的条件,在许多基于抗cd16抗体的肿瘤治疗中,由于只能特异性连接一个抗原靶点,其特异性相对较低,易产生脱靶效应。利用双特异性抗体,可以研发同时针对肿瘤细胞和nk细胞的双特异性抗体,在识别肿瘤细胞抗原,诱导adcc效应的同时,识别效应nk细胞,将nk细胞引导到肿瘤细胞的附近,加强效应nk细胞对肿瘤细胞的杀伤作用,如ca125抗原和nk细胞的cd16抗原。
[0005]
纳米抗体是一类仅有重链二聚体(h2)的抗体,分子量只有15kda,大约10纳米的直径,其主要是igg2和igg3类型,此类抗体由于缺乏轻链,于是将这种抗体称为仅有重链的抗体(heavy chain only like antibody,hcabs),而它们的抗原结合部位由一个结构域组成,称为vhh区,因此该类抗体也被称为单结构域抗体或者单域抗体(sdab)。这种仅有重链的抗体原来只是作为一种人类b细胞增生性疾病(重链病)的病理形式被人们所认识,其可能是由于基因组水平的突变和缺失而导致重链ch1结构域不能表达,使得表达出的重链缺乏ch1,从而缺乏与轻链的结合能力,因此形成一种重链二聚体。相对于常规的四链抗体的scfv而言,纳米抗体在亲和力方面与其对应的scfv相当,但在可溶性、稳定性、对聚集的抗性、可重折叠性、表达产率以及dna操作、文库构建和3-d结构测定的容易性方面超越scfv。纳米抗体有来源于成年骆驼体内hcabs的最小的功能性抗原结合片段,具有高度稳定性和与抗原结合的高亲合力,能与蛋白裂隙和酶活性位点相互作用,使之作用类似于抑制剂。因此,纳米抗体可以为从肽模拟药物设计小分子酶抑制物提供新的思路。由于仅有重链,纳米抗体的制造较单克隆抗体容易。纳米抗体的独特性质,如处于极端温度和ph环境中的稳定性,可以低成本制造大产量。因此,纳米抗体在疾病的治疗和诊断中具有很大的价值,在肿瘤的抗体靶向诊断和治疗中也具有很大的发展前景。
[0006]
基于在肿瘤治疗领域现有技术中的单一识别位点或者传统抗体分子较大难以到达作用细胞等问题,本发明的目的就是提供一种同时针对肿瘤细胞和nk细胞的双特异性纳米抗体,在识别癌细胞的ca125抗原,抑制ca125诱导肿瘤细胞增殖等作用的同时,特异性识
别nk细胞,将nk细胞引导到肿瘤细胞的附近,加强nk细胞对肿瘤细胞的杀伤作用。
技术实现要素:
[0007]
基于上述发明目的,本发明首先提供了一种抗nk细胞表面抗原cd16的纳米抗体,所述纳米抗体的可变区具有3个互补决定区cdr1、cdr2、cdr3,其中,cdr1序列由seq id no.1所述氨基酸序列组成,cdr2序列由seq id no.2所述氨基酸序列组成,cdr3序列由seq id no.3所述氨基酸序列组成。
[0008]
在一个优选的技术方案中,所述纳米抗体的可变区序列由seq id no.4所述氨基酸序列组成。在本发明中具有该可变区序列的纳米抗体的一个优选实施例为纳米抗体6b8。
[0009]
其次,本发明还提供了一种编码上述纳米抗体的核酸,所述核酸的序列由seq id no.5所示。
[0010]
第三,本发明提供了一种含有上述核酸的表达载体,所述表达载体为pmes4。
[0011]
第四,本发明提供了一种含有上述表达载体的宿主细胞,所述宿主细胞为大肠杆菌bl21 (de3)。
[0012]
第五,本发明还提供了一种双特异性纳米抗体,所述双特异性抗体含有第一重链和第二重链,所述第一重链的可变区识别cd16抗原,其可变区序列由seq id no.4所述氨基酸序列组成;所述第二重链的可变区识别ca125抗原,其可变区序列由seq id no.6所述氨基酸序列组成。
[0013]
在一个优选的技术方案中,所述第一重链和第二重链之间设有连接肽,所述连接肽为(g4s)n,其中n为1-6之间的整数。
[0014]
更为优选地,所述n=4,所述双特异性抗体的氨基酸序列如seq id no.7所示。
[0015]
第六,本发明还提供了一种编码上述双特异性抗体的核酸,所述核酸的序列由seq id no.9所示。
[0016]
尤为优选地,在所述双特异性抗体的羧基端还带有抗体恒定区,其恒定区序列如seq id no.8所述的氨基酸序列所示。
[0017]
第七,本发明还提供了一种编码上述带有恒定区的双特异性抗体的核酸,所述编码序列由seq id no.10所示。
[0018]
第八,本发明提供了一种含有上述核酸的表达载体,所述表达载体为pfuse higg1-fc2。
[0019]
第九,本发明提供了一种含有上述表达载体的宿主细胞,所述宿主细胞为hek293细胞。
[0020]
最后,本发明还提供了所述抗nk细胞表面抗原cd16的纳米抗体以及上述的双特异性抗体在制备肿瘤治疗药物中的应用。
[0021]
本发明提供的抗cd16纳米抗体具有较高的亲和力,双特异性纳米抗体可以分别识别ca125抗原和nk细胞表面的cd16抗原。在针对ovcar-3的adcc细胞毒性实验中,本发明提供的双特异性抗体显示出了优异的细胞毒性,显著增强抗体介导的nk细胞杀伤肿瘤靶细胞的活性,其杀伤率达到86%,高于ca125抗体和cd16抗体的联合应用,更显著高于两种抗体的单独应用。且本发明提供的双特异性抗体与单独纳米抗体相比具有较长的体内半衰期,这显示出本发明的双特异性抗体在临床治疗ca125抗原阳性的肿瘤以及药物制备领域的应用
价值。
附图说明
[0022]
图1. 提取的总rna电泳鉴定图;图2. 第一轮pcr扩增抗体可变区基因电泳鉴定图;图3. 第二轮pcr扩增抗体可变区基因电泳鉴定图;图4. pmes4载体双酶切反应产物电泳鉴定图;图5. 菌落pcr鉴定转化子电泳鉴定图;图6. 纳米抗体6b8纯化sds-page图;图7. biacore分析纳米抗体6b8亲和力曲线图;图8. 双特异性抗体纯化sds-page图;图9. adcc细胞毒性试验结果图;图10. 双特异性抗体与纳米抗体在兔体内的代谢曲线图。
具体实施方式
[0023]
下面结合具体实施例来进一步描述本发明,本发明的优点和特点将会随着描述而更为清楚。但这些实施例仅是范例性的,并不对本发明的权利要求所限定的保护范围构成任何限制。
[0024]
实施例1. 抗cd16单价纳米抗体的制备1.1羊驼的免疫选取健康成年羊驼一只,将重组人源cd16抗原(厂家:abcam,货号为ab151819)与弗氏佐剂按1:1的比例混匀,按6-7μg/kg采用背部皮下多点注射的方式免疫羊驼,共免疫四次,免疫间隔为2周。之后采集羊驼外周血10ml,用于构建噬菌体展示文库。
[0025]
1.2驼源淋巴细胞的分离将采集的羊驼外周血利用骆驼外周血淋巴细胞分离液试剂盒(天津灏洋公司,货号lts1076)说明书操作进行分离淋巴细胞,每2.5
×
107个活细胞加入1ml rna分离试剂,取1ml进行rna提取,其余-80℃保存。
[0026]
1.3总rna提取将含有淋巴细胞的1ml tipure isolation reagent反复吹打,放置5分钟;加入200μl氯仿,涡旋30秒后继续放置5分钟;4℃,12000g离心15分钟,吸取水相转入新的ep管中;加入等量异丙醇,放置10分钟;4℃,12000g离心10分钟,弃上清;用1ml预冷的70%乙醇洗涤,4℃,7500g离心5分钟,弃上清并干燥5分钟;加入30μl rnase-free水溶解沉淀,调整浓度到1μg/μl进行凝胶电泳检测,结果见图1。
[0027]
1.4反转录合成cdna根据逆转录试剂盒说明书(roche公司 的transcripor first stand cdna synthesis kit)以1.3步骤获得的rna为模板进行逆转录cdna。
[0028]
1.5抗体可变区基因扩增将反转录得到的cdna作为模版进行pcr反应。扩增共进行两轮,第一轮pcr的引物序列如下:
call001:gtcctggctgctcttctacaaggcall002:ggtacgtgctgttgaactgttccpcr反应条件及程序为:95℃ 5分钟;95℃ 30秒,57℃ 30秒,72℃ 30秒,30个循环;72℃ 7分钟。使用琼脂糖凝胶回收试剂盒胶回收700bp左右的条带,最终用水调整核酸浓度至5ng/μl(图2:m为trans 2k dna marker;1为阴性对照;2为第一轮pcr产物)。第二轮pcr的引物序列如下:vhh-back:gatgtgcagctgcaggagtctggrggaggvhh-for:ctagtgcggccgctggagacggtgacctgggtpcr反应条件及程序为:95℃ 5分钟;95℃ 30秒,55℃ 30秒,72℃ 30秒,15个循环;72℃ 7分钟。使用pcr产物回收试剂盒纯化pcr产物(图3:m为trans 2k dna marker;1为第二轮pcr产物;2为阴性对照)。
[0029]
1.6载体构建将pmes4(购自biovector)与第二次pcr产物分别进行 psti、bsteii双酶切,取1.5μg酶切后载体和450ng酶切后的第二次pcr产物,加15μl t4 dna连接酶,补充缓冲液和水至150μl总体积,16℃过夜连接并回收连接产物。使用pcr产物回收试剂盒进行产物回收,20μl水洗脱。1%琼脂糖电泳凝胶检测pmes4载体双酶切结果(图4:m为trans 5k plus dna marker;1为pmes4载体未酶切质粒;2为pmes4载体双酶切后产物)。
[0030]
1.7电转化及库容测定取10μl纯化后的连接产物,加入到含有50μl大肠杆菌tg1感受态细胞的预冷电转杯中置入电转仪(美国btx的ecm630电转仪)进行电转化,取出电转杯,复苏并培养转化子。随机挑选克隆,进行菌落pcr鉴定(图5:m为trans 2k dna marker;1为阴性对照;2-11为随机挑选的单克隆pcr鉴定产物)。根据pcr阳性率推算库容(库容量=克隆数
×
稀释倍数
×
pcr鉴定阳性率
×
10)。引物序列如下:mp57:ttatgcttccggctcgtatggiii:ccacagacagccctcatag1.8噬菌体扩增取复苏的菌液接种至yt-ag培养基中,37℃ 200rpm培养到培养物od
600
=0.5。取出10ml菌液加入4
×
10
10
vcsm13,37℃静止感染30分钟。4000rpm,常温离心10分钟,去净上清。用2
×
yt-ak(含氨苄青霉素和卡那霉素)培养基重悬菌体,37℃ 200rpm培养过夜。离心取上清40ml管中,加入10ml peg/nacl(20%/2.5m)溶液充分混合,离心弃上清,沉淀用1ml冰pbs洗涤离心,取上清250μl预冷的peg/nacl,充分混匀并洗涤重悬。
[0031]
测定噬菌体滴度:将tg1培养至od
600
=0.4,用lb培养基梯度稀释噬菌体,取倍比稀释的噬菌体tg1培养物混合培养,次日观察培养板中噬菌斑形成情况,对噬菌斑数在30-300的稀释梯度平板进行计数并按照下列公式计算噬菌体滴度(pfu):噬菌体滴度(pfu/ml)=稀释倍数
×
噬菌斑数目
×
100。
[0032]
1.9纳米抗体筛选通过elisa方法以抗原筛选阳性克隆。以抗原包被elisa板,5% bsa封闭,pbst洗涤。每孔加入100μl噬菌体上清液,37℃放置1小时。弃上清,加入hrp标记的小鼠抗m13的二抗,37℃放置1小时。弃上清,加入tmb溶液,室温孵育5小时,每孔加入2m硫酸终止液,用酶标
仪450nm读数。
[0033]
1.10纳米抗体在大肠杆菌中的表达和纯化挑选噬菌体elisa结果阳性的克隆,提取质粒并转化至菌株bl21感受态细胞,以iptg诱导纳米抗体蛋白表达,收集上清(周质提取物),并将周质提取物透析至pbs,使用ni-nta树脂进行纯化,使用不同浓度咪唑进行洗脱和收集,将收集的样品进行还原型蛋白电泳分析,最后将纳米抗体透析到pbs中。
[0034]
通过羊驼免疫、细胞分离、噬菌体文库的构建、纳米抗体的筛选,筛选出抗cd16的纳米抗体。用vector nti软件对测序结果进行抗体轻链和重链基因的分析,以确定可变区的框架区(framework regions,fr)和互补决定区(complementary determining regions,cdr)。
[0035]
本发明筛选到的一个优选实施方案的纳米抗体被命名为“6b8”。通过dna测序,所述纳米抗体6b8重链核酸序列为seq id no. 5所示,可变区氨基酸序列为seq id no. 4所示,其中第1-25位氨基酸序列为fr1,第26-33位氨基酸序列为cdr1,第34-50位氨基酸序列为fr2,第51-58位氨基酸序列为cdr2,第59-96位氨基酸序列为fr3,第97-107位氨基酸序列为cdr3,第108-118位氨基酸序列为fr4。
[0036]
实施例2. 纳米抗体6b8的制备2.1纳米抗体原始菌株tg1扩增及纳米抗体重组质粒转化大肠杆菌bl21(de3)将含有纳米抗体核酸的原始菌株tg1甘油菌,按照1:1000比例接种于5ml新鲜的lb-a培养基,37℃ 200rpm过夜培养。次日,使用plasmid mini kit(omega)按照说明书提取质粒。经验证后将上述质粒1μl转化于100μl感受态细胞中,轻轻混匀,在冰上放置30分钟,42℃水浴热击90秒,冰浴冷却3分钟。向离心管加入600μl lb培养基,37℃振荡培养60分钟。取上清100μl,用三角涂布器涂布在lb-a平板上,37℃倒置培养过夜。
[0037]
2.2纳米抗体的诱导表达挑取上述单克隆菌落于lb-a培养基中,37℃振荡培养过夜。次日,取该菌液按照1:100比例加入100ml新鲜lb-a培养基,37℃振荡培养3小时至菌液od
600
=0.8左右,加入终浓度为1mm iptg,30℃诱导过夜。第三日,8000rpm,离心10分钟收集菌体,加入1.5ml的预冷tes缓冲液重悬沉淀。冰浴2分钟后,轻柔振荡30秒,重复此循环6次。加3.0ml tes/4(将tes用水稀释4倍),轻柔振荡30秒后,冰浴静置2分钟,同样重复振荡和静置步骤共6次。9000rpm,4℃离心10分钟,收集约4.5ml的上清(周质提取物)。
[0038]
2.3纳米抗体的纯化和鉴定将imac sepharose(ge公司)重悬后,取2ml加入到重力柱内,静置30分钟,使sepharose自然沉降于重力柱底部,流出保存缓冲液。加入2倍柱体积的硫酸镍溶液(0.1m),按照约8秒/滴的流速流出硫酸镍溶液;加入10倍柱体积的平衡缓冲液平衡并洗涤sepharose,流速维持不变;将样品使用平衡缓冲液2倍稀释后,加入重力柱中,调节流速为6秒/滴,收集穿透液;加入10倍柱体积洗涤缓冲液洗涤sepharose,维持流速不变,收集洗涤液;加入3倍柱体积的洗脱缓冲液,流速维持在6秒/滴,收集含有目的蛋白的洗脱液;最后依次加入10倍柱体积的平衡缓冲液、10倍柱体积的纯水和10倍柱体积的20%乙醇洗涤sepharose,并最终保留4ml的20%乙醇来保存柱子。上述收集的样品分别进行sds-page检测(图6: m为彩虹180广谱蛋白marker;1为大肠杆菌诱导表达纯化后的纳米抗体6b8)。
(ggggs)
4-6b8。利用ecorⅰ和bglⅱ将融合纳米抗体的目的片段切割下来,通过t4连接酶连接入pfuse higg1-fc2载体,构建重组质粒pfuse higg1-fc2-5d2-(ggggs)
4-6b8,转化dh5α感受态后利用无内毒素大提试剂盒(天根公司)提取质粒。转染人293细胞,采用protein a层析的方法从293细胞的培养上清中纯化双特异性纳米抗体,并将纯化后的双特异性纳米抗体进行sds-page分析(图8:1为纯化后的双特异性纳米抗体;m为彩虹180广谱蛋白marker)。所述抗ca125和cd16双特异性抗体具有如seq id no.8所示的恒定区。带有恒定区的抗ca125和cd16双特异性抗体融合蛋白的编码序列如seq id no.10所示。
[0044]
实施例5. adcc细胞毒性试验5.1 白细胞分离取静脉血2ml,放入加有抗凝剂的试管中,轻轻混匀。将试管直立静置于室温或37℃温箱中30-60min,待红细胞自然沉降。此时可见试管中的悬液分3层,上层为淡黄色血浆,底层为红细胞,在紧贴红细胞层上有一呈灰白色的白细胞层(正常人外周血白细胞)。用毛细管吸取位于红细胞层上面的富含白细胞的细胞悬液,移入另一试管中。加入无ca
2
、mg
2
hank’s液至离试管口3cm处,混匀,以水平离心机2000r/min离心10min,弃上清,相同方法洗涤两次。沉淀细胞用适量10%-20%灭活小牛血清的hank’s液重悬,计数,配成所需的细胞浓度的悬液,一般常用2
×
106/ml。
[0045]
5.2 肿瘤细胞的培养将高表达ca125的ovcar-3细胞(人卵巢癌细胞,购买于atcc)在含10%胎牛血清中的rpmi-1640培养基中培养至75-80%的密度,弃培养基,用预热至37℃的pbs洗涤细胞2次,加2ml胰蛋白酶-edta溶液,室温放置5min,加2ml含10%胎牛血清的培养基终止反应,采用一次性的无菌吸管反复吹打细胞至单细胞悬液,以水平离心机2000r/min离心10min,弃上清,pbs再洗涤两次,计数后,用培养基重悬细胞至2
×
106个/ml备用。
[0046]
5.3 细胞毒性试验取重悬肿瘤细胞10μl(2
×
104个),加入含0.1%bsa的rpmi-1640培养基30μl,然后分别加入不同的抗体10μl(1mg/ml),37℃孵育30min,然后加入5
×
105个(效应细胞/靶细胞=25)pmbc,体积为250μl,37℃孵育4h,以水平离心机2000r/min离心10min,取上清采用roche细胞毒性检测试剂盒检测上清中ldh的活性以换算成肿瘤细胞的死亡程度,试剂盒的货号为:11644793001。结果如图9所示。
[0047]
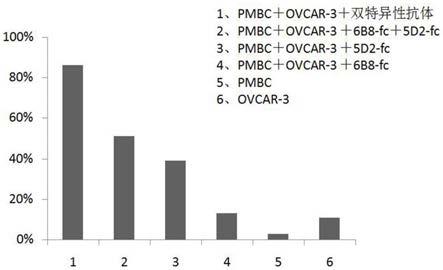
如图9所示,纵坐标为ovcar-3细胞的死亡率,横坐标1-6号样本依次为pmbc ovcar-3 双特异性抗体、pmbc ovcar-3 5d2-fc 6b8-fc、pmbc ovcar-3 5d2-fc、pmbc ovcar-3 6b8-fc、单纯的pmbc和单纯的ovcar-3细胞(其中5d2-fc和6b8-fc的制备方法同实施例4,5d2-fc的氨基酸序列如seq id no.11所示,核酸序列如seq id no.12所示,6b8-fc的氨基酸序列如seq id no.13所示,核酸序列如seq id no.14所示)。本发明提供的双特异性抗体为柱1,其显著增强抗体介导的nk细胞杀伤肿瘤靶细胞的活性,显示出了优异的细胞毒性,杀伤率高达86%(横坐标6种样本的杀伤率依次为86%、51%、39%、13%、3%和11%),高于抗ca125纳米抗体5d2和抗cd16纳米抗体6b8的联合应用,更显著高于两种抗体的单独应用,这显示出本发明的双特异性抗体在临床治疗ca125抗原阳性的肿瘤的应用价值。
[0048]
实施例6. 双特异性纳米抗体在家兔血浆中的代谢本实施例以新西兰兔为对象,进行药物代谢动力学的初步研究,每6只新西兰兔为
一组,采取背部皮下给药,双特异性纳米抗体和抗ca125纳米抗体5d2和抗cd16纳米抗体6b8的给药剂量均为1nmol/kg。给药后0.5h、1h、2h、4h、8h、12h、18h、24h、36h、48h、60h、72h、84h、96h、120h、144h进行耳缘静脉采血,分离血清进行抗体滴度的测定,绘制药物滴度时间曲线,结果见图10所示。
[0049]
结果显示纳米抗体在72h后基本已经代谢完毕,纳米抗体处于较低水平,而双特异性抗体在72h后仍然具有很高的浓度,具有治疗效果。使用graphpad prism软件分析药物代谢动力学参数,结果见表1。
[0050]
表1. 纳米抗体和双特异性抗体的家兔体内药物代谢动力学参数表1中,t
max
是指抗体滴度达到最大时的时间;t
1/2
是指抗体达到最大浓度后代谢掉一半时的时间。从表中可以看到,双特异性抗体在新西兰兔体内的半衰期长达48小时,明显长于纳米抗体的24小时。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。