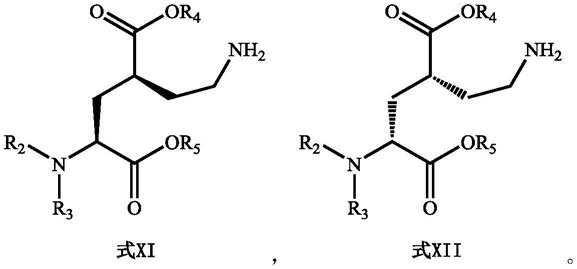
1.本发明涉及细胞生物学技术领域,更具体的是涉及细胞培养技术领域。
背景技术:
2.现有的接触式共培养常常需要将两种细胞分别抽提,分别培养后再合并共培养,过程复杂且混合后存活率低,且需要以乳鼠或胎鼠为材料,材料来源少,细胞培养成本较高,产量相对较低。
技术实现要素:
3.本发明的目的在于:为了解决上述技术问题,本发明提供一种胶质细胞和神经元共培养方法。
4.本发明为了实现上述目的具体采用以下技术方案:
5.一种胶质细胞和神经元共培养方法,包括以下步骤:
6.s1:从成年鼠或老年鼠的脑组织中提取神经元及胶质细胞,通过梯度密度离心法分离获得第二层细胞和第三层细胞,将细胞沉淀用完全培养基重悬后接种到孔板中;
7.s2:接种第1-3天不换液,也不做任何处理;
8.s3:3天后可观察到清晰的悬浮细胞球,开始吸出一半培养基及其中细胞到另一孔中,用完全培养基对两孔培养液进行补足,再继续培养2天。
9.s4:第5天观察细胞数量,如果神经球细胞较多悬浮,再次吸出一半液体及悬浮细胞到一个空孔中,用s3的方法补足培养液;
10.s5:连续分配悬浮细胞及培养基2-3次后,细胞密度达到接触式共培养要求,观察细胞生长状态,经过25-30天的培养,胶质细胞和神经元形成接触式共培养,较为稳定的形成神经元网络和胶质背景。
11.作为优选,培养在37℃二氧化碳培养箱内进行。
12.作为优选,接种时,2ml细胞悬液平均接种到6孔中。
13.作为优选,所述完全培养基包括:25ml neurobasala、0.5ml b27、glutamax和庆大霉素,其中glutamax终浓度为200mm,庆大霉素终浓度为10mg/ml)。
14.作为优选,s1包括以下步骤:
15.s11:将成年鼠或老年鼠麻醉消毒,解剖,将其大脑取出,大脑中的海马体放入冰上带有habg的盘子中进行运输并称重,剥离海马后两侧大脑半球暴露的皮质取出称重,放入4℃含有habg的试管中;
16.s12:将装有组织的试管转移到30℃的摇动水浴中,同时将装有木瓜蛋白酶的试管与装有habg的试管一起放入浴槽中,摇动8分钟以平衡温度;
17.s13:用大口径移液器将组织转移到含有木瓜蛋白酶的试管中,以刚好足以悬浮组织的速度摇晃30分钟;
18.s14:用大口径移液管和少量木瓜蛋白酶将切片转移到装有habg的试管中,在室温
下静置5分钟;
19.s15:反复吹吸组织悬液,在45秒内研磨十次,形成碎片;
20.s16:让碎片静置1分钟,然后将上清液转移到空管中,将沉淀物重新悬浮在habg中,重复操作两次,合并每次获得的上清液,制成6-12ml的悬浮细胞;
21.s17:通过梯度密度离心法分离细胞,取第二层细胞及第三层细胞,吸出的细胞用habg重悬再离心2次,清洗其中碎片及对神经元生长有害的液体。
22.作为优选,s15中研磨包括将组织吸进移液管中,没有气泡,然后立即将内容物排回管中,没有气泡。
23.作为优选,s17中的分离具体为:将细胞悬浮液涂抹在准备好的optiprep密度梯度的顶部,细胞悬液应该漂浮在梯度的顶部,在22℃,1,900转/分下,离心梯度15分钟。
24.作为优选,在细胞分离前3-24小时将蒸压过的玻璃盖玻片放在孔板当中,用poly-lyscm
–
2底物包被玻片,超过1小时或过夜后,吸出并用pbs清洗三次,在通风橱中晾干1小时以上。
25.作为优选,所有操作均在室温的层流无菌罩中进行。
26.本发明的有益效果如下:
27.1.本发明相对于现有的技术步骤更为简化,培养过程中处理较为容易;本技术去除了以往培养过程中,常规在分析细胞后5小时内全量换液的步骤,能够充分的保留早期短时间内未能贴壁的细胞。本发明能用简化的步骤来完成较为复杂的接触式共培养,得到形态功能完整的神经细胞。
28.2.本发明方法分离的神经元和胶质细胞来源于成年鼠或者老年鼠,来源较容易寻找,需要的成本较低,一只大鼠的培养细胞产量亦可完成部分特定的研究,避免大量乳鼠甚至胎鼠的使用,更加符合动物实验的伦理要求,成年鼠脑组织细胞提取后能够稳定的获得接触式共培养的两种细胞,细胞形态美观,结构完整,功能成熟,是研究神经元和胶质细胞的理想对象。
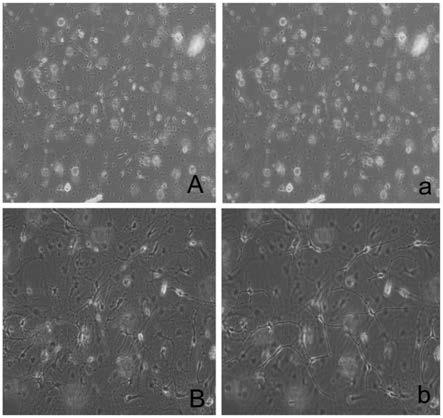
29.3.本发明在细胞分离过程中将胶质细胞和神经元一起采集,不分开采集,合并两层细胞进行接种,依据两种细胞的天然特性,将二者混合培养,自然选择出共生的两种细胞,解决了以往单独获得神经元和胶质细胞后需要用阿糖胞苷纯化神经元,之后再合并胶质细胞共培养的复杂过程。
30.4.常规技术需要在5小时后进行半量换液,本发明方法与常规培养方法不同,由于在培养细胞初期换液其实会损失细胞生长过程中产生的生长因子,经观察初期不换液,细胞并未死亡,避免了生长因子的损失。
31.5.本发明在培养过程中,将培养基中的一半悬浮细胞及培养液转移到另一个准备好的培养板孔中;由于采集的细胞当中,含有一定数量的神经元前体细胞,是形成神经球的重要细胞,且多数悬浮于细胞液中,如果此时换液,大量已经成球的细胞可能被丢弃,而本发明保留换液的培养基,继续培养可最大限度利用已经提取的细胞,提高细胞产量和存活率。
附图说明
32.图1是本发明细胞转移培养过程示意图;
33.图2是本发明胶质神经元接触式共培养的显微图,其中,图a和a为x10、相差;图b和b为x40、相差。
具体实施方式
34.为使本发明实施例的目的、技术方案和优点更加清楚,下面将结合实施例,对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。
35.因此,以下提供的实施例的详细描述并非旨在限制要求保护的本发明的范围,而是仅仅表示本发明的选定实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
36.实施例1
37.本实施例提供一种胶质细胞和神经元共培养方法,包括以下内容:
38.(一)试剂准备:
39.1.b27(invitrogen,货号17504)用于神经元培养
40.2.层粘连蛋白(10mg ml
–
1;例如,sigma,货号l2020),可加入到多聚赖氨酸当中一起包被盖玻片
41.3.庆大霉素(10mg ml
–
1;invitrogen,货号15710)
42.4.glutamax(200mm;ala
–
gln的稳定二肽;invitrogen,目录号35050-061)
43.5.neurobasala(gibco目录号10888022),接触式共培养中完全培养基的主要成分
44.6.poly-d-lys用于包被经过无菌处理的盖玻片
45.7.optiprep密度1.32(sigma,目录号d1556)用于密度梯度离心试剂配制
46.8.habg制备:含有60ml ha、1.2ml b27、0.176ml gin(最终0.5mm)的培养基
47.9.neurobasala完全培养基:其制备需要25ml neurobasala、0.5ml b27,另加入glutamax和庆大霉素(glutamax终浓度200mm,庆大霉素终浓度10mg/ml),该培养基用于分离细胞后种板前重悬细胞沉淀以及接种后细胞培养的整个过程。
48.(二)神经元及胶质细胞分离步骤
49.所有操作均在室温(20
–
23℃)的层流无菌罩中进行。
50.1.培养皿准备
51.在准备分离神经元时,在细胞分离前3-24小时将蒸压过的玻璃盖玻片放在24孔板当中,用100ml poly-lyscm
–
2底物包被玻片。超过1小时或过夜后,吸出并用pbs清洗三次,在通风橱中晾干1小时以上。
52.2.组织分离的准备
53.(1)选取6个-9个月龄(也可9月龄以上)sd大鼠,按照动物伦理操作要求处理大鼠(放入装有2ml异氟醚的容器中)(有些实验室使用戊巴对成年大鼠进行麻醉,运动停止后大约15秒,取出大鼠并通过脚趾捏合缺乏退出反射来确认麻醉。
54.(2)在断头台上斩首,用70%乙醇消毒头部。解剖头骨顶部的皮肤以暴露头骨;将剪刀插入椎管,小心地将一侧的颅骨切近前部,避免损伤大脑,用镊子抓住头骨的底部,向上和向前抬起以暴露大脑;切断嗅球和视神经。轻轻地将大脑从颅骨中取出,转移到带有4℃hibernate的解剖盘中。小心避免接触毛皮。
55.3.组织分离
56.(1)在35毫米直径的培养皿中,在4℃下将大鼠大脑中的海马或其他大脑区域或脊髓快速解剖到2ml habg中。要解剖海马体,将大脑的背侧朝上定向,以便可以看到两个半球的清晰中线。将镊子展开约2毫米,食指放在弯曲镊子的两个边缘的顶部,向下插入背中线约一半深度;挤压以切断脑连合。使用两个尖端轻轻地将一个半球剥离到一边,并切断海马/隔膜交界处。用镊子将海马体放入冰上带有habg的盘子中进行运输并进行称重。
57.(2)剥离海马后两侧大脑半球暴露的皮质取出称重,放入4℃的含有habg的50毫升管中,其中habg有5毫升。
58.(3)将装有组织的50毫升试管转移到30℃的摇动水浴中,同时将装有木瓜蛋白酶的50毫升管与装有habg的15毫升管一起放入浴槽中,摇动8分钟以平衡温度。
59.(4)用大口径移液器将组织转移到含有木瓜蛋白酶的30℃管中,以刚好足以悬浮组织的速度摇晃30分钟(170转/分)。
60.(5)用大口径移液管和尽可能少的木瓜蛋白酶将切片转移到装有habg的15毫升管中,在30℃下含有2毫升habg,并在室温下静置5分钟。
61.(6)用抛光尖端的玻璃巴斯德吸管反复吹吸组织悬液,在45秒内研磨十次。研磨包括将组织吸进移液管中,没有气泡,然后立即将内容物排回管中,没有气泡。研磨太轻不会破坏组织,注意吹吸过程中避免气泡的产生。
62.(7)让碎片静置1分钟,然后将上清液转移到15毫升的空管中。将管中的沉淀物重新悬浮在2ml habg中,再重复操作两次,合并每次获得的上清液,制成6-12ml的悬浮细胞。
63.(8)通过密度梯度离心分离细胞
64.小心地将细胞悬浮液涂抹在准备好的optiprep密度梯度的顶部,细胞悬液应该漂浮在梯度的顶部,对于皮质,使用了两个梯度。
65.22℃下以800g(在摆动桶离心机中为1,900转/分)离心梯度15分钟,还将装有neurobasal培养基的管子在4℃下转移到室温。
66.离心后细胞将被分成4层,取第2、3层用于共培养。
67.(9)将第2、3层吸出,吸出的细胞需用habg重悬再离心2次,清洗其中碎片及对神经元生长有害的液体。
68.4.种板
69.将细胞沉淀用完全培养基重悬后,平均接种到24孔板的6孔中,一般2ml悬液接种6孔留出后两排孔,用于后续的转移培养。补全培养基约0.5ml每孔,放于37℃二氧化碳培养箱培养。
70.5.培养
71.(1)接种第1-3天不换液也不做任何处理。
72.(2)3天后可观察到清晰的悬浮细胞球,开始吸出一半培养基及其中细胞到另一孔中,如图1所示,用完全培养基对两孔培养液进行补足,一般平均达到500ul,再继续培养两天。
73.(3)第5天观察细胞数量,如果神经球细胞较多悬浮,再次吸出一半液体及悬浮细胞到一个空孔中,用同样方法补足培养液。
74.(4)连续分配悬浮细胞及培养基2次后,细胞密度达到接触式共培养要求。
75.(5)观察细胞生长状态。
76.(6)经过25-30天的培养,胶质细胞和神经元形成接触式共培养,较为稳定的形成神经元网络和胶质背景。
77.6.细胞生长状态观察
78.培养成功的状态表现为:神经元细胞贴附在胶质细胞表面,胶质细胞紧贴培养皿底部,形成一宽广平坦的背景,表面的神经元与背景里的细胞不在一个层面,细胞立体,有清晰轮廓,突起丰富可互相连接成网。
79.如图2所示,是在第27天时细胞共培养的显微图,从图中可以看到,神经元细胞贴附在胶质细胞表面;a、b图中为在底部贴附的胶质细胞,a、b图中主要聚焦在表面神经元,背景中胶质细胞仍可见。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。