1.本发明涉及有机合成领域,具体而言,涉及一种2-氧吡咯烷衍生物、其制备方法及中间体的制备方法。
背景技术:
2.2-氧吡咯烷衍生物(式a)是一类非常重要的结构单元,在医药中间体等领域中有着广泛的应用。如(s)-2-((叔丁氧基羰基)氨基)甲基-3-((s)-2-氧吡咯烷-3-基)丙酸甲酯(cas:328086-60-8)(式b)就是其中之一。该化合物最早于2001年报道其合成(tetrahedron lett.2001,42,6807),并用于鼻病毒蛋白(rhinovirus protease)抑制剂rupintrivir(ag7088)中。2021年3月份,辉瑞宣布pf-07321332已经进入1b期临床试验阶段,这是全球首个进入临床试验的口服新冠治疗药物。其中化合物i就可以作为合成pf-07321332的关键中间体,因此该化合物的合成得到了更高的关注度。
[0003][0004]
以(s)-2-((叔丁氧基羰基)氨基)甲基-3-((s)-2-氧吡咯烷-3-基)丙酸甲酯(cas:328086-60-8)为例,文献报道的合成方式有很多,目前普遍采用的为,首先叔丁氧羰基氨基(n-boc)谷氨酸甲酯在双三甲基硅基氨基锂(lihmds)的作用下与溴乙腈发生α-烷基化反应得到氰基中间体2,反应有很高的收率及非对映选择性。接下来的氰基还原目前文献报道有两种方法,普遍采用的是硼氢化钠-氯化钴的还原方法(j.med.chem.,2015,58,9414;ep3835296,2021),可以直接得到目标化合物b。另外还可以通过钯碳或二氧化铂作催化剂,采用催化氢化得到中间体3,然后在碱的作用下关环得到(tetrahedron lett.2001,42,6807;j.med.chem.,2005,48,6767;j.med.chem.,2006,49,4971)。该路线虽然简洁高效,但其中氰基中间体2的还原是整个路线的瓶颈步骤,硼氢化钠-氯化钴或催化氢化的条件均存在收率低,后处理纯化工艺繁琐的问题。
[0005][0006]
近期,文献(j.org.chem.2021,86,13104-13110)中还报道了化合物b的双boc保护类似物的合成路线,同样以n-boc谷氨酸甲酯为原料,在lihmds条件下发生烯丙基化得到化合物4,然后经过叔丁氧羰基(boc)保护得到化合物5,在oso4条件下将双键转化成醛基,与o-甲基羟胺盐酸盐缩合得到化合物7,最后在雷尼镍氢化的条件下还原然后关环得到双boc保护的化合物c。该路线虽然各步收率均很高,但总步数较长,共5步,而且还用到了剧毒的化合物四氧化锇,不能用于放大生产。
[0007]
技术实现要素:
[0008]
本发明的主要目的在于提供一种2-氧吡咯烷衍生物、其制备方法及中间体的制备方法,以解决现有技术中制备2-氧吡咯烷衍生物的效率低的问题。
[0009]
为了实现上述目的,根据本发明的第一个方面,提供了一种2-氧吡咯烷衍生物的制备方法,该2-氧吡咯烷衍生物包括式ix所示的l-2-氧吡咯烷衍生物或式x所示的d-2-氧吡咯烷衍生物;该制备方法包括:a)将五元磺酰胺与谷氨酸酯化合物进行α-烷基化反应,生成磺酸中间体,将磺酸中间体进行酸性水解反应,生成氨基保护中间体;或将氮杂环丙烷与谷氨酸酯化合物进行α-烷基化反应,生成氨基保护中间体;其中,五元磺酰胺的结构式为式i,氮杂环丙烷的结构式为式viii;谷氨酸酯化合物为式ii所示的l-谷氨酸酯化合物或式iii所示的d-谷氨酸酯化合物,相应地,磺酸中间体为式iv所示的l-磺酸中间体或式v所示的d-磺酸中间体,氨基保护中间体为式vi所示的l-氨基保护中间体或式vii所示的d-氨基保护中间体;b)将l-氨基保护中间体制备成l-2-氧吡咯烷衍生物,或将d-氨基保护中间体制备成d-2-氧吡咯烷衍生物;r1、r2、r3各自独立地选自h、叔丁氧羰基、苄氧基羰基、苄基、对甲氧基苄基、对硝基苯磺酰基、邻硝基苯磺酰基、烯丙氧羰基、三氯乙基氧羰基或三氟乙酰
基;r4和r5各自独立选自c1~c
10
的烷基;
[0010][0011]
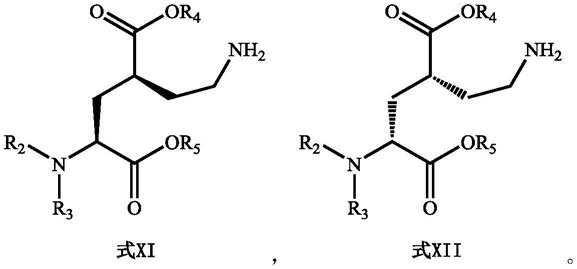
进一步地,由氨基保护中间体制备成2-氧吡咯烷衍生物包括:将氨基保护中间体进行脱保护反应,生成氨基中间体,将氨基中间体进行关环反应,生成2-氧吡咯烷衍生物;氨基保护中间体为l-氨基保护中间体或d-氨基保护中间体,相应地,氨基中间体为式xi所示的l-氨基中间体或式xii所示的d-氨基中间体,2-氧吡咯烷衍生物为l-2-氧吡咯烷衍生物或d-2-氧吡咯烷衍生物;
[0012][0013]
进一步地,将五元磺酰胺与谷氨酸酯化合物进行的α-烷基化反应记为第一反应,生成磺酸中间体;优选地,五元磺酰胺和谷氨酸酯化合物的摩尔比为(0.5~3.0):1,更优选为(1.0~1.5):1;优选地,第一反应在碱性条件下进行;优选地,提供第一反应中的碱性条件的第一碱原料为式xiii所示的第一金属氨基锂试剂,r6、r7分别独立选自三甲基硅基、乙
基、正丙基、异丙基、正丁基、正戊基或苯基;或第一碱原料包括四氢吡啶锂、哌啶锂、四甲基哌啶锂、双三甲基硅基氨基钠或三甲基硅基氨基钾;优选地,第一碱原料和谷氨酸酯化合物的摩尔比为(1.0~5.0):1,更优选为(1.8~2.5):1;优选地,第一反应在第一溶剂中进行;优选地,五元磺酰胺和谷氨酸酯化合物的总体积为v1,第一溶剂的体积为v2,v2/v1=(10~40):1;优选地,第一反应的第一溶剂包括四氢呋喃、甲苯、甲基叔丁基醚、环戊基甲醚、1,4-二氧六环、n,n-二甲基甲酰胺、n-甲基吡咯烷酮、六甲基磷酰三胺或四甲基乙二胺中的一种或多种;优选地,第一反应的第一反应温度为-100~0℃,更优选为-90~-50℃;优选地,第一反应的第一反应时间为0.1~20h,更优选为0.5~2h;
[0014][0015]
进一步地,第一反应包括以下步骤:将谷氨酸酯化合物溶于第一溶剂中,得到谷氨酸酯化合物溶液;将谷氨酸酯化合物溶液的温度调整至第一反应温度;向谷氨酸酯化合物溶液滴加第一碱原料后,进行第一搅拌,得到第一搅拌液;向第一搅拌液滴加五元磺酰胺后,进行第二搅拌,得到第二搅拌液,第二搅拌液中的产物为磺酸中间体;优选地,第一搅拌的时长为15~30min;优选地,第二搅拌的时长为10min~1h。
[0016]
进一步地,氮杂环丙烷与谷氨酸酯化合物进行的α-烷基化反应记为第二反应,生成氨基保护中间体;优选地,氮杂环丙烷和谷氨酸酯化合物的摩尔比为(0.5~3.0):1,更优选为(1.0~1.5):1;优选地,第二反应在碱性条件下进行;优选地,提供第二反应中的碱性条件的第二碱原料为式xiv所示的第二金属氨基锂试剂,r6、r7分别独立选自三甲基硅基、乙基、正丙基、异丙基、正丁基、正戊基或苯基;或第二碱原料包括四氢吡啶锂、哌啶锂、四甲基哌啶锂、双三甲基硅基氨基钠或三甲基硅基氨基钾;优选地,第二碱原料和谷氨酸酯化合物的摩尔比为(1.0~5.0):1,更优选为(1.8~2.5):1;优选地,第二反应在第二溶剂中进行;优选地,氮杂环丙烷和谷氨酸酯化合物总体积为v3,第二溶剂的体积为v4,v4/v3=(10~40):1;优选地,第二反应的第二溶剂包括四氢呋喃、甲苯、甲基叔丁基醚、环戊基甲醚、1,4-二氧六环、n,n-二甲基甲酰胺、n-甲基吡咯烷酮、六甲基磷酰三胺或四甲基乙二胺中的一种或多种;优选地,第二反应的第二反应温度为-100~0℃,更优选为-90~-50℃;优选地,第二反应的第二反应时间为0.1~20h,更优选为0.5~2h;
[0017][0018]
进一步地,第二反应包括以下步骤:将谷氨酸酯化合物溶于第二溶剂中,得到谷氨酸酯化合物溶液;将谷氨酸酯化合物溶液的温度调整至第二反应温度;向谷氨酸酯化合物溶液滴加第二碱原料后,进行第三搅拌,得到第三搅拌液;向第三搅拌液滴加氮杂环丙烷
后,进行第四搅拌,得到第四搅拌液,第四搅拌液中的产物为氨基保护中间体;优选地,第三搅拌的时长为15~30min;优选地,第四搅拌的时长为10min~1h。
[0019]
进一步地,将磺酸中间体进行的酸性水解反应记为第三反应,生成氨基保护中间体;优选地,第三反应中的解离试剂包括氯化铵、醋酸、甲酸、柠檬酸、草酸、磷酸、盐酸、硫酸中的一种或多种;优选地,第三反应包括以下步骤:向磺酸中间体加入解离试剂,淬灭反应,进行第五搅拌,得到第五搅拌液;将第五搅拌液使用有机相进行萃取,分液得到有机萃取液;将有机萃取液进行无水硫酸钠干燥、过滤、浓缩、柱层析纯化,得到氨基保护中间体;优选地,第五搅拌的时长为3~4h;优选地,第五搅拌液的温度为0~30℃。
[0020]
进一步地,将氨基保护中间体进行的脱保护反应记为第四反应,生成氨基中间体;优选地,氨基保护中间体上的氮保护基包括苄氧基羰基或叔丁氧羰基;优选地,第四反应的催化剂包括钯碳、氢氧化钯碳、铑碳、铂碳、钌碳或雷尼镍中的一种或多种;优选地,催化剂的用量为0.01~3g/g,更优选为0.05~0.5g/g;优选地,第四反应中的第四溶剂包括甲苯、乙腈、乙酸乙酯、四氢呋喃、甲基叔丁基醚、1,4-二氧六环、甲醇、乙醇、异丙醇、水、n,n-二甲基甲酰胺或n-甲基吡咯烷酮中的一种或多种;优选地,第四反应中,利用氢气进行催化氢化反应,或利用催化氢转移试剂进行催化氢转移反应,将述氨基保护中间体制备为氨基中间体;优选地,氢气的压力为0.05~10mpa,更优选为0.09~0.5mpa;优选地,第四反应的催化氢化反应温度为0~80℃,更优选为15~30℃;优选地,第四反应的催化氢化反应时间为0.1~40h,更优选为2~10h;优选地,催化氢转移试剂包括甲酸、甲酸铵、甲酸钠、三乙基硅氢或三丁基锡氢中的一种或多种;优选地,催化氢转移试剂和氨基保护中间体的摩尔比为(0.8~6.0):1,更优选为(1.5~3.0):1;优选地,第四反应的催化氢转移反应温度为0~100℃,更优选为40~60℃;优选地,第四反应的催化氢转移反应时间为0.1~40h,更优选为2~10h。
[0021]
进一步地,将氨基中间体进行的关环反应记为第五反应,生成2-氧吡咯烷衍生物;优选地,第五反应在碱性条件下进行;优选地,提供第五反应中的碱性条件的第五碱原料,包括碳酸氢钠、碳酸氢钾、碳酸锂、碳酸钠、碳酸钾、乙酸钠、乙酸钾、三乙胺、二异丙基乙胺、n-甲基吗啉、吡啶、二乙胺、二异丙基胺、环己胺中的一种或多种;优选地,第五反应的第五反应温度为0~100℃,更优选为10~60℃;优选地,第五反应的第五反应时间为0.1~24h,更优选为2~10h。
[0022]
为了实现上述目的,根据本发明的第二个方面,提供了一种2-氧吡咯烷衍生物,该2-氧吡咯烷衍生物由上述制备方法制备获得。
[0023]
为了实现上述目的,根据本发明的第三个方面,提供了一种氨基保护中间体的制备方法,该制备方法包括:五元磺酰胺与谷氨酸酯化合物进行α-烷基化反应,生成磺酸中间体,将磺酸中间体进行酸性水解反应,生成氨基保护中间体;或将氮杂环丙烷与谷氨酸酯化合物进行α-烷基化反应,生成氨基保护中间体;其中,五元磺酰胺的结构式为式i,氮杂环丙烷的结构式为式viii;谷氨酸酯化合物为式ii所示的l-谷氨酸酯化合物或式iii所示的d-谷氨酸酯化合物,相应地,磺酸中间体为式iv所示的l-磺酸中间体或式v所示的d-磺酸中间体,氨基保护中间体为式vi所示的l-氨基保护中间体或式vii所示的d-氨基保护中间体;r1、r2、r3各自独立地选自h或叔丁氧羰基、苄氧基羰基、苄基、对甲氧基苄基、对硝基苯磺酰基、邻硝基苯磺酰基、烯丙氧羰基、三氯乙基氧羰基或三氟乙酰基;r4和r5各自独立选自c1~c10
的烷基;
[0024][0025][0026]
进一步地,将五元磺酰胺与谷氨酸酯化合物混合后,制备氨基保护中间体包括以下步骤:五元磺酰胺与谷氨酸酯化合物进行α-烷基化反应,记为第一反应,生成磺酸中间体;将磺酸中间体进行酸性水解反应,生成氨基保护中间体;优选地,五元磺酰胺和谷氨酸酯化合物的摩尔比为(0.5~3.0):1,更优选为(1.0~1.5):1;优选地,第一反应在碱性条件下进行;优选地,提供第一反应中的碱性条件的第一碱原料为式xiii所示的第一金属氨基锂试剂,r6、r7分别独立选自三甲基硅基、乙基、正丙基、异丙基、正丁基、正戊基或苯基;或第一碱原料包括四氢吡啶锂、哌啶锂、四甲基哌啶锂、双三甲基硅基氨基钠或三甲基硅基氨基钾;优选地,第一碱原料和谷氨酸酯化合物的摩尔比为(1.0~5.0):1,更优选为(1.8~2.5):1;优选地,第一反应在第一溶剂中进行;优选地,五元磺酰胺、谷氨酸酯化合物总体积为v1,第一溶剂的体积为v2,v2/v1=(10~40):1;优选地,第一反应的第一溶剂包括四氢呋喃、甲苯、甲基叔丁基醚、环戊基甲醚、1,4-二氧六环、n,n-二甲基甲酰胺、n-甲基吡咯烷酮、六甲基磷酰三胺或四甲基乙二胺中的一种或多种;优选地,第一反应的第一反应温度为-100~0℃,更优选为-90~-50℃;优选地,第一反应的第一反应时间为0.1~20h,更优选为0.5~2h;第一反应包括以下步骤:将谷氨酸酯化合物溶于第一溶剂中,得到谷氨酸酯化合物溶液;将谷氨酸酯化合物溶液的温度调整至第一反应温度;向谷氨酸酯化合物溶液滴加第一碱原料后,进行第一搅拌,得到第一搅拌液;向第一搅拌液滴加五元磺酰胺后,进行第
二搅拌,得到第二搅拌液,第二搅拌液中的产物为磺酸中间体;优选地,第一搅拌的时长为15~30min;优选地,第二搅拌的时长为10min~1h;
[0027][0028]
进一步地,将磺酸中间体进行酸性水解反应,生成氨基保护中间体包括以下步骤:向磺酸中间体加入解离试剂,淬灭反应,进行第五搅拌,得到第五搅拌液;将第五搅拌液使用有机相进行萃取,分液得到有机萃取液;将有机萃取液进行无水硫酸钠干燥、过滤、浓缩、柱层析纯化,得到氨基保护中间体;优选地,酸性水解反应中的解离试剂包括氯化铵、醋酸、甲酸、柠檬酸、草酸、磷酸、盐酸、硫酸中的一种或多种;优选地,第五搅拌的时长为3~4h;优选地,第五搅拌液的温度为0~30℃。进一步地,将氮杂环丙烷与谷氨酸酯化合物混合后进行α-烷基化反应,记为第二反应,生成氨基保护中间体包括以下步骤:氮杂环丙烷和谷氨酸酯化合物的摩尔比为(0.5~3.0):1,更优选为(1.0~1.5):1;优选地,第二反应在碱性条件下进行;优选地,提供第二反应中的碱性条件的第二碱原料为式xiv所示的第一金属氨基锂试剂,r6、r7分别独立选自三甲基硅基、乙基、正丙基、异丙基、正丁基、正戊基或苯基;或第二碱原料包括四氢吡啶锂、哌啶锂、四甲基哌啶锂、双三甲基硅基氨基钠或三甲基硅基氨基钾;优选地,第二碱原料和谷氨酸酯化合物的摩尔比为(1.0~5.0):1,更优选为(1.8~2.5):1;优选地,第二反应在第二溶剂中进行;优选地,氮杂环丙烷、谷氨酸酯化合物总体积为v3,第二溶剂的体积为v4,v4/v3=(10~40):1;优选地,第二反应的第二溶剂包括四氢呋喃、甲苯、甲基叔丁基醚、环戊基甲醚、1,4-二氧六环、n,n-二甲基甲酰胺、n-甲基吡咯烷酮、六甲基磷酰三胺或四甲基乙二胺中的一种或多种;优选地,第二反应的第二反应温度为-100~0℃,更优选为-90~-50℃;优选地,第二反应的第二反应时间为0.1~20h,更优选为0.5~2h;优选地,第二反应包括以下步骤:将谷氨酸酯化合物溶于第二溶剂中,得到谷氨酸酯化合物溶液;将谷氨酸酯化合物溶液的温度调整至第二反应温度;向谷氨酸酯化合物溶液滴加第二碱原料后,进行第三搅拌,得到第三搅拌液;向第三搅拌液滴加氮杂环丙烷后,进行第四搅拌,得到第四搅拌液,第四搅拌液中的产物为氨基保护中间体;优选地,第三搅拌的时长为15~30min;优选地,第四搅拌的时长为10min~1h;
[0029][0030]
为了实现上述目的,根据本发明的第四个方面,提供了一种氨基中间体的制备方法,该制备方法包括:将按照上述制备方法合成的式vi所示的l-氨基保护中间体或式vii所示的d-氨基保护中间体进行脱保护反应,分别生成式xi所示的l-氨基中间体或式xii所示的d-氨基中间体;r2、r3各自独立地选自h或叔丁氧羰基、苄氧基羰基、苄基、对甲氧基苄基、
对硝基苯磺酰基、邻硝基苯磺酰基、烯丙氧羰基、三氯乙基氧羰基或三氟乙酰基;r4和r5各自独立选自c1~c
10
的烷基;氨基中间体为l-氨基中间体或d-氨基中间体;
[0031][0032]
进一步地,将氨基保护中间体进行脱保护反应,生成氨基中间体包括以下步骤:氨基保护中间体上的氮保护剂包括苄氧基羰基或叔丁氧羰基;优选地,脱保护反应的催化剂包括钯碳、氢氧化钯碳、铑碳、铂碳、钌碳或雷尼镍中的一种或多种;优选地,催化剂的用量为0.01~3g/g,更优选为0.05~0.5g/g;优选地,脱保护反应中的脱保护溶剂包括甲苯、乙腈、乙酸乙酯、四氢呋喃、甲基叔丁基醚、1,4-二氧六环、甲醇、乙醇、异丙醇、水、n,n-二甲基甲酰胺或n-甲基吡咯烷酮中的一种或多种;优选地,脱保护反应中,利用氢气进行催化氢化反应,或利用催化氢转移试剂进行催化氢转移反应,将述氨基保护中间体制备为氨基中间体;优选地,氢气的压力为0.05~10mpa,更优选为0.09~0.5mpa;优选地,脱保护反应的催化氢化反应温度为0~80℃,更优选为15~30℃;优选地,脱保护反应的催化氢化反应时间为0.1~40h,更优选为2~10h;优选地,催化氢转移试剂包括甲酸、甲酸铵、甲酸钠、三乙基硅氢或三丁基锡氢中的一种或多种;优选地,催化氢转移试剂和氨基保护中间体的摩尔比为(0.8~6.0):1,更优选为(1.5~3.0):1;优选地,脱保护反应的催化氢转移反应温度为0~100℃,更优选为40~60℃;优选地,脱保护反应的催化氢转移反应时间为0.1~40h,更优选为2~10h。
[0033]
应用本发明的技术方案,利用α-烷基化反应、酸性水解反应、脱保护反应和合环反应,反应步骤简短,操作简便,反应原料安全易得,总收率高。利用本技术的合成路线,为2-吡咯烷酮衍生物的合成提供了一条更加经济实用的方法,适合工艺生产。
具体实施方式
[0034]
需要说明的是,在不冲突的情况下,本技术中的实施例及实施例中的特征可以相互组合。下面将结合实施例来详细说明本发明。
[0035]
如背景技术所提到的,2-氧吡咯烷衍生物是一类非常重要的结构单元,在医药中间体等领域中有着广泛的应用。现有技术中合成2-氧吡咯烷衍生物的合成方法中,存在反应步数长、收率低、后处理纯化工艺繁琐、原料毒性大等问题。
[0036]
因而,在本技术中发明人尝试探究2-氧吡咯烷衍生物的新合成路线,利用五元磺酰胺或氮杂环丙烷为底物,进行α-烷基化反应、酸性水解反应、脱保护反应和关环反应,利用新的合成路线制备2-氧吡咯烷衍生物,提高生产效率。因而提出了本技术的一系列保护方案。
[0037]
在本技术第一种典型的实施方式中,提供了一种2-氧吡咯烷衍生物的制备方法,该2-氧吡咯烷衍生物包括式ix所示的l-2-氧吡咯烷衍生物或式x所示的d-2-氧吡咯烷衍生
物;制备方法包括:a)将五元磺酰胺与谷氨酸酯化合物进行α-烷基化反应,生成磺酸中间体,将磺酸中间体进行酸性水解反应,生成氨基保护中间体;或将氮杂环丙烷与谷氨酸酯化合物进行α-烷基化反应,生成氨基保护中间体;其中,五元磺酰胺的结构式为式i,氮杂环丙烷的结构式为式viii;谷氨酸酯化合物为式ii所示的l-谷氨酸酯化合物或式iii所示的d-谷氨酸酯化合物,相应地,磺酸中间体为式iv所示的l-磺酸中间体或式v所示的d-磺酸中间体,氨基保护中间体为式vi所示的l-氨基保护中间体或式vii所示的d-氨基保护中间体;b)将l-氨基保护中间体制备成l-2-氧吡咯烷衍生物,或将d-氨基保护中间体制备成d-2-氧吡咯烷衍生物。r1、r2、r3各自独立地选自h、叔丁氧羰基、苄氧基羰基、苄基、对甲氧基苄基、对硝基苯磺酰基、邻硝基苯磺酰基、烯丙氧羰基、三氯乙基氧羰基或三氟乙酰基;r4和r5各自独立选自c1~c
10
的烷基;
[0038][0039]
利用上述五元磺酰胺与谷氨酸酯化合物进行α-烷基化反应,生成磺酸中间体后,再进行酸性水解反应,在淬灭α-烷基化反应的同时,生成氨基保护中间体。或利用氮杂环丙烷,与谷氨酸酯化合物进行α-烷基化反应,生成氨基保护中间体。谷氨酸酯化合物上的r2和r3取代基,五元磺酰胺或氮杂环丙烷上的r1取代基分别独立选自h或用于保护n原子的氮保护基,氮保护基可以灵活选择叔丁氧羰基(boc)、苄氧基羰基(cbz)、苄基(bn)、对甲氧基苄基(pmb)、对硝基苯磺酰基、邻硝基苯磺酰基(ns)、烯丙氧羰基(alloc)、三氯乙基氧羰基(troc)、三氟乙酰基(tfa)或其他的氮保护基。谷氨酸酯化合物上的r4和r5取代基分别独立
选自c1~c
10
的烷基。
[0040]
在上述α-烷基化反应中,由于原料谷氨酸酯化合物具有手性,受空间位阻等因素的影响,在进行α-烷基化时发生手性反应。l-谷氨酸酯化合物与五元磺酰胺或氮杂环丙烷反应,生成l-磺酸中间体、l-氨基保护中间体,而不生成d-磺酸中间体、d-氨基保护中间体;d-谷氨酸酯化合物与五元磺酰胺或氮杂环丙烷反应,生成d-磺酸中间体、d-氨基保护中间体,而不生成l-磺酸中间体、l-氨基保护中间体。且在本技术的后续反应中,化合物的绝对构型不发生变化。
[0041]
在一种优选的实施例中,由l-氨基保护中间体或d-氨基保护中间体制备成2-氧吡咯烷衍生物包括:将氨基保护中间体进行脱保护反应,生成氨基中间体,将氨基中间体进行关环反应,生成2-氧吡咯烷衍生物;氨基保护中间体为l-氨基保护中间体或d-氨基保护中间体,相应地,氨基中间体为式xi所示的l-氨基中间体或式xii所示的d-氨基中间体,2-氧吡咯烷衍生物为l-2-氧吡咯烷衍生物或d-2-氧吡咯烷衍生物;
[0042][0043]
利用上述制备的氨基保护中间体,先将氨基保护中间体进行脱保护反应,生成氨基中间体。该脱保护反应,根据选用的不同氮保护基,选择相应的脱保护反应,脱去氮保护基r1,即能够制备氨基中间体。再利用上述氨基中间体进行关环反应,即能够获得带有r2、r3和r4的2-氧吡咯烷衍生物。在脱保护反应和关环反应中,化合物的绝对构型不发生变化。l-氨基保护中间体经脱保护反应生成l-氨基中间体,再经关环反应生成l-2-氧吡咯烷衍生物;d-氨基保护中间体经脱保护反应生成d-氨基中间体,再经关环反应生成d-2-氧吡咯烷衍生物。
[0044]
在一种优选的实施例中,将五元磺酰胺与谷氨酸酯化合物进行的α-烷基化反应记为第一反应,生成磺酸中间体;优选地,五元磺酰胺和谷氨酸酯化合物的摩尔比为(0.5~3.0):1,更优选为(1.0~1.5):1;优选地,第一反应在碱性条件下进行;优选地,提供第一反应中的碱性条件的第一碱原料为式xiii所示的第一金属氨基锂试剂,r6、r7分别独立选自三甲基硅基、乙基、正丙基、异丙基、正丁基、正戊基或苯基;或第一碱原料包括但不限于四氢吡啶锂、哌啶锂、四甲基哌啶锂、双三甲基硅基氨基钠、三甲基硅基氨基钾;优选地,第一碱原料和谷氨酸酯化合物的摩尔比为(1.0~5.0):1,更优选为(1.8~2.5):1;优选地,第一反应在第一溶剂中进行;优选地,五元磺酰胺和谷氨酸酯化合物的总体积为v1,第一溶剂的体积为v2,v2/v1=(10~40):1;优选地,第一反应的第一溶剂包括四氢呋喃、甲苯、甲基叔丁基醚、环戊基甲醚、1,4-二氧六环、n,n-二甲基甲酰胺、n-甲基吡咯烷酮、六甲基磷酰三胺或四甲基乙二胺中的一种或多种;优选地,第一反应的第一反应温度为-100~0℃,更优选为-90~-50℃;优选地,第一反应的第一反应时间为0.1~20h,更优选为0.5~2h;
[0045][0046]
将五元磺酰胺与谷氨酸酯化合物进行的α-烷基化反应记为第一反应。理论上五元磺酰胺和谷氨酸酯化合物发生α-烷基化反应的摩尔比为1:1,通过对五元磺酰胺和谷氨酸酯化合物的摩尔比进行优选,节约反应原料,提高反应转化率。利用第一碱原料对谷氨酸酯化合物进行去质子化反应,生成碳负离子,碳负离子进攻五元磺酰胺使其发生开环,从而促进第一反应的进行。理论上第一碱原料和谷氨酸酯化合物发生去质子化反应的摩尔比为1:1,但为了保证去质子化反应的转化率,提高第一碱原料的投料比,促进去质子化反应进行,能够提高第一反应的转化率。第一反应在第一溶剂中进行,选用的第一溶剂不能与具有去质子化活性的第一碱原料反应,即不能选用带有较活泼的羟基氢原子的醇类溶剂。为了保证反应原料溶解在第一溶剂中,且达到适宜的浓度便于反应的进行。由于第一碱原料的化学性质较为活泼,需要在较低的温度下进行反应,防止反应速率过快、迅速升温而导致的危险性和副产物的生成。根据反应产物的种类、投料量、反应温度等条件,第一反应时间可以进行灵活调整。
[0047]
第一碱原料包括第一金属氨基锂试剂,r6和r7取代基各自独立地进行选择,包括但不限于三甲基硅基、乙基、正丙基、异丙基、正丁基、正戊基或苯基。或第一碱原料包括但不限于四氢吡啶锂、哌啶锂、四甲基哌啶锂、双三甲基硅基氨基钠、双三甲基硅基氨基钾等。所用第一碱为简单烷基或苯基取代的氨基金属试剂,有足够的pka能拔除酯基a位的氢,顺利实现去质子化及后续烷基化反应。同时原料便宜易得,制备简单,利于工业化生产。上述第一碱或者商业化可得,或可相应的胺通过如下公开的技术方法(cn112430197,2021;journal of the chemical society.chemical communications,1986,11,869-870;chemical science,2020,11,25,6500-6509)从相应的二级胺得到。
[0048]
在一种优选的实施例中,第一反应包括以下步骤:将谷氨酸酯化合物溶于第一溶剂中,得到谷氨酸酯化合物溶液;将谷氨酸酯化合物溶液的温度调整至第一反应温度;向谷氨酸酯化合物溶液滴加第一碱原料后,进行第一搅拌,得到第一搅拌液;向第一搅拌液滴加五元磺酰胺后,进行第二搅拌,得到第二搅拌液,第二搅拌液中的产物为磺酸中间体;优选地,第一搅拌的时长为15~30min;优选地,第二搅拌的时长为10min~1h。
[0049]
将谷氨酸酯化合物溶于第一溶剂中后调节至第一反应温度,滴加第一碱原料,控制反应速率,使去质子化反应在谷氨酸酯化合物过量的条件下进行,减少副反应的发生,得到第一搅拌液。再向第一搅拌液中滴加五元磺酰胺,使发生去质子化、带有碳负离子的谷氨酸酯化合物处于过量的状态,利于进攻后加入的五元磺酰胺,利于α-烷基化的进行。
[0050]
在一种优选的实施例中,氮杂环丙烷与谷氨酸酯化合物进行的α-烷基化反应记为第二反应,生成氨基保护中间体;优选地,氮杂环丙烷和谷氨酸酯化合物的摩尔比为(0.5~3.0):1,更优选为(1.0~1.5):1;优选地,第二反应在碱性条件下进行;优选地,提供第二反应中的碱性条件的第二碱原料为式xiv所示的第一金属氨基锂试剂,r6、r7分别独立选自三甲基硅基、乙基、正丙基、异丙基、正丁基、正戊基或苯基;或第二碱原料包括四氢吡啶锂、哌
啶锂、四甲基哌啶锂、双三甲基硅基氨基钠或三甲基硅基氨基钾;优选地,第二碱原料和谷氨酸酯化合物的摩尔比为(1.0~5.0):1,更优选为(1.8~2.5):1;优选地,第二反应在第二溶剂中进行;优选地,氮杂环丙烷和谷氨酸酯化合物总体积为v3,第二溶剂的体积为v4,v4/v3=(10~40):1;优选地,第二反应的第二溶剂包括四氢呋喃、甲苯、甲基叔丁基醚、环戊基甲醚、1,4-二氧六环、n,n-二甲基甲酰胺、n-甲基吡咯烷酮、六甲基磷酰三胺或四甲基乙二胺中的一种或多种;优选地,第二反应的第二反应温度为-100~0℃,更优选为-90~-50℃;优选地,第二反应的第二反应时间为0.1~20h,更优选为0.5~2h;
[0051][0052]
将氮杂环丙烷与谷氨酸酯化合物进行的α-烷基化反应记为第二反应。理论上氮杂环丙烷和谷氨酸酯化合物发生α-烷基化反应的摩尔比为1:1,通过对氮杂环丙烷和谷氨酸酯化合物的摩尔比进行优选,节约反应原料,提高反应转化率。利用第二碱原料对谷氨酸酯化合物进行去质子化反应,生成碳负离子,碳负离子进攻氮杂环丙烷使其发生开环,从而促进第二反应的进行。理论上第二碱原料和谷氨酸酯化合物发生去质子化反应的摩尔比为1:1,但为了保证去质子化反应的转化率,提高第二碱原料的投料比,促进去质子化反应进行,能够提高第二反应的转化率。第二反应在第二溶剂中进行,选用的第二溶剂不能与具有去质子化活性的第二碱原料反应,即不能选用带有较活泼的羟基氢原子的醇类溶剂。为了保证反应原料溶解在第二溶剂中,且达到适宜的浓度便于反应的进行。由于第二碱原料的化学性质较为活泼,需要在较低的温度下进行反应,防止反应速率过快、迅速升温而导致的危险性和副产物的生成。根据反应产物的种类、投料量、反应温度等条件,第二反应时间可以进行灵活调整。
[0053]
第二碱原料包括第二金属氨基锂试剂,r6和r7取代基各自独立地进行选择,包括但不限于三甲基硅基、乙基、正丙基、异丙基、正丁基、正戊基或苯基。或第二碱原料包括但不限于四氢吡啶锂、哌啶锂、四甲基哌啶锂、双三甲基硅基氨基钠、双三甲基硅基氨基钾等。所用第二碱为简单烷基或苯基取代的氨基金属试剂,既能保证碱试剂有足够的pka能拔除酯基a位的氢,顺利实现去质子化及后续烷基化反应,同时原料便宜易得,制备简单,利于工业化生产。
[0054]
在一种优选的实施例中,第二反应包括以下步骤:将谷氨酸酯化合物溶于第二溶剂中,得到谷氨酸酯化合物溶液;将谷氨酸酯化合物溶液的温度调整至第二反应温度;向谷氨酸酯化合物溶液滴加第二碱原料后,进行第三搅拌,得到第三搅拌液;向第三搅拌液滴加氮杂环丙烷后,进行第四搅拌,得到第四搅拌液,第四搅拌液中的产物为氨基保护中间体;优选地,第三搅拌的时长为15~30min;优选地,第四搅拌的时长为10min~1h。
[0055]
将谷氨酸酯化合物溶于第二溶剂中后调节至第二反应温度,滴加第二碱原料,控制反应速率,使去质子化反应在谷氨酸酯化合物过量的条件下进行,减少副反应的发生,得到第三搅拌液。再向第三搅拌液中滴加氮杂环丙烷,使发生去质子化、带有碳负离子的谷氨酸酯化合物处于过量的状态,利于进攻后加入的氮杂环丙烷,利于α-烷基化的进行。
[0056]
在一种优选的实施例中,将磺酸中间体进行的酸性水解反应记为第三反应,生成氨基保护中间体;优选地,第三反应中的解离试剂包括氯化铵、醋酸、甲酸、柠檬酸、草酸、磷酸、盐酸、硫酸中的一种或多种;优选地,第三反应包括以下步骤:向磺酸中间体加入解离试剂,淬灭反应,进行第五搅拌,得到第五搅拌液;将第五搅拌液使用有机相进行萃取,分液得到有机萃取液;将有机萃取液进行无水硫酸钠干燥、过滤、浓缩、柱层析纯化,得到氨基保护中间体;优选地,第五搅拌的时长为3~4h;优选地,第五搅拌液的温度为0~30℃。
[0057]
将磺酸中间体进行的酸性水解反应记为第三反应,脱去磺酸中间体上的磺酸基团,生产氮保护中间体。第三反应中选用的解离试剂,即为进行酸性水解反应的试剂,可灵活选用不同的酸性试剂,酸性试剂可以溶解在水中,便于加入和后续的萃取。在第三反应中,首先向第一反应制备的磺酸中间体中加入解离试剂,搅拌使反应充分进行。所用的磺酸中间体无需进行前处理,在第一反应结束后即可直接加入解离试剂,解离试剂能够提供活泼氢离子,与第一反应中未反应的原料发生反应,达到淬灭反应的效果。并对磺酸中间体进行酸性水解反应,生产氨基保护中间体。对搅拌、反应完全的第五搅拌液进行有机相萃取,第一碱原料、解离试剂等引入的杂质能够溶解在水相中,通过萃取进行初步分离。对有机萃取液进行无水硫酸钠干燥、过滤、浓缩、柱层析纯化等常规纯化操作,能够得到氨基保护中间体。
[0058]
在一种优选的实施例中,将氨基保护中间体进行的脱保护反应记为第四反应,生成氨基中间体;优选地,氨基保护中间体上的氮保护基包括苄氧基羰基或叔丁氧羰基;优选地,第四反应的催化剂包括钯碳、氢氧化钯碳、铑碳、铂碳、钌碳或雷尼镍中的一种或多种;优选地,催化剂的用量为0.01~3g/g,更优选为0.05~0.5g/g;优选地,第四反应中的第四溶剂包括甲苯、乙腈、乙酸乙酯、四氢呋喃、甲基叔丁基醚、1,4-二氧六环、甲醇、乙醇、异丙醇、水、n,n-二甲基甲酰胺或n-甲基吡咯烷酮中的一种或多种;优选地,第四反应中,利用氢气进行催化氢化反应,或利用催化氢转移试剂进行催化氢转移反应,将述氨基保护中间体制备为氨基中间体;优选地,氢气的压力为0.05~10mpa,更优选为0.09~0.5mpa;优选地,第四反应的催化氢化反应温度为0~80℃,更优选为15~30℃;优选地,第四反应的催化氢化反应时间为0.1~40h,更优选为2~10h;优选地,催化氢转移试剂包括甲酸、甲酸铵、甲酸钠、三乙基硅氢或三丁基锡氢中的一种或多种;优选地,催化氢转移试剂和氨基保护中间体的摩尔比为(0.8~6.0):1,更优选为(1.5~3.0):1;优选地,第四反应的催化氢转移反应温度为0~100℃,更优选为40~60℃;优选地,第四反应的催化氢转移反应时间为0.1~40h,更优选为2~10h。
[0059]
将氨基保护中间体进行的脱保护反应记为第四反应。根据氮保护基的不同,在第四反应中灵活选择相应的不同脱保护方法,制备氨基中间体。灵活选择不同种类和用量的催化剂,能够促进第四反应的进行。为了便于反应的进行,灵活选用不同种类的第四溶剂,对反应原料进行溶解,能够反应原料均价分布,提高第四反应的转化率。常用的第四反应,包括利用氢气进行催化氢化反应,或利用催化氢转移试剂进行催化氢转移反应,根据氮保护基的不同,灵活选择不同的催化反应,脱去氮原子上的氮保护基。
[0060]
在一种优选的实施例中,将氨基中间体进行的关环反应记为第五反应,生成2-氧吡咯烷衍生物;优选地,第五反应在碱性条件下进行;优选地,提供第五反应中的碱性条件的第五碱原料,包括碳酸氢钠、碳酸氢钾、碳酸锂、碳酸钠、碳酸钾、乙酸钠、乙酸钾、三乙胺、
二异丙基乙胺、n-甲基吗啉、吡啶、二乙胺、二异丙基胺、环己胺中的一种或多种;优选地,第五反应的第五反应温度为0~100℃,更优选为10~60℃;优选地,第五反应的第五反应时间为0.1~24h,更优选为2~10h。
[0061]
将氨基中间体进行的关环反应记为第五反应,氨基和酯基在碱性条件下生产酰胺,能够成环,生成五元环的2-氧吡咯烷衍生物。根据氨基中间体的种类,灵活选用第五碱原料,能够进行关环反应。无需对第四反应制备的氨基中间体进行纯化,即可进行第五反应制备得到2-氧吡咯烷衍生物。
[0062]
在本技术第二种典型的实施方式中,提供了一种2-氧吡咯烷衍生物,该2-氧吡咯烷衍生物由上述制备方法制备获得。
[0063]
在本技术第三种典型的实施方式中,提供了氨基保护中间体的制备方法,该制备方法包括:五元磺酰胺与谷氨酸酯化合物进行α-烷基化反应,生成磺酸中间体,将磺酸中间体进行酸性水解反应,生成氨基保护中间体;或将氮杂环丙烷与谷氨酸酯化合物进行α-烷基化反应,生成氨基保护中间体;其中,五元磺酰胺的结构式为式i,氮杂环丙烷的结构式为式viii;谷氨酸酯化合物为式ii所示的l-谷氨酸酯化合物或式iii所示的d-谷氨酸酯化合物,相应地,磺酸中间体为式iv所示的l-磺酸中间体或式v所示的d-磺酸中间体,氨基保护中间体为式vi所示的l-氨基保护中间体或式vii所示的d-氨基保护中间体;r1、r2、r3各自独立地选自h或叔丁氧羰基、苄氧基羰基、苄基、对甲氧基苄基、对硝基苯磺酰基、邻硝基苯磺酰基、烯丙氧羰基、三氯乙基氧羰基或三氟乙酰基;r4和r5各自独立选自c1~c
10
的烷基;
[0064][0065]
[0066]
利用上述五元磺酰胺与谷氨酸酯化合物进行α-烷基化反应,生成磺酸中间体后,再进行酸性水解反应,在淬灭α-烷基化反应的同时,生成氨基保护中间体。或利用上述氮杂环丙烷,与谷氨酸酯化合物进行α-烷基化反应,生成氨基保护中间体。谷氨酸酯化合物上的r2和r3取代基,五元磺酰胺或氮杂环丙烷上的r1取代基分别独立选自h或用于保护n原子的氮保护基,可以灵活选择叔丁氧羰基(boc),苄氧基羰基(cbz),苄基(bn),对甲氧基苄基(pmb),对硝基苯磺酰基,邻硝基苯磺酰基(ns),烯丙氧羰基(alloc),三氯乙基氧羰基(troc)或三氟乙酰基(tfa)等现有技术中公开的保护基团。谷氨酸酯化合物上的r4和r5取代基选自c1~c
10
的烷基等化学性质稳定的取代基,不影响α-烷基化反应的进行。
[0067]
在上述α-烷基化反应中,由于原料谷氨酸酯化合物具有手性,受空间位阻等因素的影响,在进行α-烷基化时发生手性反应。l-谷氨酸酯化合物与五元磺酰胺或氮杂环丙烷反应,生成l-磺酸中间体、l-氨基保护中间体,而不生成d-磺酸中间体、d-氨基保护中间体;d-谷氨酸酯化合物与五元磺酰胺或氮杂环丙烷反应,生成d-磺酸中间体、d-氨基保护中间体,而不生成l-磺酸中间体、l-氨基保护中间体。且在本技术的后续反应中,化合物的绝对构型不发生变化。
[0068]
在一种优选的实施例中,将五元磺酰胺与谷氨酸酯化合物混合后,制备氨基保护中间体包括以下步骤:五元磺酰胺与谷氨酸酯化合物进行α-烷基化反应,记为第一反应,生成磺酸中间体;将磺酸中间体进行酸性水解反应,生成氨基保护中间体;优选地,五元磺酰胺和谷氨酸酯化合物的摩尔比为(0.5~3.0):1,更优选为(1.0~1.5):1;优选地,第一反应在碱性条件下进行;优选地,提供第一反应中的碱性条件的第一碱原料为式xiii所示的第一金属氨基锂试剂,r6、r7分别独立选自三甲基硅基、乙基、正丙基、异丙基、正丁基、正戊基或苯基;或第一碱原料包括四氢吡啶锂、哌啶锂、四甲基哌啶锂、双三甲基硅基氨基钠、三甲基硅基氨基钾;优选地,第一碱原料和谷氨酸酯化合物的摩尔比为(1.0~5.0):1,更优选为(1.8~2.5):1;优选地,第一反应在第一溶剂中进行;优选地,五元磺酰胺、谷氨酸酯化合物总体积为v1,第一溶剂的体积为v2,v2/v1=(10~40):1;优选地,第一反应的第一溶剂包括四氢呋喃、甲苯、甲基叔丁基醚、环戊基甲醚、1,4-二氧六环、n,n-二甲基甲酰胺、n-甲基吡咯烷酮、六甲基磷酰三胺或四甲基乙二胺中的一种或多种;优选地,第一反应的第一反应温度为-100~0℃,更优选为-90~-50℃;优选地,第一反应的第一反应时间为0.1~20h,更优选为0.5~2h;第一反应包括以下步骤:将谷氨酸酯化合物溶于第一溶剂中,得到谷氨酸酯化合物溶液;将谷氨酸酯化合物溶液的温度调整至第一反应温度;向谷氨酸酯化合物溶液滴加第一碱原料后,进行第一搅拌,得到第一搅拌液;向第一搅拌液滴加五元磺酰胺后,进行第二搅拌,得到第二搅拌液,第二搅拌液中的产物为磺酸中间体;优选地,第一搅拌的时长为15~30min;优选地,第二搅拌的时长为10min~1h;
[0069][0070]
将五元磺酰胺与谷氨酸酯化合物进行的α-烷基化反应记为第一反应。理论上五元磺酰胺和谷氨酸酯化合物发生α-烷基化反应的摩尔比为1:1,通过对五元磺酰胺和谷氨酸
酯化合物的摩尔比进行优选,节约反应原料,提高反应转化率。利用第一碱原料对谷氨酸酯化合物进行去质子化反应,生成碳负离子,碳负离子进攻五元磺酰胺使其发生开环,从而促进第一反应的进行。理论上第一碱原料和谷氨酸酯化合物发生去质子化反应的摩尔比为1:1,但为了保证去质子化反应的转化率,提高第一碱原料的投料比,促进去质子化反应进行,能够提高第一反应的转化率。第一反应在第一溶剂中进行,选用的第一溶剂不能与具有去质子化活性的第一碱原料反应,即不能选用带有较活泼的羟基氢原子的醇类溶剂。为了保证反应原料溶解在第一溶剂中,且达到适宜的浓度便于反应的进行。由于第一碱原料的化学性质较为或活泼,需要在较低的温度下进行反应,防止反应速率过快、迅速升温而导致的危险性和副产物的生成。根据反应产物的种类、投料量、反应温度等条件,第一反应时间可以进行灵活调整。
[0071]
第一碱原料包括第一金属氨基锂试剂,r6和r7取代基各自独立地进行选择,包括但不限于三甲基硅基、乙基、正丙基、异丙基、正丁基、正戊基或苯基。或第一碱原料包括但不限于四氢吡啶锂、哌啶锂、四甲基哌啶锂、双三甲基硅基氨基钠、双三甲基硅基氨基钾等。所用第一碱为简单烷基或苯基取代的氨基金属试剂,既能保证碱试剂有足够的pka能拔除酯基a位的氢,顺利实现去质子化及后续烷基化反应。同时原料便宜易得,制备简单,利于工业化生产。
[0072]
将谷氨酸酯化合物溶于第一溶剂中后调节至第一反应温度,滴加第一碱原料,控制反应速率,使去质子化反应在谷氨酸酯化合物过量的条件下进行,减少副反应的发生,得到第一搅拌液。再向第一搅拌液中滴加五元磺酰胺,使发生去质子化、带有碳负离子的谷氨酸酯化合物处于过量的状态,利于进攻后加入的五元磺酰胺,利于α-烷基化的进行。
[0073]
在一种优选的实施例中,将磺酸中间体进行酸性水解反应,生成氨基保护中间体包括以下步骤:向磺酸中间体加入解离试剂,淬灭反应,进行第五搅拌,得到第五搅拌液;将第五搅拌液使用有机相进行萃取,分液得到有机萃取液;将有机萃取液进行无水硫酸钠干燥、过滤、浓缩、柱层析纯化,得到氨基保护中间体;优选地,酸性水解反应中的解离试剂包括氯化铵、醋酸、甲酸、柠檬酸、草酸、磷酸、盐酸、硫酸中的一种或多种;优选地,第五搅拌的时长为3~4h;优选地,第五搅拌液的温度为0~30℃。
[0074]
将磺酸中间体进行的酸性水解反应,脱去磺酸中间体上的磺酸基团,生产氮保护中间体。酸性水解反应中选用的解离试剂,即为进行酸性水解反应的试剂,可灵活选用不同的酸性试剂,酸性试剂可以溶解在水中,便于加入和后续的萃取。在酸性水解反应中,首先向第一反应制备的磺酸中间体中加入解离试剂,搅拌使反应充分进行。所用的磺酸中间体无需进行前处理,在第一反应结束后即可直接加入解离试剂,解离试剂能够提供活泼氢离子,与第一反应中未反应的原料发生反应,达到淬灭反应的效果。并对磺酸中间体进行酸性水解反应,生产氨基保护中间体。对搅拌、反应完全的第五搅拌液进行有机相萃取,第一碱原料、解离试剂等引入的杂质能够溶解在水相中,通过萃取进行初步分离。对有机萃取液进行无水硫酸钠干燥、过滤、浓缩、柱层析纯化等常规纯化操作,能够得到氨基保护中间体。
[0075]
在一种优选的实施例中,将氮杂环丙烷与谷氨酸酯化合物混合后进行α-烷基化反应,记为第二反应,生成氨基保护中间体包括以下步骤:氮杂环丙烷和谷氨酸酯化合物的摩尔比为(0.5~3.0):1,更优选为(1.0~1.5):1;优选地,第二反应在碱性条件下进行;优选地,提供第二反应中的碱性条件的第二碱原料为式xiv所示的第二金属氨基锂试剂,r6、r7分
别独立选自三甲基硅基、乙基、正丙基、异丙基、正丁基、正戊基或苯基,或第二碱原料包括四氢吡啶锂、哌啶锂、四甲基哌啶锂、双三甲基硅基氨基钠、三甲基硅基氨基钾;优选地,第二碱原料和谷氨酸酯化合物的摩尔比为(1.0~5.0):1,更优选为(1.8~2.5):1;优选地,第二反应在第二溶剂中进行;优选地,氮杂环丙烷、谷氨酸酯化合物总体积为v3,第二溶剂的体积为v4,v4/v3=(10~40):1;优选地,第二反应的第二溶剂包括四氢呋喃、甲苯、甲基叔丁基醚、环戊基甲醚、1,4-二氧六环、n,n-二甲基甲酰胺、n-甲基吡咯烷酮、六甲基磷酰三胺或四甲基乙二胺中的一种或多种;优选地,第二反应的第二反应温度为-100~0℃,更优选为-90~-50℃;优选地,第二反应的第二反应时间为0.1~20h,更优选为0.5~2h;优选地,第二反应包括以下步骤:将谷氨酸酯化合物溶于第二溶剂中,得到谷氨酸酯化合物溶液;将谷氨酸酯化合物溶液的温度调整至第二反应温度;向谷氨酸酯化合物溶液滴加第二碱原料后,进行第三搅拌,得到第三搅拌液;向第三搅拌液滴加氮杂环丙烷后,进行第四搅拌,得到第四搅拌液,第四搅拌液中的产物为氨基保护中间体;优选地,第三搅拌的时长为15~30min;优选地,第四搅拌的时长为10min~1h;
[0076][0077]
将氮杂环丙烷与谷氨酸酯化合物进行的α-烷基化反应记为第二反应。理论上氮杂环丙烷和谷氨酸酯化合物发生α-烷基化反应的摩尔比为1:1,通过对氮杂环丙烷和谷氨酸酯化合物的摩尔比进行优选,节约反应原料,提高反应转化率。利用第二碱原料对谷氨酸酯化合物进行去质子化反应,生成碳负离子,碳负离子进攻氮杂环丙烷使其发生开环,从而促进第二反应的进行。理论上第二碱原料和谷氨酸酯化合物发生去质子化反应的摩尔比为1:1,但为了保证去质子化反应的转化率,提高第二碱原料的投料比,促进去质子化反应进行,能够提高第二反应的转化率。第二反应在第二溶剂中进行,选用的第二溶剂不能与具有去质子化活性的第二碱原料反应,即不能选用带有较活泼的羟基氢原子的醇类溶剂。为了保证反应原料溶解在第二溶剂中,且达到适宜的浓度便于反应的进行。由于第二碱原料的化学性质较为或活泼,需要在较低的温度下进行反应,防止反应速率过快、迅速升温而导致的危险性和副产物的生成。根据反应产物的种类、投料量、反应温度等条件,第二反应时间可以进行灵活调整。
[0078]
第二碱原料包括第二金属氨基锂试剂,r6和r7取代基各自独立地进行选择,包括但不限于三甲基硅基、乙基、正丙基、异丙基、正丁基、正戊基或苯基。或第二碱原料包括但不限于四氢吡啶锂、哌啶锂、四甲基哌啶锂、双三甲基硅基氨基钠、双三甲基硅基氨基钾等。所用第二碱为简单烷基或苯基取代的氨基金属试剂,既能保证碱试剂有足够的pka能拔除酯基a位的氢,顺利实现去质子化及后续烷基化反应。同时原料便宜易得,制备简单,利于工业化生产。
[0079]
将谷氨酸酯化合物溶于第二溶剂中后调节至第二反应温度,滴加第二碱原料,控制反应速率,使去质子化反应在谷氨酸酯化合物过量的条件下进行,减少副反应的发生,得到第三搅拌液。再向第三搅拌液中滴加氮杂环丙烷,使发生去质子化、带有碳负离子的谷氨
酸酯化合物处于过量的状态,利于进攻后加入的氮杂环丙烷,利于α-烷基化的进行。
[0080]
在本技术第四种典型的实施方式中,提供了一种氨基中间体的制备方法,该制备方法包括:将按照上述制备方法合成的式vi所示的l-氨基保护中间体或式vii所示的d-氨基保护中间体进行脱保护反应,分别生成式xi所示的l-氨基中间体或式xii所示的d-氨基中间体;r2、r3各自独立地选自h或叔丁氧羰基、苄氧基羰基、苄基、对甲氧基苄基、对硝基苯磺酰基、邻硝基苯磺酰基、烯丙氧羰基、三氯乙基氧羰基或三氟乙酰基;r4和r5各自独立选自c1~c
10
的烷基;氨基中间体为l-氨基中间体或d-氨基中间体;
[0081][0082]
在一种优选的实施例中,将氨基保护中间体进行脱保护反应,生成氨基中间体包括以下步骤:氨基保护中间体上的氮保护剂包括苄氧基羰基或叔丁氧羰基;优选地,脱保护反应的催化剂包括钯碳、氢氧化钯碳、铑碳、铂碳、钌碳或雷尼镍中的一种或多种;优选地,催化剂的用量为0.01~3g/g,更优选为0.05~0.5g/g;优选地,脱保护反应中的脱保护溶剂包括甲苯、乙腈、乙酸乙酯、四氢呋喃、甲基叔丁基醚、1,4-二氧六环、甲醇、乙醇、异丙醇、水、n,n-二甲基甲酰胺或n-甲基吡咯烷酮中的一种或多种;优选地,脱保护反应中,利用氢气进行催化氢化反应,或利用催化氢转移试剂进行催化氢转移反应,将述氨基保护中间体制备为氨基中间体;优选地,氢气的压力为0.05~10mpa,更优选为0.09~0.5mpa;优选地,脱保护反应的催化氢化反应温度为0~80℃,更优选为15~30℃;优选地,脱保护反应的催化氢化反应时间为0.1~40h,更优选为2~10h;优选地,催化氢转移试剂包括甲酸、甲酸铵、甲酸钠、三乙基硅氢或三丁基锡氢中的一种或多种;优选地,催化氢转移试剂和氨基保护中间体的摩尔比为(0.8~6.0):1,更优选为(1.5~3.0):1;优选地,脱保护反应的催化氢转移反应温度为0~100℃,更优选为40~60℃;优选地,脱保护反应的催化氢转移反应时间为0.1~40h,更优选为2~10h。
[0083]
将氨基保护中间体进行的脱保护反应。根据氮保护基的不同,在脱保护反应中灵活选择相应的不同脱保护方法,制备氨基中间体。灵活选择不同种类和用量的催化剂,能够促进脱保护反应的进行。为了便于反应的进行,灵活选用不同种类的脱保护溶剂,对反应原料进行溶解,能够反应原料均价分布,提高脱保护反应的转化率。常用的脱保护反应,包括利用氢气进行催化氢化反应,或利用催化氢转移试剂进行催化氢转移反应,根据氮保护基的不同,灵活选择不同的催化反应,脱去氮原子上的氮保护基。
[0084]
下面将结合具体的实施例来进一步详细解释本技术的有益效果。
[0085]
以下以(s)-2-((叔丁氧基羰基)氨基)甲基-3-((s)-2-氧吡咯烷-3-基)丙酸甲酯(cas:328086-60-8)(式b)的合成为例,说明其具体步骤。
[0086]
实施例1:
[0087][0088]
步骤1:
[0089]
向反应瓶中加入化合物1(20.0g,1.0eq),thf(200ml),降温至-78℃。滴加lda(1.0m in thf,160ml,2.2eq),滴毕,搅拌15~30min。然后滴加化合物8(20.56g,1.1eq,参考文献org.lett.,2017,19,1974合成)的thf(200ml)溶液,滴毕,保温搅拌40min。tlc监测反应完全(此时得到的产物为10a),滴加20%柠檬酸水溶液(200ml)淬灭反应,升至室温,搅拌3~4h,tlc检测中间体反应完全,得到化合物10。加入etoac(200ml)分液,有机相用硫酸钠干燥,过滤,浓缩,粗品柱层析纯化,得到化合物10,无色油状物,25.6g,收率78%。
[0090]
化合物10核磁:1hnmr(400mhz,meod)δ7.45
–
7.26(m,5h),6.98
–
6.82(m,1h),5.07(s,2h),4.24
–
4.16(m,1h),3.70(s,3h),3.67(s,3h),3.22
–
3.06(m,2h),2.60
–
2.49(m,1h),2.04
–
1.90(m,2h),1.89
–
1.67(m,2h),1.44(s,9h).
[0091]
步骤2:
[0092]
向反应瓶中加入化合物10(20.0g 1.0eq),meoh(160ml),10%pd-c(1.0g)然后用氢气置换至0.9~1.1mpa,室温搅拌16h,tlc&hplc监测原料消失,将体系转出,加入三乙胺(6.71g,1.0eq)继续搅拌4h。tlc&hplc监测开环中间体消失,将体系过滤,滤饼用meoh(40ml)洗。滤液浓缩至无馏分。粗品柱层析纯化得到化合物b,白色固体,11.4g,收率90%。
[0093]
化合物b核磁:1hnmr(400mhz,cdcl3)δ6.43(brs,1h),5.56(d,j=8.3hz,1h),4.34
–
4.24(m,1h),3.72(s,3h),3.39
–
3.27(m,2h),2.50
–
2.39(m,2h),2.15
–
2.05(m,1h),1.89
–
1.76(m,2h),1.42(s,9h)。核磁数据与文献值(j.med.chem.2015,58,23,9414
–
9420,参见补充材料)一致。
[0094]
手性hplc方法(chiralpak as-h,产物b:5.40min,异构体-1:6.07min,异构体-2:6.51min,异构体-3(对映异构体):4.18min),产品ee值98.5%,de值100%。
[0095][0096]
产物b的手性异构体有以上其他三种形式,其中产物b和异构体-3是对映异构体关系,两者的核磁数据相同,旋光数据相反。异构体-1和异构体-2是对映异构体关系,两者核磁数据相同,旋光数据相反。产物b和异构体-1代表的结构式非对映异构体关系,核磁数据是有区别的。因此从核磁数据可以确定产物的结构是产物或异构体-3,而不是异构体-1和异构体-2的结构。但是反应所用的原料(化合物1)的氨基酸位置的立体构型是确定的,并在后续的反应过程中不会翻转成异构体-3中立体构型,因此无法得到异构体3代表的结构,因此通过核磁可以确定产物的结构是正确的。
[0097]
实施例2:
[0098][0099]
步骤1:
[0100]
向反应瓶中加入化合物1(20.0g,1.0eq),thf(200ml),降温至-78℃。滴加lihmds(1.0m in thf,160ml,2.2eq),滴毕,搅拌15~30min。然后滴加化合物9(15.45g,1.2eq,参考文献journal of the chemical society.perkin transactions i,1993,1,21合成)的thf(100ml)溶液,滴毕,保温搅拌40min。tlc监测反应完全,用20%柠檬酸水溶液(200ml)淬灭反应,升至室温,搅拌3~4h。加入etoac(200ml)分液,有机相用硫酸钠干燥,过滤,浓缩,粗品柱层析纯化,得到化合物6a,无色油状物,25.3g,收率77%。
[0101]
步骤2:
[0102]
向反应瓶中加入化合物10(20.0g,1.0eq),meoh(160ml),10%pd-c(1.0g)甲酸铵(11.15g,4.0eq),升温至60℃搅拌12h,tlc&hplc监测原料消失,将体系过滤一层硅藻土(0.5g/g),用meoh(40ml)洗涤滤饼,合并滤液,加入乙酸钠(0.671g,2.0eq)升温至继续搅拌4h。tlc&hplc监测开环中间体消失,将体系过滤,滤饼用5v甲醇洗。滤液浓缩至无馏分。粗品柱层析纯化得到化合物b,白色固体,11.8g,收率93%。
[0103]
实施例3:
[0104][0105]
步骤1:
[0106]
向打料瓶中加入化合物1(20.0g,1.0eq),thf(200ml),混匀全溶后,记作体系a;lihmds(1.0m in thf,160ml,2.2eq)记作体系b,化合物8(20.56g,1.1eq,参考文献org.lett.,2017,19,1974合成)的thf(200ml)溶液记作体系c,20%柠檬酸水溶液(200ml)记作体系d,连续反应器组成:盘管反应器1(pfr1)持液量90ml,316l*6mm,保留时间30min,盘管反应器2(pfr2)持液量150ml,316l*6mm,保留时间40min,盘管反应器3(pfr3)持液量110ml,316l*6mm,保留时间20min。通过自动控制系统,体系a流速1.57ml/min,体系b流速1.43ml/min同时泵入pfr 1中进行锂化反应,反应器控温-78℃;体系c流速0.81ml/min与锂化体系同时泵入pfr 2中进行烷基化反应,反应温度-78℃;体系d流速1.54ml/min与烷基化体系同时泵入pfr 3中进行淬灭反应,控温-5~5℃,淬灭毕,体系进入至接收瓶中,升至室温,搅拌3~4h。加入etoac(200ml)分液,有机相用硫酸钠干燥,过滤,浓缩,粗品柱层析纯化,得到化合物10,无色油状物,20.3g,收率62%。
[0107]
步骤2同实施例1。
[0108]
实施例4:
[0109][0110]
向反应瓶中加入化合物1(20.0g,1.0eq),thf(200ml),降温至-78℃。滴加lihmds(1.0m in thf,160ml,2.2eq),滴毕,搅拌15~30min。然后滴加化合物11(24.32g,1.5eq,参考文献org.lett.,2013,15,6094合成)的thf(200ml)溶液,滴毕,保温搅拌40min。tlc监测反应完全,用20%的醋酸水溶液(200ml)淬灭反应,升至室温,搅拌3~4h。加入etoac(200ml)分液,有机相用硫酸钠干燥,过滤,浓缩,粗品柱层析纯化,得到化合物12,无色油状物,22.8g,收率75%。
[0111]
化合物12核磁:1hnmr(400mhz,cdcl3)δ5.19
–
5.10(m,1h),4.85(brs,1h),4.31
–
4.20(m,1h),3.65(s,3h),3.61(s,3h),3.18
–
2.94(m,2h),2.52
–
2.42(m,1h),2.00
–
1.85(m,2h),1.81
–
1.64(m,2h),1.37(s,9h),1.35(s,9h)。
[0112]
向反应瓶中加入化合物10(5.0g,1.0eq),dcm(25ml),滴加tfa(10ml),室温搅拌12h。浓缩至无馏分,用高真空除去大部分的tfa。得到的化合物13的粗品重新用dcm(25ml)溶解,加入et3n(6.03g,5eq),室温搅拌16h,然后加入boc酸酐继续反应2h。加入10ml饱和食盐水分液,有机相用硫酸钠干燥,浓缩至无馏分。粗品用制备hplc纯化得到化合物b,白色固体,1.12g,收率33%。
[0113]
实施例5:
[0114][0115]
制备四氢吡咯锂试剂:向反应瓶中加入四氢吡咯(1.56g,1.1eq)和thf(10ml),冷却至-20℃,滴加nbuli(2.5m in hexane,8ml,1.0eq),滴毕,升至室温搅拌30min备用。得到的四氢吡咯锂未标定,按照100%收率用于反应,浓度为1.0m。
[0116]
向反应瓶中加入化合物14(2.0g,1.0eq),thf(20ml),降温至-70℃。滴加新鲜制备的四氢吡咯锂(1.0m in thf,13ml,2.2eq),滴毕,搅拌15~30min。然后滴加化合物11(1.5g,1.2eq)的thf(20ml)溶液,滴毕,保温搅拌50min。滴加醋酸(2.14g,6eq)的10ml水溶液淬灭反应,升至室温,搅拌20h。加入etoac(20ml)分液,有机相用硫酸钠干燥,过滤,浓缩,粗品柱层析纯化,得到化合物15,无色油状物,1.36g,收率47%。
[0117]
化合物15核磁:1h nmr(400mhz,cdcl3)δ7.38
–
7.26(m,5h),5.50(d,j=8.3hz,1h),5.09(s,2h),4.42
–
4.32(m,1h),4.18(q,j=7.2hz,2h),4.10(q,j=7.2hz,2h),2.46
–
2.30(m,2h),2.25
–
2.12(m,1h),2.02
–
1.90(m,1h),1.31-1.18(m,6h).
[0118]
向反应瓶中加入化合物15(1.2g,1.0eq),乙酸乙酯(10ml),冰水浴降温。滴加氯化氢-二氧六环溶液(4m,2.5ml,4eq),升至室温搅拌6h,tlc&hplc监测原料消失,将体系浓缩,加入meoh(10ml)和et3n(1.42g,5.0eq)继续搅拌12h。tlc&hplc监测开环中间体消失,将体系浓缩至无馏分。粗品柱层析纯化得到化合物16,无色油状物,0.46g,收率56%。
[0119]
化合物16核磁:1h nmr(400mhz,cdcl3)δ7.32
–
7.16(m,5h),6.39(d,j=8.1hz,1h),
5.09
–
4.98(m,2h),4.31
–
4.22(m,1h),4.11(q,j=7.1hz,2h),3.26
–
3.10(m,2h),2.44
–
2.34(m,1h),2.34
–
2.24(m,1h),2.15
–
2.04(m,1h),1.83
–
1.63(m,2h),1.18(t,j=7.2hz,3h).
[0120]
实施例6:
[0121][0122]
向反应瓶中加入l-谷氨酸二甲酯盐酸盐18(6.0g,1.0eq),三乙胺(8.61g,3.0eq),dcm(60ml),冰水浴降温。滴加pivcl(6.80g,2.0eq)。滴毕升至室温搅拌12h。加30ml水分液,有机相用30ml的dcm萃取。合并有机相,硫酸钠干燥,过滤,浓缩,粗品柱层析纯化,得到化合物19,淡黄色油状物,6.31g,收率86%。
[0123]
化合物19核磁:1h nmr(400mhz,cdcl3)δ6.42(d,j=7.4hz,1h),4.62
–
4.55(m,1h),3.76(s,3h),3.69(s,3h),2.50
–
2.32(m,2h),2.27
–
2.17(m,1h),2.08
–
1.98(m,1h),1.22(s,9h).
[0124]
制备litmp试剂:向反应瓶中加入四甲基哌啶(3.88g,1.1eq)和thf(10.4ml),冷却至-20℃,滴加nbuli(2.5m in hexane,10ml,1.0eq),滴毕,升至室温搅拌30min备用。得到的litmp未标定,按照100%收率用于反应,浓度为1.0m。
[0125]
向反应瓶中加入化合物19(2.0g,1.0eq),thf(20ml),降温至-78℃。滴加新鲜制备的litmp(1.0m in thf,15.6ml,2.2eq),滴毕,搅拌15~30min。然后滴加化合物8(2.0g,1.1eq)的thf(20ml)溶液,滴毕,保温搅拌50min。滴加5%的盐酸水溶液(15ml)淬灭反应,升至室温,搅拌2h。加入etoac(20ml)分液,有机相用硫酸钠干燥,过滤,浓缩,粗品柱层析纯化,得到化合物20,无色油状物,2.15g,收率69%。
[0126]
化合物20核磁:1h nmr(400mhz,cdcl3)δ7.38
–
7.21(m,5h),6.25(d,j=7.9hz,1h),5.18(brs,1h),5.12
–
5.01(m,2h),4.63
–
4.53(m,1h),3.71(s,3h),3.63(s,3h),3.28
–
3.10(m,2h),2.49
–
2.38(m,1h),2.07
–
1.94(m,2h),1.88
–
1.76(m,2h),1.17(s,9h).
[0127]
向反应瓶中加入化合物20(2.0g,1.0eq),乙酸乙酯(20ml),10%pd-c(1.0g),然后用氢气置换至0.3~0.4mpa,室温搅拌7h,tlc&hplc监测原料消失,将体系转出,加入二异丙基胺(0.928g,2.0eq)继续搅拌14h。tlc&hplc监测开环中间体21消失,将体系过滤,滤饼用乙酸乙酯(5ml)洗。滤液浓缩至无馏分。粗品柱层析纯化得到化合物22,白色固体,1.1g,收率85%。
[0128]
化合物22核磁:1h nmr(400mhz,cdcl3)δ7.32(d,j=6.5hz,1h),6.56(s,1h),4.50
–
4.41(m,1h),3.70(s,3h),3.37
–
3.26(m,2h),2.47
–
2.31(m,2h),2.15
–
1.99(m,1h),1.94
–
1.77(m,2h),1.19(s,9h).
[0129]
实施例7:
[0130][0131]
制备二乙基氨基锂试剂:向反应瓶中加入二乙胺(4.83g,1.1eq)和thf(29ml),冷
却至-20℃,滴加nbuli(2.5m in hexane,24ml,1.0eq),滴毕,升至室温搅拌30min备用。得到的二乙基氨基锂未标定,按照100%收率用于反应,浓度为1.0m。
[0132]
向反应瓶中加入化合物23(10.0g,1.0eq),thf(200ml),降温至-70℃。滴加新鲜配置的二乙基氨基锂(1.0m in thf,69ml,1.9eq),滴毕,搅拌15~30min。然后滴加化合物8(9.34g,1.0eq)的thf(100ml)溶液,滴毕,保温搅拌40min。tlc监测反应完全(此时得到的产物为24a),滴加1%硫酸水溶液(100ml)淬灭反应,升至室温,搅拌3~4h,tlc检测中间体反应完全,得到化合物24。加入etoac(200ml)分液,有机相用硫酸钠干燥,过滤,浓缩,粗品柱层析纯化,得到化合物24,无色油状物,10.67g,收率65%。
[0133]
向反应瓶中加入化合物24(2.0g,1.0eq),meoh(20ml),10%pd-c(0.08g)然后用氢气置换至0.9~1.1mpa,室温搅拌20h,tlc&hplc监测原料消失,将体系转出,加入碳酸钠(0.84g,1.8eq)继续搅拌12h。tlc&hplc监测开环中间体消失,将体系过滤,滤饼用meoh(4ml)洗。滤液浓缩至无馏分。粗品柱层析纯化得到化合物26,白色固体,1.16g,收率92%。
[0134]
化合物26核磁:1h nmr(400mhz,cdcl3)δ6.45(brs,1h),5.56(d,j=8.2hz,1h),4.34
–
4.26(m,1h),3.72(s,3h),3.41
–
3.29(m,2h),2.50
–
2.37(m,2h),2.13
–
2.05(m,1h),1.89
–
1.76(m,2h),1.43(s,9h).
[0135]
从以上的描述中,可以看出,本发明上述的实施例实现了如下技术效果:本发明利用五元磺酰胺或氮杂环丙烷为底物,进行α-烷基化反应、酸性水解反应、脱保护反应和关环反应,利用新的合成路线制备2-氧吡咯烷衍生物,提高生产效率。
[0136]
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
