用于治疗贫血症的组合物和方法
1.本技术是申请日为2014年6月04日、题为《用于治疗贫血症的组合物和方法》的中国发明专利申请201480045048.2的分案申请。
2.本发明申请主张2013年6月13日提交的美国临时专利申请no.61/834808;2013年10月10日提交的61/889478;2013年11月1日提交的61/898890;2013年11月1日提交的61/898885;和2013年12月5日提交的61/912185的优先权益,以上每篇专利以其全部内容作为参考并入本文。
1.技术领域
3.本发明公开涉及hif脯氨酰基羟化酶抑制剂在治疗或预防贫血症,如继发于慢性肾病或与慢性肾病有关的贫血症、与化疗有关或由化疗引起的贫血症或与aids有关的贫血症中的使用。另外,本发明公开涉及hif脯氨酰基羟化酶抑制剂化合物及其可药用盐,包含所述hif脯氨酰基羟化酶抑制剂化合物的组合,并且涉及用于治疗或预防疾病,如周围性血管疾病(pvd)、冠状动脉病(cad)、心力衰竭、缺血、缺氧和贫血症的方法。另外,本发明公开涉及hif脯氨酰基羟化酶抑制剂在治疗或预防贫血症,如继发于慢性肾病或与慢性肾病有关的贫血症、与化疗有关或由化疗引起的贫血症或与aids有关的贫血症中使用的具体剂量和给药方案。
4.2.发明背景
5.2.1低氧诱导因子
6.低氧诱导因子(hif)是作为对低氧起反应的关键调控因子的转录因子。对细胞环境中的低氧条件(即氧水平降低)起反应,hif上调一些靶标基因的转录,包括编码促红细胞生成素的那些基因。hif是包含α和β亚基的异源双链。尽管β亚基通常过量存在并且不依赖于氧含量,但是在细胞中hif-α亚基仅在低氧条件下是可检测的。在这点上,hif-α的积累主要通过被称为hif脯氨酰基羟化酶的脯氨酰基羟化酶家族对两个脯氨酸残基的羟基化作用调控的,其中一个或两个脯氨酸残基的羟基化作用导致hif-α的快速降解。因此,hif脯氨酰基羟化酶的抑制导致hif-α的稳定和积累(即hif-α的降解减少),借此导致可用于hif杂二聚体形成和靶标基因(如促红细胞生成素基因)上调的hif-α的量的增加。相反地,hif脯氨酰基羟化酶的激活导致hif-α不稳定(即hif-α的降解提高),借此导致可用于hif杂二聚体形成和靶标基因(如vegf)下调的hif-α的量的减少。
7.低氧诱导因子家族包括hif-1-α、hif-2-α和hif-3-α。
8.在美国专利no.7811595中描述了新的一类脯氨酰基羟化酶抑制剂以及它们对于治疗或预防通过低氧诱导因子(hif)脯氨酰基羟化酶的调控改善的疾病的使用,该专利以其全部内容作为参考并入本文。在美国专利公开no.2012/0309977中描述了这些脯氨酰基羟化酶抑制剂的合成,该专利以其全部内容作为参考并入本文。这些化合物抑制hif脯氨酰基羟化酶,借此稳定hif-α。由于稳定了hif-α,内源促红细胞生成素(epo)的产生提高。就像对于所有药物一样,用于治疗患有疾病(如贫血症)的患者的适合的剂量和给药方案对于现实所需或最佳治疗效果而无不良影响或不希望的副作用是必需的。的确,多种活性化合物
在临床试验中失败,这是因为无法找到有效并且安全的给药方案。
9.因此,仍需要避免或降低不良或不期望的影响,提供最佳治疗效果或两者(即提供希望的治疗谱)的安全、有效且无毒的剂量和给药方案。
10.2.2促红细胞生成素
11.使用红细胞生成-刺激剂的与慢性肾病(ckd)有关的贫血症的治疗通常会导致长时间、超生理的促红细胞生成素(epo)水平,其涉及不希望的心血管副作用(包括高血压和血栓栓塞事件)的提高。因此,仍需要无长时间、超生理的促红细胞生成素(epo)水平的与慢性肾病(ckd)有关的贫血症的治疗。
12.2.3铁代谢
13.hif调控一些靶标基因的转录,包括编码参与铁代谢的蛋白的那些基因。尽管铁被认为是活细胞所必需的,但是过量的铁积累与毒性自由基的形成和进行性组织损伤有关。过量的铁还可能导致更高风险的心血管事件和血栓栓塞事件。例如,输血或由无效性红细胞生成引起的贫血症可能造成铁过载。仍需要不提高铁过载风险的贫血症的治疗。
14.2.4肝抗菌肽
15.在贫血或低氧条件下,不但促红细胞生成素表达提高,从而导致红细胞生成活性的刺激,而且同时肝抗菌肽基因表达降低。肝抗菌肽阻断膜铁转运蛋白的作用。膜铁转运蛋白将铁移出细胞。因此,当受试者中肝抗菌肽表达减少时,膜铁转运蛋白作用解除阻断,并且从细胞中释放铁,借此提高受试者中铁过载的风险。仍需要不会降低肝抗菌肽水平的贫血症的治疗,特别是在存在铁过载问题的情况下。已将erythroferrone鉴别为肝抗菌肽的抑制剂(kautz等人,2014,nature genetics,advance online publication on june 1,2014,identification of erythroferrone as an erythroid regulator of iron metabolism)。
16.3.发明概述
17.3.1剂量施用
18.本文公开了给药方案,其中根据具体的给药方案,施用具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1和代谢产物2的化合物,或其可药用盐、溶剂化物或水合物的具体剂量以调节hif脯氨酰基羟化酶,借此稳定hif-α,并借此治疗贫血症(例如,继发于慢性肾病的贫血症)。这些化学式和化合物的说明参见5.2节。本文还公开了具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1和代谢产物2的化合物,或其可药用盐、溶剂化物或水合物的具体剂量和单位剂量形式。在具体的实施方式中,所述化合物是{[5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸。在某些具体的实施方式中,所述化合物是化合物1的可药用盐。在某些具体的实施方式中,所述化合物是化合物1的溶剂化物。在某些具体的实施方式中,所述化合物是化合物1的水合物。
[0019]
在某些实施方式中,本文描述了治疗或预防通过调节hif脯氨酰基羟化酶改善的疾病的方法,其包括向患有通过调节hif脯氨酰基羟化酶改善的疾病的患者施用有效量的
具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1和代谢产物2的化合物,或其可药用盐、溶剂化物或水合物。在具体的实施方式中,所述化合物是化合物1。在具体的实施方式中,所述化合物是化合物7。
[0020]
在某些实施方式中,用于本文所述用途的具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1和代谢产物2的化合物,或其可药用盐、溶剂化物或水合物的日剂量为约100mg、约110mg、约120mg、约130mg、约140mg、约150mg、约160mg、约170mg、约180mg、约190mg、约200mg、约210mg、约220mg、约230mg、约240mg、约250mg、约260mg、约270mg、约280mg、约290mg、约300mg、约310mg、约320mg、约330mg、约340mg、约350mg、约360mg、约370mg、约380mg、约390mg、约400mg、约410mg、约420mg、约430mg、约440mg、约450mg、约600mg或约750mg。在某些这些实施方式中,所述日剂量为约150mg、约300mg、约450mg或约600mg。可以每天一次、每天两次或每天三次(优选地每天一次)口服施用这些日剂量。在某些实施方式中,所述日剂量为2mg/kg、2.1mg/kg、2.2mg/kg、2.3mg/kg、2.4mg/kg、2.5mg/kg、2.6mg/kg、2.7mg/kg、2.8mg/kg、2.9mg/kg、3mg/kg、3.1mg/kg、3.2mg/kg、3.3mg/kg、3.4mg/kg、3.5mg/kg、3.6mg/kg、3.7mg/kg、3.8mg/kg、3.9mg/kg或4mg/kg。
[0021]
在某些实施方式中,本文提供了用于治疗或预防贫血症(如继发于慢性肾病的贫血症)的方法,其包括向患有贫血症的患者施用有效量的具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1和代谢产物2的化合物,或其可药用盐、溶剂化物或水合物。在某些这些实施方式中,具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1和代谢产物2的化合物,或其可药用盐、溶剂化物或水合物的日剂量,具体地,化合物1的日剂量为约100、约110、约120、约130、约140、约150、约160、约170、约180、约190、约200、约210、约220、约230、约240、约250、约260、约270、约280、约290、约300、约310、约320、约330、约340、约350、约360、约370、约380、约390、约400、约410、约420、约430、约440、约450、约600或约750mg。在某些这些实施方式中,所述日剂量为约150、约300、约450或约600mg。可以每天一次、每天两次或每天三次(优选地每天一次)口服施用这些日剂量。在某些实施方式中,所述日剂量为2mg/kg、2.1mg/kg、2.2mg/kg、2.3mg/kg、2.4mg/kg、2.5mg/kg、2.6mg/kg、2.7mg/kg、2.8mg/kg、2.9mg/kg、3mg/kg、3.1mg/kg、3.2mg/kg、3.3mg/kg、3.4mg/kg、3.5mg/kg、3.6mg/kg、3.7mg/kg、3.8mg/kg、3.9mg/kg或4mg/kg。
[0022]
在某些实施方式中,本文提供了单位剂量形式,其包含约150mg的量的具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1和代谢产物2的化合物,或其可药用盐、溶剂化物或水合物,具体
地,化合物1。在某些这些实施方式中,所述单位剂量形式是片剂或胶囊。
[0023]
在某些实施方式中,本文提供了将患有贫血症(如继发于慢性肾病的贫血症)的患者中血红蛋白水平维持在至少约8.0g/dl至等于或低于约13.0g/dl,至少约8.5g/dl至等于或低于约13.0g/dl,至少约9.0g/dl至等于或低于约13.0g/dl,至少约9.5g/dl至等于或低于约13.0g/dl或者至少约10.0g/dl至等于或低于约13.0g/dl的水平的方法,其包括向患有贫血症的患者施用有效量的具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1和代谢产物2的化合物,或其可药用盐、溶剂化物或水合物,具体地,化合物1。在某些这些实施方式中,本文提供了将患有贫血症的患者中血红蛋白水平维持在至少约11.0g/dl,如至少约11.0g/dl至等于或低于约13.0g/dl的水平的方法,其包括施用有效量的具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1和代谢产物2的化合物,或其可药用盐、溶剂化物或水合物,具体地,化合物1。在某些这些实施方式中,具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1和代谢产物2的化合物,或其可药用盐、溶剂化物或水合物,具体地,化合物1的日剂量为约150mg、约300mg、约450mg、约600或约750mg。在某些这些实施方式中,所述日剂量为约150mg、约300mg、约450mg或约600mg。可以每天一次、每天两次或每天三次(优选地每天一次)口服施用这些日剂量。在某些实施方式中,所述日剂量为2mg/kg、2.1mg/kg、2.2mg/kg、2.3mg/kg、2.4mg/kg、2.5mg/kg、2.6mg/kg、2.7mg/kg、2.8mg/kg、2.9mg/kg、3mg/kg、3.1mg/kg、3.2mg/kg、3.3mg/kg、3.4mg/kg、3.5mg/kg、3.6mg/kg、3.7mg/kg、3.8mg/kg、3.9mg/kg或4mg/kg。
[0024]
在某些实施方式中,本文提供了用于将患有贫血症(如慢性肾病贫血症)的患者中血红蛋白水平相对于患者中基线血红蛋白水平提高至少约0.1g/dl、至少约0.2g/dl、至少约0.3g/dl、至少约0.4g/dl、至少约0.5g/dl、至少约0.6g/dl、至少约0.7g/dl、至少约0.8g/dl、至少约0.9g/dl、至少约1.0g/dl、至少约1.1g/dl、至少约1.2g/dl、至少约1.3g/dl、至少约1.4g/dl或至少约1.5g/dl的方法,其包括向患有贫血症的患者施用有效量的具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1和代谢产物2的化合物,或其可药用盐、溶剂化物或水合物,优选地,化合物1。在某些这些实施方式中,该日剂量为约150mg、约300mg、约450mg、约600或约750mg的具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1和代谢产物2的化合物。在某些这些实施方式中,所述日剂量为约150mg、约300mg、约450mg或约600mg。可以每天一次、每天两次或每天三次(优选地每天一次)口服施用这些日剂量。
[0025]
在某些实施方式中,本文提供了用于治疗或预防患者中贫血症的方法,其中所述方法包括向所述患者施用药物有效量的具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表
示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1和代谢产物2的化合物,或其可药用盐、溶剂化物或水合物,其中所述药物有效量适合于将所述血红蛋白水平相对于患者中的基线血红蛋白水平提高至少约0.5g/dl、至少约0.6g/dl、至少约0.7g/dl、至少约0.8g/dl、至少约0.9g/dl、至少约1.0g/dl、至少约1.2g/dl或至少约1.5g/dl,同时:
[0026]
a)恢复或维持epo血清水平的每日模式(diurnal pattern);
[0027]
b)提高总铁结合力;
[0028]
c)提高总铁结合力而不显著提高总铁含量;和/或
[0029]
d)不显著降低肝抗菌肽水平。
[0030]
在某些实施方式中,本文提供了以如5.5中所公开的剂量用于治疗如5.4和5.7节中所公开的疾病、病况或病症的如5.2节中所公开的化合物。
[0031]
3.2促红细胞生成素
[0032]
在某些实施方式中,本文提供了用于治疗与促红细胞生成素(epo)的内源产生降低有关的疾病或病况的多种方法,其包括向患有与epo的内源产生降低有关的疾病或病况的患者施用足够数目的hif脯氨酰基羟化酶抑制剂或hif-α稳定剂的连续剂量,从而相对于患者中的基线血红蛋白水平提高血红蛋白水平,同时模拟健康个体中血清epo水平的日变化,其中所述hif脯氨酰基羟化酶抑制剂或者hif-α稳定剂是具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1和代谢产物2的化合物,或其可药用盐、溶剂化物或水合物。
[0033]
在某些实施方式中,本文提供了用于治疗与促红细胞生成素(epo)的内源产生降低有关的疾病或病况的方法,其包括向患有与epo的内源产生降低有关的疾病或病况的患者施用足够数目的hif脯氨酰基羟化酶抑制剂或hif-α稳定剂的连续剂量,从而相对于患者中的基线血红蛋白水平提高血红蛋白水平,其中所述连续剂量中至少一个的施用和紧邻的上一个剂量的施用之间的时间段为足以使患者中血清epo的水平返回至大约基线血清epo水平的时间段,其中所述hif脯氨酰基羟化酶抑制剂或hif-α稳定剂是具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1和代谢产物2的化合物,或其可药用盐、溶剂化物或水合物。在某些这些实施方式中,最大程度降低了与外源epo施用有关的心血管副作用和血栓栓塞事件风险。
[0034]
在某些实施方式中,本文提供了用于治疗与促红细胞生成素(epo)的内源产生降低有关的疾病或病况的多种方法,其包括向患有与epo的内源产生降低有关的疾病或病况的患者施用足够数目的hif脯氨酰基羟化酶抑制剂或hif-α稳定剂的连续剂量,从而相对于患者中的基线血红蛋白水平提高血红蛋白水平,其中在初始剂量后,在加入一个或多个剂量前,血清epo水平返回至大约基线水平,其中所述hif脯氨酰基羟化酶抑制剂或hif-α稳定剂是具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1和代谢产物2的化合物,或其可药用盐、溶剂化物或
水合物。在某些这些实施方式中,最大程度降低了与外源epo施用有关的心血管副作用和血栓栓塞事件风险。
[0035]
在某些实施方式中,本文提供了用于治疗与促红细胞生成素(epo)的内源产生降低有关的疾病或病况的方法,其包括向患有与epo的内源产生降低有关的疾病或病况的患者施用足够数目的hif脯氨酰基羟化酶抑制剂或hif-α稳定剂的连续剂量,从而相对于患者中基线血红蛋白水平提高血红蛋白水平而不会相对于血清epo的基线水平显著提高血清epo水平,其中所述hif脯氨酰基羟化酶抑制剂或hif-α稳定剂是具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1和代谢产物2的化合物,或其可药用盐、溶剂化物或水合物。在某些这些实施方式中,最大程度降低了与外源epo施用有关的心血管副作用和血栓栓塞事件风险。
[0036]
在某些这些实施方式中,血清epo水平在施用本文所公开的hif脯氨酰基羟化酶抑制剂或hif-α稳定剂剂量的约1周、约6天、约5天、约4天、约3天、约2天、约24小时、约18小时或约12小时内返回至大约基线水平。
[0037]
在某些实施方式中,血清epo水平返回至基线epo水平的约5miu/ml、约4miu/ml、约3miu/ml、约2miu/ml或约1miu/ml内。
[0038]
在某些实施方式中,在1周的一段时间内,血红蛋白水平相对于基线血红蛋白水平提高约0.1至约1.0g/dl。在某些这些实施方式中,在1周的一段时间内,血红蛋白水平相对于基线血红蛋白水平提高约0.1g/dl。
[0039]
在某些实施方式中,在2周的一段时间内,血红蛋白水平相对于基线血红蛋白水平提高约0.1至约1.0g/dl。在某些这些实施方式中,在2周的一段时间内,血红蛋白水平相对于基线血红蛋白水平提高约0.1g/dl。
[0040]
在某些实施方式中,在3周的一段时间内,血红蛋白水平相对于基线血红蛋白水平提高约0.1至约1.0g/dl。在某些这些实施方式中,在3周的一段时间内,血红蛋白水平相对于基线血红蛋白水平提高约0.5g/dl。
[0041]
在某些实施方式中,在4周的一段时间内,血红蛋白水平相对于基线血红蛋白水平提高约0.1至约1.0g/dl。在某些这些实施方式中,在4周的一段时间内,血红蛋白水平相对于基线血红蛋白水平提高约0.6g/dl。
[0042]
在某些实施方式中,所述疾病或病况是贫血症。在某些这些实施方式中,所述贫血症是继发于慢性肾病(ckd)的贫血症。在某些这些实施方式中,所述慢性肾病是3、4或5期慢性肾病。在某些这些实施方式中,所述慢性肾病是透析前慢性肾病。
[0043]
在某些实施方式中,每天施用一次hif脯氨酰基羟化酶抑制剂或hif-α稳定剂。在某些实施方式中,口服施用hif脯氨酰基羟化酶抑制剂或hif-α稳定剂。
[0044]
在某些实施方式中,所述hif脯氨酰基羟化酶抑制剂或hif-α稳定剂是化合物1或其可药用盐、溶剂化物或水合物。
[0045]
在某些实施方式中,所述hif脯氨酰基羟化酶抑制剂或hif-α稳定剂是化合物7或其可药用盐、溶剂化物或水合物。
[0046]
在某些实施方式中,本文提供了以如5.5中所公开的剂量(具体地,以适合于模拟天然epo每日模式(参见5.3.1节)的剂量)用于治疗如5.4和5.7节中所公开的疾病、病况或
病症的如5.2节中所公开的化合物。
[0047]
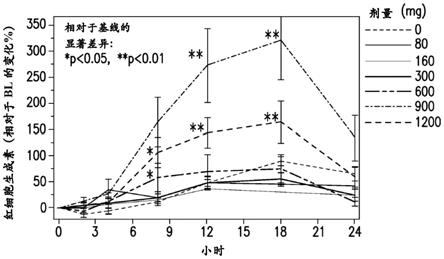
3.3铁代谢
[0048]
通常,认为为了有效治疗与促红细胞生成素(epo)的内源产生降低有关的疾病或病况,如贫血症或继发于慢性肾病的贫血症,需要血清铁水平的提高和转铁蛋白饱和度(tsat)的提高。意外地,发现可以通过提高总铁结合力同时不提高血清铁水平,借此导致转铁蛋白饱和度降低来有效治疗与促红细胞生成素(epo)的内源产生降低有关的疾病或病况或者与内源血红蛋白产生缺乏有关的疾病或病况,如贫血症或继发于慢性肾病的贫血症。因此,可以降低或避免与血清铁水平提高有关的不希望的副作用。
[0049]
在某些实施方式中,本文提供了治疗与促红细胞生成素(epo)的内源产生降低有关的疾病或病况的方法,其包括向患有与epo的内源产生降低有关的疾病或病况的患者施用足够数目的hif脯氨酰基羟化酶抑制剂或hif-α稳定剂的连续剂量,从而相对于患者中基线总铁结合力(tibc)提高tibc而不会相对于基线血清铁水平显著提高血清铁水平。
[0050]
在某些实施方式中,本文提供了用于治疗或预防受试者中贫血症的方法,其中所述方法包括向所述受试者施用药物有效量的具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1和代谢产物2的化合物,或其可药用盐、溶剂化物或水合物。在某些更具体的实施方式中,具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1和代谢产物2的化合物,或其可药用盐、溶剂化物或水合物的药物有效量适合于将tibc相对于基线tibc提高至少约10g/dl、至少约20g/dl、至少约30g/dl、至少约40g/dl、至少约50g/dl或至少约60g/dl,和/或将血红蛋白水平相对于患者中的基线血红蛋白水平提高至少约0.5g/dl、至少约0.6g/dl、至少约0.7g/dl、至少约0.8g/dl、至少约0.9g/dl、至少约1.0g/dl、至少约1.2g/dl或至少约1.5g/dl,同时:
[0051]
a)恢复或维持epo血清水平的每日模式;和/或
[0052]
b)维持总铁的处理前水平(即,不显著提高总铁水平);和/或
[0053]
c)不显著降低肝抗菌肽水平。
[0054]
在某些实施方式中,本文提供了治疗与促红细胞生成素(epo)的内源产生降低有关的疾病或病况同时最大程度降低心血管副作用和与血清铁水平提高有关的血栓栓塞事件风险的方法,其包括向患有与epo的内源产生降低有关的疾病或病况的患者施用足够数目的hif脯氨酰基羟化酶抑制剂或hif-α稳定剂的连续剂量,从而相对于患者中基线总铁结合力(tibc)提高tibc而不会相对于基线血清铁水平显著提高血清铁水平。
[0055]
在某些实施方式中,相对于基线转铁蛋白饱和度(tsat),tsat降低。在某些实施方式中,相对于基线血清铁水平,血清铁水平降低。
[0056]
在某些实施方式中,相对于基线tibc,tibc提高至少约10g/dl、至少约20g/dl、至少约30g/dl、至少约40g/dl、至少约50g/dl或至少约60g/dl。
[0057]
在某些实施方式中,相对于基线tibc,在约1周内、约2周内、约3周内、约4周内、约5周内或约6周内发生tibc提高。
[0058]
在某些实施方式中,相对于基线血清铁水平,血清铁水平提高小于约20μg/dl、小
于约15μg/dl、小于约10μg/dl或小于约5μg/dl。
[0059]
在某些实施方式中,所述疾病或病况是贫血症。在某些这些实施方式中,所述贫血症是继发于慢性肾病(ckd)的贫血症。在某些这些实施方式中,所述慢性肾病是3、4或5期慢性肾病。在某些这些实施方式中,所述慢性肾病是透析前慢性肾病。
[0060]
在某些实施方式中,每天施用一次hif脯氨酰基羟化酶抑制剂或hif-α稳定剂。
[0061]
在某些实施方式中,口服施用hif脯氨酰基羟化酶抑制剂或hif-α稳定剂。
[0062]
在某些实施方式中,所述hif脯氨酰基羟化酶抑制剂或hif-α稳定剂是杂环羧酰胺。在某些这些实施方式中,所述hif脯氨酰基羟化酶抑制剂或hif-α稳定剂选自吡啶羧酰胺、喹啉羧酰胺和异喹啉羧酰胺。在某些实施方式中,所述hif脯氨酰基羟化酶抑制剂或hif-α稳定剂是具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1和代谢产物2的化合物,或其可药用盐、溶剂化物或水合物。
[0063]
在某些实施方式中,本文提供了以如5.5中所公开的剂量(具体地,以适合于提高如5.3.2节中所述的总铁结合力的剂量)用于治疗如5.4和5.7节中所公开的疾病、病况或病症的如5.2节中所公开的化合物。
[0064]
3.4肝抗菌肽
[0065]
意外地,发现可以通过提高血清血红蛋白水平而不降低肝抗菌肽表达来治疗某些类型的贫血症,如继发于慢性肾病的非重型贫血症、继发于慢性心力衰竭的非重型贫血症或衰老的特发性贫血症(idiopathic anemia of aging)。因此,肝抗菌肽表达类似于健康成年人中的表达并且起作用以调控铁正常转运。
[0066]
在某些实施方式中,本文提供了治疗选自继发于慢性肾病的非重型贫血症、继发于充血性心力衰竭的非重型贫血症和衰老的特发性贫血症的疾病或病况的方法,其包括向患有继发于慢性肾病的非重型贫血症、继发于充血性心力衰竭的非重型贫血症和衰老的特发性贫血症的患者施用足够数目的hif脯氨酰基羟化酶抑制剂或hif-α稳定剂的连续剂量,从而相对于患者中的基线血清血红蛋白水平提高血清血红蛋白水平,而不会相对于基线肝抗菌肽表达水平显著降低肝抗菌肽表达。
[0067]
在某些实施方式中,在1周的一段时间内,血清血红蛋白水平相对于基线血红蛋白水平提高约0.1至约1.0g/dl。在某些这些实施方式中,在1周的一段时间内,血清血红蛋白水平相对于基线血红蛋白水平提高约0.1g/dl。
[0068]
在某些实施方式中,在2周的一段时间内,血清血红蛋白水平相对于基线血红蛋白水平提高约0.1至约1.0g/dl。在某些这些实施方式中,在2周的一段时间内,血清血红蛋白水平相对于基线血红蛋白水平提高约0.1g/dl。
[0069]
在某些实施方式中,在3周的一段时间内,血清血红蛋白水平相对于基线血红蛋白水平提高约0.1至约1.0g/dl。在某些这些实施方式中,在3周的一段时间内,血清血红蛋白水平相对于基线血红蛋白水平提高约0.5g/dl。
[0070]
在某些实施方式中,在4周的一段时间内,血清血红蛋白水平相对于基线血红蛋白水平提高约0.1至约1.0g/dl。在某些这些实施方式中,在4周的一段时间内,血清血红蛋白水平相对于基线血红蛋白水平提高约0.6g/dl。
[0071]
在某些实施方式中,在5周的一段时间内,血清血红蛋白水平相对于基线血红蛋白水平提高约0.1至约1.0g/dl。在某些这些实施方式中,在5周的一段时间内,血清血红蛋白水平相对于基线血红蛋白水平提高约0.6g/dl。
[0072]
在某些实施方式中,在6周的一段时间内,血清血红蛋白水平相对于基线血红蛋白水平提高约0.1至约1.0g/dl。在某些这些实施方式中,在6周的一段时间内,血清血红蛋白水平相对于基线血红蛋白水平提高约0.6g/dl。
[0073]
在某些实施方式中,相对于基线肝抗菌肽表达水平,肝抗菌肽表达降低小于约20%、小于约15%、小于约10%、小于约5%、小于约4%、小于约3%、小于约2%或小于约1%。
[0074]
在某些实施方式中,所述疾病或病况是继发于慢性肾病的非重型贫血症。在某些实施方式中,所述疾病或病况是非重型充血性心力衰竭。在某些实施方式中,所述疾病或病况是衰老的特发性贫血症。
[0075]
在某些实施方式中,每天施用一次hif脯氨酰基羟化酶抑制剂或hif-α稳定剂。在某些实施方式中,口服施用hif脯氨酰基羟化酶抑制剂或hif-α稳定剂。
[0076]
在某些实施方式中,所述hif脯氨酰基羟化酶抑制剂或hif-α稳定剂是杂环羧酰胺。在某些这些实施方式中,所述hif脯氨酰基羟化酶抑制剂或hif-α稳定剂选自吡啶羧酰胺、喹啉羧酰胺和异喹啉羧酰胺。
[0077]
在某些实施方式中,所述hif脯氨酰基羟化酶抑制剂或hif-α稳定剂是具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1和代谢产物2的化合物,或其可药用盐、溶剂化物或水合物。在具体的实施方式中,所述hif脯氨酰基羟化酶抑制剂或hif-α稳定剂是化合物1或其可药用盐、溶剂化物或水合物。在具体的实施方式中,所述hif脯氨酰基羟化酶抑制剂或hif-α稳定剂是化合物7或其可药用盐、溶剂化物或水合物。
[0078]
在某些实施方式中,本文提供了以如5.5中所公开的剂量(具体地,以适合于治疗贫血症而不降低肝抗菌肽水平(如5.3.3节中所述)和/或提高erythroferrone水平(如5.3.4节中所述)的剂量)用于治疗如5.4和5.7节中所公开的疾病、病况或病症的如5.2节中所公开的化合物。
4.附图说明
[0079]
图1a显示了健康男性成年人在24小时内的化合物1的血清浓度。
[0080]
图1b显示了施用化合物1后24小时内,健康男性成年人中的epo反应。
[0081]
图2显示了施用化合物1后24小时内,继发于慢性肾病的贫血症患者中的epo水平。
[0082]
图3显示了24小时内继发于慢性肾病的贫血症患者中的化合物1的浓度。
[0083]
图4显示了当以多个剂量施用化合物1时,继发于慢性肾病的贫血症患者中血红蛋白相对于基线的变化。
[0084]
图5显示了使用化合物1治疗6周内,继发于慢性肾病的贫血症患者中血红蛋白、网织红细胞和epo水平。
[0085]
图6显示了在继发于慢性肾病的贫血症患者中,在剂量递增研究中,血红蛋白和铁
蛋白相对于平均基线的平均(
±
se)绝对变化。
[0086]
图7显示了6周内继发于慢性肾病的贫血症患者中总铁结合力的提高,同时还显示了当用化合物1治疗时,血清铁水平无显著提高。
[0087]
图8显示当用化合物1治疗时,6周内继发于慢性肾病的贫血症患者中相对于基线的血清血红蛋白水平提高。
[0088]
图9显示在低剂量下,当用化合物1治疗时,6周内继发于慢性肾病的贫血症患者中相对于基线肝抗菌肽表达不降低。
[0089]
5.发明详述
[0090]
在某些实施方式中,本文提供了用于治疗或预防患者中贫血症的方法,其中所述方法包括向所述患者施用药物有效量的具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1和代谢产物2的化合物,或其可药用盐、溶剂化物或水合物,其中所述药物有效量适合于将所述血红蛋白水平相对于患者中的基线血红蛋白水平提高至少约0.2g/dl、0.3g/dl、0.4g/dl、0.5g/dl、至少约0.6g/dl、至少约0.7g/dl、至少约0.8g/dl、至少约0.9g/dl、至少约1.0g/dl、至少约1.2g/dl或至少约1.5g/dl,同时:a)恢复或维持epo血清水平的每日模式;和/或b)提高总铁结合力;和/或c)提高总铁结合力而不显著提高总铁水平;和/或c)不显著降低肝抗菌肽水平。
[0091]
5.1定义和缩写
[0092]
在某些实施方式中,如在本说明书的整个描述和权利要求中所使用的,单词“包含”及该单词的其它形式表示包括(但不限于)和不意欲排除(例如)其它添加剂、成分、整数或步骤。在某些实施方式中,如在描述和所附权利要求中所使用的,除非在上下文中明确说明,否则单数形式的“一个”和“所述”包括复数对象。因此,例如,提及“组合物”包括两种或更多种这些组合物的混合物。在某些实施方式中,“任选的”或“任选地”表示随后描述的事件或情况可以或可以不发生,并且该描述包括其中所述事件或情况发生的情况以及其不发生的情况。
[0093]
如本文所使用的,“烷基”基团是饱和直链或支链非环烃,其具有(例如)1至12个碳原子、1至9个碳原子、1至6个碳原子、1至4个碳原子或2至6个碳原子。代表性的烷基包括-甲基、-乙基、-正丙基、-正丁基、-正戊基和-正己基;而支链烷基包括-异丙基、-仲丁基、异丁基、叔丁基、异戊基、2-甲基戊基、3-甲基戊基、4-甲基戊基、2,3-二甲基丁基等。
[0094]c1-6
烷基单元包括以下非限制性实例:甲基(c1)、乙基(c2)、正丙基(c3)、异丙基(c3)、正丁基(c4)、仲丁基(c4)、异丁基(c4)、叔丁基(c4)、正戊基(c5)、叔戊基(c5)、新戊基(c5)、异戊基(c5)、仲戊基(c5)、3-戊基(c5)、正己基(c6)、异己基(c6)、新己基(c6)、3-甲基戊基(c6)、4-甲基戊基(c6)、3-甲基戊-2-基(c6)、4-甲基戊-2-基(c6)、2,3-二甲基丁基(c6)、3,3-二甲基丁-2-基(c6)、2,3-二甲基丁-2-基(c6)等。
[0095]
如本文所使用的,“烯基”是含有至少一个碳-碳双键并且具有(例如)1-6个碳原子的部分不饱和的直链或支链非环烃。代表性的烯基包括丙烯基等。
[0096]
如本文所使用的,“炔基”是含有至少一个碳-碳三键并且具有(例如)2-6个碳原子的部分不饱和的直链或支链非环烃。代表性的炔基包括丙炔基、丁炔基等。
[0097]
如本文所使用的,“烷氧基”是烷基-o-基团,其中所述烷基如本文所定义。代表性的烷氧基包括甲氧基、乙氧基、n-丙氧基、异丙氧基和n-丁氧基。
[0098]
如本文所使用的,“环烷基”是具有单环的3-6个碳原子的饱和环状烷基。代表性的环烷基包括环丙基、环丁基和环戊基。
[0099]
如本文所使用的,“环烯基”是含有至少一个碳-碳双键并且是具有单环的3-6个碳原子的部分不饱和环烷基。代表性的环烯基包括环丙烯基和环丁烯基。
[0100]
如本文所使用的,“环烷氧基”是环烷基-o-基团,其中所述环烷基如本文所定义。代表性的环烷氧基包括环丙氧基、环丁氧基和环戊氧基。
[0101]
如本文所使用的,“卤代烷基”是一个或多个(例如,1至5个)氢原子被卤素原子取代的如本文以上所定义的烷基。代表性的卤代烷基包括cf3、chf2、ch2f、ccl3、cf3ch2ch2和cf3cf2。
[0102]
如本文所使用的,“卤代环烷基”是一个或多个(例如,1至5个)氢原子被卤素原子取代的如本文以上所定义的环烷基。代表性的卤代环烷基包括2,2-二氟环丙基、2,2-二氯环丙基、2,2-二溴环丙基、四氟环丙基、3,3-二氟环丁基和2,2,3,3-四氟环丁基。
[0103]
如本文所使用的,“杂环烷基”是4-7个原子,优选地,5或6个环原子的饱和环,其中1个或2个环成员选自o、s和nr”并且剩余的原子为碳。在环中没有相邻的氧和/或硫原子。代表性的杂环烷基为哌啶基、吡咯烷基、哌嗪基、吗啉基、硫代吗啉基、噻唑烷基、1,3-二氧戊环基、1,4-二氧己环基、恶唑啉、四氢呋喃基、四氢苯硫基和四氢硫代吡喃基。
[0104]
如本文所使用的,“芳基”是包含6至10个碳原子的芳香族单环或多环环系统。代表性的芳基包括苯基和萘基。
[0105]
如本文所使用的,“杂芳基”是5至10个原子的单环、双环或苯并稠合杂芳基,所述原子包括2-9个碳原子和1-4个杂原子,所述杂原子独立地选自n、o和s,只要所述环不包含相邻的氧和/或硫原子。还包括所述环氮的n-氧化物。代表性的单环杂芳基包括吡啶基、恶唑基、异恶唑基、氧杂二唑基、呋喃基、吡咯基、噻吩基、咪唑基、吡唑基、四唑基、噻唑基、异噻唑基、噻二唑基、吡嗪基、嘧啶基、哒嗪基和三唑基。代表性的双环杂芳基是萘啶基(例如,1,5或1,7)、咪唑并吡啶基、吡啶并嘧啶基和7-氮杂吲哚基。代表性的苯并稠合杂芳基包括吲哚基、喹啉基、异喹啉基、2,3-二氮杂萘基、苯并噻吩基(即硫茚基)、苯并咪唑基、苯并呋喃基、苯并噁唑基、苯并异噁唑基、苯并噻唑基和苯并呋咱基。考虑了所有位置异构体,例如,2-吡啶基、3-吡啶基和4-吡啶基。
[0106]
出于本发明公开的目的,术语“化合物”、“类似物”和“物质组合物(composition of matter)”等同地表示本文所述的hif脯氨酰基羟化酶抑制剂,包括所有的对映体形式、非对映体形式、盐、互变异构体等。本文所公开的化合物包括所有盐的形式,例如,两种碱性基团的盐,尤其是胺,以及酸性基团的盐,尤其是羧酸。以下是可以与碱性基团形成可药用盐的阴离子的非限制性实例:氯离子、溴离子、碘离子、硫酸根、硫酸氢根、碳酸根、碳酸氢根、磷酸根、甲酸根、乙酸根、丙酸根、丁酸根、丙酮酸根、乳酸根、草酸根、丙二酸根、马来酸根、琥珀酸根、酒石酸根、延胡索酸根、柠檬酸根等。以下是可以形成本文所述的化合物上的酸性取代基团的阴离子形式的可药用盐的阳离子的非限制性实例:钠、锂、钾、钙、镁、锌、铋等。以下是可以形成本文所述的化合物上的酚、芳基醇或杂芳基醇取代基团的阴离子形式的可药用盐的阳离子的非限制性实例:钠、锂和钾。在某些实施方式中,在整个本发明的说
明书中,术语“化合物”、“类似物”和“物质组合物”是可互换使用的。.
[0107]
应注意如果在所示结构和命名该结构的名称之间存在差异,则以所示结构为准。另外,如果没有用(例如)黑体或下划线标出结构的立体化学或结构部分,则所述结构或所述结构部分应理解为涵盖其所有立体异构体。
[0108]
如本文所使用的,术语“贫血症”是本领域承认的并且通过如下所示的血红蛋白阈值所限定:
[0109]
年龄或性别分组血红蛋白阈值(g/dl)儿童(0.50-4.99岁)11.0儿童(5.00-11.99岁)11.5儿童(12.00-14.99岁)12.0非孕妇(≥15.00岁)12.0孕妇11.0男性(≥15.00岁)13.0
[0110]
贫血症可以是慢性(例如,继发于慢性肾病的贫血症、继发于慢性心力衰竭的贫血症、衰老的特发性贫血症、慢性疾病的贫血症,如炎症性肠病或类风湿性关节炎、脊髓发育不良综合征、骨髓纤维化及其它发育不全或发育不良贫血症)、亚急性(例如,化疗引起的贫血症,如用于治疗癌症、丙肝或其它慢性疾病的降低骨髓产生的化疗)、急性(例如,因受伤或手术的失血)、营养相关(例如,缺铁症或维生素b12缺乏)或血红蛋白病(例如,镰刀形红细胞病、地中海贫血等)或由于早熟所引起的贫血症或由于自体献血所造成的贫血症。
[0111]
如本文所使用的,术语“非重度贫血症”是指其中血红蛋白为至少9.0g/dl的患有贫血症的患者。在某些这些实施方式中,非重度贫血症是指患者中的贫血症,其中所述患者不需要输血。
[0112]
如本文所使用的,术语“剂量”表示一次施用时的化合物或它们的可药用盐、溶剂化物或水合物的量。剂量可以包括单一单位剂量形式,否则作为另外一种选择,可以包括大于单一单位剂量形式(例如,单一剂量可以包括两个片剂)或甚至小于单一单位剂量形式(例如,单一剂量可以包括半片片剂)。因此,如果每天一次以450mg的日剂量施用化合物,则化合物的剂量可以是三个片剂,每个片剂包含150mg的化合物,每天施用一次。
[0113]
如本文所使用的,术语“日剂量”表示在24小时的一段时间内施用的化合物或它们的可药用盐、溶剂化物或水合物的量。因此,可以同时施用日剂量(即每天一次剂量施用),或者作为另外一种选择,可以划分每天剂量施用,从而所述化合物的施用是每天两次、每天三次或甚至每天四次。当每天无间断的施用日剂量时,则这种剂量施用被称为是“连续”剂量施用。
[0114]
如本文所使用的,术语“单位剂量形式”包括片剂;囊片剂;胶囊,如弹性软明胶胶囊;香囊剂(sachets);扁囊剂;锭剂;糖锭剂;分散剂;粉末;溶液;凝胶剂;适于口腔或粘膜施用患者的液体剂量形式,包括混悬液(例如,水性或非水性液体混悬液)、乳液(例如,水包油乳液或油包水液体乳液)、溶液剂和酏剂;可以重新配制以提供适于向患者口服或肠胃外施用的液体剂量形式的无菌固体(例如,结晶或无定形固体)。单位剂量形式不需要必须作为单一剂量施用,并且单一单位剂量形式也不需要构成整个剂量。
[0115]
如本文所使用的,“有效量”是指在疾病的治疗中足以提供治疗益处或者足以延缓
或最大程度降低与所述疾病有关的症状的化合物或其可药用盐、溶剂化物或水合物的量。本文描述了某些优选的有效量。在某些实施方式中,所述化合物是本文所公开的化合物。
[0116]
如本文所使用的,术语“预防”是本领域所承认的,并且当与病况,如局部复发(例如,疼痛)、疾病,如癌症、复合型综合征,如心力衰竭或任何其它医学病况相关使用时,它在本领域中是良好理解的,并且包括本文所提供的化合物或其可药用盐、溶剂化物或水合物的施用,其相对于未接受所述组合物的受试者,降低了受试者中医学病况症状的频率或延缓了它的发生。在某些实施方式中,所述化合物是本文未公开的化合物。在某些实施方式中,所述病况是与促红细胞生成素(epo)的内源产生降低有关的疾病或病况或与内源血红蛋白产生缺乏有关的疾病或病况,如贫血症或继发于慢性肾病的贫血症。
[0117]
如本文所使用的,术语“治疗”是指以改善或稳定受试者状况的形式逆转、降低或控制病况的症状、临床征象和潜在病理。术语“治疗”还表示疾病或与疾病有关的症状的根除或改善。在某些实施方式中,这些术语表示由于向患有疾病的患者施用本文所提供的化合物或其可药用盐、溶剂化物或水合物,最大程度降低所述疾病的扩散或恶化。
[0118]
如本文所使用的,术语“可药用盐”是指从可药用无毒酸或碱(包括无机酸和碱以及有机酸和碱)制备的盐。具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1和代谢产物2的化合物的适合的可药用碱加成盐包括(但不限于)钠、锂、钾、钙、镁、锌、铋、铵(包括烷基取代铵)、氨基酸(例如,赖氨酸、鸟氨酸、精氨酸或谷氨酰胺)、氨丁三醇和葡甲胺。适合的无毒酸包括(但不限于)无机酸和有机酸,如乙酸、海藻酸、邻氨基苯甲酸、苯磺酸、苯甲酸、樟脑磺酸、柠檬酸、乙磺酸、甲酸、反丁烯二酸、糠酸、半乳糖醛酸、葡萄糖酸、葡萄糖醛酸、谷氨酸、乙醇酸、氢溴酸、盐酸、羟乙磺酸、乳酸、马来酸、苹果酸、扁桃酸、甲磺酸、粘酸、硝酸、双羟萘酸、泛酸、苯乙酸、磷酸、丙酸、水杨酸、硬脂酸、琥珀酸、磺胺酸、硫酸、酒石酸和对甲基苯磺酸。盐的其它实例在本领域中是熟知的,参见,例如,remington’s pharmaceutical sciences,第22版,pharmaceutical press,(2012)。
[0119]
在某些实施方式中,“可药用”是指不是生物学上或另外不期望的材料,即可以将所述材料与相关活性化合物一起施用于个体而不会导致临床上不可接受的生物作用或以有害的方式与药物组合物所含有的它的任何另一种成分相互作用。
[0120]
如本文所使用的,术语“水合物”是指本文所提供的化合物或其可药用盐,其还包含通过非共价分子间力结合的化学计量或非化学计量的量的水。
[0121]
如本文所使用的,术语“溶剂化物”是指本文所提供的化合物或其可药用盐,其还包含通过非共价分子间作用力结合除水之外的化学计量的或非化学计量的量的溶剂。
[0122]
如本文所使用的并且除非另外说明,否则术语“约”或“大约”表示如本领域的技术人员所确定的具体值的可接受误差,其部分取决于如何测量或确定该值。在某些实施方式中,术语“约”或“大约”表示在1、2、3或4个标准偏差内。在某些实施方式中,术语“约”或“大约”表示给定值或范围的50%,20%、15%,10%,9%,8%,7%,6%,5%,4%,3%,2%,1%,0.5%或0.05%之内。在某些实施方式中,可以从“约”一个具体值和/或至“约”另一个具体值来表示范围。当表达该范围时,另一方面包括从一个具体值和/或至另一个具体值。类似地,当值表示为近似值时,通过使用先行词“约”,将理解具体值形成了另一个方面。还将理
解相对于另一个终点并且独立于另一个终点,每个范围的终点是显著的。还应理解存在一些本文所公开的值,并且除了该值本身外,每个值也在本文中作为该具体值的“约”值公开。例如,如果公开了值“10”,那么还公开了“约10”。还应理解当公开了一个值时,则还公开了“小于或等于”该值、“大于或等于该值”以及所述值之间的可能范围,如本领域技术人员所正确理解的。例如,如果公开了值“10”,那么还公开了“小于或等于10”以及“大于或等于10”。还应理解在整个发明申请中,以一些不同形式提供了数据,并且该数据表示数据点的任意组合的终点和起点以及范围。例如,如果公开了具体数据点“10”和具体数据点“15”,则应理解认为公开了大于、大于或等于、小于、小于或等于和等于10和15以及10至15之间。还应理解还公开了两个具体单位之间的每个单位。例如,如果公开了10和15,那么还公开了11、12、13和14。
[0123]
在某些实施方式中,术语受试者或患者可以表示哺乳动物,如人、小鼠、狗、驴、马、大鼠、豚鼠、鸟或猴。在具体的实施方式中,受试者或患者是人受试者或患者。
[0124]
在某些实施方式中,本文所提供的化合物是化合物1,即具有以下结构的{[5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸
[0125][0126]
在某些实施方式中,所述化合物可以是{[5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸,而在某些替代实施方式中,所述化合物可以是{[5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸的可药用盐。在某些替代实施方式中,所述化合物可以是{[5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸的溶剂化物。在某些替代实施方式中,所述化合物可以是{[5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸的水合物。在某些优选的实施方式中,本发明涉及处于其母体形式的化合物(即非盐、溶剂化物或水合物)。在某些替代的优选实施方式中,本发明涉及化合物或其可药用盐。
[0127]
如本文所使用的,术语“hif脯氨酰基羟化酶”是本领域承认的并且可以缩写为“phd”。hif脯氨酰基羟化酶也称为“含脯氨酰基羟化酶域的蛋白”,其可以缩写为“phd”。在这点上,存在三种不同的phd同工型,phd1、phd2和phd3,其分别还被称为egln2、egln1和egln3,或hph3、hph2和hph1。在某些实施方式中,hif脯氨酰基羟化酶可以表示酶的特定靶标(例如,hif-1α脯氨酰基羟化酶、hif-2α脯氨酰基羟化酶和/或hif-3α脯氨酰基羟化酶)。
[0128]
5.2化合物
[0129]
在某些实施方式中,用于通过本文所提供的方法使用的化合物是hif脯氨酰基羟化酶的调节因子。在更具体的实施方式中,用于通过本文所提供的方法使用的化合物是hif-1-α脯氨酰基羟化酶的调节因子。在其它更具体的实施方式中,用于通过本文所提供的方法使用的化合物是hif-2-α脯氨酰基羟化酶的调节因子。在某些更具体的实施方式中,用于通过本文所提供的方法使用的化合物是hif-2-α脯氨酰基羟化酶的调节因子,其对hif-2-α脯氨酰基羟化酶的活性比对hif-1-α脯氨酰基羟化酶高至少10%、20%、25%、30%、40%、50%、60%、70%、75%、80%、90%、100%、125%、150%、175%、200%、250%、500%、750%或至少1000%。因此,在某些实施方式中,相比于hif-1-α,用于通过本文所提供的方
法使用的本文所提供的化合物优选地稳定hif-2-α。为了确定相对于hif-1-α,对hif-2-α的优选的稳定,可以使用hif-1-α和hif-2-αelisa试剂盒确定使用和未使用测试化合物的受试者中hif-1-α和hif-2-α的浓度。应小心各个试剂盒中的第一抗体与另一种hif无交叉反应性(即,抗hif-1-α的第一抗体与hif-1-α免疫特异性反应而不与hif-2-α交叉反应;抗hif-2-α的第一抗体与hif-2-α免疫特异性反应而不与hif-1-α交叉反应)。
[0130]
在某些实施方式中,作为hif脯氨酰基羟化酶抑制剂或hif-α稳定剂的本发明的化合物是杂环羧酰胺。在某些这些实施方式中,所述杂环羧酰胺选自吡啶基羧酰胺、喹啉羧酰胺和异喹啉羧酰胺。
[0131]
在某些实施方式中,所述hif脯氨酰基羟化酶抑制剂或hif-α稳定剂具有式(i)所表示的结构:
[0132][0133]
或其可药用盐、溶剂化物或水合物,其中
[0134]
r和r1分别独立地为:
[0135]
(i)氢
[0136]
(ii)取代的或未取代的苯基;或者
[0137]
(iii)取代的或未取代的杂芳基;
[0138]
所述取代选自:
[0139]
(i)c
1-c4烷基;
[0140]
(ii)c
3-c4环烷基;
[0141]
(iii)c
1-c4烷氧基;
[0142]
(iv)c
3-c4环烷氧基;
[0143]
(v)c
1-c4卤代烷基;
[0144]
(vi)c
3-c4卤代环烷基;
[0145]
(vii)卤素;
[0146]
(viii)氰基;
[0147]
(ix)nhc(o)r4;
[0148]
(x)c(o)nr
5ar5b
;和
[0149]
(xi)杂芳基;或者
[0150]
(xii)两个取代基结合以形成具有5至7个原子的稠环;
[0151]
r4是c
1-c4烷基或者c
3-c4环烷基;
[0152]r5a
和r
5b
分别独立地选自:
[0153]
(i)氢;
[0154]
(ii)c
1-c4烷基;
[0155]
(iii)c
3-c4环烷基;或者
[0156]
(iv)r
5a
和r
5b
结合以形成具有3-7个原子的环;
[0157]
r2选自:
[0158]
(i)or6[0159]
(ii)nr
7ar7b
;和
[0160]
r6选自氢和c
1-c4烷基或c
3-c4环烷基;
[0161]r7a
和r
7b
分别独立地选自:
[0162]
(i)氢;
[0163]
(ii)c
1-c4烷基或者c
3-c4环烷基;或者
[0164]
(iii)r
7a
和r
7b
结合以形成具有3-7个原子的环;
[0165]
r3选自氢、甲基和乙基;
[0166]
l是具有结构-[c(r
8ar8b
)]
n-的连接单元
[0167]r8a
和r
8b
分别独立地选自氢、甲基和乙基;
[0168]
n是1-3的整数;和
[0169]
r9选自氢和甲基。
[0170]
在某些更具体的实施方式中,在式(i)中,r和r1不都是氢。
[0171]
在某些实施方式中,所述hif脯氨酰基羟化酶抑制剂或hif-α稳定剂具有式(ii)所表示的结构:
[0172][0173]
或其可药用盐、溶剂化物或水合物,其中
[0174]
a选自cr’、n、n
-o-和n
(c
1-c6烷基);
[0175]
r'选自h、c
1-c6烷基、c
3-c6环烷基、c
2-c6烯基、c
3-c6环烯基、c
2-c6炔基、c
4-c7杂环烷基、c
6-c
10
芳基、c
5-c
10
杂芳基、nh2、nhr”、n(r”)2、nhc(o)r”、nr”c(o)r”、f、cl、br、i、oh、or”、sh、sr”、s(o)r”、s(o)2r”、s(o)nhr”、s(o)2nhr”、s(o)nr”2
、s(o)2nr”2
、c(o)r”、co2h、co2r”、c(o)nh2、c(o)nhr”、c(o)nr”2
、cn、ch2cn、cf3、chf2、ch2f、nh(cn)、n(cn)2、ch(cn)2、c(cn)3;和
[0176]
r”独立地选自c
1-c6烷基、c
3-c6环烷基、c
4-c7杂环烷基、c
6-c
10
芳基和c
5-c
10
杂芳基;并且其中c
1-c6烷基、c
3-c6环烷基或c
4-c7杂环烷基任选地被以下基团取代:oxo、nh2、nhr”、n(r”)2、f、cl、br、i、oh、or”、sh、sr”、s(o)r”、s(o)2r”、s(o)nhr”、s(o)2nhr”、s(o)nr”2
、s(o)2nr”2
、c(o)r”、co2h、co2r”、c(o)nh2、c(o)nhr”、c(o)nr”2
、cn、ch2cn、cf3、chf2、ch2f、nh(cn)、n(cn)2、ch(cn)2、c(cn)3;并且其中c
6-c
10
芳基或c
5-c
10
杂芳基任选地被以下基团取代:c
1-c6烷基、c
3-c6环烷基、c
2-c6烯基、c
3-c6环烯基、c
2-c6炔基、c
4-c7杂环烷基、c6芳基、c
5-c6杂芳基、nh2、nhr”、n(r”)2、nhc(o)r”、nr”c(o)r”、f、cl、br、i、oh、or”、sh、sr”、s(o)r”、s(o)2r”、s(o)nhr”、s(o)2nhr”、s(o)nr”2
、s(o)2nr”2
、c(o)r”、co2h、co2r”、c(o)nh2、c(o)nhr”、c(o)nr”2
、cn、ch2cn、cf3、chf2、ch2f、nh(cn)、n(cn)2、ch(cn)2或c(cn)3;并且其中氮上的两个r”基团结合以形成具有2-7个碳原子和1-3个杂原子的环,所述杂原子选自氮、氧和硫,包括将两个r”基团结合在一起的氮原子;
[0177]
r2选自:
[0178]
(i)or6;
[0179]
(ii)nr
7ar7b
;和
[0180]
r6选自氢和c
1-c4烷基或c
3-c4环烷基;
[0181]r7a
和r
7b
分别独立地选自:
[0182]
(i)氢;
[0183]
(ii)c
1-c4烷基或者c
3-c4环烷基;或者
[0184]
(iii)r
7a
和r
7b
结合以形成具有3-7个原子的环。
[0185]
在某些实施方式中,hif稳定剂是具有式(iii)的结构的化合物
[0186][0187]
或其可药用盐、溶剂化物或水合物,其中
[0188]
r选自
[0189](i)–
or1;或
[0190]
(ii)
–
nr2r3;或
[0191]
(iii)
–
om1;
[0192]
r1是:
[0193]
(i)氢;或者
[0194]
(ii)c
1-c6烷基或者c
3-c6环烷基;
[0195]
r2和r3分别独立地选自:
[0196]
(i)氢;
[0197]
(ii)c
1-c4烷基或者c
3-c4环烷基;或者
[0198]
(iii)r2和r3可以结合以形成具有2-7个碳原子和1-3个杂原子的环,所述杂原子选自氮、氧和硫,包括将r2和r3结合在一起的氮原子;和
[0199]
m1是阳离子;和
[0200]
r4是:
[0201](i)–
oh;或
[0202]
(ii)
–
om2;和
[0203]
m2是阳离子。
[0204]
在某些实施方式中,hif稳定剂是具有式(iv)的结构的化合物
[0205][0206]
或其可药用盐、溶剂化物或水合物,其中
[0207]
r选自
[0208](i)–
or1;或
[0209]
(ii)
–
nr2r3;或
[0210]
(iii)
–
om1;
[0211]
r1是:
[0212]
(i)氢;或者
[0213]
(ii)c1-c6烷基或者c3-c6环烷基;
[0214]
r2和r3分别独立地选自:
[0215]
(i)氢;
[0216]
(ii)c
1-c4烷基或者c
3-c4环烷基;或者
[0217]
(iii)r2和r3可以结合以形成具有2-7个碳原子和1-3个杂原子的环,所述杂原子选自氮、氧和硫,包括将r2和r3结合在一起的氮原子;和
[0218]
m1是阳离子;和
[0219]
r4是:
[0220](i)–
oh;或
[0221]
(ii)
–
om2;和
[0222]
m2是阳离子。
[0223]
本文所述的hif脯氨酰基羟化酶抑制剂化合物是未取代的或取代的3-羟基-吡啶-2-羧酰胺,其具有以下式(v)所示的结构:
[0224][0225]
及其可药用盐和互变异构体,其中:l是c
1-6
烷基;并且其中r1和r2独立地为h或c
1-6
烷基。
[0226]
在某些实施方式中,所述hif脯氨酰基羟化酶抑制剂或hif-α稳定剂是{[5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸(化合物1)。
[0227][0228]
或其可药用盐、溶剂化物或水合物。
[0229]
在某些实施方式中,hif稳定剂是具有以下结构的化合物2:
[0230][0231]
或其可药用盐、溶剂化物或水合物。
[0232]
在某些实施方式中,hif稳定剂是具有以下结构的化合物3:
[0233][0234]
或其可药用盐、溶剂化物或水合物。
[0235]
在某些实施方式中,hif稳定剂是具有以下结构的化合物4:
[0236][0237]
或其可药用盐、溶剂化物或水合物。
[0238]
在某些实施方式中,hif稳定剂是具有以下结构的化合物5:
[0239][0240]
或其可药用盐、溶剂化物或水合物。
[0241]
在某些实施方式中,hif稳定剂是具有以下结构的化合物6:
[0242][0243]
或其可药用盐、溶剂化物或水合物。
[0244]
在某些实施方式中,所述hif脯氨酰基羟化酶抑制剂或hif-α稳定剂是具有以下结构的化合物7:
[0245][0246]
或其可药用盐、溶剂化物或水合物。
[0247]
在某些实施方式中,hif稳定剂是具有以下结构的化合物8:
[0248][0249]
或其可药用盐、溶剂化物或水合物。
[0250]
在某些实施方式中,hif稳定剂是具有以下结构的化合物9:
[0251][0252]
或其可药用盐、溶剂化物或水合物。
[0253]
在某些实施方式中,hif稳定剂是具有以下结构的化合物10:
[0254][0255]
或其可药用盐、溶剂化物或水合物。
[0256]
在某些实施方式中,hif稳定剂是具有以下结构的化合物11:
[0257][0258]
或其可药用盐、溶剂化物或水合物。
[0259]
在某些实施方式中,hif稳定剂是具有以下结构的化合物12:
[0260][0261]
或其可药用盐、溶剂化物或水合物。
[0262]
在某些实施方式中,hif稳定剂是具有以下结构的化合物13:
[0263][0264]
其具有名称n-(2-氨乙基)-3-羟基-吡啶-2-羧酰胺,包括其可药用盐和互变异构体。化合物13的互变异构体包括以下化合物:
[0265][0266]
在某些实施方式中,具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12或化合物13的化合物的代谢产物可以与本文所提供的方法一起使用。在某些更具体的实施方式中,该代谢产物是酚葡糖苷酸或酰基葡糖苷酸。
[0267][0268]
可以使用本领域中已知的试剂和方法制备化合物13,包括1987年4月8日公开的中
国专利申请公开no.cn 85107182 a和1986年3月13日公开的德国专利申请公开no.de 3530046 a1中提供的方法,以上每篇专利的整个内容作为参考并入本文。
[0269]
5.3治疗和预防的方法
[0270]
在某些实施方式中,本文提供了用于治疗和/或预防贫血症(如继发于慢性肾病的贫血症)方法,其包括向患有贫血症的患者施用有效量的hif脯氨酰基羟化酶抑制剂或者hif-α稳定剂,如具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1或代谢产物2的化合物,或其可药用盐、溶剂化物或水合物,其中日剂量包含约100mg、约110mg、约120mg、约130mg、约140mg、约150mg、约160mg、约170mg、约180mg、约190mg、约200mg、约210mg、约220mg、约230mg、约240mg、约250mg、约260mg、约270mg、约280mg、约290mg、约300mg、约310mg、约320mg、约330mg、约340mg、约350mg、约360mg、约370mg、约380mg、约390mg、约400mg、约410mg、约420mg、约430mg、约440mg、约450mg、约600mg或约750mg的化合物、它们的可药用盐、溶剂化物或水合物。在某些这些实施方式中,所述日剂量为约150mg、约300mg、约450mg或约600mg。可以每天一次、每天两次或每天三次(优选地每天一次)口服施用这些日剂量。在某些实施方式中,所述日剂量为2mg/kg、2.1mg/kg、2.2mg/kg、2.3mg/kg、2.4mg/kg、2.5mg/kg、2.6mg/kg、2.7mg/kg、2.8mg/kg、2.9mg/kg、3mg/kg、3.1mg/kg、3.2mg/kg、3.3mg/kg、3.4mg/kg、3.5mg/kg、3.6mg/kg、3.7mg/kg、3.8mg/kg、3.9mg/kgm或4mg/kg。
[0271]
在某些实施方式中,本文提供了用于在治疗贫血症(如继发于慢性肾病的贫血症)的方法中使用的hif脯氨酰基羟化酶抑制剂或者hif-α稳定剂,如具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、如继发于慢性肾病的贫血症、化合物11、化合物12、化合物13、代谢产物1或代谢产物2的化合物,或其可药用盐、溶剂化物或水合物,其包括以下列日剂量施用所述hif脯氨酰基羟化酶抑制剂或hif-α稳定剂:约100mg、约110mg、约120mg、约130mg、约140mg、约150mg、约160mg、约170mg、约180mg、约190mg、约200mg、约210mg、约220mg、约230mg、约240mg、约250mg、约260mg、约270mg、约280mg、约290mg、约300mg、约310mg、约320mg、约330mg、约340mg、约350mg、约360mg、约370mg、约380mg、约390mg、约400mg、约410mg、约420mg、约430mg、约440mg、约450mg、约600mg或约750mg的化合物、它们的可药用盐、溶剂化物或水合物。在某些这些实施方式中,所述日剂量为约150mg、约300mg、约450mg或约600mg。可以每天一次、每天两次或每天三次(优选地每天一次)口服施用这些日剂量。在某些实施方式中,所述日剂量为2mg/kg、2.1mg/kg、2.2mg/kg、2.3mg/kg、2.4mg/kg、2.5mg/kg、2.6mg/kg、2.7mg/kg、2.8mg/kg、2.9mg/kg、3mg/kg、3.1mg/kg、3.2mg/kg、3.3mg/kg、3.4mg/kg、3.5mg/kg、3.6mg/kg、3.7mg/kg、3.8mg/kg、3.9mg/kg或4mg/kg。在某些实施方式中,所述化合物是{[5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸。在某些实施方式中,所述化合物是{[5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸的可药用盐。在某些实施方式中,所述化合物是{[5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸的溶剂化物。在某些实施方式中,所述化合物是{[5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸的水合物。在某些实施方式中,所述化合物是2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸。在某些实施方式中,所述化合物是2-(5-(3-氟苯基)-3-羟基甲吡啶胺
基)乙酸的可药用盐。在某些实施方式中,所述化合物是2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸的溶剂化物。在某些实施方式中,所述化合物是2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸的水合物。
[0272]
在某些这些实施方式中,所述日剂量包含约150mg、约300mg、约450mg或约600mg的化合物、它们的可药用盐、溶剂化物或水合物。在某些实施方式中,所述日剂量包含约150mg。在某些实施方式中,所述日剂量包含约300mg。在某些实施方式中,所述日剂量包含约450mg。在某些实施方式中,所述日剂量包含约600mg。
[0273]
在某些实施方式中,所述慢性肾病是3、4或5期慢性肾病。在某些这些实施方式中,所述慢性肾病是透析前慢性肾病。在某些实施方式中,所述患者先前未对贫血症(如继发于慢性肾病的贫血症)进行治疗。在某些替代实施方式中,所述患者先前已对贫血症(如继发于慢性肾病的贫血症)进行治疗。在某些实施方式中,所述患者对使用重组促红细胞生成素的治疗是难治的。
[0274]
在某些实施方式中,连续施用所述日剂量。在某些实施方式中,长时期施用所述日剂量,如施用超过连续42天,或者甚至超过连续90天。在某些替代实施方式中,将所述日剂量施用至少1周并且多至连续30天、多至连续35天或甚至多至连续40天。在某些实施方式中,口服施用所述日剂量,每天一次。在某些实施方式中,以划分剂量口服施用所述日剂量,每天施用两次。在某些实施方式中,在一天的具体时间施用所述日剂量。在更具体的实施方式中,在下午较早时间施用所述日剂量。在具体的实施方式中,患者患有慢性肾病,并且在每天相同时间施用所述化合物(参见5.2节),具体地,在早晨较晚时间、下午较早时间,更具体地,在刚要吃午餐前、刚吃完午餐后、午餐至2pm之间、10am至2pm之间、在10am、11am、在12pm、在1pm或在2pm。
[0275]
在某些实施方式中,患者的血红蛋白水平保持在8.0g/dl至等于或低于约13.0g/dl的水平、至少约8.5g/dl至等于或低于约13.0g/dl的水平、至少约9.0g/dl至等于或低于约13.0g/dl的水平、至少约9.5g/dl至等于或低于约13.0g/dl的水平或至少约10.0g/dl至等于或低于约13.0g/dl的水平。在某些这些实施方式中,血红蛋白水平保持在至少约11.0g/dl至等于或低于约13.0g/dl的水平。在某些这些实施方式中,血红蛋白水平保持在至少约11.0g/dl至等于或低于约12.0g/dl的水平。在某些实施方式中,根据患者身高、性别和年龄来调整这些值。
[0276]
在某些实施方式中,本文所提供的化合物的施用(参见5.2节)导致相对于基线血红蛋白水平,血红蛋白水平提高至少约0.1g/dl、至少约0.2g/dl、至少约0.3g/dl、至少约0.4g/dl、至少约0.5g/dl、至少约0.6g/dl、至少约0.7g/dl、至少约0.8g/dl、至少约0.9g/dl、至少约1.0g/dl、至少约1.1g/dl、至少约1.2g/dl、至少约1.3g/dl、至少约1.4g/dl或至少约1.5g/dl。
[0277]
在某些实施方式中,任选地与另一种药剂组合施用所述化合物。在某些这些实施方式中,所述另一种药剂是铁补充剂,如硫酸亚铁、葡萄糖酸亚铁或富马酸亚铁,其可以在所述化合物的施用后至少2小时施用。在某些实施方式中,以一定量施用所述铁补充剂,从而将铁蛋白保持在约50ng/ml至约300ng/ml之间的水平。在某些实施方式中,以约50mg元素铁的日剂量口服施用所述铁补充剂。在某些实施方式中,根据需要施用所述铁补充剂,而在某些替代实施方式中,连续和/或长时间施用所述铁补充剂。
[0278]
在某些实施方式中,所述另一种药剂是红细胞生成刺激剂(esa),如促红细胞生成素模拟物。在某些实施方式中,所述另一种药剂是rhepo产物,如阿法依伯汀、倍他依泊汀、达贝泊汀或peginesatide。在某些实施方式中,作为救治疗法施用esa,而在某些替代实施方式中,连续和/或长时间施用esa。
[0279]
在某些这些实施方式中,在治疗过程中调节具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1或代谢产物2的化合物,或其可药用盐、溶剂化物或水合物的日剂量。具体地,使用常规测试,如(例如)血压、血细胞比容、血红蛋白水平和/或红细胞计数监控治疗。根据这些测试结果,调节(即提高或降低)所述日剂量。在更具体的实施方式中,使用以下日剂量开始治疗:约50mg、60mg、70mg、80mg、90mg、100mg、110mg、120mg、130mg、140mg、150mg、160mg、170mg、180mg、190mg、200mg、210mg、220mg、230mg、240mg、250mg、260mg、270mg、280mg、290mg、300mg、310mg、320mg、330mg、340mg、350mg、360mg、370mg、380mg、390mg、400mg、410mg、420mg、430mg、440mg或以日剂量约450mg的化合物、它们的可药用盐、溶剂化物或水合物。在某些实施方式中,随后将所述日剂量提高约50mg、100mg、150mg或200mg。在某些实施方式中,随后将所述日剂量减少约50mg、100mg、150mg或200mg。在某些实施方式中,所述化合物是化合物1或它们的可药用盐、溶剂化物或水合物。在某些实施方式中,所述化合物是化合物7或它们的可药用盐、溶剂化物或水合物。
[0280]
在某些实施方式中,本文提供了治疗贫血症(如继发于慢性肾病的贫血症)的方法,其包括向患有贫血症的患者施用具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1或代谢产物2的化合物,或其可药用盐、溶剂化物或水合物的日剂量;在施用所述化合物日剂量后测量患者中的血红蛋白水平,并且在一段时间之后再次测量,其中当患者中的血红蛋白水平小于约10.0g/dl并且与一段时间之前测量的水平相比血红蛋白水平降低小于约0.5g/dl时;或者当患者中的血红蛋白水平小于约10.0g/dl并且与一段时间之前测量的水平相比血红蛋白水平变化多至约0.4g/dl时;或者当患者中的血红蛋白水平在约10.0g/dl至约10.9g/dl之间并且与一段时间之前测量的水平相比血红蛋白水平降低小于约0.5g/dl时;施用比所述日剂量大150mg的所述化合物的调节的日剂量。在某些实施方式中,所述时间段为约1周至约8周,如约2周至约7周,约3周至约6周或约4周。在具体的实施方式中,所述化合物是化合物1或它们的可药用盐、溶剂化物或水合物。在具体的实施方式中,所述化合物是化合物7或它们的可药用盐、溶剂化物或水合物。
[0281]
在某些实施方式中,本文提供了治疗贫血症(如继发于慢性肾病的贫血症)的方法,其包括向患有贫血症的患者施用具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1或代谢产物2的化合物,或其可药用盐、溶剂化物或水合物;在施用所述化合物日剂量后测量患者中的血红蛋白水平,并且在一段时间之后再次测量,其中当患者中的血红蛋白水平小于约10.0g/dl并且与一段时间之前测量的水平相比血红蛋白水平提高大于约1.5g/dl时;或者当患者中的
血红蛋白水平在约10.0至约10.9g/dl之间并且与一段时间之前测量的水平相比血红蛋白水平提高大于约1.5g/dl时;或者当血红蛋白水平在约11.0至约12.2g/dl之间并且与一段时间之前测量的水平相比血红蛋白水平提高在约1.0至约1.4g/dl之间时;或者当血红蛋白水平在约12.3至约12.9g/dl之间并且与一段时间之前测量的水平相比血红蛋白水平降低多至约0.4g/dl或者提高多至约0.4g/dl时;或者当血红蛋白水平在约12.3至约12.9g/dl之间并且与一段时间之前测量的水平相比血红蛋白水平提高约0.5至约0.9g/dl时;施用比所述日剂量小150mg的所述化合物的调整的日剂量。在某些实施方式中,所述化合物的日剂量为约450mg。在某些实施方式中,所述化合物是{[5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸。在某些实施方式中,所述化合物是{[5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸的可药用盐。在某些实施方式中,所述化合物是{[5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸的溶剂化物。在某些实施方式中,所述化合物是{[5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸的水合物。在某些实施方式中,所述化合物是2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸。在某些实施方式中,所述化合物是2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸的可药用盐。在某些实施方式中,所述化合物是2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸的溶剂化物。在某些实施方式中,所述化合物是2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸的水合物。在某些实施方式中,所述时间段为约1周至约8周,如约2周至约7周,约3周至约6周或约4周。
[0282]
在某些实施方式中,本文提供了治疗贫血症(如继发于慢性肾病的贫血症)的方法,其包括向患有贫血症的患者施用具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1或代谢产物2的化合物,或其可药用盐、溶剂化物或水合物的日剂量;在施用所述化合物的日剂量后测量患者中的血红蛋白水平,并且在一段时间之后再次测量,其中当患者中的血红蛋白水平在约11.0至约12.2g/dl之间并且与一段时间之前测量的水平相比,血红蛋白水平提高大于约1.5g/dl时;或者当患者中的血红蛋白水平在约12.3至约12.9g/dl之间并且与一段时间之前测量的水平相比,血红蛋白水平提高在约1.0至约1.4g/dl时;或者当患者中的血红蛋白水平在约12.3至约12.9g/dl之间并且与一段时间之前测量的水平相比,血红蛋白水平提高大于约1.5g/dl时;施用比所述日剂量小300mg的所述化合物的调整的日剂量。在某些实施方式中,所述化合物的日剂量为约450mg。在某些实施方式中,所述化合物是{[5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸。在某些实施方式中,所述化合物是{[5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸的可药用盐。在某些实施方式中,所述化合物是{[5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸的溶剂化物。在某些实施方式中,所述化合物是{[5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸的水合物。在某些实施方式中,所述化合物的日剂量为约450mg。在某些实施方式中,所述化合物是2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸。在某些实施方式中,所述化合物是2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸的可药用盐。在某些实施方式中,所述化合物是2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸的溶剂化物。在某些实施方式中,所述化合物是2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸的水合物。在某些实施方式中,所述时间段为约1周至约8周,如约2周至约7周,约3周至约6周或约4周。
[0283]
在某些实施方式中,本发明涉及治疗贫血症(如继发于慢性肾病的贫血症)的方法,其包括向患有贫血症的患者施用作为{[5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸的化合物或它们的可药用盐、溶剂化物或水合物的日剂量,其中所述日剂量为约450mg。
[0284]
在某些这些实施方式中,将所述日剂量提高约150mg,从而使所述化合物的日剂量为约600mg。在某些实施方式中,将所述日剂量降低约150mg,从而使所述化合物的日剂量为约300mg。在某些实施方式中,将所述日剂量降低约300mg,从而使所述化合物的日剂量为约150mg。
[0285]
在某些实施方式中,所述化合物是{[5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸。在某些实施方式中,所述化合物是{[5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸的可药用盐。在某些实施方式中,所述化合物是{[5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸的溶剂化物。在某些实施方式中,所述化合物是{[5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸的水合物。
[0286]
在某些实施方式中,所述慢性肾病是3、4或5期慢性肾病。在某些这些实施方式中,所述慢性肾病是透析前慢性肾病。在某些实施方式中,所述患者先前未对贫血症(如继发于慢性肾病的贫血症)进行治疗。在某些替代实施方式中,所述患者先前已对贫血症(如继发于慢性肾病的贫血症)进行治疗。
[0287]
在某些实施方式中,本发明涉及治疗贫血症(如继发于慢性肾病的贫血症)的方法,其包括向患有贫血症的患者施用作为{[5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸的化合物或其可药用盐、溶剂化物或水合物的日剂量;在施用所述化合物的日剂量后测量患者中的血红蛋白水平,并且在一段时间之后再次测量,其中当患者中的血红蛋白水平在约11.0至约12.2g/dl之间并且与一段时间之前测量的水平相比,血红蛋白水平提高大于约1.5g/dl时;或者当患者中的血红蛋白水平在约12.3至约12.9g/dl之间并且与一段时间之前测量的水平相比,血红蛋白水平提高在约1.0至约1.4g/dl之间时;或者当患者中的血红蛋白水平在约12.3至约12.9g/dl之间并且与一段时间之前测量的水平相比,血红蛋白水平提高大于约1.5g/dl时;施用比所述日剂量小300mg的所述化合物的调整的日剂量。在某些实施方式中,所述化合物的日剂量为约450mg。
[0288]
5.3.1血清促红细胞生成素的每日变化
[0289]
健康成年男性中的临床i期试验显示在施用后24小时内,作为hif脯氨酰基羟化酶抑制剂的化合物1能够提高血清血红蛋白水平,同时使血清epo水平回到大约基线水平。意外地,随后发现在患有与促红细胞生成素(epo)的内源产生降低有关的疾病或病况或者与内源血红蛋白生产缺乏有关的疾病或病况(如贫血症或继发于慢性肾病的贫血症)的患者中,通过施用本文所公开的类型的hif脯氨酰基羟化酶抑制剂化合物的连续剂量,有可能提高所述患者中的血清血红蛋白水平,同时模拟健康个体中的血清epo水平的每日变化,并且不会显著提高患者的基线血清epo水平。出于一些原因,这是意外的结果。例如,由于与健康成年男性中的半衰期相比,在这些不健康的患者中所述化合物的半衰期长两倍,因此该结果是意外的。因此,本领域技术人员预计在肾损伤患者中回到基线epo水平将需要显著更长的时间,这有可能导致延长的、超生理的epo水平以及通常与外源epo施用有关的不期望的副作用。另外,由于肾是人类促红细胞生成素产生的主要来源,因此该结果是意外的。因此,具体地,对于患有与肾损伤有关的疾病或病况的患者,本领域技术人员预计本文所提供的
化合物的施用可以导致患者血清血红蛋白水平的提高,同时还模拟了健康个体中血清epo水平的每日变化,并且不会提高患者的基线血清epo水平。该意外的结果允许向患有与促红细胞生成素(epo)的内源产生降低有关的疾病或病况或与内源血红蛋白产生有关的疾病或病况(如贫血症或继发于慢性肾病的贫血症)的患者施用足够数目的如本文所公开的化合物(如化合物1)的连续剂量,从而相对于患者中的基线血红蛋白水平提高血红蛋白水平,同时模拟健康个体中血清epo水平的日变化,并且不会显著提高基线血清促红细胞生成素(epo)水平。
[0290]
在某些实施方式中,本文提供了治疗和/或预防受试者中贫血症的方法,所述方法包括向所述受试者施用药物有效量的hif脯氨酰基羟化酶抑制剂或hif-α稳定剂,其中所述药物有效量适合于模拟血清促红细胞生成素的每日变化。更具体地,相对于治疗之前epo mrna和/或epo蛋白的谷值水平和/或相对于无贫血症受试者中epo mrna和/或epo蛋白的谷值水平,药物有效量的本文所提供的化合物的施用将epo mrna和/或epo蛋白的谷值水平提高了约0%、至多5%、10%、15%、20%、25%、30%、35%、40%、45%或至多50%,同时相对于治疗之前血清epo的峰值水平(或者与健康、非贫血症受试者相比),将生理周期期间血清epo的峰值水平提高了至少10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、100%、110%、120%、130%、140%或至少150%。在某些实施方式中,所述hif脯氨酰基羟化酶抑制剂或hif-α稳定剂是具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1或代谢产物2的化合物,或其可药用盐、溶剂化物或水合物。
[0291]
更具体地,所述药物有效量适合于模拟血清促红细胞生成素的每日变化,而不会将血清促红细胞生成素提高至基线水平之上,其中所述基线水平是无贫血症的健康志愿者中的epo的每日基线。
[0292]
在某些实施方式中,所述药物有效量适合于提高epo水平,如通过对24小时的一段时间内的epo蛋白水平作图,通过曲线下面积所测量的。epo蛋白水平处于其每日最低水平(谷值)的12小时的一段时间是“谷值阶段”;epo蛋白水平处于其每日最高水平(峰值)的12小时的一段时间是“峰值阶段”。在某些实施方式中,在峰值阶段发生了epo水平的至少50%、55%、60%、65%、70%、75%、80%、85%、90%或至少95%或100%的提高。
[0293]
在某些实施方式中,本文提供了用于治疗与促红细胞生成素(epo)的内源产生降低有关的疾病或病况的方法,其包括向患有与epo的内源产生降低有关的疾病或病况的患者施用足够数目的hif脯氨酰基羟化酶抑制剂或hif-α稳定剂的连续剂量,从而相对于患者中的基线血红蛋白水平提高血红蛋白水平,同时模拟健康个体中血清epo水平的每日变化。在某些实施方式中,所述hif脯氨酰基羟化酶抑制剂或hif-α稳定剂是具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1或代谢产物2的化合物,或其可药用盐、溶剂化物或水合物。在具体的实施方式中,所述hif脯氨酰基羟化酶抑制剂或hif-α稳定剂是化合物1或其可药用盐、溶剂化物或水合物。在具体的实施方式中,所述hif脯氨酰基羟化酶抑制剂或hif-α稳定剂是化合物7或其可药用盐、溶剂化物或水合物。在某些这些实施方式中,最大程度降低了与外源epo施
用有关的心血管副作用和血栓栓塞事件风险。
[0294]
更具体地,以一定剂量向患有与促红细胞生成素(epo)的内源产生降低有关的疾病或病况的受试者施用本文所提供的化合物,所述剂量相对于治疗之前epo mrna和/或epo蛋白水平的谷值水平和/或相对于无贫血症受试者中epo mrna和/或epo蛋白的谷值水平,将epo mrna和/或epo蛋白的谷值水平提高了约0%、至多5%、10%、15%、20%、25%、30%、35%、40%、45%或至多50%,同时相对于治疗之前epo mrna和/或epo蛋白的峰值水平和/或相对于无贫血症受试者中epo mrna和/或epo蛋白的谷值水平,将生理周期期间epo mrna和/或epo蛋白的峰值水平提高了至少10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或至少100%。
[0295]
更具体地,所述药物有效量适合于模拟与促红细胞生成素(epo)的内源产生降低有关的疾病或病况的受试者中血清促红细胞生成素的每日变化,而不会将血清促红细胞生成素提高至基线水平之上,其中所述基线水平是无贫血症的健康志愿者中epo的每日基线。在某些这些实施方式中,模拟了每日循环,但是提高了血清epo水平的每日变化的幅度。例如,在峰值阶段,epo水平提高了至少50%、55%、60%、65%、70%、75%、80%、85%、90%或至少95%或100%,但谷值水平不会显著提高。
[0296]
在某些这些实施方式中,血清epo水平在施用hif脯氨酰基羟化酶抑制剂或hif-α稳定剂剂量的约1周、约6天、约5天、约4天、约3天、约2天、约24小时、约18小时或约12小时内返回至大约基线水平。
[0297]
在某些实施方式中,血清epo水平返回至基线epo水平的约5miu/ml、约4miu/ml、约3miu/ml、约2miu/ml或约1miu/ml内。
[0298]
在某些实施方式中,在1周的一段时间内,血红蛋白水平相对于基线血红蛋白水平提高约0.1至约1.0g/dl。在某些这些实施方式中,在1周的一段时间内,血红蛋白水平相对于基线血红蛋白水平提高约0.1g/dl。
[0299]
在某些实施方式中,在2周的一段时间内,血红蛋白水平相对于基线血红蛋白水平提高约0.1至约1.0g/dl。在某些这些实施方式中,在2周的一段时间内,血红蛋白水平相对于基线血红蛋白水平提高约0.1g/dl。
[0300]
在某些实施方式中,在3周的一段时间内,血红蛋白水平相对于基线血红蛋白水平提高约0.1至约1.0g/dl。在某些这些实施方式中,在3周的一段时间内,血红蛋白水平相对于基线血红蛋白水平提高约0.5g/dl。
[0301]
在某些实施方式中,在4周的一段时间内,血红蛋白水平相对于基线血红蛋白水平提高约0.1至约1.0g/dl。在某些这些实施方式中,在4周的一段时间内,血红蛋白水平相对于基线血红蛋白水平提高约0.6g/dl。
[0302]
在某些实施方式中,所述疾病或病况是贫血症。在某些这些实施方式中,所述贫血症是继发于慢性肾病(ckd)的贫血症。在某些这些实施方式中,所述慢性肾病是3、4或5期慢性肾病。在某些这些实施方式中,所述慢性肾病是透析前慢性肾病。
[0303]
在某些实施方式中,每天施用一次hif脯氨酰基羟化酶抑制剂或hif-α稳定剂。在某些实施方式中,口服施用hif脯氨酰基羟化酶抑制剂或hif-α稳定剂。
[0304]
在某些实施方式中,本文提供了用于治疗与促红细胞生成素(epo)的内源产生降低有关的疾病或病况的方法,其包括向患有与epo的内源产生降低有关的疾病或病况的患
者施用足够数目的hif脯氨酰基羟化酶抑制剂或hif-α稳定剂的连续剂量,从而相对于患者中的基线血红蛋白水平提高血红蛋白水平,其中所述连续剂量中至少一个的施用和紧邻的上一个剂量的施用之间的时间段为足以使患者中血清epo的水平返回至大约基线血清epo水平的时间段。在某些更具体的实施方式中,所述hif脯氨酰基羟化酶抑制剂或hif-α稳定剂是具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1或代谢产物2的化合物,或其可药用盐、溶剂化物或水合物。在更具体的实施方式中,所述hif脯氨酰基羟化酶抑制剂或hif-α稳定剂是化合物1或其可药用盐、溶剂化物或水合物。。在更具体的实施方式中,所述hif脯氨酰基羟化酶抑制剂或hif-α稳定剂是化合物7或其可药用盐、溶剂化物或水合物。在某些这些实施方式中,最大程度降低了与外源epo施用有关的心血管副作用和血栓栓塞事件风险。
[0305]
在某些这些实施方式中,血清epo水平在施用hif脯氨酰基羟化酶抑制剂或hif-α稳定剂剂量的约1周、约6天、约5天、约4天、约3天、约2天、约24小时、约18小时或约12小时内返回至大约基线水平。
[0306]
在某些实施方式中,血清epo水平返回至基线epo水平的约5miu/ml、约4miu/ml、约3miu/ml、约2miu/ml或约1miu/ml内。
[0307]
在某些实施方式中,在1周的一段时间内,血红蛋白水平相对于基线血红蛋白水平提高约0.1至约1.0g/dl。在某些这些实施方式中,在1周的一段时间内,血红蛋白水平相对于基线血红蛋白水平提高约0.1g/dl。
[0308]
在某些实施方式中,在2周的一段时间内,血红蛋白水平相对于基线血红蛋白水平提高约0.1至约1.0g/dl。在某些这些实施方式中,在2周的一段时间内,血红蛋白水平相对于基线血红蛋白水平提高约0.1g/dl。
[0309]
在某些实施方式中,在3周的一段时间内,血红蛋白水平相对于基线血红蛋白水平提高约0.1至约1.0g/dl。在某些这些实施方式中,在3周的一段时间内,血红蛋白水平相对于基线血红蛋白水平提高约0.5g/dl。
[0310]
在某些实施方式中,在4周的一段时间内,血红蛋白水平相对于基线血红蛋白水平提高约0.1至约1.0g/dl。在某些这些实施方式中,在4周的一段时间内,血红蛋白水平相对于基线血红蛋白水平提高约0.6g/dl。
[0311]
在某些实施方式中,所述疾病或病况是贫血症。在某些这些实施方式中,所述贫血症是继发于慢性肾病(ckd)的贫血症。在某些这些实施方式中,所述慢性肾病是3、4或5期慢性肾病。在某些这些实施方式中,所述慢性肾病是透析前慢性肾病。
[0312]
在某些实施方式中,每天施用一次hif脯氨酰基羟化酶抑制剂或hif-α稳定剂。在某些实施方式中,口服施用hif脯氨酰基羟化酶抑制剂或hif-α稳定剂。
[0313]
在某些实施方式中,本文提供了治疗与促红细胞生成素(epo)的内源产生降低有关的疾病或病况的方法,其包括向患有与epo的内源产生降低有关的疾病或病况的患者施用足够数目的hif脯氨酰基羟化酶抑制剂或hif-α稳定剂的连续剂量,从而相对于患者中的基线血红蛋白水平提高血红蛋白水平,其中在初始剂量之后,在加入一个或多个剂量之前,血清epo水平回到大约基线水平。在某些更具体的实施方式中,所述hif脯氨酰基羟化酶抑制剂或hif-α稳定剂是具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合
物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1或代谢产物2的化合物,或其可药用盐、溶剂化物或水合物。在某些具体的实施方式中,所述化合物是化合物1。在某些具体的实施方式中,所述化合物是化合物7。在某些这些实施方式中,最大程度降低了与外源epo施用有关的心血管副作用和血栓栓塞事件风险。
[0314]
在某些这些实施方式中,血清epo水平在施用hif脯氨酰基羟化酶抑制剂或hif-α稳定剂剂量的约1周、约6天、约5天、约4天、约3天、约2天、约24小时、约18小时或约12小时内返回至大约基线水平。
[0315]
在某些实施方式中,血清epo水平返回至基线epo水平的约5miu/ml、约4miu/ml、约3miu/ml、约2miu/ml或约1miu/ml内。
[0316]
在某些实施方式中,在1周的一段时间内,血红蛋白水平相对于基线血红蛋白水平提高约0.1至约1.0g/dl。在某些这些实施方式中,在1周的一段时间内,血红蛋白水平相对于基线血红蛋白水平提高约0.1g/dl。
[0317]
在某些实施方式中,在2周的一段时间内,血红蛋白水平相对于基线血红蛋白水平提高约0.1至约1.0g/dl。在某些这些实施方式中,在2周的一段时间内,血红蛋白水平相对于基线血红蛋白水平提高约0.1g/dl。
[0318]
在某些实施方式中,在3周的一段时间内,血红蛋白水平相对于基线血红蛋白水平提高约0.1至约1.0g/dl。在某些这些实施方式中,在3周的一段时间内,血红蛋白水平相对于基线血红蛋白水平提高约0.5g/dl。
[0319]
在某些实施方式中,在4周的一段时间内,血红蛋白水平相对于基线血红蛋白水平提高约0.1至约1.0g/dl。在某些这些实施方式中,在4周的一段时间内,血红蛋白水平相对于基线血红蛋白水平提高约0.6g/dl。
[0320]
在某些实施方式中,所述疾病或病况是贫血症。在某些这些实施方式中,所述贫血症是继发于慢性肾病(ckd)的贫血症。在某些这些实施方式中,所述慢性肾病是3、4或5期慢性肾病。在某些这些实施方式中,所述慢性肾病是透析前慢性肾病。
[0321]
在某些实施方式中,每天施用一次hif脯氨酰基羟化酶抑制剂或hif-α稳定剂。在某些实施方式中,口服施用hif脯氨酰基羟化酶抑制剂或hif-α稳定剂。
[0322]
在某些实施方式中,本文提供了治疗与促红细胞生成素(epo)的内源产生降低有关的疾病或病况的方法,其包括向患有与epo的内源产生降低有关的疾病或病况的患者施用足够数目的hif脯氨酰基羟化酶抑制剂或hif-α稳定剂的连续剂量,从而相对于患者中的基线血红蛋白水平提高血红蛋白水平,而不会相对于基线血清epo水平显著提高血清epo水平,其中所述hif脯氨酰基羟化酶抑制剂或hif-α稳定剂是具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1或代谢产物2的化合物,或其可药用盐、溶剂化物或水合物。在具体的实施方式中,所述化合物是化合物1或它们的可药用盐、溶剂化物或水合物。在具体的实施方式中,所述化合物是化合物7或它们的可药用盐、溶剂化物或水合物。在某些这些实施方式中,最大程度降低了与外源epo施用有关的心血管副作用和血栓栓塞事件风险。
[0323]
在某些这些实施方式中,血清epo水平在施用hif脯氨酰基羟化酶抑制剂或hif-α
稳定剂剂量的约1周、约6天、约5天、约4天、约3天、约2天、约24小时、约18小时或约12小时内返回至大约基线水平。
[0324]
在某些实施方式中,血清epo水平返回至基线epo水平的约5miu/ml、约4miu/ml、约3miu/ml、约2miu/ml或约1miu/ml内。
[0325]
在某些实施方式中,在1周的一段时间内,血红蛋白水平相对于基线血红蛋白水平提高约0.1至约1.0g/dl。在某些这些实施方式中,在1周的一段时间内,血红蛋白水平相对于基线血红蛋白水平提高约0.1g/dl。
[0326]
在某些实施方式中,在2周的一段时间内,血红蛋白水平相对于基线血红蛋白水平提高约0.1至约1.0g/dl。在某些这些实施方式中,在2周的一段时间内,血红蛋白水平相对于基线血红蛋白水平提高约0.1g/dl。
[0327]
在某些实施方式中,在3周的一段时间内,血红蛋白水平相对于基线血红蛋白水平提高约0.1至约1.0g/dl。在某些这些实施方式中,在3周的一段时间内,血红蛋白水平相对于基线血红蛋白水平提高约0.5g/dl。
[0328]
在某些实施方式中,在4周的一段时间内,血红蛋白水平相对于基线血红蛋白水平提高约0.1至约1.0g/dl。在某些这些实施方式中,在4周的一段时间内,血红蛋白水平相对于基线血红蛋白水平提高约0.6g/dl。
[0329]
在某些实施方式中,所述疾病或病况是贫血症。在某些这些实施方式中,所述贫血症是继发于慢性肾病(ckd)的贫血症。在某些这些实施方式中,所述慢性肾病是3、4或5期慢性肾病。在某些这些实施方式中,所述慢性肾病是透析前慢性肾病。
[0330]
在某些实施方式中,每天施用一次hif脯氨酰基羟化酶抑制剂或hif-α稳定剂。在某些实施方式中,口服施用hif脯氨酰基羟化酶抑制剂或hif-α稳定剂。
[0331]
在正常、健康的成年人中,促红细胞生成素(epo)的血清水平存在正常每日变化,其中血清水平升高,然后恢复到基线血清epo水平。也就是说,在血清中epo是可检测的,并且在24小时的一段时间内epo显示出波动,其具有明显的节律:在下午处于最高水平,此后回到基线水平,这在个体间存在变化。
[0332]
可以(例如)使用体内生物测定、体外生物测定和免疫学测定确定血清epo水平。在某些实施方式中,使用免疫学测定,如elisa测定确定本文所述的血清epo水平。
[0333]
可以(例如)使用标准方法cbc确定血清血红蛋白水平,其中将红细胞裂解并且铁氰化钾将血红蛋白氧化为高铁血红蛋白,其与氰化钾结合,从而形成氰化正铁血红蛋白。通过分光光度法测量棕色颜色,并且报告相应的血红蛋白。
[0334]
在某些实施方式中,本文提供了用于治疗与促红细胞生成素(epo)的内源产生降低有关的疾病或病况或者与血红蛋白产生降低有关的疾病或病况的方法,其包括向患有与epo的内源产生降低有关的疾病或病况的患者施用足够数目的hif脯氨酰基羟化酶抑制剂或hif-α稳定剂的连续剂量,从而相对于患者中的基线血红蛋白水平提高血红蛋白水平,同时模拟健康个体中血清epo水平的每日变化。在某些这些实施方式中,本文提供了治疗与促红细胞生成素(epo)的内源产生降低有关的疾病或病况或者与血红蛋白产生降低有关的疾病或病况,同时最大程度降低心血管副作用和与外源epo施用有关的血栓栓塞事件风险的方法。在具体的实施方式中,所述化合物是化合物1或它们的可药用盐、溶剂化物或水合物。在具体的实施方式中,所述化合物是化合物7或它们的可药用盐、溶剂化物或水合物。
[0335]
在某些实施方式中,本文提供了治疗与促红细胞生成素(epo)的内源产生降低有关的疾病或病况或者与血红蛋白产生降低有关的疾病或病况的方法,其包括向患有与epo的内源产生降低有关的疾病或病况的患者施用足够数目的hif脯氨酰基羟化酶抑制剂或hif-α稳定剂的连续剂量,从而相对于患者中的基线血红蛋白水平提高血红蛋白的水平,其中所述连续剂量中至少一个的施用和紧邻的上一个剂量的施用之间的时间段为足以使患者中血清epo的水平返回至大约基线血清epo水平的时间段。在某些这些实施方式中,本文提供了治疗与促红细胞生成素(epo)的内源产生降低有关的疾病或病况或者与血红蛋白产生降低有关的疾病或病况,同时最大程度降低心血管副作用和与外源epo施用有关的血栓栓塞事件风险的方法。在具体的实施方式中,所述化合物是化合物1或它们的可药用盐、溶剂化物或水合物。在具体的实施方式中,所述化合物是化合物7或它们的可药用盐、溶剂化物或水合物。
[0336]
在某些实施方式中,本文提供了用于治疗与促红细胞生成素(epo)的内源产生降低有关的疾病或病况或者与血红蛋白产生降低有关的疾病或病况的方法,其包括向患有与epo的内源产生降低有关的疾病或病况的患者施用足够数目的hif脯氨酰基羟化酶抑制剂或hif-α稳定剂的连续剂量,从而相对于患者中的基线血红蛋白水平提高血红蛋白水平,其中在初始剂量后,在加入一个或多个剂量前,血清epo水平返回至大约基线水平。在某些这些实施方式中,本文提供了治疗与促红细胞生成素(epo)的内源产生降低有关的疾病或病况或者与血红蛋白产生降低有关的疾病或病况,同时最大程度降低心血管副作用和与外源epo施用有关的血栓栓塞事件风险的方法。在具体的实施方式中,所述化合物是化合物1或它们的可药用盐、溶剂化物或水合物。在具体的实施方式中,所述化合物是化合物7或它们的可药用盐、溶剂化物或水合物。
[0337]
在某些实施方式中,本文提供了用于治疗与促红细胞生成素(epo)的内源产生降低有关的疾病或病况或者与血红蛋白产生降低有关的疾病或病况的方法,其包括向患有与epo的内源产生降低有关的疾病或病况的患者施用足够数目的hif脯氨酰基羟化酶抑制剂或hif-α稳定剂的连续剂量,从而相对于患者中的基线血红蛋白水平提高血红蛋白水平,而不会相对于基线血清epo水平显著提高血清epo水平。在某些这些实施方式中,本文提供了治疗与促红细胞生成素(epo)的内源产生降低有关的疾病或病况或者与血红蛋白产生降低有关的疾病或病况,同时最大程度降低心血管副作用和与外源epo施用有关的血栓栓塞事件风险的方法。在具体的实施方式中,所述化合物是化合物1或它们的可药用盐、溶剂化物或水合物。在具体的实施方式中,所述化合物是化合物7或它们的可药用盐、溶剂化物或水合物。
[0338]
在某些这些实施方式中,本文提供了治疗与促红细胞生成素(epo)的内源产生降低有关的疾病或病况或者与血红蛋白产生降低有关的疾病或病况,同时最大程度降低心血管副作用和与外源epo施用有关的血栓栓塞事件风险的方法。
[0339]
在某些实施方式中,血清epo水平在hif脯氨酰基羟化酶抑制剂或hif-α稳定剂剂量施用的1周内、6天内、5天内、4天内、3天内、2天内、24小时内、18小时内或12小时内返回至大约基线水平。
[0340]
在某些实施方式中,血清epo水平返回至基线epo水平的约5miu/ml、约4miu/ml、约3miu/ml、约2miu/ml或约1miu/ml内。
[0341]
在某些实施方式中,在一段时间内,如约1周、约2周、约3周或约4周,相对于基线血红蛋白水平,血红蛋白水平提高约0.1至1.0g/dl,约0.1至0.9g/dl,约0.1至0.8g/dl,约0.1至0.7g/dl,约0.1至0.6g/dl或约0.1至0.5g/dl。在某些实施方式中,在一段时间内,如约1周、约2周、约3周或约4周,相对于基线血红蛋白水平,血红蛋白水平提高至少约0.1g/dl、约0.2g/dl、约0.3g/dl、约0.4g/dl、约0.5g/dl、约0.6g/dl、约0.7g/dl、约0.8g/dl、约0.9g/dl或约1.0g/dl。
[0342]
在某些实施方式中,在1周的一段时间内,血红蛋白水平相对于基线血红蛋白水平提高约0.1g/dl。在某些实施方式中,在2周的一段时间内,血红蛋白水平相对于基线血红蛋白水平提高约0.1g/dl。在某些实施方式中,在3周的一段时间内,血红蛋白水平相对于基线血红蛋白水平提高约0.5g/dl。在某些实施方式中,在4周的一段时间内,血红蛋白水平相对于基线血红蛋白水平提高约0.6g/dl。
[0343]
在某些实施方式中,本文提供了治疗或预防贫血症(例如,继发于慢性肾病或与慢性肾病有关的贫血症,继发于慢性心脏病的贫血症、衰老的特发性贫血症、慢性疾病的贫血症、脊髓发育不良综合征、骨髓纤维化、其它发育不全或发育不良贫血症、化疗引起的贫血症(包括用于治疗癌症、丙肝的化疗或降低骨髓产生的其它长期药物疗法)、由失血引起的贫血症、由缺铁症引起的贫血症、由维生素b12缺乏引起的贫血症、镰刀形红细胞病或地中海贫血)的方法,其包括向患有贫血症的患者施用有效量的本文所公开的化合物,如化合物1,其中在对如上所述的施用起反应的患者中模拟epo表达的每日模式。在某些实施方式中,本文提供了治疗贫血症(如继发于慢性肾病的贫血症)的方法,其包括向患有贫血症的患者施用有效量的本文所公开的化合物,如化合物1,其中在对如上所述的施用起反应的患者中模拟epo表达的每日模式。
[0344]
在某些实施方式中,本文提供了治疗或预防继发于慢性肾病的贫血症(ckd)的方法,其包括向患有继发于ckd的贫血症的患者施用有效量的本文所公开的化合物,如化合物1。可以口服施用这些日剂量,优选地每天一次。在某些实施方式中,每天施用一次所述日剂量。在某些实施方式中,ckd是1、2、3、4或5期慢性肾病。在某些这些实施方式中,ckd是3、4或5期慢性肾病。在某些实施方式中,ckd是1期慢性肾病。在某些实施方式中,ckd是2期慢性肾病。在某些实施方式中,ckd是3期慢性肾病。在某些实施方式中,ckd是4期慢性肾病。在某些实施方式中,ckd是5期慢性肾病。在某些实施方式中,所述慢性肾病是透析前的慢性肾病。在某些实施方式中,所述患者是透析患者,并且可以将这些患者称为患有终末期肾病(esrd)。在某些这些实施方式中,所述贫血症(如继发于ckd或esrd的贫血症)可以对使用红细胞生成刺激剂(包括rhepo产物,如阿法依伯汀、倍他依泊汀、达贝泊汀或peginesatide)的治疗是难治的。
[0345]
在某些实施方式中,所述患者先前已对贫血症进行治疗,而在某些替代实施方式中,所述患者先前未对贫血症进行治疗。
[0346]
在某些实施方式中,所述患者是患有慢性肾病的患者。在某些更具体的实施方式中,所述患者不具有内源epo生理循环表达类型。在某些实施方式中,施用所述化合物(即,5.2节中公开的化合物)以模拟epo的正常的内源(即,健康人的)昼夜节律模式,从而在6p.m.至午夜之间发生epo表达的峰值。在某些实施方式中,每次施用所述化合物使得epo峰值早于皮质醇峰值,具体地,使得epo峰值在皮质醇峰值前约1小时、约2小时、约3小时、约4
小时、约5小时、约6小时、约7小时或约8小时。在某些实施方式中,皮质醇峰值处于上午。在某些实施方式中,在8a.m.、9a.m.、10a.m.、11a.m.、12p.m.、1p.m.或2p.m.施用所述化合物。在某些实施方式中,在早餐之后施用化合物。在某些实施方式中,在早餐至8a.m.、9a.m.、10a.m.、11a.m.、12p.m.、1p.m.或2p.m.之间施用所述化合物。在某些实施方式中,在午餐前施用所述化合物。在某些实施方式中,在早餐和午餐之间施用所述化合物。在某些实施方式中,在午餐后施用所述化合物。在某些实施方式中,在午餐和2p.m.之间施用所述化合物。在某些实施方式中,每天在相同时间或在大约相同时间施用所述化合物。在具体的实施方式中,本文提供了治疗患有慢性肾病的受试者中贫血症的方法,其中每天在上午至2pm之间的相同时间施用100mg、约110mg、约120mg、约130mg、约140mg、约150mg、约160mg、约170mg、约180mg、约190mg、约200mg、约210mg、约220mg、约230mg、约240mg、约250mg、约260mg、约270mg、约280mg、约290mg、约300mg、约310mg、约320mg、约330mg、约340mg、约350mg、约360mg、约370mg、约380mg、约390mg、约400mg、约410mg、约420mg、约430mg、约440mg、约450mg、约600mg或约750mg的日剂量。
[0347]
5.3.2总铁结合力
[0348]
临床2a期试验显示在3、4或5期ckd患者中,与安慰剂治疗的患者相比,作为hif脯氨酰基羟化酶抑制剂的化合物1能够在施用后6周提高tibc水平。意外地,tibc水平的提高与血清铁水平的提高无关。另外,还发现化合物1导致剂量-相关的tibc增加和tsat的减少,表明化合物1的施用导致铁动员的提高。
[0349]
在某些实施方式中,本文提供了治疗或预防与促红细胞生成素(epo)的内源产生降低有关的疾病或病况的方法,其包括向患有与epo的内源产生降低有关的疾病或病况的患者施用药物有效量的如本文所公开的hif脯氨酰基羟化酶抑制剂或hif-α稳定剂,其中所述药物有效量的hif脯氨酰基羟化酶抑制剂或hif-α稳定剂适合于将患者中总铁结合力提高至少5%、10%、15%、20%、25%、30%、35%、40%、45%或至少50%。在更具体的实施方式中,药物有效量适合于将患者中的总铁结合力提高至少5%、10%、15%、20%、25%、30%、35%、40%、45%或至少50%,同时总血清铁水平不提高或提高至多1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%或至多25%。在某些实施方式中,所述hif脯氨酰基羟化酶抑制剂或者hif-α稳定剂是具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1或代谢产物2的化合物,或其可药用盐、溶剂化物或水合物。具体地,所述hif脯氨酰基羟化酶抑制剂或hif-α稳定剂是化合物1或其可药用盐、溶剂化物或水合物。具体地,所述hif脯氨酰基羟化酶抑制剂或hif-α稳定剂是化合物7或其可药用盐、溶剂化物或水合物。
[0350]
在某些实施方式中,本文提供了治疗通过提高内源促红细胞生成素(epo)产生可治疗的疾病或病况的方法,其包括向患有通过提高内源epo产生可治疗的疾病或病况的患者施用药物有效量的如本文所公开的hif脯氨酰基羟化酶抑制剂或hif-α稳定剂,其中所述药物有效量的hif脯氨酰基羟化酶抑制剂或hif-α稳定剂适合于将患者中的总铁结合力提高至少5%、10%、15%、20%、25%、30%、35%、40%、45%或至少50%。在更具体的实施方式中,药物有效量适合于将患者中的总铁结合力提高至少5%、10%、15%、20%、25%、30%、35%、40%、45%或至少50%,同时总血清铁水平不提高或提高至多1%、2%、3%、
4%、5%、6%、7%、8%、9%、10%、15%、20%或至多25%。在某些实施方式中,所述hif脯氨酰基羟化酶抑制剂或者hif-α稳定剂是具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1或代谢产物2的化合物,或其可药用盐、溶剂化物或水合物。具体地,所述hif脯氨酰基羟化酶抑制剂或hif-α稳定剂是化合物1或其可药用盐、溶剂化物或水合物。具体地,所述hif脯氨酰基羟化酶抑制剂或hif-α稳定剂是化合物7或其可药用盐、溶剂化物或水合物。
[0351]
在某些实施方式中,本文提供了治疗或预防患者中贫血症的方法,其包括向患有贫血症的患者施用药物有效量的如本文所公开的hif脯氨酰基羟化酶抑制剂或hif-α稳定剂,其中所述药物有效量的hif脯氨酰基羟化酶抑制剂或hif-α稳定剂适合于将患者中总铁结合力提高至少5%、10%、15%、20%、25%、30%、35%、40%、45%或至少50%。在更具体的实施方式中,药物有效量适合于将患者中的总铁结合力提高至少5%、10%、15%、20%、25%、30%、35%、40%、45%或至少50%,同时总血清铁水平不提高或提高至多1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%或至多25%。在某些实施方式中,所述hif脯氨酰基羟化酶抑制剂或者hif-α稳定剂是具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1或代谢产物2的化合物,或其可药用盐、溶剂化物或水合物。具体地,所述hif脯氨酰基羟化酶抑制剂或hif-α稳定剂是化合物1或其可药用盐、溶剂化物或水合物。具体地,所述hif脯氨酰基羟化酶抑制剂或hif-α稳定剂是化合物7或其可药用盐、溶剂化物或水合物。
[0352]
在某些实施方式中,所述贫血症是(例如)继发于慢性肾病或与慢性肾病有关的贫血症、继发于慢性心脏病的贫血症、衰老的特发性贫血症、慢性疾病的贫血症、脊髓发育不良综合征、骨髓纤维化、其它发育不全或发育不良贫血症、化疗引起的贫血症(包括用于治疗癌症、丙肝的化疗或降低骨髓产生的其它长期药物疗法)、由失血引起的贫血症、由缺铁症引起的贫血症、由维生素b12缺乏引起的贫血症、镰刀形红细胞病或地中海贫血。
[0353]
在某些更具体的实施方式中,所述贫血症是继发于慢性肾病的贫血症(ckd)并且可以口服施用hif脯氨酰基羟化酶抑制剂或hif-α稳定剂的日剂量,优选地,每天一次。在某些实施方式中,每天施用一次所述日剂量。在某些实施方式中,ckd是1、2、3、4或5期慢性肾病。在某些这些实施方式中,ckd是3、4或5期慢性肾病。在某些实施方式中,ckd是1期慢性肾病。在某些实施方式中,ckd是2期慢性肾病。在某些实施方式中,ckd是3期慢性肾病。在某些实施方式中,ckd是4期慢性肾病。在某些实施方式中,ckd是5期慢性肾病。在某些实施方式中,所述慢性肾病是透析前的慢性肾病。在某些实施方式中,所述患者是透析患者,并且可以将这些患者称为患有终末期肾病(esrd)。在某些这些实施方式中,所述贫血症(如继发于ckd或esrd的贫血症)可以对使用红细胞生成刺激剂(包括rhepo产物,如阿法依伯汀、倍他依泊汀、达贝泊汀或peginesatide)的治疗是难治的。在某些实施方式中,所述患者先前已对贫血症进行治疗,而在某些替代实施方式中,所述患者先前未对贫血症进行治疗。
[0354]
在某些实施方式中,与内源epo产生降低有关的疾病或病况是贫血症,如继发于慢性肾病的贫血症。在某些实施方式中,通过提高内源epo产生可治疗的疾病或病况是贫血症,如继发于慢性肾病的贫血症。
[0355]
在某些实施方式中,本文提供了治疗或预防患者中与内源血红蛋白产生降低有关的疾病或病况的方法,其包括向患有与内源血红蛋白产生降低有关的疾病或病况的患者施用药物有效量的如本文所公开的hif脯氨酰基羟化酶抑制剂或hif-α稳定剂,其中所述药物有效量的hif脯氨酰基羟化酶抑制剂或hif-α稳定剂适合于将患者中的总铁结合力提高至少5%、10%、15%、20%、25%、30%、35%、40%、45%或至少50%。在更具体的实施方式中,药物有效量适合于将患者中的总铁结合力提高至少5%、10%、15%、20%、25%、30%、35%、40%、45%或至少50%,同时总血清铁水平不提高或提高至多1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%或至多25%。在某些实施方式中,所述hif脯氨酰基羟化酶抑制剂或者hif-α稳定剂是具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1或代谢产物2的化合物,或其可药用盐、溶剂化物或水合物。具体地,所述hif脯氨酰基羟化酶抑制剂或hif-α稳定剂是化合物1或其可药用盐、溶剂化物或水合物。具体地,所述hif脯氨酰基羟化酶抑制剂或hif-α稳定剂是化合物7或其可药用盐、溶剂化物或水合物。
[0356]
在某些实施方式中,本文提供了治疗通过提高内源血红蛋白产生可治疗的疾病或病况的方法,其包括向患有通过提高内源血红蛋白产生可治疗的疾病或病况的患者施用药物有效量的如本文所公开的hif脯氨酰基羟化酶抑制剂或hif-α稳定剂,其中所述药物有效量的hif脯氨酰基羟化酶抑制剂或hif-α稳定剂适合于将患者中的总铁结合力提高至少5%、10%、15%、20%、25%、30%、35%、40%、45%或至少50%。在更具体的实施方式中,药物有效量适合于将患者中的总铁结合力提高至少5%、10%、15%、20%、25%、30%、35%、40%、45%或至少50%,同时总血清铁水平不提高或提高至多1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%或至多25%。在某些实施方式中,所述hif脯氨酰基羟化酶抑制剂或者hif-α稳定剂是具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1或代谢产物2的化合物,或其可药用盐、溶剂化物或水合物。具体地,所述hif脯氨酰基羟化酶抑制剂或hif-α稳定剂是化合物1或其可药用盐、溶剂化物或水合物。具体地,所述hif脯氨酰基羟化酶抑制剂或hif-α稳定剂是化合物7或其可药用盐、溶剂化物或水合物。
[0357]
在某些实施方式中,与内源血红蛋白产生降低有关的疾病或病况是贫血症,如继发于慢性肾病的贫血症。在某些实施方式中,可以通过提高内源血红蛋白产生治疗的疾病或病况是贫血症,如继发于慢性肾病的贫血症。
[0358]
在某些实施方式中,可以使用基于菲洛嗪(ferrozine)法的测试确定血清铁,而无需脱蛋白。使用roche诊断剂在roche modular instrument上分析样品。在酸性条件下,从转铁蛋白释放出铁。去污剂使脂血症样品澄清。抗坏血酸将释放的fe3 离子还原为fe2 离子,然后与菲洛嗪反应形成有色复合物。颜色强度与铁浓度成正比并且可以通过光度计测量。
[0359]
在某些实施方式中,可以通过向血清添加含有已知浓度的铁的碱性缓冲液/还原剂来使转铁蛋白上可用的结合位点饱和来确定不饱和铁结合力(uibc)。菲洛嗪发色团仅与fe
2
反应;因此,加入铁还原剂以确保所有的铁以亚铁状态存在。过量的未结合的二价铁与
菲洛嗪发色团反应以形成深红色复合物,并通过分光光度法测量所述复合物。不饱和铁结合力(uibc)等于加入的铁溶液的浓度与过量未结合的铁的浓度所测量的差异。血清tibc等于总血清铁加uibc,并且因此可以使用uibc和血清铁测定的结果计算。
[0360]
总铁结合力(tibc)是血液通过转铁蛋白结合铁的能力的量度,并且通过抽血并测量血液可以具有的最大铁量来进行。因此,tibc代表了循环转铁蛋白的量,所述转铁蛋白含有两个结合位点以用于将铁从铁存储位置转运至红系祖细胞。
[0361]
血清铁水平测量确定了血浆中存在的铁的量。血清中存在的铁的量取决于动员储存在细胞中的铁的能力。通过一起起作用来调控输出到血浆的铁的量的膜铁转运蛋白和肝抗菌肽来控制该铁动员过程。膜铁转运蛋白将铁移入或移除细胞,同时肝抗菌肽调控膜铁转运蛋白的作用,借此确定是将铁释放到血浆中还是保留在细胞中。因此,有可能将大量铁保存在细胞中,但是相对低的血清铁水平取决于膜铁转运蛋白和肝抗菌肽的活性。
[0362]
在某些实施方式中,本文提供了治疗与促红细胞生成素(epo)的内源产生降低有关的疾病或病况的方法,其包括向患有与epo的内源产生降低有关的疾病或病况的患者施用足够数目的hif脯氨酰基羟化酶抑制剂或hif-α稳定剂的连续剂量,从而相对于患者中基线tibc提高tibc,而相对于基线不显著提高血清铁水平。在某些这些实施方式中,本文提供了治疗与epo的内源产生降低有关的疾病或病况同时最大程度降低心血管副作用和与血清铁水平提高有关的血栓栓塞事件风险的方法。在某些这些实施方式中,所述疾病或病况是贫血症,如继发于慢性肾病的贫血症。
[0363]
在某些实施方式中,本文提供了治疗通过提高内源促红细胞生成素(epo)产生可治疗的疾病或病况的方法,其包括向患有通过提高内源epo产生可治疗的与epo的内源产生降低有关的疾病或病况的患者施用足够数目的hif脯氨酰基羟化酶抑制剂或hif-α稳定剂的连续剂量,从而相对于患者中基线tibc提高tibc,而相对于基线不显著提高血清铁水平。在某些这些实施方式中,本文提供了治疗通过提高epo内源产生可治疗的疾病或病况同时最大程度降低心血管副作用和与血清铁水平提高有关的血栓栓塞事件风险的方法。在某些这些实施方式中,所述疾病或病况是贫血症,如继发于慢性肾病的贫血症。
[0364]
在某些实施方式中,相对于基线tibc,tibc提高约10g/dl、约20g/dl、约30g/dl、约40g/dl、约50g/dl、约60g/dl、约70g/dl、约80g/dl、约90g/dl或约100g/dl。在某些实施方式中,tibc提高至少约10μg/dl、至少约20μg/dl、至少约30μg/dl、至少约40μg/dl、至少约50μg/dl、至少约60μg/dl、至少约70μg/dl、至少约80μg/dl、至少约90μg/dl或至少约100μg/dl。在某些实施方式中,tibc提高约10μg/dl至约60μg/dl、约10μg/dl至约50μg/dl、约10μg/dl至约40μg/dl、约10μg/dl至约30μg/dl或约10μg/dl至约20μg/dl。在某些实施方式中,tibc提高20μg/dl至约60μg/dl、约30μg/dl至约60μg/dl、40μg/dl至约60μg/dl或约50μg/dl至约60μg/dl、
[0365]
在某些这些实施方式中,相对于基线tibc,在约1周内、约2周内、约3周内、约4周内、约5周内或约6周内发生tibc提高。
[0366]
在某些实施方式中,相对于基线血清铁水平,血清铁水平提高小于约20μg/dl、小于约15μg/dl、小于约10μg/dl或小于约5μg/dl。在某些实施方式中,血清铁水平提高约0μg/dl至约20μg/dl、约0μg/dl至约15μg/dl、约0μg/dl至约10μg/dl或约0μg/dl至约5μg/dl。
[0367]
5.3.3肝抗菌肽水平
[0368]
临床2a期试验显示在3、4或5期ckd患者中,与基线相比并且与安慰剂治疗的患者相比,作为hif脯氨酰基羟化酶抑制剂的化合物1能够在施用后6周提高血清血红蛋白水平。意外地,血红蛋白水平的提高与肝抗菌肽水平的降低不相关。
[0369]
在某些实施方式中,本文提供了治疗或预防与促红细胞生成素(epo)的内源产生降低有关的疾病或病况的方法,其包括向患有与epo的内源产生降低有关的疾病或病况的患者施用药物有效量的hif脯氨酰基羟化酶抑制剂或hif-α稳定剂,其中相对于血清epo的谷值水平,所述药物有效量适合于将生理周期期间血清epo的峰值水平提高至少10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、100%、110%、120%、130%、140%或至少150%,同时相对于hif脯氨酰基羟化酶抑制剂或hif-α稳定剂施用之前的肝抗菌肽水平,不会将肝抗菌肽的血清水平降低大于1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、16%、17%、18%、19%或大于20%。在某些实施方式中,所述hif脯氨酰基羟化酶抑制剂或者hif-α稳定剂是具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1或代谢产物2的化合物,或其可药用盐、溶剂化物或水合物。具体地,所述hif脯氨酰基羟化酶抑制剂或hif-α稳定剂是化合物1或其可药用盐、溶剂化物或水合物。具体地,所述hif脯氨酰基羟化酶抑制剂或hif-α稳定剂是化合物7或其可药用盐、溶剂化物或水合物。在某些实施方式中,与内源epo产生降低有关的疾病或病况是贫血症,如继发于慢性肾病的非重型贫血症、继发于充血性心力衰竭的非重型贫血症和衰老的特发性贫血症。
[0370]
在某些实施方式中,本文提供了治疗或预防通过提高内源促红细胞生成素(epo)的产生可治疗的疾病或病况的方法,其包括向患有通过提高内源epo的产生可治疗的疾病或病况的患者施用药物有效量的hif脯氨酰基羟化酶抑制剂或hif-α稳定剂,其中相对于血清epo的谷值水平,所述药物有效量适合于将生理周期期间血清epo的峰值水平提高至少10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、100%、110%、120%、130%、140%或至少150%,同时相对于hif脯氨酰基羟化酶抑制剂或hif-α稳定剂施用之前的肝抗菌肽水平,不会将肝抗菌肽的血清水平降低大于1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、16%、17%、18%、19%或大于20%。在某些实施方式中,所述hif脯氨酰基羟化酶抑制剂或者hif-α稳定剂是具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1或代谢产物2的化合物,或其可药用盐、溶剂化物或水合物。具体地,所述hif脯氨酰基羟化酶抑制剂或hif-α稳定剂是化合物1或其可药用盐、溶剂化物或水合物。具体地,所述hif脯氨酰基羟化酶抑制剂或hif-α稳定剂是化合物7或其可药用盐、溶剂化物或水合物。在某些实施方式中,通过提高内源epo产生可治疗的疾病或病况是贫血症,如继发于慢性肾病的非重型贫血症、继发于充血性心力衰竭的非重型贫血症和衰老的特发性贫血症。
[0371]
在某些实施方式中,本文提供了治疗或预防与内源血红蛋白产生有关的疾病或病况的方法,其包括向患有与内源血红蛋白产生有关的疾病或病况的患者施用药物有效量的
hif脯氨酰基羟化酶抑制剂或hif-α稳定剂,其中相对于治疗前的肝抗菌肽水平,所述药物有效量适合于将血红蛋白水平的峰值水平提高至少2%、3%、4%、5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、16%、17%、18%或至少20%,而相对于hif脯氨酰基羟化酶抑制剂或hif-α稳定剂施用之前的肝抗菌肽水平,不会将肝抗菌肽的血清水平降低大于1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、16%、17%、18%、19%或大于20%。在某些实施方式中,所述hif脯氨酰基羟化酶抑制剂或者hif-α稳定剂是具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1或代谢产物2的化合物,或其可药用盐、溶剂化物或水合物。具体地,所述hif脯氨酰基羟化酶抑制剂或hif-α稳定剂是化合物1或其可药用盐、溶剂化物或水合物。具体地,所述hif脯氨酰基羟化酶抑制剂或hif-α稳定剂是化合物7或其可药用盐、溶剂化物或水合物。在某些实施方式中,与内源血红蛋白产生降低有关的疾病或病况是贫血症,如继发于慢性肾病的非重型贫血症、继发于充血性心力衰竭的非重型贫血症和衰老的特发性贫血症。
[0372]
在某些实施方式中,本文提供了治疗或预防通过提高内源血红蛋白产生可治疗的疾病或病况的方法,其包括向患有通过提高内源血红蛋白产生可治疗的疾病或病况的患者施用药物有效量的hif脯氨酰基羟化酶抑制剂或hif-α稳定剂,其中相对于治疗前的肝抗菌肽水平,所述药物有效量适合于将血红蛋白水平的峰值水平提高至少2%、3%、4%、5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、16%、17%、18%或至少20%,同时相对于hif脯氨酰基羟化酶抑制剂或hif-α稳定剂施用之前的肝抗菌肽水平,不会将肝抗菌肽的血清水平降低大于1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、16%、17%、18%、19%或大于20%。在某些实施方式中,所述hif脯氨酰基羟化酶抑制剂或者hif-α稳定剂是具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1或代谢产物2的化合物,或其可药用盐、溶剂化物或水合物。具体地,所述hif脯氨酰基羟化酶抑制剂或hif-α稳定剂是化合物1或其可药用盐、溶剂化物或水合物。具体地,所述hif脯氨酰基羟化酶抑制剂或hif-α稳定剂是化合物7或其可药用盐、溶剂化物或水合物。在某些实施方式中,通过提高内源epo产生可治疗的疾病或病况是贫血症,如继发于慢性肾病的非重型贫血症、继发于充血性心力衰竭的非重型贫血症和衰老的特发性贫血症。
[0373]
在某些实施方式中,本文提供了治疗或预防患者中贫血症的方法,其包括向患有贫血症的患者施用药物有效量的hif脯氨酰基羟化酶抑制剂或hif-α稳定剂,其中相对于治疗前的肝抗菌肽水平,所述药物有效量适合于将血红蛋白水平的峰值水平提高至少2%、3%、4%、5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、16%、17%、18%或至少20%,而相对于hif脯氨酰基羟化酶抑制剂或hif-α稳定剂施用之前的肝抗菌肽水平,不会将肝抗菌肽的血清水平降低大于1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、16%、17%、18%、19%或大于20%。在某些实施方式中,所述hif脯氨酰基羟化酶抑制剂或者hif-α稳定剂是具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合
物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1或代谢产物2的化合物,或其可药用盐、溶剂化物或水合物。具体地,所述hif脯氨酰基羟化酶抑制剂或hif-α稳定剂是化合物1或其可药用盐、溶剂化物或水合物。具体地,所述hif脯氨酰基羟化酶抑制剂或hif-α稳定剂是化合物7或其可药用盐、溶剂化物或水合物。在某些实施方式中,通过提高内源epo产生可治疗的疾病或病况是贫血症,如继发于慢性肾病的非重型贫血症(ckd)、继发于充血性心力衰竭的非重型贫血症和衰老的特发性贫血症。在某些实施方式中,所述贫血症是(例如)继发于慢性肾病或与慢性肾病有关的贫血症、继发于慢性心脏病的贫血症、衰老的特发性贫血症、慢性疾病的贫血症、脊髓发育不良综合征、骨髓纤维化、其它发育不全或发育不良贫血症、化疗引起的贫血症(包括用于治疗癌症、丙肝的化疗或降低骨髓产生的其它长期药物疗法)、由失血引起的贫血症、由缺铁症引起的贫血症、由维生素b12缺乏引起的贫血症、镰刀形红细胞病或地中海贫血。
[0374]
在某些实施方式中,可以口服施用这些日剂量,优选地每天一次。在某些实施方式中,每天施用一次所述日剂量。在某些实施方式中,ckd是1、2、3、4或5期慢性肾病。在某些这些实施方式中,ckd是3、4或5期慢性肾病。在某些实施方式中,ckd是1期慢性肾病。在某些实施方式中,ckd是2期慢性肾病。在某些实施方式中,ckd是3期慢性肾病。在某些实施方式中,ckd是4期慢性肾病。在某些实施方式中,ckd是5期慢性肾病。在某些实施方式中,所述慢性肾病是透析前的慢性肾病。在某些实施方式中,所述患者是透析患者,并且可以将这些患者称为患有终末期肾病(esrd)。在某些这些实施方式中,所述贫血症(如继发于ckd或esrd的贫血症)可以对使用红细胞生成刺激剂(包括rhepo产物,如阿法依伯汀、倍他依泊汀、达贝泊汀或peginesatide)的治疗是难治的。在某些实施方式中,所述患者先前已对贫血症进行治疗,而在某些替代实施方式中,所述患者先前未对贫血症进行治疗。
[0375]
在某些实施方式中,可以确定肝抗菌肽表达,如ganz,t.等人,
[0376]“immunoassay for human serum hepcidin”blood 112:4292-4297(2008)中所述。简要地,根据生产商的规程,在葡萄球菌蛋白a柱上纯化抗人肝抗菌肽的抗体;用所述抗体涂覆96孔板并与100μl(标准样品)或者200μl(具有极低浓度的肝抗菌肽的样品)在含有0.05%tween-20的tris-缓冲盐水(tbs-tween 20)中的1:20稀释的血清或者1:10稀释的尿一起培育,加入10ng/ml的生物素化的肝抗菌肽-25作为示踪剂。通过在含有示踪剂的tbs-tween 20缓冲液中的4000ng/ml的合成肝抗菌肽的连续2-倍稀释制备标准曲线。通过质谱分析法并通过使用表达膜铁转运蛋白-绿色荧光蛋白的hek-293细胞的生物测定验证合成肝抗菌肽和生物素化的肝抗菌肽的完整性和生物活性。清洗后,使用抗生蛋白链菌素-过氧化物酶和四甲基联苯胺使测定显色。通过硫酸终止酶促反应,并在dtx 880酶标仪上在450nm对板读数。使用graphpad prism软件通过12-点拟合对标准曲线进行拟合。然后,使用拟合曲线将样品吸光值读数转化为肝抗菌肽浓度。
[0377]
可以(例如)使用标准方法cbc确定血清血红蛋白水平,其中将红细胞裂解并且铁氰化钾将血红蛋白氧化为高铁血红蛋白,其与氰化钾结合,从而形成氰化正铁血红蛋白。通过分光光度法测量棕色颜色,并且报告相应的血红蛋白。
[0378]
在某些实施方式中,本文提供了治疗与促红细胞生成素(epo)的内源产生降低有关的疾病或病况的方法,其包括向患有与epo的内源产生降低有关的疾病或病况的患者施用足够数目的hif脯氨酰基羟化酶抑制剂或hif-α稳定剂的连续剂量,从而相对于基线血清
血红蛋白水平提高血清血红蛋白水平,而相对于基线水平不显著提高肝抗菌肽。在某些实施方式中,与内源epo产生降低有关的疾病或病况选自继发于慢性肾病的非重型贫血症、继发于充血性心力衰竭的非重型贫血症和衰老的特发性贫血症。
[0379]
在某些实施方式中,本文提供了治疗通过提高促红细胞生成素(epo)的内源产生可治疗的疾病或病况的方法,其包括向患有通过提高内源epo产生可治疗的疾病或病况的患者施用足够数目的hif脯氨酰基羟化酶抑制剂或hif-α稳定剂的连续剂量,从而相对于基线血清血红蛋白水平提高血清血红蛋白水平,而相对于基线水平不显著提高肝抗菌肽。在某些这些实施方式中,所述疾病或病况是贫血症,如继发于慢性肾病的非重型贫血症、继发于充血性心力衰竭的非重型贫血症或衰老的特发性贫血症。在某些实施方式中,通过提高内源epo产生可治疗的疾病或病况选自继发于慢性肾病的非重型贫血症、继发于充血性心力衰竭的非重型贫血症和衰老的特发性贫血症。
[0380]
在某些实施方式中,在一段时间内,如约1周、约2周、约3周、约4周、约5周或约6周,相对于基线血红蛋白水平,血清血红蛋白水平提高约0.1至约1.0g/dl,约0.1至约0.9g/dl,约0.1至约0.8g/dl,约0.1至约0.7g/dl,约0.1至约0.6g/dl或约0.1至约0.5g/dl。在某些实施方式中,在一段时间内,如约1周、约2周、约3周、约4周、约5周或约6周,相对于基线血红蛋白水平,血红蛋白水平提高至少约0.1g/dl、约0.2g/dl、约0.3g/dl、约0.4g/dl、约0.5g/dl、约0.6g/dl、约0.7g/dl、约0.8g/dl、约0.9g/dl或约1.0g/dl。
[0381]
在某些实施方式中,在1周的一段时间内,血红蛋白水平相对于基线血红蛋白水平提高约0.1g/dl。在某些实施方式中,在2周的一段时间内,血红蛋白水平相对于基线血红蛋白水平提高约0.1g/dl。在某些实施方式中,在3周的一段时间内,血红蛋白水平相对于基线血红蛋白水平提高约0.5g/dl。在某些实施方式中,在4周的一段时间内,血红蛋白水平相对于基线血红蛋白水平提高约0.6g/dl。在某些实施方式中,在5周的一段时间内,血红蛋白水平相对于基线血红蛋白水平提高约0.6g/dl。在某些实施方式中,在6周的一段时间内,血红蛋白水平相对于基线血红蛋白水平提高约0.6g/dl。
[0382]
在某些实施方式中,相对于基线肝抗菌肽表达水平,肝抗菌肽表达降低小于约20%、小于约15%、小于约10%、小于约5%、小于约4%、小于约3%、小于约2%或小于约1%。在某些实施方式中,相对于基线肝抗菌肽表达水平,肝抗菌肽表达降低约0%至约20%,约0%至约15%,约0%至约10%,约0%至约5%,约0%至约4%,约0%至约3%,约0%至约2%或约0%至约1%。在某些实施方式中,相对于基线肝抗菌肽表达水平,肝抗菌肽表达降低约20%、约15%、约10%、约5%、约4%、约3%、约2%或约1%。
[0383]
5.3.4erythroferrone水平
[0384]
在某些实施方式中,本文提供了治疗选自继发于慢性肾病的非重型贫血症、继发于充血性心力衰竭的非重型贫血症和衰老的特发性贫血症的疾病或病况的方法,其包括向患有继发于慢性肾病的非重型贫血症、继发于充血性心力衰竭的非重型贫血症和衰老的特发性贫血症的患者施用足够数目的hif脯氨酰基羟化酶抑制剂或hif-α稳定剂的连续剂量,从而相对于患者中的基线血清血红蛋白水平提高血清血红蛋白水平,而不会相对于基线erythroferrone表达水平显著提高erythroferrone表达。
[0385]
在某些实施方式中,在1周的一段时间内,血清血红蛋白水平相对于基线血红蛋白水平提高约0.1至约1.0g/dl。在某些这些实施方式中,在1周的一段时间内,血清血红蛋白
水平相对于基线血红蛋白水平提高约0.1g/dl。
[0386]
在某些实施方式中,在2周的一段时间内,血清血红蛋白水平相对于基线血红蛋白水平提高约0.1至约1.0g/dl。在某些这些实施方式中,在2周的一段时间内,血清血红蛋白水平相对于基线血红蛋白水平提高约0.1g/dl。
[0387]
在某些实施方式中,在3周的一段时间内,血清血红蛋白水平相对于基线血红蛋白水平提高约0.1至约1.0g/dl。在某些这些实施方式中,在3周的一段时间内,血清血红蛋白水平相对于基线血红蛋白水平提高约0.5g/dl。
[0388]
在某些实施方式中,在4周的一段时间内,血清血红蛋白水平相对于基线血红蛋白水平提高约0.1至约1.0g/dl。在某些这些实施方式中,在4周的一段时间内,血清血红蛋白水平相对于基线血红蛋白水平提高约0.6g/dl。
[0389]
在某些实施方式中,在5周的一段时间内,血清血红蛋白水平相对于基线血红蛋白水平提高约0.1至约1.0g/dl。在某些这些实施方式中,在5周的一段时间内,血清血红蛋白水平相对于基线血红蛋白水平提高约0.6g/dl。
[0390]
在某些实施方式中,在6周的一段时间内,血清血红蛋白水平相对于基线血红蛋白水平提高约0.1至约1.0g/dl。在某些这些实施方式中,在6周的一段时间内,血清血红蛋白水平相对于基线血红蛋白水平提高约0.6g/dl。
[0391]
在某些实施方式中,相对于基线erythroferrone转录水平,erythroferrone转录提高小于约20%,小于约15%,小于约10%,相对于基线erythroferrone转录水平,小于约5%,小于约4%,小于约3%,小于约2%或小于约1%,如通过(例如)rna(参见seq id no:3)的qrt-pcr所测量的。
[0392]
在某些实施方式中,相对于基线erythroferrone表达水平,erythroferrone蛋白表达提高小于约20%,小于约15%,小于约10%,相对于基线erythroferrone表达水平,小于约5%,小于约4%,小于约3%,小于约2%或小于约1%,如通过(例如)erythroferrone蛋白(参见seq id no:2)的免疫印迹所测量的。
[0393]
在某些实施方式中,所述疾病或病况是继发于慢性肾病的非重型贫血症。在某些实施方式中,所述疾病或病况是非重型充血性心力衰竭。在某些实施方式中,所述疾病或病况是衰老的特发性贫血症。
[0394]
在某些实施方式中,每天施用一次hif脯氨酰基羟化酶抑制剂或hif-α稳定剂。在某些实施方式中,口服施用hif脯氨酰基羟化酶抑制剂或hif-α稳定剂。
[0395]
在某些实施方式中,所述hif脯氨酰基羟化酶抑制剂或hif-α稳定剂是杂环羧酰胺。在某些这些实施方式中,所述hif脯氨酰基羟化酶抑制剂或hif-α稳定剂选自吡啶羧酰胺、喹啉羧酰胺和异喹啉羧酰胺。
[0396]
在某些实施方式中,所述hif脯氨酰基羟化酶抑制剂或hif-α稳定剂是具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1和代谢产物2的化合物,或其可药用盐、溶剂化物或水合物。在具体的实施方式中,所述hif脯氨酰基羟化酶抑制剂或hif-α稳定剂是化合物1或其可药用盐、溶剂化物或水合物。在具体的实施方式中,所述hif脯氨酰基羟化酶抑制剂或hif-α稳定剂是化合物7或其可药用盐、溶剂化物或水合物。
[0397]
5.4与hif脯氨酰基羟化酶调控有关的疾病
[0398]
本发明公开还涉及用于治疗和/或预防和/或控制(特别是)周围性血管疾病(pvd);冠状动脉病(cad);心力衰竭;缺血;贫血症;伤口愈合;溃疡;缺血性溃疡;供血不足;毛细血管循环不良;小动脉粥样硬化;郁血;动脉粥样硬化病变(例如,在冠状动脉中);绞痛;心肌梗塞;糖尿病;高血压;伯格氏病;与vegf、gapdh和/或epo异常水平有关的疾病;克罗恩氏病;溃疡性结肠炎;银屑病;结节病;类风湿性关节炎;血管瘤;奥斯勒-韦伯-朗迪病;遗传性出血性毛细血管扩张症;实体瘤或血源肿瘤和获得性免疫缺损综合症;房性心律不齐;组织中缺血性组织损害,所述组织如:心脏组织,如心肌和心室、骨骼肌、神经组织,如小脑、内脏,如胃、肠、胰腺、肝、脾和肺;和远端肢,如手指和脚趾的方法。具体地,本文提供了用于治疗和/或预防和/或控制(特别是)周围性血管疾病(pvd);冠状动脉病(cad);心力衰竭;缺血;贫血症;伤口愈合;溃疡;缺血性溃疡;供血不足;毛细血管循环不良;小动脉粥样硬化;郁血;动脉粥样硬化病变(例如,在冠状动脉中);绞痛;心肌梗塞;糖尿病;高血压;伯格氏病;与vegf、gapdh和/或epo异常水平有关的疾病;克罗恩氏病;溃疡性结肠炎;银屑病;结节病;类风湿性关节炎;血管瘤;奥斯勒-韦伯-朗迪病;遗传性出血性毛细血管扩张症;实体瘤或血源肿瘤和获得性免疫缺损综合症;房性心律不齐;组织中缺血性组织损害,所述组织如:心脏组织,如心肌和心室、骨骼肌、神经组织,如小脑、内脏,如胃、肠、胰腺、肝、脾和肺;和远端肢,如手指和脚趾的方法,其中所述方法包括施用药物有效量的hif脯氨酰基羟化酶抑制剂或hif-α稳定剂,其中所述药物有效量适合于减轻这些疾病的至少一种症状的严重性或降低其频率,同时:
[0399]
a)恢复或维持epo血清水平的每日模式;
[0400]
b)提高总铁结合力;
[0401]
c)提高总铁结合力而不显著提高总铁含量;和/或
[0402]
d)不显著降低肝抗菌肽水平。
[0403]
动脉粥样硬化性pvd可以以三种方式存在:
[0404]
1)根据无创检查(通常体检)确诊的无症状pvd;
[0405]
2)间歇性跛行,其症状为锻炼时腿疼;和
[0406]
3)严重肢体缺血,休息时腿疼,危及肢体的缺血性变化(通常是不愈合性或感染的皮肤溃疡)。
[0407]
本发明公开还涉及调节缺血组织中血流、氧气递送和/或能量利用的方法,其中所述方法可以包括向人施用有效量的本文所公开的一种或多种化合物或其可药用盐或互变异构体。
[0408]
本文所列举的化合物和组合物可以具有一些应用,并且应对一些未满足的医学需要,特别是:
[0409]
1)提供作为hif脯氨酰基羟化酶抑制剂有效的组合物,借此刺激人组织中血管生成反应,借此提供用于提高缺血组织中血流、氧气递送和能量利用的方法;
[0410]
2)提供作为人蛋白hif脯氨酰基羟化酶抑制剂有效的组合物,并借此提高hif-1α的浓度,从而导致作为对细胞缺氧的正常反应的多种生物途径的更大的激活和保持;
[0411]
3)提供在细胞中对刺激epo反应有效的组合物,并借此通过控制红系祖细胞向红细胞的增殖和分化来提高红细胞的维持;
[0412]
4)提供在刺激血管生成反应中有效的组合物,并借此提高血管的数目和密度,并因此减轻高血压和糖尿病的不良后果,特别是跛行、缺血性溃疡、急进型高血压和肾衰竭;
[0413]
5)提供在低氧细胞中激活血管内皮生长因子(vegf)基因转录的组合物,并因此提高重要生物反应,特别是血管舒张、血管渗透性和内皮细胞迁移和增殖的刺激。
[0414]
6)提供在低氧细胞中引起可溶性vegf(vegf的抑制剂)产生的组合物,并因此提高重要生物反应,特别是抗血管生成活性的刺激。
[0415]
因此,通过本发明公开所述的hif脯氨酰基羟化酶抑制剂解决了这些及其它未满足的医学需要,所述hif脯氨酰基羟化酶抑制剂能够调节由hif脯氨酰基羟化酶调控不足所引起的缺血组织中的血流、氧气递送和能量利用。本领域技术人员还将认识到hif-1-α脯氨酰基羟化酶的抑制将对人组织具有其它积极医学作用并且减轻了除本发明公开具体指出的那些症状或疾病状态外的症状或疾病状态。然而,随着与血管生成过程相关疾病状况和状态有关的更详细的细节的出现,所述组合物将积极影响这些尚未揭示或尚未知道的状况,所述组合物刺激身体自身对缺氧及其它低血氧状况起反应。
[0416]
在某些实施方式中,本文提供了用于治疗或预防通过hif脯氨酰基羟化酶的调节改善的疾病或病症的方法,其包括根据本文所述的剂量和/或给药方案,向患有通过hif脯氨酰基羟化酶的调节改善的疾病的患者施用有效量的具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1或代谢产物2的化合物,或其可药用盐、溶剂化物或水合物(具体地,{[5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸或者2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸)。在某些这些实施方式中,在24小时的一段时间内,将所述化合物施用1至3次,如1、2或3次。在某些这些实施方式中,本文提供了用于治疗或预防通过hif脯氨酰基羟化酶的调节改善的疾病的方法,其包括向患有通过hif脯氨酰基羟化酶的调节改善的疾病或病症的患者施用有效量的{[5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸,每天施用1次。在某些这些实施方式中,所述日剂量为约150mg、约300mg、约450mg、约600mg或约750mg的{[5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸。在某些这些实施方式中,本文提供了用于治疗或预防通过hif脯氨酰基羟化酶的调节改善的疾病的方法,其包括向患有通过hif脯氨酰基羟化酶的调节改善的疾病或病症的患者施用有效量的2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸,每天施用1次。在某些这些实施方式中,所述日剂量为约150mg、约300mg、约450mg、约600mg或约750mg的2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸。在某些这些实施方式中,所述日剂量为约150mg、约300mg、约450mg或约600mg。可以每天一次、每天两次或每天三次(优选地每天一次)口服施用这些日剂量。
[0417]
在某些实施方式中,本文提供了治疗或预防通过抑制hif脯氨酰基羟化酶(例如,phd1、phd2和/或phd3)改善的疾病或病症的方法,其包括根据本文所述的剂量和/或给药方案,向患有通过抑制hif脯氨酰基羟化酶改善的疾病或病症的患者施用有效量的具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1或代谢产物2的化合物,或其可药用盐、溶剂化物或水合物(具体地,5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸或2-(5-(3-氟苯基)-3-羟基甲吡啶胺
基)乙酸。在某些这些实施方式中,所述日剂量为约150mg、约300mg、约450mg、约600mg或约750mg的{[5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸。在某些这些实施方式中,所述日剂量为约150mg、约300mg、约450mg、约600mg或约750mg的2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸。在某些这些实施方式中,所述日剂量为约150mg、约300mg、约450mg或约600mg。可以每天一次、每天两次或每天三次(优选地每天一次)口服施用这些日剂量。在某些这些实施方式中,本文提供了治疗或预防通过抑制phd1改善的疾病或病症的方法,其包括根据本文所述的剂量和/或给药方案,向患有通过抑制phd1改善的疾病或病症的患者施用有效量的5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸。在某些这些实施方式中,本文提供了治疗或预防通过抑制phd1改善的疾病或病症的方法,其包括根据本文所述的剂量和/或给药方案,向患有通过抑制phd1改善的疾病或病症的患者施用有效量的2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸。在某些这些实施方式中,本文提供了治疗或预防通过抑制phd2改善的疾病或病症的方法,其包括根据本文所述的剂量和/或给药方案,向患有通过抑制phd2改善的疾病或病症的患者施用有效量的5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸。。在某些这些实施方式中,本文提供了治疗或预防通过抑制phd2改善的疾病或病症的方法,其包括根据本文所述的剂量和/或给药方案,向患有通过抑制phd2改善的疾病或病症的患者施用有效量的2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸。在某些这些实施方式中,本文提供了治疗或预防通过抑制phd3改善的疾病或病症的方法,其包括根据本文所述的剂量和/或给药方案,向患有通过抑制phd3改善的疾病或病症的患者施用有效量的5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸。在某些这些实施方式中,本文提供了治疗或预防通过抑制phd3改善的疾病或病症的方法,其包括根据本文所述的剂量和/或给药方案,向患有通过抑制phd3改善的疾病或病症的患者施用有效量的2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸。
[0418]
在某些实施方式中,本文提供了治疗或预防通过稳定hif-α(例如,hif-1-α、hif-2-α和/或hif-3-α)改善的疾病或病症的方法,其包括根据本文所述的剂量和/或给药方案,向患有通过稳定hif-α改善的疾病或病症的患者施用有效量的具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1或代谢产物2的化合物,或其可药用盐、溶剂化物或水合物(具体地,5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸或2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸。在某些这些实施方式中,所述日剂量为约150mg、约300mg、约450mg、约600mg或约750mg的{[5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸。在某些这些实施方式中,所述日剂量为约150mg、约300mg、约450mg或约600mg。在某些这些实施方式中,所述日剂量为约150mg、约300mg、约450mg、约600mg或约750mg的2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸。在某些这些实施方式中,所述日剂量为约150mg、约300mg、约450mg或约600mg。可以每天一次、每天两次或每天三次(优选地每天一次)口服施用这些日剂量。在某些这些实施方式中,本文提供了治疗或预防通过稳定hif-1α改善的疾病或病症的方法,其包括根据本文所述的剂量和/或给药方案,向患有通过稳定hif-1-α改善的疾病或病症的患者施用有效量的5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸。在某些这些实施方式中,本文提供了治疗或预防通过稳定hif-1α改善的疾病或病症的方法,其包括根据本文所述的剂量和/或给药方案,向患
有通过稳定hif-1α改善的疾病或病症的患者施用有效量的2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸。在某些这些实施方式中,本文提供了治疗或预防通过稳定hif-2-α改善的疾病或病症的方法,其包括根据本文所述的剂量和/或给药方案,向患有通过抑制hif-2-α改善的疾病或病症的患者施用有效量的5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸。在某些这些实施方式中,本文提供了治疗或预防通过稳定hif-2-α改善的疾病或病症的方法,其包括根据本文所述的剂量和/或给药方案,向患有通过抑制hif-2-α改善的疾病或病症的患者施用有效量的2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸。
[0419]
在某些这些实施方式中,本文提供了治疗或预防通过稳定hif-3-α改善的疾病或病症的方法,其包括根据本文所述的剂量和/或给药方案,向患有通过稳定hif-3-α改善的疾病或病症的患者施用有效量的5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸。在某些这些实施方式中,本文提供了治疗或预防通过稳定hif-3-α改善的疾病或病症的方法,其包括根据本文所述的剂量和/或给药方案,向患有通过稳定hif-3-α改善的疾病或病症的患者施用有效量的2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸。
[0420]
在某些实施方式中,本文提供了治疗或预防与促红细胞生成素(epo)的内源产生降低有关的疾病或病况的方法,其包括根据本文所述的剂量和/或给药方案,向患有与epo内源产生降低有关的疾病或病症的患者施用有效量的具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1或代谢产物2的化合物,或其可药用盐、溶剂化物或水合物(具体地,5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸或2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸)。在某些这些实施方式中,所述日剂量为约150mg、约300mg、约450mg、约600mg或约750mg的{[5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸。在某些这些实施方式中,所述日剂量为约150mg、约300mg、约450mg、约600mg或约750mg的2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸。在某些这些实施方式中,所述日剂量为约150mg、约300mg、约450mg或约600mg。可以每天一次、每天两次或每天三次(优选地每天一次)口服施用这些日剂量。
[0421]
在某些实施方式中,本文提供了治疗或预防贫血症(例如,继发于慢性肾病或与慢性肾病有关的贫血症,继发于慢性心脏病的贫血症、衰老的特发性贫血症、慢性疾病的贫血症、脊髓发育不良综合征、骨髓纤维化、其它发育不全或发育不良贫血症、化疗引起的贫血症(包括用于治疗癌症、丙肝的化疗或降低骨髓产生的其它长期药物疗法)、由失血引起的贫血症、由缺铁症引起的贫血症、由维生素b12缺乏引起的贫血症、镰刀形红细胞病或地中海贫血)的方法,其包括根据本文所述的剂量和/或给药方案,向患有贫血症的患者施用有效量的具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1或代谢产物2的化合物,或其可药用盐、溶剂化物或水合物(具体地,5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸或2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸)。在某些实施方式中,本文提供了治疗贫血症,如继发于慢性肾病的贫血症的方法,其包括向患有贫血症的患者施用有效量的[5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸。在某些实施方式中,本文提供了治疗贫血症,如继发于慢性肾病的贫血症的方法,其包括向患有贫血症的患者施用有效量的2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)
乙酸。在某些这些实施方式中,所述日剂量为约150mg、约300mg、约450mg、约600mg或约750mg的{[5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸。在某些这些实施方式中,所述日剂量为约150mg、约300mg、约450mg、约600mg或约750mg的2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸。在某些这些实施方式中,所述日剂量为约150mg、约300mg、约450mg或约600mg。可以每天一次、每天两次或每天三次(优选地每天一次)口服施用这些日剂量。
[0422]
在某些实施方式中,本文提供了继发于慢性肾病(ckd)的贫血症的治疗,其包括根据本文所述的剂量和/或给药方案,向患有继发于ckd的贫血症的患者施用有效量的具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1或代谢产物2的化合物,或其可药用盐、溶剂化物或水合物(具体地,5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸或2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸)。在某些这些实施方式中,所述日剂量为约150mg、约300mg、约450mg、约600mg或约750mg的{[5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸。在某些这些实施方式中,所述日剂量为约150mg、约300mg、约450mg、约600mg或约750mg的2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸。在某些这些实施方式中,所述日剂量为约150mg、约300mg、约450mg或约600mg。可以每天一次、每天两次或每天三次(优选地每天一次)口服施用这些日剂量。在某些实施方式中,每天施用一次所述日剂量。在某些实施方式中,ckd是1、2、3、4或5期慢性肾病。在某些这些实施方式中,ckd是3、4或5期慢性肾病。在某些实施方式中,ckd是1期慢性肾病。在某些实施方式中,ckd是2期慢性肾病。在某些实施方式中,ckd是3期慢性肾病。在某些实施方式中,ckd是4期慢性肾病。在某些实施方式中,ckd是5期慢性肾病。在某些实施方式中,所述慢性肾病是透析前的慢性肾病。在某些实施方式中,所述患者是透析患者,并且可以将这些患者称为患有终末期肾病(esrd)。在某些这些实施方式中,所述贫血症(如继发于ckd或esrd的贫血症)可以对使用红细胞生成刺激剂(包括rhepo产物,如阿法依伯汀、倍他依泊汀、达贝泊汀或peginesatide)的治疗是难治的。在某些实施方式中,所述患者先前已对贫血症进行治疗,而在某些替代实施方式中,所述患者先前未对贫血症进行治疗。
[0423]
在某些实施方式中,本文提供了治疗或预防血管生成相关疾病或病症的方法,其包括根据本文所述的剂量和/或给药方案,向患有血管生成相关疾病或病症的患者施用有效量的具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1或代谢产物2的化合物,或其可药用盐、溶剂化物或水合物(具体地,5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸或2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸)。在某些实施方式中,本文提供了调节血管生成的方法,其包括根据本文所述的剂量和/或给药方案,向患者施用有效量的[5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸。在某些实施方式中,本文提供了调节血管生成的方法,其包括根据本文所述的剂量和/或给药方案,向患者施用有效量的2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸。在某些这些实施方式中,所述日剂量为约150mg、约300mg、约450mg、约600mg或约750mg的{[5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸。在某些这些实施方式中,所述日剂量为约150mg、约300mg、约450mg、约600mg或约750mg的2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸。在某些这些实施方式中,所述日剂量为约150mg、约300mg、约450mg或约600mg。可以每天
一次、每天两次或每天三次(优选地每天一次)口服施用这些日剂量。
[0424]
在某些实施方式中,本文提供了治疗或预防受vegf或gapdh的水平影响的疾病或病症的方法,其包括根据本文所述的剂量和/或给药方案,向患有受vegf或gapdh的水平影响的疾病或病症的患者施用有效量的具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1或代谢产物2的化合物,或其可药用盐、溶剂化物或水合物(具体地,5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸或2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸)。在某些这些实施方式中,所述日剂量为约150mg、约300mg、约450mg、约600mg或约750mg的{[5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸。在某些这些实施方式中,所述日剂量为约150mg、约300mg、约450mg、约600mg或约750mg的2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸。在某些这些实施方式中,所述日剂量为约150mg、约300mg、约450mg或约600mg。可以每天一次、每天两次或每天三次(优选地每天一次)口服施用这些日剂量。
[0425]
在某些实施方式中,本文提供了促进伤口愈合的方法,其包括根据本文所述的剂量和/或给药方案,向具有伤口的患者施用有效量的具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1或代谢产物2的化合物,或其可药用盐、溶剂化物或水合物(具体地,5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸或2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸)。在某些这些实施方式中,所述日剂量为约150mg、约300mg、约450mg、约600mg或约750mg的{[5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸。在某些这些实施方式中,所述日剂量为约150mg、约300mg、约450mg、约600mg或约750mg的2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸。在某些这些实施方式中,所述日剂量为约150mg、约300mg、约450mg或约600mg。可以每天一次、每天两次或每天三次(优选地每天一次)口服施用这些日剂量。
[0426]
在某些实施方式中,本文提供了提高受损组织的血管再形成或提高脉管系统的方法,其包括根据本文所述的剂量和/或给药方案,向具有受损组织的患者施用有效量的具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1或代谢产物2的化合物,或其可药用盐、溶剂化物或水合物(具体地,5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸或2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸)。在某些实施方式中,本文提供了使缺血组织血管化的方法,其包括根据本文所述的剂量和/或给药方案,向具有缺血组织的患者施用有效量的5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸。在某些实施方式中,本文提供了使缺血组织血管化的方法,其包括根据本文所述的剂量和/或给药方案,向具有缺血组织的患者施用有效量的2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸。在某些这些实施方式中,所述日剂量为约150mg、约300mg、约450mg、约600mg或约750mg的{[5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸。在某些这些实施方式中,所述日剂量为约150mg、约300mg、约450mg、约600mg或约750mg的2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸。在某些这些实施方式中,所述日剂量为约150mg、约300mg、约450mg或约600mg。可以每天一次、每天两次或每天三次(优选地每天一次)口服施用这些日
剂量。
[0427]
在某些实施方式中,本文提供了促进皮肤移植物置换的生长的方法,其包括根据本文所述的剂量和/或给药方案,向具有皮肤移植物的患者施用有效量的具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1或代谢产物2的化合物,或其可药用盐、溶剂化物或水合物(具体地,5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸或2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸)。在某些这些实施方式中,所述日剂量为约150mg、约300mg、约450mg、约600mg或约750mg的{[5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸。在某些这些实施方式中,所述日剂量为约150mg、约300mg、约450mg、约600mg或约750mg的2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸。在某些这些实施方式中,所述日剂量为约150mg、约300mg、约450mg或约600mg。可以每天一次、每天两次或每天三次(优选地每天一次)口服施用这些日剂量。
[0428]
在某些实施方式中,本文提供了在引导组织再生(gtr)的背景中促进组织修复的方法,其包括根据本文所述的剂量和/或给药方案,向患者施用有效量的具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1或代谢产物2的化合物,或其可药用盐、溶剂化物或水合物(具体地,5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸或2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸)。在某些这些实施方式中,所述日剂量为约150mg、约300mg、约450mg、约600mg或约750mg的{[5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸。在某些这些实施方式中,所述日剂量为约150mg、约300mg、约450mg、约600mg或约750mg的2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸。在某些这些实施方式中,所述日剂量为约150mg、约300mg、约450mg或约600mg。可以每天一次、每天两次或每天三次(优选地每天一次)口服施用这些日剂量。
[0429]
在某些实施方式中,本文提供了治疗或预防疾病或病症的方法,所述疾病或病症选自糖尿病性视网膜病、黄斑变性、癌症、镰刀形红细胞贫血症、类肉瘤、梅毒、弹性假黄瘤、畸形性骨炎、静脉阻塞、动脉阻塞、颈动脉阻塞性疾病、慢性葡萄膜炎/玻璃体炎、分枝杆菌感染、莱姆病、全身性红斑狼疮、早产儿视网膜病变、伊尔斯氏病、白塞氏病、导致视网膜炎或脉络膜炎的感染、眼假组织胞质菌病、贝斯特氏病、近视、视窝、斯特格氏病、睫状体扁平部炎、慢性视网膜脱离、高粘稠度综合征、弓形体病、激光创伤后并发症(trauma post-laser complications)、与虹膜发红有关的疾病和增殖性玻璃体视网膜病变、克罗恩氏病和溃疡性结肠炎、银屑病、结节病、类风湿性关节炎、血管瘤、奥斯勒-韦伯-朗迪病或遗传性出血性毛细血管扩张症、实体瘤或血源肿瘤、获得性免疫缺损综合症、骨骼肌和心肌缺血、中风、冠状动脉病、周围性血管疾病和冠状动脉病,其包括根据本文所述的用量和/或剂量和/或给药方案,向患有该疾病或病症的患者施用有效量的具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1或代谢产物2的化合物,或其可药用盐、溶剂化物或水合物(具体地,5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸或2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸)。在某些这些实施方式中,所述日剂量为约150mg、约300mg、约450mg、约600mg或约750mg的{[5-(3-氯苯
基)-3-羟基吡啶-2-羰基]氨基}乙酸。在某些这些实施方式中,所述日剂量为约150mg、约300mg、约450mg、约600mg或约750mg的2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸。在某些这些实施方式中,所述日剂量为约150mg、约300mg、约450mg或约600mg。可以每天一次、每天两次或每天三次(优选地每天一次)口服施用这些日剂量。
[0430]
5.5剂量和给药方案
[0431]
本文描述了多个参数以指导hif脯氨酰基羟化酶抑制剂或hif-α稳定剂的给药方案,以用于如5.4节中所述的多种疾病和病症,如贫血症(例如,继发于慢性肾病的贫血症)的预防和/或治疗。本节提供了用于hif脯氨酰基羟化酶抑制剂或者hif-α稳定剂的这些使用的一些具体剂量。在某些实施方式中,该剂量是治疗开始时的初始剂量。在其它实施方式中,该剂量是治疗过程中后期的调整剂量。在某些实施方式中,所述hif脯氨酰基羟化酶抑制剂或hif-α稳定剂是具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1或代谢产物2的化合物,或其可药用盐、溶剂化物或水合物。在具体的实施方式中,所述化合物是化合物1或它们的可药用盐、溶剂化物或水合物。在具体的实施方式中,所述化合物是化合物7或它们的可药用盐、溶剂化物或水合物。
[0432]
在某些实施方式中,本文提供了治疗贫血症(如继发于慢性肾病的贫血症)的方法,其包括向患有贫血症的患者施用具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1或代谢产物2的化合物,或其可药用盐、溶剂化物或水合物(具体地,{[5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸或者2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸)的日剂量,所述日剂量在约100mg至约1200mg之间、在约200mg至约1000mg之间、在约400mg至约800mg之间或者在约450mg至约600mg之间或者在约300mg至约600mg之间。在某些实施方式中,具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1或代谢产物2的化合物,或其可药用盐、溶剂化物或水合物(具体地,{[5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸或者2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸)的日剂量在约150mg至约600mg之间。在某些实施方式中,所述化合物的日剂量在约150mg至约300mg之间,约300至约600mg之间或者约600mg至约750mg之间。在某些实施方式中,所述日剂量为约100mg、150mg、200mg、250mg、300mg、350mg、400mg、450mg、500mg、550mg、600mg、650mg、700mg、750mg、800mg、850mg、900mg、950mg、1,000mg、1,050mg、1,100mg、1,150mg或甚至约1,200mg的具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1或代谢产物2的化合物,或其可药用盐、溶剂化物或水合物(具体地,{[5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸或者2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸)。在某些实施方式中,所述日剂量为至少约300mg,至少约450mg或甚至至少约600mg。
[0433]
在某些实施方式中,所述日剂量为约150mg、约300mg、约450mg、约600mg或约750mg
的具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1或代谢产物2的化合物,或其可药用盐、溶剂化物或水合物(具体地,{[5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸或者2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸)。在某些实施方式中,所述日剂量为约150mg、约300mg、约450mg或约600mg。在某些实施方式中,所述日剂量不是240mg、370mg、500mg或630mg的化合物1。在某些实施方式中,所述日剂量为约240mg、370mg、500mg或约630mg的具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1或代谢产物2的化合物,或其可药用盐、溶剂化物或水合物(具体地,{[5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸或者2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸)。
[0434]
在某些实施方式中,本文提供了治疗贫血症(如继发于慢性肾病的贫血症)的方法,其包括向患有贫血症的患者施用化合物的日剂量,所述化合物是具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1或代谢产物2的化合物,或其可药用盐、溶剂化物或水合物(具体地,{[5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸或者2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸),其中连续和/或长时间施用所述化合物。
[0435]
在某些实施方式中,本文提供了治疗贫血症(如继发于慢性肾病的贫血症)的方法,其包括向患有贫血症的患者施用具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1或代谢产物2的化合物,或其可药用盐、溶剂化物或水合物(具体地,{[5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸或者2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸)的日剂量,其中所述日剂量为约450mg。在某些这些实施方式中,约450mg的日剂量包含三个单位剂量形式,如三个片剂,其分别包含约150mg的具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1或代谢产物2的化合物,或其可药用盐、溶剂化物或水合物(具体地,{[5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸或者2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸)。在某些实施方式中,约450mg的具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1或代谢产物2的化合物,或其可药用盐、溶剂化物或水合物(具体地,{[5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸或者2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸)的日剂量可以提高约150mg,从而所述化合物的日剂量为约600mg。在某些实施方式中,约450mg的具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1或代谢产物2的化合物,或其可药用
盐、溶剂化物或水合物(具体地,{[5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸或者2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸)的日剂量可以降低约150mg,从而所述化合物的日剂量为约300mg。在某些实施方式中,具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1或代谢产物2的化合物,或其可药用盐、溶剂化物或水合物(具体地,{[5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸或者2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸)的日剂量可以降低约300mg,从而所述化合物的日剂量为约150mg。在某些实施方式中,所述日剂量可以提高或降低约75mg、约100mg、约125mg、约150mg、约175mg、约200mg、约225mg、约250mg、约275mg或约300mg。在某些实施方式中,所述日剂量可以提高或降低约75mg至300mg之间的量、约100mg至300mg之间的量、约125mg至300mg之间的量、约150mg至300mg之间的量、约175mg至300mg之间的量、约200mg至300mg之间的量、约225mg至300mg之间的量、约250mg至300mg之间的量或约275mg至300mg之间的量。在某些实施方式中,所述日剂量可以提高或降低约75mg至约250mg的量、约100mg至约225mg的量或约125mg至约250mg的量。在某些这些实施方式中,所述日剂量不超过约600mg或约750mg。
[0436]
在某些实施方式中,本文提供了治疗贫血症(如继发于慢性肾病的贫血症)的方法,其包括向患有贫血症的患者施用有效量的具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1或代谢产物2的化合物,或其可药用盐、溶剂化物或水合物(具体地,{[5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸或者2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸),其中可以连续和/或长时间施用所述化合物,如施用超过连续42天。在某些这些实施方式中,所述化合物的日剂量为约150mg、约300mg、约450mg、约600mg或约750mg的具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1或代谢产物2的化合物,或其可药用盐、溶剂化物或水合物(具体地,{[5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸或者2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸)。在某些这些实施方式中,所述日剂量为约150mg、约300mg、约450mg或约600mg。
[0437]
在某些实施方式中,本文提供了治疗贫血症(如继发于慢性肾病的贫血症)的方法,其包括向患有贫血症的患者施用有效量的具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1或代谢产物2的化合物,或其可药用盐、溶剂化物或水合物(具体地,{[5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸或者2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸),其中患者的血红蛋白水平保持在至少约10.0g/dl至等于或低于约13.0g/dl的水平。在某些这些实施方式中,所述血红蛋白水平保持在至少约11.0g/dl至等于或低于约13.0g/dl的水平。在某些这些实施方式中,所述血红蛋白水平保持在至少约11.0g/dl至等于或低于约12.0g/dl的水平。在某些这些实施方式中,所述化合物的日剂量为约150mg、约300mg、约450mg、约600mg或约750mg的具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化
合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1或代谢产物2的化合物,或其可药用盐、溶剂化物或水合物(具体地,{[5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸或者2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸)。在某些这些实施方式中,所述日剂量为约150mg、约300mg、约450mg或约600mg。
[0438]
在某些实施方式中,本文提供了治疗贫血症(如继发于慢性肾病的贫血症)的方法,其包括向患有贫血症的患者施用有效量的具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1或代谢产物2的化合物,或其可药用盐、溶剂化物或水合物(具体地,{[5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸或者2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸),其中患者的血红蛋白水平相对于基线血红蛋白水平提高至少约1.2g/dl。在某些这些实施方式中,所述化合物的日剂量为约150mg、约300mg、约450mg、约600mg或约750mg的具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1或代谢产物2的化合物,或其可药用盐、溶剂化物或水合物(具体地,{[5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸或者2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸)。在某些这些实施方式中,所述日剂量为约150mg、约300mg、约450mg或约600mg。
[0439]
在某些实施方式中,如果血红蛋白水平为13.0g/dl或以上,则可以中止具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1或代谢产物2的化合物,或其可药用盐、溶剂化物或水合物(具体地,{[5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸或者2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸)的施用。在某些这些实施方式中,一旦血红蛋白水平为12.5g/dl或以下,则可以恢复所述化合物的施用。
[0440]
在某些实施方式中,监控血红蛋白水平并且可以基于血红蛋白水平和/或血红蛋白水平的变化调整具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1或代谢产物2的化合物,或其可药用盐、溶剂化物或水合物(具体地,{[5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸或者2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸)的剂量。在某些实施方式中,可以通过将具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1或代谢产物2的化合物,或其可药用盐、溶剂化物或水合物(具体地,{[5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸或者2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸)的量提高或降低150mg或甚至300mg来调整剂量。
[0441]
在某些实施方式中,可以在向患者给予所述化合物的日剂量当天开始经过一段时间以后提高具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合
物10、化合物11、化合物12、化合物13、代谢产物1或代谢产物2的化合物,或其可药用盐、溶剂化物或水合物(具体地,{[5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸或者2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸)的日剂量。在某些实施方式中,所述时间段为约1周至约8周,如约2周至约7周,约3周至约6周或约4周。
[0442]
在某些实施方式中,可以在一段时间中,调整一次具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1或代谢产物2的化合物,或其可药用盐、溶剂化物或水合物(具体地,{[5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸或者2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸)的日剂量。在某些实施方式中,所述一段时间为约1周至约8周,如约2周至约7周,约3周至约6周或约4周。
[0443]
在某些实施方式中,如果相对于基线血红蛋白水平,血红蛋白水平提高超过1.2g/dl,则不提高具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1或代谢产物2的化合物,或其可药用盐、溶剂化物或水合物(具体地,{[5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸或者2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸)的日剂量。
[0444]
在某些实施方式中,本发明提供了治疗贫血症(如继发于慢性肾病的贫血症)的方法,其包括向患有贫血症的患者施用作为具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1或代谢产物2的化合物,或其可药用盐、溶剂化物或水合物(具体地,{[5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸或者2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸)的化合物的日剂量;在施用所述化合物的日剂量后测量患者中的血红蛋白水平,并且在一段时间之后再次测量,其中当患者中的血红蛋白水平小于约10.0g/dl并且与一段时间之前测量的水平相比,血红蛋白水平降低小于约0.5g/dl时;或者当患者中的血红蛋白水平小于约10.0g/dl并且与一段时间之前测量的水平相比,血红蛋白水平变化多至约0.4g/dl;或者当患者中的血红蛋白水平在约10.0至约10.9g/dl之间并且与一段时间之前测量的水平相比,血红蛋白水平降低小于约0.5g/dl;施用比所述日剂量大约150mg的所述化合物的调整的日剂量。在某些这些实施方式中,每天施用一次所述化合物并且可以口服施用。在某些实施方式中,所述日剂量为约450mg,从而当所述日剂量提高约150mg时,所述调整的日剂量为约600mg。在某些实施方式中,所述时间段为约1周至约8周,如约2周至约7周,约3周至约6周或约4周。在某些实施方式中,所述日剂量可以提高或降低约75mg、约100mg、约125mg、约150mg、约175mg、约200mg、约225mg、约250mg、约275mg或约300mg。在某些实施方式中,所述日剂量可以提高或降低约75mg至300mg之间的量、约100mg至300mg之间的量、约125mg至300mg之间的量、约150mg至300mg之间的量、约175mg至300mg之间的量、约200mg至300mg之间的量、约225mg至300mg之间的量、约250mg至300mg之间的量或约275mg至300mg之间的量。在某些实施方式中,所述日剂量可以提高或降低约75mg至约250mg的量、约100mg至约225mg的量或约125mg至约250mg的量。在某些实施方式中,所述调整的日剂量不超过600mg或750mg。
[0445]
在某些实施方式中,本文提供了治疗贫血症(如继发于慢性肾病的贫血症)的方法,其包括向患有贫血症的患者施用化合物的日剂量,所述化合物为具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1或代谢产物2的化合物,或其可药用盐、溶剂化物或水合物(具体地,{[5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基)乙酸);在施用所述化合物的日剂量之后测量患者中的血红蛋白水平,然后在一段时间之后再次测量,其中当患者中的血红蛋白水平小于约10.0g/dl并且与一段时间之前测量的水平相比,血红蛋白水平提高大于约1.5g/dl时;或者当患者中的血红蛋白水平在约10.0至约10.9g/dl之间并且与一段时间之前测量的水平相比,血红蛋白水平提高大于约1.5g/dl时;或者当患者中的血红蛋白水平在约11.0至约12.2g/dl之间并且与一段时间之前测量的水平相比,血红蛋白水平提高约1.0至约1.4g/dl时;或者当患者中的血红蛋白水平在约12.3至约12.9g/dl之间并且与一段时间之前测量的水平相比,血红蛋白水平降低多至约0.4g/dl或提高多至约0.4g/dl时;或者当患者中的血红蛋白水平在约12.3至约12.9g/dl之间并且与一段时间之前测量的水平相比,血红蛋白水平提高约0.5至约0.9g/dl时,施用比所述日剂量小150mg的所述化合物的调整的日剂量。在某些这些实施方式中,每天施用一次所述化合物并且可以口服施用。在某些实施方式中,所述日剂量为约450mg,从而当所述日剂量降低约150mg时,所述调整的日剂量为约300mg。在某些实施方式中,所述时间段为约1周至约8周,如约2周至约7周,约3周至约6周或约4周。在某些实施方式中,所述日剂量可以提高或降低约75mg、约100mg、约125mg、约150mg、约175mg、约200mg、约225mg、约250mg、约275mg或约300mg。在某些实施方式中,所述日剂量可以提高或降低约75mg至300mg之间的量、约100mg至300mg之间的量、约125mg至300mg之间的量、约150mg至300mg之间的量、约175mg至300mg之间的量、约200mg至300mg之间的量、约225mg至300mg之间的量、约250mg至300mg之间的量或约275mg至300mg之间的量。在某些实施方式中,所述日剂量可以提高或降低约75mg至约250mg的量、约100mg至约225mg的量或约125mg至约250mg的量。在某些实施方式中,所述调整的日剂量不超过600mg或750mg。
[0446]
在某些实施方式中,本文提供了治疗贫血症(如继发于慢性肾病的贫血症)的方法,其包括向患有贫血症的患者施用化合物的日剂量,所述化合物为具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1或代谢产物2的化合物,或其可药用盐、溶剂化物或水合物(具体地,{[5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸或者2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸);在施用所述化合物的日剂量后测量患者中的血红蛋白水平,并且在一段时间之后再次测量,其中当患者中的血红蛋白水平在约11.0至约12.2g/dl之间并且与一段时间之前测量的水平相比,血红蛋白水平提高大于约1.5g/dl时;或者当患者中的血红蛋白水平在约12.3至约12.9g/dl之间并且与一段时间之前测量的水平相比,血红蛋白水平提高在约1.0至约1.4g/dl之间时;或者当患者中的血红蛋白水平在约12.3至约12.9g/dl之间并且与一段时间之前测量的水平相比,血红蛋白水平提高大于约1.5g/dl,施用比所述日剂量小约300mg的所述化合物的调整的日剂量。在某些实施方式中,每天施用一次所述化合物并且可以口服施用。在某些实施方式中,所述日剂量为450mg,从而当所述初始日剂量降低约300mg时,
所述调整的日剂量为约150mg。在某些实施方式中,所述时间段为约1周至约8周,如约2周至约7周,约3周至约6周或约4周。在某些实施方式中,所述日剂量可以提高或降低约75mg、约100mg、约125mg、约150mg、约175mg、约200mg、约225mg、约250mg、约275mg或约300mg。在某些实施方式中,所述日剂量可以提高或降低约75mg至300mg之间的量、约100mg至300mg之间的量、约125mg至300mg之间的量、约150mg至300mg之间的量、约175mg至300mg之间的量、约200mg至300mg之间的量、约225mg至300mg之间的量、约250mg至300mg之间的量或约275mg至300mg之间的量。在某些实施方式中,所述日剂量可以提高或降低约75mg至约250mg的量、约100mg至约225mg的量或约125mg至约250mg的量。在某些实施方式中,所述调整的日剂量不超过600mg或750mg。
[0447]
在某些实施方式中,本文提供了治疗经历血液透析的患者中与ckd有关的贫血症的方法,其中所述方法包括在开始血液透析之前约8小时、7小时、6小时、5小时、4小时、3小时、2小时或1小时或在约7小时至8小时之间、6小时至7小时之间、5小时至6小时之间、4小时至5小时之间、3小时至4小时之间、2小时至3小时之间、1小时至2小时之间或多至约1小时向所述患者施用药物有效量的具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1或代谢产物2的化合物。
[0448]
在某些实施方式中,本文提供了治疗经历血液透析的患者中与ckd有关的贫血症的方法,其中所述方法包括在完成血液透析之后约8小时、7小时、6小时、5小时、4小时、3小时、2小时或1小时或在约7小时至8小时之间、6小时至7小时之间、5小时至6小时之间、4小时至5小时之间、3小时至4小时之间、2小时至3小时之间、1小时至2小时之间或多至约1小时向所述患者施用药物有效量的具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1或代谢产物2的化合物。
[0449]
在某些实施方式中,本文所提供的方法还包括监控步骤,其中确定了具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1或代谢产物2的化合物的代谢产物的血清浓度。在更具体的实施方式中,确定了具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1或代谢产物2的化合物的酚葡糖苷酸和/或酰基葡糖苷酸的血清浓度。在更具体的实施方式中,确定了化合物1的酚葡糖苷酸和/或酰基葡糖苷酸(即代谢产物1或者代谢产物2(参见5.2节))的血清浓度。在某些更具体的实施方式中,根据代谢产物的血清浓度调节日剂量。
[0450]
5.6组合疗法
[0451]
在某些实施方式中,本文提供了治疗贫血症(如继发于慢性肾病的贫血症)的方法,其包括与另一种药剂组合施用具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1或代谢产物2的化合物,或其可药用盐、溶剂化物或水合物(具体地,{[5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨
基}乙酸或者2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸)。可以通过单独的治疗组分的同时、顺序或单独剂量施用来实现这种组合疗法。另外,当作为这种组合疗法的组分施用时,具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1或代谢产物2的化合物或其可药用盐、溶剂化物或水合物(具体地,{[5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸或者2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸)和另一种药剂可以是协同的,从而与通常将作为单一疗法给予的任一种组分的剂量相比,可以降低任一种或两种组分的日剂量。作为另外一种选择,当作为这种组合疗法的组分施用时,具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1或代谢产物2的化合物或其可药用盐、溶剂化物或水合物(具体地,{[5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸或者2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸)和另一种药剂可以是相加的,从而每种组分的日剂量与通常将作为单一疗法给予的任一种组分的剂量相似或相同。
[0452]
在某些实施方式中,本文提供了用于治疗继发于慢性肾病的非重型贫血症、继发于充血性心力衰竭的非重型贫血症和衰老的特发性贫血症的方法,其包括向患有贫血症的患者施用日剂量的hif脯氨酰基羟化酶抑制剂或hif-α稳定剂,如具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1或代谢产物2的化合物,或其可药用盐、溶剂化物或水合物(具体地,本文所公开的化合物,如化合物1),其中连续和/或长时间施用所述化合物,并且其中所述化合物与另一种药剂一起施用。
[0453]
在某些实施方式中,本文提供了治疗贫血症(如继发于慢性肾病的贫血症)的方法,其包括向患有贫血症的患者施用具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1或代谢产物2的化合物,或其可药用盐、溶剂化物或水合物(具体地,{[5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸或者2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸),其中所述化合物任选地与铁补充剂,如硫酸亚铁、葡萄糖酸亚铁或富马酸亚铁组合施用。在某些这些实施方式中,在所述化合物施用后至少1小时、至少2小时、至少3小时、至少4小时或甚至至少6小时施用所述铁补充剂。在某些实施方式中,以一定量施用所述铁补充剂,从而将铁蛋白保持在约50ng/ml至约300ng/ml之间的水平。在某些实施方式中,以至少约50mg元素铁的日剂量口服施用所述铁补充剂。在某些实施方式中,以约50mg元素铁的剂量口服施用所述铁补充剂。在某些实施方式中,静脉内施用所述铁补充剂。在某些实施方式中,连续和/或长时间施用所述铁补充剂,如施用超过连续42天。在某些替代实施方式中,根据需要施用所述铁补充剂,从而将铁蛋白保持在约50ng/ml至约300ng/ml之间的水平。在某些这些实施方式中,所述化合物的日剂量为约150mg、约300mg、约450mg、约600mg或约750mg的具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢
产物1或代谢产物2的化合物,或其可药用盐、溶剂化物或水合物(具体地,{[5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸或者2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸)。在某些这些实施方式中,所述日剂量为约150mg、约300mg、约450mg或约600mg。可以每天一次、每天两次或每天三次(优选地每天一次)口服施用这些日剂量。
[0454]
在某些实施方式中,本文提供了治疗贫血症(如继发于慢性肾病的贫血症)的方法,其包括向患有贫血症的患者施用具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1或代谢产物2的化合物,或其可药用盐、溶剂化物或水合物(具体地,{[5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸或者2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸),其中所述化合物任选地与红细胞生成刺激剂(esa),如促红细胞生成素模拟物组合施用。在某些这些实施方式中,esa是rhepo产物,其包括(但不限于)阿法依伯汀、倍他依泊汀、达贝泊汀或peginesatide。在某些这些实施方式中,作为救治疗法施用esa。在某些替代实施方式中,连续和/或长时间施用esa,如施用超过连续42天。在某些这些实施方式中,所述化合物的日剂量为约150mg、约300mg、约450mg、约600mg或约750mg的具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1或代谢产物2的化合物,或其可药用盐、溶剂化物或水合物(具体地,{[5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸或者2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸)。在某些这些实施方式中,所述日剂量为约150mg、约300mg、约450mg或约600mg。可以每天一次、每天两次或每天三次(优选地每天一次)口服施用这些日剂量。
[0455]
5.7患者群体
[0456]
在某些实施方式中,本文提供了治疗贫血症(如继发于慢性肾病(ckd)的贫血症)的方法,其包括根据本文所述的剂量和/或给药方案,向患有贫血症的患者施用有效量的具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1或代谢产物2的化合物,或其可药用盐、溶剂化物或水合物(具体地,5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸或2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸),其中所述患者至少50岁、至少60岁、至少65岁、至少70岁或甚至至少80岁。在某些实施方式中,所述患者为老年患者。在某些实施方式中,所述患者小于18岁。在某些实施方式中,所述患者为小儿科患者。在某些实施方式中,所述患者至少18岁。在某些这些实施方式中,所述日剂量为约150mg、约300mg、约450mg、约600mg或约750mg的具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1或代谢产物2的化合物,或其可药用盐、溶剂化物或水合物(具体地,{[5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸或者2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸)。在某些这些实施方式中,所述日剂量为约150mg、约300mg、约450mg或约600mg。可以每天一次、每天两次或每天三次(优选地每天一次)口服施用这些日剂量。
[0457]
在某些实施方式中,本文提供了治疗贫血症(如继发于慢性肾病(ckd)的贫血症)
的方法,其包括根据本文所述的剂量和/或给药方案,向患有贫血症的患者施用有效量的具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1或代谢产物2的化合物,或其可药用盐、溶剂化物或水合物(具体地,5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸或2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸),其中,所述患者是选自白种人、拉丁裔人、黑人和亚洲人的亚群的成员。在某些实施方式中,所述患者是选自男性和女性的亚群的成员。在某些这些实施方式中,所述日剂量为约150mg、约300mg、约450mg、约600mg或约750mg的具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1或代谢产物2的化合物,或其可药用盐、溶剂化物或水合物(具体地,{[5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸或者2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸)。在某些这些实施方式中,所述日剂量为约150mg、约300mg、约450mg或约600mg。可以每天一次、每天两次或每天三次(优选地每天一次)口服施用这些日剂量。
[0458]
在某些实施方式中,本文提供了治疗贫血症(如继发于慢性肾病(ckd)的贫血症)的方法,其包括根据本文所述的剂量和/或给药方案,向患有贫血症的患者施用有效量的具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1或代谢产物2的化合物,或其可药用盐、溶剂化物或水合物(具体地,5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸或2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸),其中,所述患者患有其它疾病或病况,其选自癌症、aids、充血性心力衰竭、左心室肥厚、糖尿病、高血压、血脂异常、慢性心力衰竭、中风、疲劳、抑郁症和认知障碍或它们的任意组合。在某些这些实施方式中,所述日剂量为约150mg、约300mg、约450mg、约600mg或约750mg的具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1或代谢产物2的化合物,或其可药用盐、溶剂化物或水合物(具体地,{[5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸或者2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸)。在某些这些实施方式中,所述日剂量为约150mg、约300mg、约450mg或约600mg。可以每天一次、每天两次或每天三次(优选地每天一次)口服施用这些日剂量。
[0459]
在某些实施方式中,本文提供了治疗贫血症(如继发于ckd的贫血症)的方法,其包括根据本文所述的剂量和/或给药方案,向患有贫血症的患者施用有效量的具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1或代谢产物2的化合物,或其可药用盐、溶剂化物或水合物(具体地,5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸或2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸),其中所述患者对使用esa(如促红细胞生成素模拟物)的治疗是难治的。在某些实施方式中,esa是rhepo产物,其包括(但不限于)阿法依伯汀、倍他依泊汀、达贝泊汀或peginesatide。在某些这些实施方式中,所述日剂量为约150mg、约300mg、约450mg、约600mg
或约750mg的具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1或代谢产物2的化合物,或其可药用盐、溶剂化物或水合物(具体地,{[5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸或者2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸)。在某些这些实施方式中,所述日剂量为约150mg、约300mg、约450mg或约600mg。可以每天一次、每天两次或每天三次(优选地每天一次)口服施用这些日剂量。
[0460]
在某些实施方式中,本文提供了治疗贫血症(如继发于ckd的贫血症)的方法,其包括根据本文所述的剂量和/或给药方案,向患有贫血症的患者施用有效量的具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1或代谢产物2的化合物,或其可药用盐、溶剂化物或水合物(具体地,5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸或2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸),其中所述患者的转铁蛋白饱和度(tsat)为至少15%、至少18%或甚至至少20%。在某些这些实施方式中,所述日剂量为约150mg、约300mg、约450mg、约600mg或约750mg的具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1或代谢产物2的化合物,或其可药用盐、溶剂化物或水合物(具体地,{[5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸或者2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸)。在某些这些实施方式中,所述日剂量为约150mg、约300mg、约450mg或约600mg。可以每天一次、每天两次或每天三次(优选地每天一次)口服施用这些日剂量。
[0461]
在某些实施方式中,本文提供了治疗贫血症(如继发于ckd的贫血症)的方法,其包括根据本文所述的剂量和/或给药方案,向患有贫血症的患者施用有效量的具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1或代谢产物2的化合物,或其可药用盐、溶剂化物或水合物(具体地,5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸或2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸),其中所述患者的铁蛋白水平为至少50ng/ml或甚至至少100ng/ml。在某些这些实施方式中,所述日剂量为约150mg、约300mg、约450mg、约600mg或约750mg的具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1或代谢产物2的化合物,或其可药用盐、溶剂化物或水合物(具体地,{[5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸或者2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸)。在某些这些实施方式中,所述日剂量为约150mg、约300mg、约450mg或约600mg。可以每天一次、每天两次或每天三次(优选地每天一次)口服施用这些日剂量。
[0462]
在某些实施方式中,本文提供了治疗贫血症(如继发于ckd的贫血症)的方法,其包括根据本文所述的剂量和/或给药方案,向患有贫血症的患者施用有效量的具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、
化合物13、代谢产物1或代谢产物2的化合物,或其可药用盐、溶剂化物或水合物(具体地,5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸或2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸),其中所述患者的铁蛋白水平为至少50ng/ml,转铁蛋白饱和度为至少18%,或者铁蛋白水平为至少100ng/ml,转铁蛋白饱和度为至少15%。在某些这些实施方式中,所述日剂量为约150mg、约300mg、约450mg、约600mg或约750mg的具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1或代谢产物2的化合物,或其可药用盐、溶剂化物或水合物(具体地,{[5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸或者2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸)。在某些这些实施方式中,所述日剂量为约150mg、约300mg、约450mg或约600mg。可以每天一次、每天两次或每天三次(优选地每天一次)口服施用这些日剂量。
[0463]
在某些实施方式中,本文提供了治疗贫血症(如继发于ckd的贫血症)的方法,其包括根据本文所述的剂量和/或给药方案,向患有贫血症的患者施用有效量的具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1或代谢产物2的化合物,或其可药用盐、溶剂化物或水合物(具体地,5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸或2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸),其中所述患者的体重指数(bmi)小于42或小于44k/m2。在某些这些实施方式中,所述日剂量为约150mg、约300mg、约450mg、约600mg或约750mg的具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1或代谢产物2的化合物,或其可药用盐、溶剂化物或水合物(具体地,{[5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸或者2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸)。在某些这些实施方式中,所述日剂量为约150mg、约300mg、约450mg或约600mg。可以每天一次、每天两次或每天三次(优选地每天一次)口服施用这些日剂量。
[0464]
在某些实施方式中,本文提供了治疗贫血症(如继发于ckd的贫血症)的方法,其包括根据本文所述的剂量和/或给药方案,向患有贫血症的患者施用有效量的具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1或代谢产物2的化合物,或其可药用盐、溶剂化物或水合物(具体地,5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸或2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸),其中所述患者在开始使用所述化合物的治疗的11周或12周内进行了红细胞输注。在某些替代实施方式中,所述患者在开始使用所述化合物的治疗的11周或12周内未进行红细胞输注。在某些这些实施方式中,所述日剂量为约150mg、约300mg、约450mg、约600mg或约750mg的具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1或代谢产物2的化合物,或其可药用盐、溶剂化物或水合物(具体地,{[5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸或者2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸)。在某些这些实施方式中,所述日剂量为约150mg、约
300mg、约450mg或约600mg。可以每天一次、每天两次或每天三次(优选地每天一次)口服施用这些日剂量。
[0465]
在某些实施方式中,本文提供了治疗继发于慢性肾病的非重型贫血症、继发性于充血性心力衰竭的非严重的贫血症和衰老的特发性贫血症的方法,其包括向患有贫血症的患者施用本文所公开的化合物(如化合物1)的日剂量,其中连续和/或长时间施用所述化合物。
[0466]
在某些实施方式中,本文提供了治疗和/或预防患者中铁过载的方法,所述方法包括向所述患者施用有效量的具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1或代谢产物2的化合物,或其可药用盐、溶剂化物或水合物(具体地,5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸或2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸)。在某些实施方式中,根据本文所述的剂量和/或给药方案进行所述施用步骤。
[0467]
5.8药物组合物
[0468]
可以在单个单一单位剂量形式的制备中使用药物组合物。本文所提供的药物组合物和剂量形式包含如本文所提供的化合物,或它们的可药用盐、溶剂化物或水合物(例如,母体化合物)。药物组合物和剂量形式还可以包含一种或多种赋形剂。
[0469]
在某些实施方式中,药物组合物和剂量形式包含一种或多种赋形剂。适合的赋形剂对于药学领域技术人员来说是熟知的,并且本文提供了适合的赋形剂的非限制性实例。特定赋形剂是否适合掺入到药物组合物或剂量形式中取决于本领域中熟知的多种因素,其包括(但不限于)所述剂量形式将施用给患者的方式。例如,口服剂量形式(如片剂)可能含有不适合于在肠胃外剂量形式中使用的赋形剂。特定赋形剂的适合性还可以取决于所述剂量形式中具体的活性成分。例如,通过一些赋形剂(如乳糖),或者当暴露于水时,可以加快一些活性成分的分解。包含伯胺或仲胺的活性成分对这种加速分解是特别敏感的。因此,提供了药物组合物和剂量形式,其含有少量(如果有的话)乳糖、其它的单糖或二糖。如本文所使用的,术语“不含乳糖的”是指所存在的乳糖的量(如果有的话)不足以显著提高活性成分的降解速率。
[0470]
不含乳糖的组合物可以包含本领域熟知的并且在(例如)美国药典(usp)25nf20(2002)中所列的赋形剂。一般说来,不含乳糖的组合物包含药物相容的并且可药用量的活性成分、粘结剂/填充剂和润滑剂。在一个实施方式中,不含乳糖的剂量形式包含活性成分、微晶纤维素、预胶凝淀粉和硬脂酸镁。
[0471]
由于水可以有利于一些化合物的降解,因此还提供了无水药物组合物和剂量形式。例如,在药学领域中加入水(例如,5%)作为模拟长期储存的方式以确定制剂随时间的特性(如货架期或稳定性)是广泛接受的。参见,例如,jens t.carstensen,drug stability:principles&practice,第2版,marcel dekker,ny,ny,1995,第379-80页。实际上,水和热加快了一些化合物的分解。因此,水对制剂的影响可以是显著的,这是因为在制剂的生产、处理、包装、存储、运输和使用期间一般会遇到水分和/或潮气。
[0472]
应制备和存储无水药物组合物从而维持其无水性质。因此,在一个实施方式中,使用已知防止暴露于水的材料包装无水组合物从而使它们可以包含在适合的配方试剂盒中。
适合的包装的实例包括(但不限于)气密性箔片、塑料制品、单位剂量容器(例如,小瓶)、泡罩包装和条状包装。
[0473]
还提供了药物组合物和剂量形式,其包含一种或多种降低活性成分分解速率的化合物。这些化合物(在本文中称为“稳定剂”)包括(但不限于)抗氧化剂(如抗坏血酸)、ph缓冲剂或盐缓冲剂。
[0474]
像赋形剂的量和类型一样,剂量形式中活性成分的量和特定类型可以根据因素而不同,如(但不限于)其向患者施用的途径。
[0475]
5.8.1口服剂量形式
[0476]
适合于口服的药物组合物可以作为分开的剂量形式提供,如(但不限于)片剂(例如,咀嚼片)、囊片剂、胶囊和液体剂(例如,调味糖浆)。这些剂量形式含有预定量的活性成分,并且可以通过本领域技术人员熟知的药学方法制备。通常,参见remington’s the science and practice of pharmacy,第21版,lippincott williams&wilkins(2005)。
[0477]
本文所提供的口服剂量形式是根据常规药物混合技术通过将活性成分与至少一种赋形剂密切混合制备的。根据施用所期望的制剂形式,赋形剂可以采取多种形式。例如,适用于在口服液体或气溶胶剂量形式中使用的赋形剂包括(但不限于)水、乙二醇、油剂、醇、调味剂、防腐剂和着色剂。适用于在固体口服剂量形式(例如,粉剂、片剂、胶囊和囊片)中使用的赋形剂的实例包括(但不限于)淀粉、糖、微晶纤维素、稀释剂、成粒剂、润滑剂、粘结剂和崩解剂。
[0478]
在一个实施方式中,口服剂量形式是片剂或胶囊,在这种情况下,采用固体赋形剂。在另一个实施方式中,可以通过标准水性或非水性技术涂覆片剂。可以通过任何药学方法制备这些剂量形式。一般地,通过将活性成分与液体载体、细碎的固体载体或两者均匀并且密切地混合,然后如有必要将产物成形为所需的外观来制备药物组合物和剂量形式。
[0479]
例如,可以通过挤压或模制制备片剂。可以通过将任选地与赋形剂混合的自由流动形式(如粉末或颗粒)的活性成分在适合的机械中挤压来制备压制片剂。可以通过将用惰性液体稀释剂湿润的粉末化合物的混合物在适合的机械中模制来制备模制片剂。
[0480]
可以在本文所提供的口服剂量形式中使用的赋形剂的实例包括(但不限于)粘结剂、填充剂、崩解剂和润滑剂。适合在药物组合物和剂量形式中使用的粘结剂包括(但不限于)玉米淀粉、马铃薯淀粉或其它淀粉、明胶、天然和合成树胶,如阿拉伯胶、海藻酸钠、海藻酸、其它海藻酸盐、粉末黄芪胶、瓜耳豆胶、纤维素及其衍生物(例如,乙基纤维素、醋酸纤维素、羧甲基纤维素钙、羧甲基纤维素钠)、聚乙烯基吡咯烷酮、甲基纤维素、预胶凝淀粉、羟丙基甲基纤维素(例如,no.2208、2906、2910)、微晶纤维素及其混合物。
[0481]
适合的微晶纤维素的形式包括(但不限于)作为avicel-ph-101、avicel-ph-103、avicel rc-581、avicel-ph-105出售的材料(得自fmc corporation,american viscose division,avicel sales,marcus hook,pa)及其混合物。具体的粘合剂是微晶纤维素和作为avicel rc-581出售的羧甲基纤维素钠的混合物。适合的无水或低水分赋形剂或添加剂包括avicel-ph-103
tm
和starch 1500lm。其它适合的微晶纤维素的形式包括(但不限于)硅酸化微晶纤维素,如作为prosolv 50、prosolv 90、prosolv hd90、prosolv 90lm出售的材料及其混合物。
[0482]
适合在本文所提供的药物组合物和剂量形式中使用的填充剂的实例包括(但不限
于)滑石、碳酸钙(例如,颗粒或粉末)、微晶纤维素、粉末纤维素、葡聚糖结合剂、白陶土、甘露醇、硅酸、山梨糖醇、淀粉、预胶凝淀粉及其混合物。在一个实施方式中,药物组合物中的粘结剂或填充剂以所述药物组合物或剂量形式的约50至约99wt%存在。
[0483]
在某些实施方式中,填充剂可以包括(但不限于)环氧乙烷和环氧丙烷的嵌段共聚物。这些嵌段共聚物可以作为poloxamer或pluronic出售,并且包括(但不限于)poloxamer 188nf、poloxamer 237nf、poloxamer 338nf、poloxamer 437nf及其混合物。
[0484]
在某些实施方式中,填充剂可以包括(但不限于)异麦芽糖醇、乳糖、拉克替醇、甘露糖醇、山梨糖醇、木糖醇、赤藓醇及其混合物。
[0485]
可以在所述组合物中使用崩解剂以提供当暴露于水相环境时分解的片剂。含有过多崩解剂的片剂可能会在储存时分解,而含有过少的那些可能不会以所需的速率或者在所需的条件下分解。因此,可以使用既不多也不少的不会有害地改变活性成分释放的足够量的崩解剂来形成固体口服剂量形式。所使用的崩解剂的量根据制剂类型而改变,并且是本领域那些技术人员易于分辨的。在一个实施方式中,药物组合物包含约0.5至约15wt%的崩解剂,或约1至约5wt%的崩解剂。
[0486]
可以在药物组合物和剂量形式中使用的崩解剂包括(但不限于)琼脂、海藻酸、碳酸钙、微晶纤维素、交联羧甲纤维素钠、聚维酮、交聚维酮、波拉克林钾、淀粉羟基乙酸钠、马铃薯或木薯淀粉、其它淀粉、预胶凝淀粉、其它淀粉、粘土、其它褐藻胶、其它纤维素、树胶及其混合物。
[0487]
可以在药物组合物和剂量形式中使用的润滑剂包括(但不限于)硬脂酸钙、硬脂酸镁、矿物油、轻质矿物油、甘油、山梨糖醇、甘露糖醇、聚乙二醇、其它乙二醇、硬脂酸、硬脂酰富马酸钠、月桂基硫酸钠、滑石、氢化植物油(例如,花生油、棉花子油、向日葵油、芝麻油、橄榄油、玉米油和豆油)、硬脂酸锌、油酸乙酯、月桂酸乙酯、琼脂及其混合物。其它润滑剂包括(例如)syloid硅胶(aerosil200,由w.r.grace co.,baltimore,md生产)、凝固的合成二氧化硅气溶胶(由degussa co.of plano,tx销售)、cab-o-sil(焦化胶体二氧化硅产品,由cabot co.of boston,ma销售)及其混合物。如果非要使用,则润滑剂可以以小于其所掺入的药物组合物或剂量形式的约1wt%的量使用。
[0488]
在某些实施方式中,口服剂量形式包含化合物、硅酸化微晶纤维素、淀粉羟基乙酸钠、环氧乙烷和环氧丙烷的嵌段共聚物、硬脂酰富马酸钠和胶体二氧化硅。在某些实施方式中,口服剂量形式包含按重量计约5%至约75%的量的化合物、按口服剂量形式的重量计的约15%至约85%的量的硅酸化微晶纤维素、约2%至约10%的量的淀粉羟基乙酸钠、约2%至约10%的量的环氧乙烷和环氧丙烷的嵌段共聚物、0.2%至约2%的量的硬脂酰富马酸钠和约0.2%至约2%的量的胶体二氧化硅。
[0489]
在某些实施方式中,口服剂量形式包含化合物、微晶纤维素、异麦芽糖醇、淀粉羟基乙酸钠、月桂基硫酸钠、聚维酮、胶体二氧化硅和硬脂酸镁。在某些实施方式中,口服剂量形式包含约40%至约50%的量的化合物、按口服剂量形式的重量计的约40%至约50%的量的微晶纤维素、0%至约5%的量的异麦芽糖醇、约5%至约10%的量的淀粉羟基乙酸钠、0.2%至约2%的量的月桂基硫酸钠、约2%至约10%的量的聚维酮、0.1%至约1%的量的胶体二氧化硅和约0.1%至约1%的量的硬脂酸镁。
[0490]
在某些实施方式中,本文提供了单位剂量形式,其包含约100mg至约1200mg、约
200mg至约1000mg、约400mg至约800mg或约450mg至约600mg的具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1或代谢产物2的化合物,或其可药用盐、溶剂化物或水合物(具体地,{[5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸或2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸)。
[0491]
在某些实施方式中,本文提供了单位剂量形式,其包含约100mg、150mg、200mg、250mg、300mg、350mg、400mg、450mg、500mg、550mg、600mg、650mg、700mg、750mg、800mg、850mg、900mg、950mg、1000mg、1050mg、1100mg、1150或甚至约1200mg的具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1或代谢产物2的化合物,或其可药用盐、溶剂化物或水合物(具体地,{[5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸或2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸)。在某些实施方式中,所述单位剂量形式包含约40mg、约120mg、约150mg、约185mg、约200mg、约250mg、约300mg或甚至约315mg的具有式(i)、式(ii)、式(iii)、式(iv)或式(v)所表示的结构的化合物,或者选自化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11、化合物12、化合物13、代谢产物1或代谢产物2的化合物,或其可药用盐、溶剂化物或水合物(具体地,{[5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸或2-(5-(3-氟苯基)-3-羟基甲吡啶胺基)乙酸)。在某些这些实施方式中,所述单位剂量形式是包含约40mg、约120mg、约185mg、约200mg、约200、约250mg或甚至约300mg的化合物的胶囊。在某些这些实施方式中,所述单位剂量形式是包含约150mg的化合物的片剂。在某些这些实施方式中,所述单位剂量形式是包含约315mg的化合物的片剂。
[0492]
用于口服施用的液体剂量形式包含可药用乳剂、微乳剂、溶液、混悬剂、糖浆和酏剂。除了活性成分之外,所述液体剂量形式可以含有本领域中常用的惰性稀释剂,如(例如)水或其它溶剂、增溶剂和乳化剂,如乙醇、异丙醇、碳酸乙酯、乙酸乙酯、苯甲醇、苯甲酸苄酯、丙二醇、1,3-丁二醇、油剂(具体地,棉籽油、花生油、玉米油、胚芽油、橄榄油、蓖麻油和芝麻油)、甘油、四氢糠醇、聚乙二醇和山梨糖醇酐的脂肪酸酯及其混合物。
[0493]
除了惰性稀释剂之外,口服组合物还可以包含佐剂,如润湿剂、乳化剂和助悬剂、甜味剂、调味剂、着色剂、芳香剂和防腐剂。
[0494]
除了活性抑制剂之外,混悬液可以含有助悬剂,如(例如)乙氧基化的异硬脂醇、聚氧乙烯山梨糖醇和脱水山梨糖醇酯、微晶纤维素、氢氧化铝氧化物(aluminum metahydroxide)、膨润土、琼脂和黄芪胶及其混合物。
[0495]
通过以下非限制性实施例说明了某些实施方式。
6.实施例
[0496]
6.1研究设计
[0497]
在患有继发于ckd的贫血症的受试者(g3a-g5类肾小球过滤率(gfr)(透析前))中,在剂量施用20周期间,进行2b期、随机、双盲、安慰剂对照研究以评价口服施用的5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸的血液学药效反应、安全性和耐受性。在本研究中仅包括了尚未进行透析的g5患者。
[0498]
根据筛选时(未进行治疗、先前治疗过或积极治疗)他们的esa(红细胞生成刺激剂)状态,将受试者分配至研究组。使用中心随机化系统,在每个研究组中,以双盲方式将受试者以2:1的比值分配至5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸或安慰剂,并以三(3)个每片150mg的片剂进行初始剂量施用,每天一次,每天口服施用一次450mg的总剂量。相对于:1)ckd状况(g3a/b、g4或g5类gfr);和2)它们是否患有糖尿病,将受试者随机分配以维持安慰剂和5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸处理的受试者之间的平衡。
[0499]
基于门诊病人,每天进行一次研究药物治疗,连续进行20周。在剂量施用期间,在每次研究访问时,监控血红蛋白(hgb),并将血红蛋白用于确定是否应调节研究药物治疗的剂量。将血红蛋白浓度(hb)以克血红蛋白/分升血液(g/dl)报告。由于红细胞为约33%的血红蛋白,因此全血的血红蛋白浓度通常为血细胞比容(hct)的约三分之一。通常,使用氰化高铁血红蛋白法测量血红蛋白,其中将裂解试剂加入至稀释血液样品中。裂解试剂破坏样品中所有的红血球,并将血红蛋白释放到血流中,从而使样品成为血红蛋白溶液。将血红蛋白转化为称为氰化正铁血红蛋白的形式,并使用设置在氰化高铁血红蛋白峰值吸光值的波长,通过分光光度计读取浓度。然后,通过溶液的光密度计算血红蛋白的浓度。
[0500]
作为另外一种选择,可以使用装置确定血红蛋白浓度,所述装置可以测量毛细管、静脉或动脉全血中的血红蛋白浓度。比色皿中的反应是修改的叠氮高铁血红蛋白反应。通过脱氧胆酸钠使红细胞膜破裂,从而释放血红蛋白。亚硝酸钠将血红蛋白铁从亚铁转化为三价铁状态以形成高铁血红蛋白,然后高铁血红蛋白与叠氮化物结合以形成叠氮高铁血红蛋白。光度计使用用于浊度补偿的双波长(570nm和880nm)测量法。
[0501]
最后,可以使用无创法(如允许无创且连续监控血红蛋白的masimo总血红蛋白确定血红蛋白浓度。
[0502]
根据剂量调整指导方案(参见下文)调整剂量。在研究期间,根据需要开具铁补充的处方,从而将铁蛋白水平维持在50ng/ml至300ng/ml之间。
[0503]
尽管该研究的主要结局是hgb反应,但是该研究还将评价指定的神经认知功能和患者报告的结局(pro)测量,以评价对认知、抑郁情绪和疲劳的影响。
[0504]
6.2神经认知和患者报告的结局测量的评价
[0505]
本研究将包括对指定神经认知和pro测量的评价以评定对认知、抑郁情绪和疲劳的影响。患有继发于ckd的贫血症的患者经历一些不良症状,通过有效治疗可以最大程度降低和/或减轻这些症状。这些包括认知障碍、抑郁情绪、疲劳等症状。
[0506]
6.3受试者的选择和退出。
[0507]
基于以下入选和排除标准,选择研究的受试者。
[0508]
入选标准。受试者必须满足所有下列入选标准,从而入选:
[0509]
1.18至82岁,包括18和82岁;
[0510]
2.慢性肾病的诊断(根据“肾病:改善全局结局(2012)用于慢性肾病的评价和控制的临床实践指导(the kidney disease:improving global outcomes 2012clinical practice guideline for the evaluation and management of chronic kidney disease)”),g3a-g5类gfr,尚未透析,并且在研究期间预计不开始透析;
[0511]
3.筛选访问时,计算的估计的肾小球过滤率(egfr)≥10且≤65ml/分钟/1.73m2。(使用2009ckd-epi肌酐方程计算egfr);
[0512]
4.继发于ckd的贫血症,具有满足以下分组之一的标准的esa状态和筛选hgb:
[0513]
未进行治疗(从未接受esa[组1]),筛选时hgb≤10.5g/dl;或者
[0514]
先前治疗过(先前接受≥1剂量的esa并且在筛选时已停止esa疗法≥11周[组2]),筛选时hgb≤10.5g/dl;或者
[0515]
积极治疗(筛选前,积极且持续地用esa治疗至少3个月,其中在上两次剂量施用期间,esa剂量未变化并且在前3个月开具的esa剂量施用间隔≤4周[组3]),筛选时hgb≥9.5且≤12g/dl)。不能招募未进入这三组之一的受试者;
[0516]
5.铁蛋白≥50ng/ml,且转铁蛋白饱和度(tsat)≥18%,或者铁蛋白≥100ng/ml,且tsat≥15%。
[0517]
6.理解研究的程序和要求并且提供了受保护的健康信息公开的书面知情同意和授权。
[0518]
排除标准。出现任何以下情况的受试者对于本研究的入选是不合格的:
[0519]
1.怀孕或哺乳的女性以及具有怀孕可能且不能或不愿使用可接受的避孕方法的妇女;
[0520]
2.不能或不愿使用可接受的避孕方法的非输精管切除的男性受试者;
[0521]
3.bmi》44.0kg/m2;
[0522]
4.主要由于溶血(溶血性贫血)、活动性出血或近期失血所造成的贫血症;
[0523]
5.筛选访问前11周内进行过红细胞输注,或预计在研究期间需要进行输血;
[0524]
6.筛选访问前的21天内进行过雄激素疗法;
[0525]
7.筛选访问前,在过去4周内静脉注射过铁;
[0526]
8.活动性感染的迹象,除非医学监控和研究者同意受试者适合于本研究;
[0527]
9.慢性肝病史或者肝功能障碍的迹象(天冬氨酸转氨酶(ast)或者丙氨酸转氨酶(alt)》1.8
×
正常值上限(uln),碱性磷酸酶》2
×
uln或总胆红素》1.5
×
uln);
[0528]
10.用qtc》500msec筛选心电图(对于心率校正方法,使用bazett公式);
[0529]
11.不受控制的高血压(筛选时,舒张压》110mmhg或者收缩压》190mmhg);
[0530]
12.纽约心脏学会心功能分级iii或iv级充血性心力衰竭;
[0531]
13.筛选访问前6个月内,心肌梗塞、急性冠状动脉综合征或中风;
[0532]
14.脊髓发育不良综合征或骨髓纤维化史;
[0533]
15.已知患有糖尿病胃轻瘫的受试者,其对疗法有症状或对疗法是难治的(糖尿病本身不能排除受试者在本研究中是合格的);
[0534]
16.在之前2年,任何活跃恶性肿瘤或恶性肿瘤治疗史,原位治愈性切除的皮肤基底细胞癌、皮肤鳞状细胞癌、宫颈癌或切除的良性结肠息肉除外;
[0535]
17.全身性红斑狼疮(sle)史;
[0536]
18.年龄相关性黄斑变性(amd)、糖尿病性黄斑水肿或者在试验期间可能需要治疗的活跃的增殖性糖尿病性视网膜病变(疾病本身不是排除性的);
[0537]
19.在之前3个月内需要积极治疗的深静脉血栓形成(dvt)史;
[0538]
20.含铁血黄素沉积史;
[0539]
21.先前或已安排的器官移植或者干细胞或骨髓移植史(角膜移植不排除在外);
[0540]
22.在筛选访问前,在45天内或者在研究性药物治疗的5个半衰期内(哪个更长以哪个为准),研究性药物治疗的使用或者参与研究性研究;
[0541]
23.先前参与本研究或者先前在另一项临床研究中接受过5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸或者先前接受过另一种hif脯氨酰基羟化酶抑制剂;;
[0542]
24.可能提高与研究参与或研究药物施用有关的风险或者可能防碍对研究结果的解释和研究人员的判断的其它重度急性或慢性医学或精神病学病况或实验室异常将使得受试者不适合进入本研究。
[0543]
6.4受试者的治疗
[0544]
根据筛选时(未进行治疗、先前治疗过或积极治疗)他们的esa状态,将受试者分配至研究组。在随机分配前,组3(积极治疗)中的受试者将终止他们的esa。随机分配和研究药物治疗的第一剂量应在受试者将另外接受他们在先的esa疗法的下一剂量的大致相同时间发生。
[0545]
分配至5-(3-氯苯基)-3-羟基吡啶-2-羰基]氨基}乙酸或安慰剂的受试者将以三个片剂(每个150mg)开始剂量施用,每天一次。每天将进行一次研究药物治疗,连续进行20周。
[0546]
在整个研究过程中监控hgb以确定是否调节或终止研究药物治疗的剂量。根据剂量调整指导方案调整剂量。剂量改变伴随着每天服用的片剂数目的改变,每片片剂包含150mg的化合物1。
[0547]
在研究期间,研究者可以根据需要开具铁补充剂以维持。在研究期间,研究者应根据需要开具铁补充剂以维持铁蛋白≥50ng/ml且≤300ng/ml。一般地,仅口服铁可以用于疗法并且可以开具50mg元素铁的最小日剂量。当受试者铁蛋白在限定范围(≥50至≤300ng/ml)时,促使研究者开具铁补充剂以防止它们降低到所述范围下边界之外。铁蛋白水平》300ng/ml的受试者不应接受铁补充剂(口服或静脉内)。
[0548]
已接受口服铁补充剂作为他们治疗计划的一部分的受试者可以继续它们当前的治疗方案(只要他们的铁蛋白≤300ng/ml并且它们口服接受治疗性等价的50mg元素铁的最小日剂量)。在随机分组时,已接受口服铁补充剂作为他们治疗计划的一部分但铁蛋白》300ng/ml的受试者应停止它们当前的铁治疗方案。
[0549]
如果hgb升至≥13.0g/dl,则应终止研究药物治疗的剂量施用,并且直至hgb降低至≤12.5g/dl时才应重新开始。(在终止剂量前,应考虑暂时改变hgb水平的因素。)在该时间段内,应每2周评价hgb。
[0550]
一旦hgb降低至≤12.5g/dl,如下所示重新开始研究药物治疗的剂量施用:1)如果在终止剂量施用前2周的一段时间内受试者的剂量降低,则将剂量施用恢复至最近的剂量水平;或者2)如果在终止剂量施用前2周的一段时间内受试者的剂量未降低,则将剂量施用恢复至比受试者上次服用的剂量水平低150mg的剂量。
[0551]
剂量调整指导方案
[0552]
1.在实施任何剂量变化或剂量终止之前,应考虑可能暂时改变hgb水平的因素(例如,体液平衡,如体液过多或脱水、感染、住院治疗、输血、剂量错过、急性失血)。如果怀疑暂时因素是hgb变化的主要原因,则研究者能够选择将剂量调整延迟多至7天。应通过7天内重
复的hgb(与通过中心实验室进行的cbc一起记录)确认延迟或继续剂量调整的决定。
[0553]
2.应基于hgb测量调整剂量。
[0554]
3.在任何时间,允许对于耐受性或hgb的剂量降低。
[0555]
4.根据剂量调整指导方案(表1),可以从第4周开始提高剂量。在12周访问之后,不能提高剂量。一般地,在每4周的一段时间应仅进行一次剂量调整。
[0556]
5.如果受试者的hgb比剂量前的平均值提高≥1.2g/dl,则不应提高研究药物治疗的剂量。
[0557]
6.可用的剂量水平包括:150(1个片剂)、300(2个片剂)、450(3个片剂)和600(4个片剂)mg每天。
[0558]
7.将根据以下标准进行剂量调整:
[0559]
表1:剂量调整指导方案
[0560][0561]
*如果hgb比剂量前的平均值提高≥1.2g/dl,则不应提高研究药物治疗的剂量。最高的剂量水平为600mg每天。已处于最高剂量水平的受试者将继续每天600mg。在12周访问之后,不能提高剂量。
[0562]
**对于基线hgb≥10.0g/dl并且与基线相比,他们的hgb在第8周或第12周未增加》0.4g/dl的受试者,则研究员可以将剂量提高一个水平。
[0563]
最低剂量水平为150mg每天。已处于最低剂量水平的受试者将继续150mg每天,除非他们的hgb提高至≥13.0g/dl。
[0564]
如果hgb升至≥13.0g/dl,则将终止剂量施用,并且直至hgb降低至≤12.5g/dl时才将重新开始。在终止剂量前,应考虑暂时改变hgb水平的因素。在该时间段内,将每2周
评价hgb。
[0565]
可选的esa救治从第6周开始,将允许受试者(尽管将不需要)通过esa疗法救治他们的hgb。除了他们的贫血症或贫血症症状经历临床显著恶化外,受试者必须满足esa救治的hgb标准。将通过受试者基线esa状况确定起始救治疗法的标准和救治疗法的hgb救治目标。将按照研究人员的意见进行esa救治。
[0566]
研究人员应使用他们本地机构用于施用救治疗法的esa剂量施用指导方案。一旦达到如表2所列的hgb救治目标,则应停止esa疗法。
[0567]
表2:用于可选esa救治疗法的hgb标准和hgb救治目标
[0568][0569]
接受esa救治疗法的受试者应继续进行研究药物治疗。在esa救治疗法开始时或期间,不应改变或调整研究药物治疗的剂量。在整个esa救治疗法期间,应维持研究药物治疗的剂量,除非hgb升至≥13.0g/dl。如果hgb升至≥13.0g/dl,则应终止研究药物治疗的剂量施用和esa救治疗法。在esa救治完成后,应按照剂量调整指导方案继续调整研究药物治疗剂量。
[0570]
6.5药物组合物
[0571]
6.5.1 40mg、200mg和300mg胶囊制剂
[0572]
如下所示制备了胶囊制剂:
[0573][0574]
6.5.2 120mg、185mg、250mg和315mg胶囊制剂
[0575]
如下所示制备了胶囊制剂:
[0576][0577][0578]
6.5.3 150mg片剂制剂
[0579]
如下所示制备了片剂制剂:
[0580][0581]
缩写:nf=国家处方集,usp=美国药典
[0582]1加工期间除去
[0583]
6.5.4 315mg片剂制剂
[0584]
如下所示使用湿法制粒工艺制备315mg片剂制剂:
[0585][0586][0587]
6.5.5替代性315mg片剂制剂
[0588]
如下所示可以使用湿法制粒工艺制备315mg片剂制剂:
[0589][0590]
6.5.6 100mg片剂制剂
[0591]
如下所示可以使用湿法制粒工艺制备100mg片剂制剂:
[0592][0593][0594]
缩写:nf=国家处方集,usp=美国药典
[0595]1加工期间除去
[0596]
6.5.7 250mg片剂制剂
[0597]
如下所示可以使用湿法制粒工艺制备250mg片剂制剂:
[0598][0599]
缩写:nf=国家处方集,usp=美国药典
[0600]1加工期间除去
[0601]
6.6epo的每日循环
[0602]
到目前为止所获得的临床数据显示化合物1以类似于每日生理反应的方式刺激epo水平适度的与剂量成比例的每日提高,同时不会提高基线epo。在整个这些研究中,化合物1在药物动力学和药效学两者中已显示出明确且一致的剂量反应类型,其中epo、网织红细胞和hgb顺序提高。血液学反应伴随有铁相关参数中的剂量反应性变化,其中肝抗菌肽和铁蛋白降低,而总铁结合力(tibc)提高。这种变化组合表明化合物1通过协调反应提高造血作用。此外,这实现了epo每日峰值水平的适度提高,但基础(剂量前)水平不提高(以模拟健康个体中每日生理反应的方式)。
[0603]
6.6.1i期研究
[0604]
在i期研究中,epo的升高与所施用的化合物1的剂量成正比。在1a期单升剂量(sad)研究中,当与安慰剂相比时,在900和1200mg组中,在剂量施用后8、12、18和24小时观察到显著的剂量依赖性升高(图1)(p《0.01)。另外,600mg组在8小时具有显著增加(p=0.034)。
[0605]
在1b期多升剂量(mad)研究中观察到了类似的反应。峰值epo浓度显示了剂量反应性升高。不考虑剂量施用组,在下一次早晨剂量之前,epo浓度基本回到基线,因此维持了每日反应模式。在第7天,安慰剂组具有与500mg组类似的epo反应谱,这再次可能是由于研究期间由放血所造成的失血所驱动的(第1天至第8天,约230ml)。
[0606]
6.6.2iia期研究
[0607]
当前使用红细胞生成-刺激剂(esa)的与慢性肾病(ckd)有关的贫血症的治疗可以
tof ms-有关测定细节,参见参考文献(greis等人,2006))确定egln-1(或egln-3)酶活性。如以上和补充数据中所述制备了重组人egln-1-179/426。以类似方式制备了全长重组人egln-3;然而,由于切割蛋白的不稳定性,必须使用his-mbp-tvmv-egln-3融合体进行测定。对于两种酶,将对应于残基556-574(dldlealapyipadddfql)的hif-1α肽用作底物。在含有triscl(5mm,ph 7.5)、抗坏血酸(120mm)、2-酮戊二酸(3.2mm)、hif-1α(8.6mm)和牛血清白蛋白(0.01%)的50μl总体积中进行反应。加入预先确定在20分钟羟基化20%底物的量的酶来起始反应。当使用抑制剂时,在二甲基亚砜中以10倍最终测定浓度制备化合物。在室温下20分钟后,通过将10ml反应混合物转移至50ml质谱基质溶液(α-氰基-4-羟基肉桂酸,5mg/ml,在50%乙腈/0.1%tfa中,5mm nh4po4)中来终止反应。使用配备有nd:yag激光(355nm,3ns脉冲宽度,200hz重复率)的applied biosystems(foster city,ca)4700蛋白质组学分析仪maldi-tof ms,将2微升混合物点在maldi-tof ms靶标板上进行分析。通过16da的增加来鉴别来自底物的羟基化肽。在graphpad prism 4中分析定义为底物向产物的转化率的数据以计算ic
50
值。
[0616]
vegf elisa测定:以dmem(10%fbs,1%neaa,0.1%谷氨酰胺)中20000个细胞/孔将hek293细胞接种到96孔聚赖氨酸涂覆的板上。培育过夜后,用100μl opti-mem(gibco,carlsbad,ca)清洗细胞以除去血清。在opti-mem中顺序稀释dmso中的化合物13(从100mm开始)并加入细胞。使用quantikine人vegf免疫测定试剂盒(r&d systems,minneapolis,mn)分析条件培养基的vegf。使用spectra max 250(molecular devices,sunnyvale,ca)记录450nm下的光密度测量。使用graphpad prism 4软件(san diego,ca),将定义为dfo刺激%的数据用于计算ec
50
值。
[0617]
小鼠缺血性后肢研究:根据实验室动物管理和使用指南(guide for the care and use of laboratory animals)(national academy of sciences;1996)和procter and gamble pharmaceuticals的实验动物关怀及使用委员会指导方案进行所有动物工作。将来自charles river实验室(portage,mi)的9-10周大的雄性c57bl/6小鼠用于研究。以50mg/kg或100mg/kg,对小鼠口服剂量施用媒介物(碳酸盐缓冲水溶液,50mm;ph 9.0)或媒介物中的化合物13。对动物剂量施用三次:第1天的8am和5pm,第2天的8am。第1次剂量后1小时,在使用异氟烷麻醉的情况下,实施单侧动脉结扎术。将邻近腘动脉起点的股动脉结扎。对侧肢体可以进行假手术程序。以交替方式,在左右后肢之间进行结扎。在第2天8am剂量施用后2小时,在用异氟烷麻醉小鼠的同时,通过心室刺穿(ventricular stick)获得血液。使用凝胶凝块血清分离管获得用于epo分析的血清样品。收获心、肝和腓肠肌,在液氮中快速冷冻并保存在-80℃直至使用。
[0618]
小鼠血清epo测定:根据生产商的说明,使用来自r&d systems的小鼠quantikine促红细胞生成素elisa试剂盒检测小鼠血清epo。
[0619]
小鼠组织hif免疫印迹分析:将储存在-80℃的小鼠组织用液氮冷冻的研钵磨成粉。使用ne-per试剂盒(pierce biotechnology)制备细胞核提取物。对于免疫沉淀,以200:1的组织:抗体比,将细胞核提取物加入到抗hif-1α的单克隆抗体(novus,littleton,co)中。将混悬液在4℃在圆锥形微量离心管中培育4小时。然后,将蛋白a/g-偶联的琼脂糖珠(40μl,50%的混悬液)加入管中。在4℃翻转过夜后,用冷磷酸盐缓冲盐水清洗所述珠3次。然后,使用40μl laemmli样品缓冲液,将所述珠制备用于sds-page。使用xcell-ii印迹模块
系统(invitrogen,carlsbad,ca),将sds-page上分离的蛋白质转移至硝化纤维素片上。在与1:100稀释的抗hif-1α的兔抗体(novus)培育之前,用5%bsa封闭印迹。然后,可以用tris-缓冲盐水/tween-20缓冲液清洗印迹,并将其与辣根过氧化物酶-缀合的山羊抗兔第二抗体(pierce,rockford,il)一起培育。用ecl试剂(amersham,piscataway,nj)使印迹显色。用epson expression 1600扫描仪捕获印迹图像。
[0620]
6.9.2假定的hif脯氨酰基羟化酶抑制剂的实验分析
[0621]
研究目标:评价假定的低氧诱导因子(hif)脯氨酰基羟化酶抑制剂抑制hif脯氨酰基羟化酶活性并借此稳定人细胞系(hep3b细胞)中hif(hre荧光素酶激活)和提高epo产生(epo免疫测定)的活性。
[0622]
材料和方法:细胞培养物:人肝细胞癌(hep3b)细胞得自美国模式培养物保藏所(atcc,mannassas,va)并根据atcc建议培养。在37℃,将细胞在95%空气和5%co2的气氛中在加湿的培育箱中培养。在dmso(sigma)中,将化合物13稀释至50mm的储液浓度。
[0623]
细胞处理:将hep3b细胞在24孔板上铺板。用hif报告子质粒(phre-荧光素酶)转染hep3b培养物亚型过夜。(参见sheta等人,oncogene.2001nov 15;20(52):7624-34)。在95%空气和5%co2的气氛下,在37℃,在加湿培育箱中,将细胞对50μm的媒介物(1:1000dmso)或测试化合物13暴露18小时。
[0624]
分析:培养48小时后,收集细胞上清液,在4℃以15,000
×
g离心15分钟以沉淀碎片。
[0625]
体外epo诱导测定:根据生产商的说明,通过特异性免疫测定(mesoscale discovery,gaithersburg,md)测定分泌的epo水平。
[0626]
体外hif脯氨酰基羟化酶抑制测定:使用双重荧光素酶报告子-测定(promega,madison,wi,usa)测定细胞裂解液。将观察到的荧光虫荧光素酶活性对共转染的海肾荧光素酶进行归一化。
[0627]
研究结果:测试了与作为阴性对照的dmso媒介物相比,化合物13抑制hif脯氨酰基羟化酶活性并借此在人细胞系(hep3b细胞)中体外稳定hif(hre荧光素酶激活)和提高epo产生(epo免疫测定)的能力。化合物13重复测定两次。计算了相对于媒介物对照的变化倍数。测试了50μm浓度的化合物13。如果与对照相比活性增加≤1.0倍,则认为化合物是无活性的。表1和表2显示了对体外epo诱导测定和体外hif脯氨酰基羟化酶抑制测定所得的结果。意外地,发现化合物13均抑制hif脯氨酰基羟化酶活性和提高epo产生。
[0628]
表1.体外epo诱导测定
[0629][0630]
表2.体外hif脯氨酰基羟化酶抑制测定
[0631][0632]
尽管已显示和描述了本发明公开的具体实施方式,但是对于本领域技术人员显而易见的是可以在不背离本发明公开的精神和范围的情况下做出多种其它改变和变化。因此,意欲在所附权利要求中涵盖处于本发明公开范围内的所有这些改变和变化。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。