1.本公开提供了用于检测和/或量化脂肪分解活性的组合物、方法和试剂盒。本文还提供了确定蛋白质制剂稳定性的方法。在一些实施例中,用于检测脂肪分解活性的组合物包含水性测定样品和有机溶剂,其中该有机溶剂包含4-甲基伞形酮油酸酯(4muo)。
背景技术:
2.细胞培养物可用于生成商业上重要的蛋白质,如治疗性蛋白质。除了靶蛋白质,细胞还产生宿主细胞蛋白质(hcps),例如脂肪酶,它们可以在靶蛋白质的生产池中找到,例如细胞培养上清液或细胞裂解液。可以包含各种色谱步骤(例如,在单克隆抗体生产的情况下的亲和色谱)的下游纯化过程通常能够除去绝大多数的hcp。然而,由于分离和纯化方法的自然原则,即基于平衡,可能无法100%除去hcp。工业和卫生当局接受的hcp限制在相对于活性蛋白质的量~1-100ppm。hcp通常借助于酶联免疫吸附测定(elisa)作为总参数进行测量和报告,如例如usp《1132》中所述,因此,这些通常包含一系列不同浓度的不同宿主来源的蛋白质。用elisa方法量化的总hcp含量相同的药物物质可能有不同的hcp概况。这可能导致的情况是,轻微的工艺变化导致低浓度的特定hcp,如脂肪酶的增加,该增加应用总hcp测定可能无法检测到。因此,小部分的hcp可能存在于最终的蛋白质产品中,并且可能具有催化活性。残留的催化活性可能对产品质量具有有害影响,如赋形剂,例如表面活性剂,如聚山梨酯的稳定性,并最终对蛋白质产品的稳定性、质量和安全性具有有害影响。如果蛋白质是治疗性蛋白质,尤其是用于人类的治疗性蛋白质,则最小化或消除这些有害影响可能是最重要的。
3.蛋白质制剂中残留的脂肪酶活性,例如,由于在靶蛋白质的下游纯化过程期间的次优去除,可能导致一些赋形剂,例如表面活性剂的水解。后果可能包含,例如由于非极性的并且因此是不溶性的长链脂肪酸和其他降解剂从表面活性剂中释放出来导致的次可见和可见颗粒的形成,以及表面活性剂提供的稳定作用的丧失。表面活性剂降解也可能对蛋白质量具有不利影响,例如,产生导致蛋白质降解的过氧化物,或产生诱发蛋白质聚集的月桂酸。表面活性剂的降解也降低了它们在调配物中的浓度,有可能造成对蛋白质的保护不足,例如,对界面应力(例如摇动、冷冻/解冻等)的保护,并且也导致产品的安全性考虑的潜在差异,例如,由于降解的表面活性剂而导致的不同的体内责任。因此,由于赋形剂的水解,残留的脂肪酶活性可能导致最终蛋白质制剂的质量受到影响。赋形剂的降解产物,如例如聚山梨酯,也会给患者带来安全问题,如注射部位反应(参见例如,singh等人,《药物科学杂志(j pharm sci)》107(11):2735-2741(2018))。
技术实现要素:
4.在一些实施例中,本公开提供了一种组合物,其包含:(a)包含蛋白质制剂的水性测定样品;和(b)有机溶剂,其中该有机溶剂进一步包含4-甲基伞形酮油酸酯(4muo);其中该水性测定样品的ph为5.0至7.0;以及其中该水性测定样品为该组合物的约80%至约
99.9%,并且该有机溶剂为该组合物的约0.1%至约20%。
5.在一些实施例中,蛋白质制剂是细胞培养上清液。在一些实施例中,蛋白质制剂是部分纯化的蛋白质制剂。在一些实施例中,蛋白质制剂是纯化的蛋白质制剂。
6.在一些实施例中,蛋白质制剂包含治疗性蛋白质。
7.在一些实施例中,蛋白质制剂包含表面活性剂。在一些实施例中,表面活性剂是聚山梨酯。在一些实施例中,聚山梨酯是聚山梨酯-20、聚山梨酯-80或其组合。
8.在一些实施例中,蛋白质制剂进一步包含额外的宿主细胞蛋白质。
9.在一些实施例中,水性测定样品进一步包含缓冲剂、盐或两者。
10.在一些实施例中,盐是氯化钠、氯化钙或其组合。在一些实施例中,盐是氯化钠和氯化钙。在一些实施例中,氯化钠在水性测定样品中为约50mm至约400mm。在一些实施例中,氯化钠在水性测定样品中为约100mm至约200mm。在一些实施例中,氯化钙在水性测定样品中为约0.2mm至约10mm。在一些实施例中,氯化钙在水性测定样品中为约1.0mm至约2.0mm。
11.在一些实施例中,缓冲剂在约ph 6.0时具有缓冲能力。在一些实施例中,缓冲剂是tris。在一些实施例中,缓冲剂是bis-tris。在一些实施例中,缓冲剂在水性测定样品中为约2mm至约200mm。在一些实施例中,缓冲剂在水性测定样品中为约10mm至约100mm。在一些实施例中,缓冲剂在水性测定样品中为约40mm至约60mm。在一些实施例中,缓冲剂在水性测定样品中为约45mm至约55mm。
12.在一些实施例中,有机溶剂是醇、亚砜、腈或其组合。在一些实施例中,有机溶剂是二甲亚砜(dmso)。在一些实施例中,有机溶剂包含乙腈。
13.在一些实施例中,有机溶剂包含醇。在一些实施例中,有机溶剂包含乙腈和异丙醇的混合物。在一些实施例中,有机溶剂是c
1-c6醇。在一些实施例中,有机溶剂是甲醇、乙醇、丙醇、异丙醇、丁醇、仲丁醇、异丁醇、叔丁醇,或其组合。
14.在一些实施例中,组合物进一步包含脂肪酶抑制剂。在一些实施例中,脂肪酶抑制剂是(s)-2-甲酰氨基-4-甲基-戊酸(s)-1-[[(2s,3s)-3-己基-4-氧代-2-氧杂环丁烷基]甲基]-十二烷基酯(奥利司他)。
[0015]
在一些实施例中,脂肪酶抑制剂在有机溶剂中。在一些实施例中,脂肪酶抑制剂在组合物中为约1μm至约50μm。在一些实施例中,脂肪酶抑制剂在组合物中为约5μm至约25μm。
[0016]
在一些实施例中,本公开提供了一种组合物,其包含:(a)水性测定样品,所述水性测定样品包含(i)纯化的蛋白质制剂;(ii)缓冲剂;和(iii)盐;以及(b)有机溶剂,其中该有机溶剂进一步包含4-甲基伞形酮油酸酯(4muo);其中该水性测定样品的ph为5.0至7.0;并且其中该水性测定样品为该组合物的约80%至约99.9%,其中该有机溶剂为该组合物的约0.1%至约20%。
[0017]
在一些实施例中,本公开提供了一种组合物,其包含:(a)约90%至约99.9%(vol/vol)的水性测定样品,所述水性测定样品包含(i)包含蛋白质和脂质的纯化蛋白质制剂;(ii)缓冲剂;(iii)约1.0mm至约2.0mm氯化钙;和(iv)约100mm至约200mm氯化钠;和(b)约10%至约0.1%(vol/vol)的有机溶剂,该有机溶剂选自甲醇、乙醇、丙醇、异丙醇、丁醇、仲丁醇、异丁醇、叔丁醇、二甲亚砜(dmso)、乙腈或其组合,进一步包含4-甲基伞形酮油酸酯(4muo);其中该水样测定样品的ph为5.0至7.0。
[0018]
在一些实施例中,本公开提供了一种检测水性测定样品中脂肪分解活性的方法,
该方法包括(a)将包含蛋白质制剂的水性测定样品与包含4-甲基伞形酮油酸酯(4muo)的有机溶剂组合;和(b)通过荧光测量油酸酯和4-甲基伞形酮(4mu)的形成。
[0019]
在一些实施例中,本公开提供了一种检测水性测定样品中脂肪分解活性的方法,该方法包括(a)将包含蛋白质制剂的水性测定样品与包含4-甲基伞形酮油酸酯(4muo)的有机溶剂组合以形成测定组合物;(b)将包含蛋白质制剂和脂肪酶抑制剂的对照样品与包含4-甲基伞形酮油酸酯(4muo)的有机溶剂组合以形成对照组合物;以及(c)通过荧光测量测定组合物和对照组合物中油酸酯和4-甲基伞形酮(4mu)的形成。
[0020]
在一些实施例中,本公开提供了一种确定蛋白质制剂稳定性的方法,其包含(a)将包含蛋白质制剂的水性测定样品与包含4-甲基伞形酮油酸酯(4muo)的有机溶剂组合;(b)通过荧光测量油酸酯和4-甲基伞形酮(4mu)的形成;以及(c)基于测量的荧光确定蛋白质制剂的稳定性。
[0021]
在一些实施例中,水性测定样品的ph为5.0至7.0。在一些实施例中,水性测定样品和有机溶剂以约80:20至约98:2的比例组合。在一些实施例中,水性测定样品和有机溶剂以约90:10至约99.9:0.1的比例组合。
[0022]
在一些实施例中,荧光通过在330nm的荧光激发和495nm的荧光发射来测量。在一些实施例中,测量荧光持续直至24小时。在一些实施例中,测量荧光持续约24小时至约400小时。在一些实施例中,测量荧光持续大于约100小时。
[0023]
在一些实施例中,在步骤(a)之前,将水性测定样品与脂肪酶抑制剂一起温育约10分钟至约1小时。在一些实施例中,在步骤(a)之前,将水性测定样品与脂肪酶抑制剂一起温育约30分钟。在一些实施例中,脂肪酶抑制剂是(s)-2-甲酰氨基-4-甲基-戊酸(s)-1-[[(2s,3s)-3-己基-4-氧代-2-氧杂环丁烷基]甲基]-十二烷基酯(奥利司他)。在一些实施例中,脂肪酶抑制剂以约1μm至约50μm添加。在一些实施例中,脂肪酶抑制剂以约5μm至约25μm添加。
[0024]
在一些实施例中,本公开提供了一种试剂盒,其包含在两个或更多个容器中的:(a)有机溶剂;(b)4-甲基伞形酮油酸酯(4muo);(c)脂肪酶抑制剂。
[0025]
在一些实施例中,试剂盒进一步包含缓冲剂、盐或两者。在一些实施例中,试剂盒进一步包含缓冲交换柱。
[0026]
在一些实施例中,本公开提供了一种试剂盒,其包含:(a)包含4-甲基伞形酮油酸酯(4muo)的有机溶剂;(b)适合交换蛋白质制剂缓冲剂的柱;以及(c)脂肪酶抑制剂。
附图说明
[0027]
图1a-1e与实例1a有关。图1a和1b分别显示了tris和bis-tris缓冲剂的缓冲浓度和ph对胰腺猪脂肪酶(ppl)活性和4-甲基伞形酮(4mu)荧光淬灭的影响。图1c显示了缓冲剂浓度和ph对脂肪酶活性和4-甲基伞形酮油酸酯(4muo)的自动水解的影响。图1d显示了测量4mu荧光的ph范围。图1e显示了4mu在各种ph下的不同形式。
[0028]
图2a-2c与实例2a有关。图2a和2b分别显示了cacl2浓度对脂肪酶活性和4mu荧光淬灭的影响。图2c显示了cacl2浓度对脂肪酶活性和4muo的自动水解的影响。
[0029]
图3a-3c与实例3a有关。图3a和3b分别显示了nacl浓度对脂肪酶活性和4mu荧光淬灭的影响。图3c显示了nacl浓度对脂肪酶活性和4muo的自动水解的影响。
[0030]
图4a-4c与实例4a有关。图4a和4b分别显示了有机溶剂对脂肪酶活性和4mu荧光淬灭的影响。图4c显示了有机溶剂对脂肪酶活性和4muo的自动水解的影响。
[0031]
图5a-5c与实例5有关。图5a和5b分别显示了表面活性剂对脂肪酶活性和4mu荧光淬灭的影响。图5c显示了表面活性剂对脂肪酶活性和4muo的自动水解的影响。
[0032]
图6a-6b与实例6有关。图6a和6b分别显示了三种不同浓度的脂肪酶抑制剂奥利司他对脂肪酶活性和4mu荧光淬灭的影响。
[0033]
图7a-7d与实例7有关。图7a和7c显示了理论上完全降解的ps20对脂肪酶活性和4mu的自动水解的产物抑制影响。图7b和7d显示了理论上完全降解的ps80对脂肪酶活性和4mu的自动水解的产物抑制影响。
[0034]
图8与实例8有关。图8显示了ps80对4mu荧光淬灭的影响。
[0035]
图9a-9d与实例9有关。图9a和9b显示了测试ps20(图9a)和ps80(图9b)在不同浓度的细胞培养收获液(cchf)中的降解的hplc-fma测定的结果。图9c显示了4muo脂肪酶测定的理论读数。图9d显示了测试不同浓度的cchf对聚山梨酯降解的4muo脂肪酶测定的实际读数。
[0036]
图10a-10h与实例9有关。图10a-10h显示了在不同cchf浓度下用ps80进行的4muo脂肪酶测定的结果。
[0037]
图11与实例1b有关。图11显示了tris和bis-tris的ph对ppl和cchf的脂肪分解活性以及4mu自动水解(ah)的影响。
[0038]
图12与实例2b有关。图12显示了cacl2浓度对ppl和cchf的脂肪分解活性的影响。
[0039]
图13与实例3b有关。图13显示了nacl浓度对ppl和cchf的脂肪分解活性的影响。
[0040]
图14与实例4b有关。图14显示了有机溶剂对ppl和cchf的脂肪分解活性的影响。
[0041]
图15a和15b与实例5b有关。图15a显示了不同的表面活性剂对ppl和cchf的脂肪分解活性的影响。图15b显示了不同表面活性剂对4mu荧光的淬灭。
[0042]
图16与实例6b有关。图16显示了将样品与三种不同浓度的脂肪酶抑制剂奥利司他预温育或共同温育对ppl活性的影响。
[0043]
图17a和17b与实例10有关。图17a显示了用含有蛋白质的调配物与各种阳性和阴性对照(样品、测定、调配物和自动水解)进行的脂肪酶测定的动力学。所测试的样品在本文表10中进行了总结。图17b是测定动力学的缩放图。
[0044]
图18与实例9有关。图18显示了用不同浓度的cchf进行的脂肪酶测定的总结。
[0045]
图19a和19b与实例1b有关。图19a和19b分别显示了0.01至5mm浓度范围内的4mu校准曲线和4mu校准曲线的数值结果。
具体实施方式
[0046]
本公开涉及用于检测脂肪分解活性的组合物、方法和试剂盒。
[0047]
如本文所用,“一(a)”或“一个(an)”可指一个或多个。如本文所用,当与“包含”一词一起使用时,“一(a)”或“一个(an)”可以指一个或多于一个。如本文所用,“另外的”或“进一步的”可指至少第二个或更多个。
[0048]
本技术通篇所使用的,术语“约”用于指示值包含用于确定所述值的方法/装置的误差的固有变化,或存在于研究受试者之间的变化。通常,该术语意味着根据情况包含大约
或小于1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、16%、17%、18%、19%或20%的可变性。在一些实施例中,由于在本文使用的背景,本领域技术人员将理解术语“约”所表示的可变性水平。还应该理解,使用术语“约”也包含具体记载的值。
[0049]
尽管本公开支持只指替代物和“和/或”的定义,但是权利要求中使用术语“或”是指“和/或”,除非明确指出只指替代物或替代物是相互排斥的。
[0050]
如在本说明书和权利要求书中所使用的,术语“包含(comprising)”(和任何形式的包含,如“包含(comprise)”和“包含(comprises)”),“具有(having)”(和任何形式的具有,如“具有(have)”和“具有(has)”),“包含(including)”(和任何形式的包含,例如“包含(includes)”和“包含(include)”)或“含有(containing)”(和任何形式的包含,如“含有(contains)”和“含有(contain)”)是包含性的或开放式的,并且不排除附加的、未陈述的元件或方法步骤。可以设想,本说明书中讨论的任何实施例都可以针对本公开的任何方法、组合物和/或试剂盒来实施。此外,本公开的组合物可用于实现本公开的方法和试剂盒。
[0051]
使用术语“例如”及其相应的缩写“e.g.”(无论是否斜体)意味着所记载的具体术语是本公开的代表性实例和实施例,除非另有明确说明,否则该代表性实例和实施例不旨在局限于所参考或引用的具体实例。
[0052]
如本文所用,“在
…
之间”是包含范围两端的范围。例如,在x和y之间的数字明确地包含数字x和y,以及落在x和y之内的任何数字。
[0053]
如本文所用,“蛋白质”、“肽”或“多肽”是指可以是任何长度的氨基酸的聚合形式。蛋白质可以包含例如抗体、结构蛋白质、酶、膜、膜相关和/或跨膜蛋白质、转运蛋白质、受体、信号传导蛋白质等。本公开的蛋白质和/或肽还包含修饰的蛋白质,例如,与一种或多种非肽物质共轭,该非肽物质如例如药物、靶向部分、如可视化标签的标签等。本公开的蛋白质可以是治疗性蛋白质,例如,用于诊断、治疗和/或预防疾病或病症的治疗性蛋白质。在一些实施例中,本文所述的聚山梨酯可以提高蛋白质在药物调配物中的稳定性。在一些实施例中,治疗性蛋白质是抗体。在一些实施例中,治疗性蛋白质是抗体-药物共轭物。在一些实施例中,本文所述的蛋白质制剂包含蛋白质,例如,治疗性蛋白质。
[0054]
如本文在蛋白质制剂的背景下所用,“纯化”是指将一种或多种物质,例如蛋白质,从复杂的混合物中分离出来的过程,该混合物通常是细胞、组织或生物体。“纯化的”蛋白质样品或蛋白质制剂可以指以下样品,其中细胞、组织或生物体的一种或多种非水溶性组分(如例如,细胞膜、脂质、聚集的蛋白质或核酸以及其他疏水物质)已经被减少或去除,并且只留下可溶性组分(如例如,可溶性蛋白质)。如本文所用,“可溶性”可指物质溶解于某种溶剂的能力,该溶剂例如细胞培养基、缓冲剂、水或有机溶剂。在蛋白质的背景下,“可溶性”也可以指在某种溶剂中不沉淀和/或聚集的蛋白质,该溶剂例如细胞培养基、缓冲剂、水或有机溶剂。
[0055]
示例性的纯化过程可以包含:使含有感兴趣的蛋白质,例如治疗性蛋白质的细胞培养物生长;将细胞从培养基中分离;裂解细胞并分离裂解的细胞以产生含有可溶性组分的细胞培养上清液和含有本文所述不溶组分的沉淀;以及使细胞培养上清液经历缓冲剂交换、ph调整、离心、过滤(包含例如超滤和/或渗滤)、色谱或其任何组合,以产生纯化的蛋白质制剂。在一些实施例中,本公开的纯化的蛋白质制剂通过本文所述的过程纯化。在一些实施例中,已使本公开的部分纯化的蛋白质制剂经历部分本文所述的纯化过程。例如,部分纯
化的蛋白质制剂可能没有经历用于生成纯化蛋白质制剂的所有缓冲剂交换、ph调整、离心、过滤和/或色谱步骤。在一些实施例中,本文所述的细胞培养上清液包含本公开的治疗性蛋白质。在一些实施例中,本文所述的部分纯化的蛋白质制剂包含本公开的治疗性蛋白质。在一些实施例中,本文所述的纯化蛋白质制剂包含本公开的治疗性蛋白质。
[0056]
在一些实施例中,本公开涉及用于检测脂肪分解活性的组合物和方法。脂肪分解活性,即脂解,一般是指脂质的水解。脂解反应可由脂肪酶催化,脂肪酶是酯酶的一个亚类。因此,“脂肪酶”是指水解脂质,例如甘油三酯、磷脂、胆固醇酯等的酯键的酶。脂肪酶包含,例如,甘油三酯脂肪酶、脂蛋白质脂肪酶、胰脂肪酶、肝脂肪酶、胃脂肪酶、舌脂肪酶、内皮脂肪酶和磷脂酰丝氨酸磷脂酶。脂肪酶是自然产生的,例如,由哺乳动物的胰腺、肝脏、舌腺、胃、甲状腺和/或粘膜产生,由某些细菌和真菌分泌,和/或在溶酶体中发现。在一些实施例中,脂肪酶是得到蛋白质纯化中的蛋白质的细胞内生的。在一些实施例中,脂肪酶是蛋白质制剂中另一种生物组分内生的,例如,包含添加到蛋白质制剂中的稳定蛋白质的生物组分。
[0057]
在一些实施例中,脂肪酶由细胞培养物中的细胞产生。在一些实施例中,脂肪酶由细胞培养物中的细胞产生以用于生产感兴趣的蛋白质。适合生产感兴趣的蛋白质的细胞的非限制性实例包含细菌、昆虫、酵母、哺乳动物和/或转基因细胞。细胞系的非限制性实例包含cho、hek 293、ht-1080、per.c6、cap、vero、bhk、hela、cv1、cos、mdck、3t3、ns0、ns1、pc12、w138、sp2/0、hkb-11、tm4、mmt 060562、tr1、mrc 5、fs4、骨髓瘤细胞系、杂交瘤细胞系和肝瘤细胞系。在一些实施例中,用于生产感兴趣的蛋白质的细胞系是稳定的细胞系,例如,其中感兴趣的蛋白质的基因被稳定地整合到细胞的基因组中。在一些实施例中,用于生产感兴趣的蛋白质的细胞系是瞬时细胞系,例如,其中细胞表达但不将基因整合到基因组中。
[0058]
在一些实施例中,感兴趣的蛋白质是治疗性蛋白质。在一些实施例中,感兴趣的蛋白质从细胞培养物中纯化,以生成纯化的蛋白质制剂。在一些实施例中,在纯化过程期间,细胞培养物中的脂肪酶没有完全从蛋白质制剂中去除。因此,在一些实施例中,脂肪酶存在于纯化的蛋白质制剂中。
[0059]
如本文所指,“活性”脂肪酶是能够进行脂解的脂肪酶(本文也称为具有“脂肪分解活性”)。存在于蛋白质制剂中的活性脂肪酶可干扰涉及感兴趣的蛋白质如治疗性蛋白质的下游过程。在一些实施例中,包含感兴趣的蛋白质如治疗性蛋白质和脂肪酶的蛋白质制剂被包含在药物调配物中。在一些实施例中,将赋形剂添加到蛋白质制剂中。在一些实施例中,赋形剂稳定蛋白质制剂,例如通过最小化界面应力、减少蛋白质聚集和/或提高蛋白质溶解度来稳定蛋白质制剂。在一些实施例中,赋形剂是表面活性剂。在一些实施例中,赋形剂包含脂肪酸、酯或两者。在一些实施例中,赋形剂容易被活性脂肪酶水解。在一些实施例中,活性脂肪酶在包含感兴趣的蛋白质和赋形剂的蛋白质制剂中的存在降低了制剂的稳定性。因此,可靠地检测蛋白质制剂中的脂肪分解活性是有利的,以最小化赋形剂的脂肪酶水解造成的负面影响,如颗粒增加、安全问题(例如,由于注射部位反应增加)和质量下降。
[0060]
在一些实施例中,本公开提供了其中可以检测蛋白质制剂中脂肪分解活性的组合物。
[0061]
在一些实施例中,本公开提供了一种组合物,其包含:(a)包含蛋白质制剂的水性测定样品;和(b)有机溶剂,其中该有机溶剂进一步包含4-甲基伞形酮油酸酯(4muo);其中该水性测定样品的ph为5.0至7.0;以及其中该水性测定样品为该组合物的约80%至约
98%,并且该有机溶剂为该组合物的约2%至约20%。
[0062]
在进一步的实施例中,本公开提供了一种组合物,其包含:(a)水性测定样品,所述水性测定样品包含(i)纯化蛋白质制剂;(ii)缓冲剂;和(iii)盐;和(b)有机溶剂,其中该有机溶剂进一步包含4-甲基伞形酮油酸酯(4muo);其中该水性测定样品的ph为5.0至7.0;以及其中该水性测定样品为该组合物的约80%至约98%(vol/vol),并且该有机溶剂为该组合物的约2%至约20%(vol/vol)。
[0063]
在进一步的实施例中,本公开提供了一种组合物,其包含:(a)约90%至约98%(vol/vol)的水性测定样品,所述水性测定样品包含(i)纯化蛋白质制剂;(ii)缓冲剂;(iii)约1.0mm至约20mm氯化钙;和(iv)约100mm至约200mm氯化钠;和(b)约2%至约10%(vol/vol)的有机溶剂,该有机溶剂选自甲醇、乙醇、丙醇、异丙醇、丁醇、仲丁醇、异丁醇、叔丁醇、二甲亚砜(dmso)、乙腈或其组合,进一步包含4-甲基伞形酮油酸酯(4muo);其中该水样测定样品的ph为5.0至7.0。
[0064]
如本文所用,“水性”(例如,水性测定样品)是指其中水为溶剂的溶液或样品。因此,本公开的水性测定样品可以包含例如细胞培养基、缓冲溶液、蛋白质样品等。在一些实施例中,本公开的水性测定样品包含蛋白质制剂。
[0065]
在一些实施例中,蛋白质制剂是细胞培养上清液。细胞培养上清液描述于本文,并且可以例如从生产感兴趣的蛋白质的细胞培养物中获得。在一些实施例中,蛋白质是治疗性蛋白质。在一些实施例中,细胞培养上清液是在裂解培养的细胞并分离可溶性和不可溶性组分后产生的,例如通过离心分离。本文提供了适合培养和蛋白质生产的细胞和细胞系的实例。在一些实施例中,细胞培养上清液包含感兴趣的蛋白质,例如,治疗性蛋白质以及额外的宿主细胞组分。在一些实施例中,额外的宿主细胞组分包含额外的宿主细胞蛋白质。在一些实施例中,额外的宿主细胞蛋白质包含脂肪酶。在一些实施例中,脂肪酶具有脂肪分解活性。
[0066]
在一些实施例中,蛋白质制剂是部分纯化的蛋白质制剂。部分纯化的蛋白质制剂描述于本文,并且可以例如在经历来自细胞培养物的感兴趣的蛋白质的部分纯化程序(例如本文所述的纯化过程)后获得。在一些实施例中,蛋白质是治疗性蛋白质。在一些实施例中,与细胞培养上清液相比,部分纯化的蛋白质制剂经历了额外的纯化步骤。在一些实施例中,部分纯化的蛋白质制剂包含治疗性蛋白质和宿主细胞的额外组分。在一些实施例中,宿主细胞组分包含宿主细胞蛋白质。在一些实施例中,宿主细胞蛋白质包含脂肪酶。在一些实施例中,脂肪酶具有脂肪分解活性。在一些实施例中,治疗性蛋白质是部分纯化蛋白质制剂中所有蛋白质的20%至95%(w/w)、30%至90%(w/w)或40%至80%(w/w)。
[0067]
在一些实施例中,蛋白质制剂是纯化的蛋白质制剂。纯化的蛋白质制剂描述于本文,并且可以例如在经历来自细胞培养物的感兴趣的蛋白质的纯化过程(例如,本文描述的纯化过程)后获得。在一些实施例中,感兴趣的蛋白质是治疗性蛋白质。在一些实施例中,纯化的蛋白质制剂包含治疗性蛋白质和额外的宿主细胞组分。在一些实施例中,宿主细胞组分包含宿主细胞蛋白质。在一些实施例中,宿主细胞蛋白质包含脂肪酶。在一些实施例中,脂肪酶具有脂肪分解活性。在一些实施例中,治疗性蛋白质是纯化蛋白质制剂中所有蛋白质的大于70%(w/w),大于80%(w/w),大于85%(w/w),大于90%(w/w),大于95%(w/w),或大于99%(w/w)。
[0068]
在一些实施例中,蛋白质制剂包含治疗性蛋白质。治疗性蛋白质的非限制性实例包含抗体(如单克隆或多克隆抗体)和抗体片段;基于蛋白质的疫苗(如例如乙型肝炎表面抗原);血液因子(如例如因子viii和因子ix);溶栓剂(如例如组织纤溶酶原激活物);激素(如例如胰岛素、胰高血糖素、生长激素和促性腺激素);造血生长因子(如例如促红细胞生成素和集落刺激因子);干扰素(如例如干扰素-α、干扰素-β和干扰素-γ);基于白细胞介素的蛋白质(如例如白细胞介素-12);以及其他蛋白质,如肿瘤坏死因子和治疗性酶。基于蛋白质的疗法的进一步实例包含贝利木单抗、伊匹单抗、贝拉西普、本妥昔单抗、阿柏西普、菊欧文氏菌天冬酰胺酶(asparaginase erwinia chrysanthemi)、羧肽酶、奥滨尤妥珠单抗、派姆单抗、博纳吐单抗、尼韦单抗、伊达鲁单抗、asofatase-alfa、达拉图单抗、埃洛妥单抗、sebelipase alfase、阿替唑利珠单抗、taliglucerase alfa、瑞西巴库单抗、elosulfase alfa、美曲普汀、雷莫芦单抗、斯妥昔单抗、派姆单抗、定妥昔单抗、依伐单抗、奈西妥单抗、奥比妥昔单抗、阿巴西普、阿达木单抗、阿法赛特、依那西普、英夫利昔单抗、曲妥珠单抗、乌司他单抗、地尼白介素(denileukin diftitox)和戈利木单抗。蛋白质疗法的进一步实例描述于例如dimitrov,《分子生物学方法(methods mol biol)》899:1-26(2012),lagass
é
等人,f1000res 6:113(2017)和《蛋白质疗法(protein therapeutics)》,eds:vaughan等人,2017:wiley-vch verlag。治疗性蛋白质可以包含重组蛋白质、修饰蛋白质和融合蛋白质,如例如,抗体-药物缀合物、抗体-细胞因子融合物、fc-融合物、双特异性抗体、多特异性抗体、亲和体融合物、糖基化蛋白质和肽,以及工程化受体拮抗剂。在一些实施例中,包含治疗性蛋白质的蛋白质制剂用于药物调配物中。
[0069]
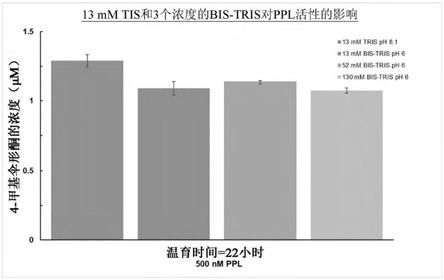
在一些实施例中,蛋白质制剂包含商业上重要的蛋白质,例如,工业酶。商业上重要的蛋白质可用于各种工业,如制药、化学生产、生物燃料、食品和饮料以及消费产品。例如,在一些实施例中,蛋白质制剂是产生所需产品的过程内使用的酶,或者可能是感兴趣的产品。在一些实施例中,商业上重要的蛋白质用于食品、医药合成、生物燃料、化学或制造工业。在一些实施例中,工业酶包含但不限于palatase lipozyme、lipopan、木糖异构酶、菠萝蛋白质酶和noopazyme(用于食品工业)、纤维素酶和淀粉酶(用于生物燃料工业)、树脂酶(用于纸张加工工业)、酰胺酶(用于化学工业)、novozym-435(用于肉豆蔻酸异丙酯的化妆品生产)或枯草杆菌蛋白质酶(用于洗涤剂)。
[0070]
在一些实施例中,蛋白质制剂包含药物赋形剂。包含药物赋形剂例如以在制造之前、期间或之后帮助药物递送系统的加工;保护、支持或增强稳定性、生物利用度或患者可接受性;协助产品鉴定和增强整体安全性;协助药物在使用中的有效性和/或递送;和/或协助在储存期间保持药物产品的完整性。药物赋形剂的非限制性实例包含表面活性剂、填料、稀释剂、粘度剂、悬浮剂、粘性剂、包衣、调味剂、崩解剂、着色剂、润滑剂、助流剂、防腐剂、甜味剂等。在一些实施例中,将药物赋形剂添加到蛋白质制剂中。在一些实施例中,在纯化之前、之后或期间将药物赋形剂添加到蛋白质制剂中。
[0071]
在一些实施例中,药物赋形剂是表面活性剂。如本文所用,“表面活性剂”是指降低两种液体之间的表面张力或界面张力的试剂。在一些实施例中,表面活性剂可以通过最小化聚集和/或沉淀和/或改善组合物的一种或多种组分的可溶性(例如,通过降低表面张力和抑制蛋白质表面吸附;参见例如agarkhed等人,《aaps药物科学技术(aaps pharmscitech)》14:1-9(2013))来稳定组合物,例如本文所述的蛋白质制剂。药物组合物中
的表面活性剂还可以调节活性药物成分(api)的生物利用度;协助api保持优选的多态形式;防止聚集或解离;和/或调节活性成分的免疫原性反应。表面活性剂可以包含阳离子、阴离子、非离子、两性离子、酸碱兼性和/或两性表面活性剂。表面活性剂的非限制性实例包含聚山梨酯(例如,tween表面活性剂,如tween 20和tween 80,它们也分别称为聚山梨酯20、聚山梨酯80),其源自用脂肪酸(例如,聚山梨酯20中的月桂酸和聚山梨酯80中的油酸)酯化的乙氧基化脱水山梨糖醇;泰洛沙泊;泊洛沙姆(例如,pluronic f68lf、pluronic l-g2lf、pluronic l62d、lutrol f68和kolliphor p188);聚氧乙烯蓖麻油(例如kolliphor el)及其衍生物;脱水山梨糖醇酯,也称为spans;聚氧乙烯硬脂酸酯;卵磷脂;磷脂;聚氧乙烯表面活性剂,如例如,triton(例如triton x-100)和brij(例如brij 35);以及聚乙氧基化脂肪酸,如例如,myrj s40、myrj s100和myrj 52。
[0072]
在一些实施例中,表面活性剂包含脂肪酸。在一些实施例中,表面活性剂包含酯。在一些实施例中,表面活性剂是聚山梨酯。聚山梨酯是一类源自用脂肪酸酯化的乙氧基化脱水山梨糖醇的化合物,并且包含例如聚山梨酯20、聚山梨酯40、聚山梨酯60、聚山梨酯80、聚山梨酯21、聚山梨酯61、聚山梨酯65、聚山梨酯81,和聚山梨酯81。在一些实施例中,本文提供的蛋白质制剂包含聚山梨酯。在一些实施例中,蛋白质制剂中的聚山梨酯是聚山梨酯20、聚山梨酯80,或其组合。
[0073]
在一些实施例中,表面活性剂是水性测定样品的约0.001%w/v至约2%w/v。在一些实施例中,表面活性剂是水性测定样品的约0.005%w/v至约2%w/v。在一些实施例中,表面活性剂是水性测定样品的约0.01%w/v至约2%w/v。在一些实施例中,表面活性剂是水性测定样品的约0.02%至约1.5%w/v。在一些实施例中,表面活性剂是水性测定样品的约0.03%至约1.0%w/v。在一些实施例中,表面活性剂是水性测定样品的约0.04%至约0.8%w/v。在一些实施例中,表面活性剂是水性测定样品的约0.05%至约0.6%w/v。在一些实施例中,表面活性剂是水性测定样品的约0.06%至约0.4%w/v。在一些实施例中,表面活性剂是水性测定样品的约0.07%至约0.2%w/v。在一些实施例中,表面活性剂是水性测定样品的约0.08%至约0.15%w/v。在一些实施例中,表面活性剂是水性测定样品的约0.09%至约0.10%w/v。在一些实施例中,表面活性剂是水性测定样品的约0.01%至约0.04%w/v。在一些实施例中,表面活性剂是聚山梨酯。在一些实施例中,表面活性剂是聚山梨酯20、聚山梨酯80或其组合。
[0074]
在一些实施例中,蛋白质制剂进一步包含一个或多个额外的宿主细胞蛋白质。如本文所述,蛋白质制剂是由细胞培养物制备的,即该细胞培养物包含感兴趣的蛋白质如治疗性蛋白质的宿主细胞。在一些实施例中,蛋白质制剂包含一种或多种额外的宿主细胞蛋白质。在一些实施例中,额外的宿主细胞蛋白质在与感兴趣的蛋白质如治疗性蛋白质基本相同的条件下是可溶的。在一些实施例中,额外的宿主细胞蛋白质不容易与感兴趣的蛋白质如治疗性蛋白质分离。在一些实施例中,额外的宿主细胞蛋白质包含脂肪酶。在一些实施例中,一种或多种额外的宿主细胞蛋白质具有脂肪分解活性。
[0075]
在一些实施例中,包含蛋白质制剂的水性测定样品进一步包含缓冲剂、盐或两者。一般来说,本公开的盐是指其阴离子不是oh-和o
2-的离子化合物。在一些实施例中,盐减少和/或防止组合物中的一种或多种组分的降解。本领域的普通技术人员可以选择可以包含在水性测定样品中的合适的盐,包含例如,钠盐、钾盐、钙盐、铵盐等。在一些实施例中,盐是
氯化钾(kcl)、氯化钠(nacl)、碳酸钠(na2co3)、硫酸钠(na2so4)、氯化钙(cacl2)、氯化铵(nh4cl)、乙酸铵(nh4ch3coo)、硫酸铵((nh4)2so4),或其组合。在一些实施例中,盐是nacl、cacl2或其组合。在一些实施例中,盐是nacl和cacl2两者。
[0076]
在一些实施例中,水性测定样品中nacl的浓度有利于准确和/或有效检测样品中的脂肪分解活性。在一些实施例中,nacl在水性测定样品中为约10mm至约500mm。在一些实施例中,nacl在水性测定样品中为约25mm至约400mm。在一些实施例中,nacl在水性测定样品中为约50mm至约300mm。在一些实施例中,nacl在水性测定样品中为约75mm至约250mm。在一些实施例中,nacl在水性测定样品中为约100mm至约200mm。在一些实施例中,nacl在水性测定缓冲剂中为约50mm、约60mm、约70mm、约80mm、约90mm、约100mm、约110mm、约120mm、约130mm、140mm、150mm、160mm、170mm、180mm、190mm,或200mm。
[0077]
在一些实施例中,nacl在最终组合物(水性测定样品和有机溶剂)中为约10mm至约500mm。在一些实施例中,nacl在最终组合物中为约25mm至约400mm。在一些实施例中,nacl在最终组合物中为约50mm至约300mm。在一些实施例中,nacl在最终组合物中为约75mm至约250mm。在一些实施例中,nacl在最终组合物中为约100mm至约200mm。在一些实施例中,nacl在最终组合物中为约100mm至约140mm,例如120mm。在一些实施例中,nacl在最终组合物中为约50mm、约60mm、约70mm、约80mm、约90mm、约100mm、约110mm、约120mm、约130mm、140mm、150mm、160mm、170mm、180mm、190mm或200mm。
[0078]
在一些实施例中,水性测定样品中的cacl2浓度有利于准确和/或有效检测样品中的脂肪分解活性。在一些实施例中,cacl2在水性测定样品中为约0.1mm至约20mm。在一些实施例中,cacl2在水性测定样品中为约0.2mm至约10mm。在一些实施例中,cacl2在水性测定样品中为约0.5mm至约5.0mm。在一些实施例中,cacl2在水性测定样品中为约0.7mm至约3.0mm。在一些实施例中,cacl2在水性测定样品中为约1.0mm至约2.0mm。在一些实施例中,cacl2在水性测定样品中为约0.5mm、约0.6mm、约0.7mm、约0.8mm、约0.9mm、约1.0mm、约1.1mm、约1.2mm、约1.3mm、约1.5mm、约1.5mm、约1.6mm、约1.7mm、约1.8mm、约1.9mm、约2.0mm、约2.5mm、约3.0mm、约3.5mm、约4.0mm、约4.5mm或约5.0mm。
[0079]
在一些实施例中,cacl2在最终组合物(水性测定样品和有机溶剂)中为约0.1mm to about 20mm。在一些实施例中,cacl2在最终组合物中为约0.2mm至约10mm。在一些实施例中,cacl2在最终组合物中为约0.5mm至约5.0mm。在一些实施例中,cacl2在最终组合物中为约0.7mm至约3.0mm。在一些实施例中,cacl2在最终组合物中为约1.0mm至约2.0mm。在一些实施例中,cacl2在最终组合物中为约0.5mm、约0.6mm、约0.7mm、约0.8mm、约0.9mm、约1.0mm、约1.1mm、约1.2mm、约1.3mm、约1.5mm、约1.5mm、约1.6mm、约1.7mm、约1.8mm、约1.9mm、约2.0mm、约2.5mm、约3.0mm、约3.5mm、约4.0mm、约4.5mm或约5.0mm。
[0080]
在一些实施例中,nacl和cacl2减少和/或防止水性测定样品中一种或多种组分的降解。在一些实施例中,nacl和cacl2减少和/或防止蛋白质例如治疗性蛋白质的聚集和/或沉淀。在一些实施例中,nacl和cacl2减少和/或防止组合物中的一种或多种组分的降解,该组分不在水性测定样品中,例如在有机溶剂中。在一些实施例中,nacl和cacl2减少和/或防止4-甲基伞形酮油酸酯(4muo)的自动水解。在一些实施例中,在水性测定样品中,nacl为约10mm至约500mm,并且cacl2为约0.1mm至约20mm。在一些实施例中,在水性测定样品中,nacl为约25mm至约400mm,并且cacl2为约0.2mm至约10mm。在一些实施例中,在水性测定样品中,
nacl为约50mm至约300mm,并且cacl2为约0.5mm至约5.0mm。在一些实施例中,在水性测定样品中,nacl为约75mm至约250mm,并且cacl2为约0.7至约3.0mm。在一些实施例中,在水性测定样品中,nacl为约100mm至约200mm,并且cacl2为约1.0至约2.0mm。在一些实施例中,在水性测定样品中,nacl为约150mm,并且cacl2为约0.3mm。
[0081]
如本文所用,“缓冲剂”是指在溶液中用于维持溶液的ph的物质。缓冲剂可以将溶液维持在一定的ph范围内(即在特定范围内的缓冲能力),并防止向溶液中添加额外组分时ph的迅速变化。一般来说,缓冲剂可以是弱酸或弱碱。在一些实施例中,缓冲剂在约ph 5.0、约ph 5.5、约ph 6.0、约ph 6.5、或约ph 7.0时具有缓冲能力。在约ph 5.0至约ph 7.0下具有缓冲能力的缓冲剂包含例如柠檬酸盐、乙酸盐、磷酸盐、mes、bis-tris、ada、aces、pipes、mopso、bis-tris丙烷、bes、mops、tes、hepes、dipso、mobs、tapso和tris。缓冲剂的缓冲能力可由技术人员确定。在一些实施例中,水性测定样品中的缓冲剂有利于准确和/或有效地检测样品中的脂肪分解活性。在一些实施例中,缓冲剂减少和/或防止水性测定样品中一种或多种组分的降解。在一些实施例中,缓冲剂减少和/或防止蛋白质例如治疗性蛋白质的聚集。在一些实施例中,缓冲剂减少和/或防止组合物中的一种或多种组分的降解,该组分不在水性测定样品中,例如在组合物的有机溶剂中。在一些实施例中,缓冲剂减少和/或防止4-甲基伞形酮油酸酯(4muo)的自动水解。在一些实施例中,缓冲剂以水性缓冲溶液的形式提供在水性测定样品中。
[0082]
在一些实施例中,缓冲剂在水性测定样品中为约5mm至约200mm。在一些实施例中,缓冲剂在水性测定样品中为约10mm至约100mm。在一些实施例中,缓冲剂在水性测定样品中为约20mm至约80mm。在一些实施例中,缓冲剂在水性测定样品中为约30mm至约70mm。在一些实施例中,缓冲剂在水性测定样品中为约40mm至约60mm。在一些实施例中,缓冲剂在水性测定样品中为约10mm、约12mm、约15mm、约18mm、约20mm、约22mm、约25mm、约28mm、约30mm、约32mm、约35mm、约38mm、约40mm、约42mm、约45mm、约48mm、约50mm、约52mm、约55mm、约58mm、约60mm、约62mm、约65mm、约68mm、约70mm、约72mm、约75mm、约78mm、约80mm、约82mm、约85mm、约88mm、约90mm、约92mm、约95mm、约98mm或约100mm。在一些实施例中,缓冲剂是bis-tris。在一些实施例中,缓冲剂是tris。
[0083]
在一些实施例中,缓冲剂在最终组合物(水性测定样品和有机溶剂)中为约5mm至约200mm。在一些实施例中,缓冲剂在最终组合物(水性测定样品和有机溶剂)中为约10mm to about 100mm。在一些实施例中,缓冲剂在最终组合物中为约20mm至约80mm。在一些实施例中,缓冲剂在最终组合物中为约30mm至约70mm。在一些实施例中,缓冲剂在最终组合物中为约40mm至约60mm。在一些实施例中,缓冲剂在最终组合物中为约10mm、约12mm、约15mm、约18mm、约20mm、约22mm、约25mm、约28mm、约30mm、约32mm、约35mm、约38mm、约40mm、约42mm、约45mm、约48mm、约50mm、约52mm、约55mm、约58mm、约60mm、约62mm、约65mm、约68mm、约70mm、约72mm、约75mm、约78mm、约80mm、约82mm、约85mm、约88mm、约90mm、约92mm、约95mm、约98mm、或约100mm。
[0084]
在一些实施例中,水性测定样品包含nacl、cacl2和缓冲剂。在一些实施例中,在水性测定样品中,nacl为约10mm至约500mm,cacl2为约0.1mm至约20mm,并且缓冲剂为约5mm至约200mm。在一些实施例中,在水性测定样品中,nacl为约25mm至约400mm,cacl2为约0.2mm至约10mm,并且缓冲剂为约10mm至约100mm。在一些实施例中,在水性测定样品中,nacl为约
50mm至约300mm,cacl2为约0.5mm至约5.0mm,并且缓冲剂为约20mm至约8mm。在一些实施例中,在水性测定样品中,nacl为约75mm至约250mm,cacl2为约0.7至约3.0mm,并且缓冲剂为约30mm至约70mm。在一些实施例中,在水性测定样品中,nacl为约100mm至约200mm,cacl2为约1.0至约2.0mm,并且缓冲剂为约40mm至约60mm。在一些实施例中,在水性测定样品中,nacl为约150mm,cacl2为约0.3mm,并且缓冲剂为约45mm至约55mm。在一些实施例中,缓冲剂是bis-tris。在一些实施例中,缓冲剂是tris。本领域技术人员会认识到,盐和缓冲剂通常存在于蛋白质制剂中,并且因此上述百分比只是作为实例提供。
[0085]
在一些实施例中,调整水性测定样品的ph以最大化4mu的荧光强度。在一些实施例中,调整水性测定样品的ph以稳定水性测定样品和/或有机溶剂的一种或多种组分。在一些实施例中,略带酸性至中性的ph(例如,约5.0至约7.0)最小化水性测定样品中组分的降解。在一些实施例中,略带酸性至中性的ph(例如,约5.0至约7.0)最小化治疗性蛋白质的聚集。在一些实施例中,略带酸性至中性的ph(例如,约5.0至约7.0)最小化4-甲基伞形酮油酸酯(4muo)的自动水解。
[0086]
在一些实施例中,水性测定样品具有酸性ph。在一些实施例中,水性测定样品的ph为5.0至7.0。在一些实施例中,水性测定样品的ph为约5.0、约5.1、约5.2、约5.3、约5.4、约5.5、约5.6、约5.7、约5.8、约5.9、约6.0、约6.1、约6.2、约6.3、约6.4、约6.5、约6.6、约6.7、约6.8、约6.9或约7.0。
[0087]
在一些实施例中,本公开的组合物包含本文所述的水性测定样品,以及有机溶剂。如本文所用,“有机溶剂”是指可用于溶解一种或多种溶质的碳基物质。有机溶剂的实例包含但不限于烃,包含例如脂肪族烃、环状烃、芳香族烃和卤代烃;酮;胺;酯;醇;醛;醚;腈;亚砜等等。在一些实施例中,有机溶剂能够溶解4-甲基伞形酮油酸酯(4muo)。
[0088]
在一些实施例中,有机溶剂包含醇、亚砜、腈或其组合。在一些实施例中,有机溶剂是二甲亚砜(dmso)。在一些实施例中,有机溶剂包含乙腈(acn)。在一些实施例中,有机溶剂包含醇。在一些实施例中,有机溶剂是c
1-c6醇。在一些实施例中,c
1-c6醇是甲醇、乙醇、丙醇、异丙醇、丁醇、仲丁醇、叔丁醇、戊醇或己醇。在一些实施例中,有机溶剂是甲醇、乙醇、丙醇、异丙醇、丁醇、仲丁醇、叔丁醇,或其组合。在一些实施例中,有机溶剂包含乙腈和醇的混合物。在一些实施例中,有机溶剂包含乙腈和异丙醇的混合物。在一些实施例中,乙腈和异丙醇以约5:1、约4:1、约3:1、约2:1或约1:1的比例混合。
[0089]
在一些实施例中,有机溶剂中存在4-甲基伞形酮油酸酯(4muo)。4muo具有以下结构:
[0090][0091]
在一些实施例中,4muo水解形成油酸和4-甲基伞形酮(4mu)(方案i):
[0092][0093]
方案i
[0094]
在一些实施例中,4muo不发荧光。在一些实施例中,4mu发荧光。在一些实施例中,4mu的荧光用于检测4muo被脂肪酶的水解,并且因此是脂肪分解活动的指示物。技术人员将理解,4muo的水解(通过4mu荧光测量)可能表明蛋白质制剂中发生了脂肪分解活动,即表面活性剂可能已经被水解,这可能使蛋白质制剂不稳定。在一些实施例中,4mu的荧光可以在激发波长为约330nm和发射波长为约495nm下测量。在一些实施例中,4mu的荧光可以在激发波长为约327nm和发射波长为约449nm下测量。在一些实施例中,4mu的荧光可以在激发波长为约300nm至约350nm和发射波长为约420nm至约500nm下测量。在一些实施例中,当ph改变时,4mu的荧光测量参数(例如,激发和发射波长)会改变。在一些实施例中,当盐和/或缓冲剂浓度改变时,4mu的荧光测量参数会发生变化。在一些实施例中,4muo是脂肪酶的底物。在一些实施例中,4muo被本文所述的蛋白质制剂中的脂肪酶水解。在一些实施例中,4mu的形成通过荧光测量。在一些实施例中,包含本文所述蛋白质制剂的测定样品的脂肪分解活性通过4mu的荧光来测量。
[0095]
各种浓度的4muo可用于本文所述的组合物和方法。一般来说,应最小化4muo的量以最小化自动水解的影响。在一些实施例中,有机溶剂中的4muo为约1μm至约1mm,或约10μm至约500μm,或约20μm至约200μm,或约50μm至约150μm,或约75μm至约125μm,或约100μm。
[0096]
在一些实施例中,组合物包含含本文所述的蛋白质制剂的水性测定样品;以及包含本文所述的4muo的有机溶剂。在一些实施例中,组合物不包含等体积的水性测定样品和有机溶剂。在一些实施例中,组合物中的有机溶剂的量少于组合物中的水性测定缓冲剂的量,以最小化有机溶剂对蛋白质制剂、特别是治疗性蛋白质的潜在不利影响。例如,如果有机溶剂的量太高,则治疗性蛋白质可能会聚集。在一些实施例中,水性测定样品为约70%至约99.9%,以组合物体积计,并且有机溶剂为约0.1%至约30%,以组合物体积计。在一些实施例中,水性测定样品为约70%至约99.5%,以组合物体积计,并且有机溶剂为约0.5%至约30%,以组合物体积计。在一些实施例中,水性测定样品为约70%至约99%,以组合物体积计,并且有机溶剂为约1%至约30%,以组合物体积计。在一些实施例中,水性测定样品为约75%至约99%,以组合物体积计,并且有机溶剂为约1%至约25%,以组合物体积计。在一些实施例中,水性测定样品为约80%至约98%,以组合物体积计,并且有机溶剂为约2%至
约20%,以组合物体积计。在一些实施例中,水性测定样品为约90%至约98%,以组合物体积计,并且有机溶剂为约2%至约10%,以组合物体积计。在一些实施例中,水性测定样品为约95%至约98%,以组合物体积计,并且有机溶剂为约2%至约5%,以组合物体积计。
[0097]
在一些实施例中,水性测定样品为约80%、约81%、约82%、约83%、约84%、约85%、约86%、约87%、约88%、约89%、约90%、约91%、约92%、约93%、约94%、约95%、约96%、约97%、约98%、约99%、约99.1%、约99.2%、约99.3%、约99.4%、约99.5%、约99.6%、约99.7%、约99.8%或约99.9%,以组合物体积计。在一些实施例中,蛋白质制剂为约70%至约85%,约75%至约85%,或约80%至约85%,以组合物体积计,并且水性测定样品的非蛋白质制剂组分如缓冲剂和/或盐占约15%至约30%,约15%至约25%,约15%至约20%,以组合物体积计。在一些实施例中,有机溶剂为约0.1%、约0.2%、约0.3%、约0.4%、约0.5%、约0.6%、约0.7%、约0.8%、约0.9%、约1%、约2%、约3%、约4%、约5%、约6%、约7%、约8%、约9%、约10%、约11%、约12%、约13%、约14%、约15%、约16%、约17%、约18%、约19%、约20%、约25%、约30%、约35%、约40%、约45%、或约50%,以组合物体积计。本领域技术人员会认识到,盐和缓冲剂通常存在于蛋白质制剂中,并且因此上述百分比仅作为实例使用。
[0098]
在一些实施例中,组合物进一步包含脂肪酶抑制剂。在一些实施例中,脂肪酶抑制剂通过使脂肪酶失活而减少或消灭组合物中的脂肪分解活性。在一些实施例中,将脂肪酶抑制剂包含在组合物中以提供检测脂肪分解活性的阴性对照,即预计包含脂肪酶抑制剂的组合物不会有脂肪分解活性。在一些实施例中,在例如通过测量4mu的荧光来检测脂肪分解活性后,将脂肪酶抑制剂添加至组合物中。在一些实施例中,脂肪酶抑制剂在水性测定样品中。在一些实施例中,脂肪酶抑制剂是水溶性的。在一些实施例中,脂肪酶抑制剂在有机溶剂中。在一些实施例中,脂肪酶抑制剂不是水溶性的。
[0099]
在一些实施例中,脂肪酶抑制剂的浓度足以减少或消灭组合物中的脂肪分解活性。在一些实施例中,脂肪酶抑制剂的浓度足以使组合物中的脂肪分解活性降低约50%、约60%、约70%、约80%、约90%、约95%、约99%或约100%。在一些实施例中,脂肪酶抑制剂在组合物中为约1μm至约50μm。在一些实施例中,脂肪酶抑制剂在组合物中为约2μm至约40μm。在一些实施例中,脂肪酶抑制剂在组合物中为约3μm至约35μm。在一些实施例中,脂肪酶抑制剂在组合物中为约4μm至约30μm。在一些实施例中,脂肪酶抑制剂在组合物中为约5μm至约25μm。在一些实施例中,脂肪酶抑制剂在组合物中为约1μm、约2μm、约3μm、约4μm、约5μm、约6μm、约7μm、约8μm、约9μm、约10μm、约11μm、约12μm、约13μm、约14μm、约15μm、约16μm、约17μm、约17μm、约18μm、约19μm、约20μm、约21μm、约22μm、约23μm、约24μm、约25μm、约30μm、约35μm、约40μm、约45μm、或约50μm。
[0100]
在一些实施例中,脂肪酶抑制剂是(s)-2-甲酰氨基-4-甲基-戊酸(s)-1-[[(2s,3s)-3-己基-4-氧代-2-氧杂环丁烷基]甲基]-十二烷基酯(奥利司他)。在一些实施例中,脂肪酶抑制剂是生物碱,例如,咖啡因、茶碱和可可碱。在一些实施例中,脂肪酶抑制剂是类胡萝卜素,如例如,岩藻黄质。在一些实施例中,脂肪酶抑制剂是糖苷,例如,类叶升麻苷、山柰酚-3-o-rutinoside、芦丁、山柰酚、槲皮素和木樨草素。在一些实施例中,脂肪酶抑制剂是多酚,例如,高良姜素、橙皮苷、licohalcone a、ct-ii、7-phloroeckol和异甘草素。在一些实施例中,脂肪酶抑制剂是皂苷,例如,sessiloside和chiianoside。在一些实施例中,脂肪
酶抑制剂是萜烯,例如,西红花苷和番红花酸。在一些实施例中,脂肪酶抑制剂源自细菌,例如,利普司他汀、缬基内酯、percyquinnin、panclicin、厄比内酯、韧革菌素和抑酯酶素。在一些实施例中,脂肪酶抑制剂是合成的脂肪酶抑制剂,例如,天然脂肪的合成类似物。脂肪酶抑制剂综述于lunagariya等人,《excli杂志(exclij)》13:897-921(2014)。
[0101]
在一些实施例中,公开提供了一种组合物,其包含:(a)约90%至约99.9%(vol/vol)的水性测定样品,所述水性测定样品包含(i)包含蛋白质和脂质的纯化蛋白质制剂;(ii)缓冲剂;(iii)约1.0mm至约2.0mm氯化钙;和(iv)约100mm至约200mm氯化钠;和(b)约10%至约0.1%(vol/vol)的有机溶剂,该有机溶剂选自甲醇、乙醇、丙醇、异丙醇、丁醇、仲丁醇、异丁醇、叔丁醇、二甲亚砜(dmso)、乙腈或其组合,进一步包含4-甲基伞形酮油酸酯(4muo);其中水样测定样品的ph为5.0至7.0。
[0102]
在一些实施例中,公开提供了一种组合物,其包含:(a)约90%至约99.9%(vol/vol)的水性测定样品,所述水性测定样品包含(i)包含蛋白质和聚山梨酯表面活性剂的纯化蛋白质制剂;(ii)缓冲剂;(iii)约1.0mm至约2.0mm氯化钙;和(iv)约100mm至约200mm氯化钠;和(b)约10%至约0.1%(vol/vol)的有机溶剂,该有机溶剂选自甲醇、乙醇、丙醇、异丙醇、丁醇、仲丁醇、异丁醇、叔丁醇、二甲亚砜(dmso)、乙腈或其组合,进一步包含4-甲基伞形酮油酸酯(4muo);其中水样测定样品的ph为5.0至7.0。
[0103]
在一些实施例中,公开提供了一种组合物,其包含:(a)约90%至约99.9%(vol/vol)的水性测定样品,所述水性测定样品包含(i)包含蛋白质和脂质的部分纯化蛋白质制剂;(ii)缓冲剂;(iii)约1.0mm至约2.0mm氯化钙;和(iv)约100mm至约200mm氯化钠;和(b)约10%至约0.1%(vol/vol)的有机溶剂,该有机溶剂选自甲醇、乙醇、丙醇、异丙醇、丁醇、仲丁醇、异丁醇、叔丁醇、二甲亚砜(dmso)、乙腈或其组合,进一步包含4-甲基伞形酮油酸酯(4muo);其中水样测定样品的ph为5.0至7.0。
[0104]
在一些实施例中,公开提供了一种组合物,其包含:(a)约90%至约99.9%(vol/vol)的水性测定样品,所述水性测定样品包含(i)包含蛋白质和脂质的细胞培养上清液;(ii)缓冲剂;(iii)约1.0mm至约2.0mm氯化钙;和(iv)约100mm至约200mm氯化钠;和(b)约10%至约0.1%(vol/vol)的有机溶剂,该有机溶剂选自甲醇、乙醇、丙醇、异丙醇、丁醇、仲丁醇、异丁醇、叔丁醇、二甲亚砜(dmso)、乙腈或其组合,进一步包含4-甲基伞形酮油酸酯(4muo);其中水样测定样品的ph为5.0至7.0。
[0105]
在另外的实施例中,本文提供的组合物适合用于检测蛋白质制剂中脂肪分解活性的方法。在一些实施例中,本公开进一步提供了检测水性测定样品中脂肪分解活性的方法。
[0106]
在一些实施例中,本公开提供了一种检测水性测定样品中脂肪分解活性的方法,该方法包括(a)将包含蛋白质制剂的水性测定样品与包含4-甲基伞形酮油酸酯(4muo)的有机溶剂组合;和(b)通过荧光测量油酸酯和4-甲基伞形酮(4mu)的形成。
[0107]
在一些实施例中,水性测定样品是本文所述的水性测定样品。在一些实施例中,水性测定样品的ph为5.0至7.0。
[0108]
在一些实施例中,水性测定样品进一步包含缓冲剂、盐或两者,如本文所述。本文还提供了适合本方法的缓冲剂和盐及其浓度的实例。在一些实施例中,盐是氯化钠(nacl)、氯化钙(cacl2)或其组合。在一些实施例中,盐是氯化钠和氯化钙。在一些实施例中,氯化钠在水性测定样品中为约50mm至约400mm。在一些实施例中,氯化钠在水性测定样品中为约
100mm至约200mm。在一些实施例中,氯化钠在水性测定样品中为约0.2mm至约10mm。在一些实施例中,氯化钠在水性测定样品中为约1.0mm至约2.0mm。
[0109]
在一些实施例中,缓冲剂在约ph 6.0时具有缓冲能力。在一些实施例中,缓冲剂是tris。在一些实施例中,缓冲剂是bis-tris。在一些实施例中,缓冲剂在水性测定样品中为约2mm至约200mm。在一些实施例中,缓冲剂在水性测定样品中为约10mm至约100mm。在一些实施例中,缓冲剂在水性测定样品中为约40mm至约60mm。在一些实施例中,缓冲剂在水性测定样品中为约45mm至约55mm。
[0110]
在一些实施例中,蛋白质制剂是本文所述的蛋白质制剂。在一些实施例中,蛋白质制剂是细胞培养上清液。在一些实施例中,蛋白质制剂是部分纯化的蛋白质制剂。在一些实施例中,蛋白质制剂是纯化的蛋白质制剂。本文描述了纯化到各种程度的蛋白质制剂,例如细胞培养上清液、部分纯化的蛋白质制剂和纯化的蛋白质制剂。在一些实施例中,蛋白质制剂包含治疗性蛋白质,例如本文所述的治疗性蛋白质。本公开的方法有利地允许在其整个纯化过程中简单和有效地确定蛋白质制剂中的脂肪分解活性。例如,可以用本方法测量细胞培养上清液(或后续纯化过程产品)的脂肪分解活性以确定是否有必要在后续纯化步骤期间去除脂肪酶。有利地,本方法可以在整个纯化过程中在产品上使用以确定蛋白质制剂中的脂肪分解活性是否已被适当消灭。
[0111]
在一些实施例中,蛋白质制剂包含额外的宿主细胞蛋白质。在一些实施例中,额外的宿主细胞蛋白质包含脂肪酶。脂肪酶描述于本文。
[0112]
在一些实施例中,蛋白质制剂包含表面活性剂,例如,本文所述的表面活性剂。在一些实施例中,表面活性剂是聚山梨酯。在一些实施例中,聚山梨酯是聚山梨酯20、聚山梨酯80,或其组合。
[0113]
在一些实施例中,有机溶剂是本文所述的有机溶剂。在一些实施例中,有机溶剂是醇、亚砜、腈或其组合。在一些实施例中,有机溶剂是二甲亚砜(dmso)。在一些实施例中,有机溶剂包含乙腈。在一些实施例中,有机溶剂包含醇。在一些实施例中,有机溶剂是c
1-c6醇。在一些实施例中,有机溶剂是甲醇、乙醇、丙醇、异丙醇、丁醇、仲丁醇、叔丁醇,或其组合。在一些实施例中,有机溶剂包含乙腈和异丙醇的混合物。在一些实施例中,乙腈和异丙醇以大约3:1的比例混合。
[0114]
在一些实施例中,有机溶剂包含4-甲基伞形酮油酸酯(4muo)。本文提供了4muo的结构。在一些实施例中,4muo水解形成油酸和4-甲基伞形酮(4mu),如例如方案i中所述。本文提供了4mu的结构。在一些实施例中,4mu发荧光。在一些实施例中,4mu的荧光在大约330nm的激发和495nm的发射下测量。
[0115]
在一些实施例中,该方法包括测量荧光持续直至24小时。在一些实施例中,测量荧光持续约24小时至约400小时。在一些实施例中,测量荧光持续大于约24小时。在一些实施例中,测量荧光持续大于约100小时。在一些实施例中,测量荧光持续大于约300小时。应该理解的是,荧光测量不一定是连续的测量,并且可以在预定的时间点测量荧光。在一些实施例中,荧光在约12小时至约400小时的选定时间点测量。在一些实施例中,荧光在约24小时、约48小时、约72小时、约96小时、约120小时、约144小时、约168小时、约192小时、约216小时、约240小时、约264小时、约288小时、约312小时、约336小时、约360小时、约384小时或约400小时的时间点测量。测量荧光的时间段可以根据蛋白质制剂中的脂肪酶活性水平来选择。
例如,由于4muo的水解较慢,低水平的脂肪分解活性可能需要更长的检测时段。
[0116]
在一些实施例中,将包含治疗性蛋白质的蛋白质制剂纯化,然后储存一段时间(例如,少于4小时、少于8小时、少于1天、约1天、约2天、约3天、约4天、约5天、约6天、约1周、大于1周、约2周、大于2周、约3周、大于3周、约1个月、大于1个月、约2个月、大于2个月、约3个月或大于3个月)。然后使蛋白质制剂经历本方法,以检测脂肪分解活性。
[0117]
在一些实施例中,水性测定样品和有机溶剂以约70:30至约99:1的比例组合。在一些实施例中,水性测定样品和有机溶剂以约75:25至约99:1的比例组合。在一些实施例中,水性测定样品和有机溶剂以约80:20至约98:2的比例组合。在一些实施例中,水性测定样品和有机溶剂以约85:15至约98:2的比例组合。在一些实施例中,水性测定样品和有机溶剂以约90:10至约98:2的比例组合。在一些实施例中,水性测定样品和有机溶剂以约95:5至约98:2的比例组合。
[0118]
在一些实施例中,在步骤(a)将包含蛋白质制剂的水性测定样品与有机溶剂组合之前,将水性测定样品与脂肪酶抑制剂一起温育约10分钟至约1小时。在一些实施例中,在步骤(a)之前,将水性测定样品与脂肪酶抑制剂一起温育约15分钟至约45分钟,约20分钟至约40分钟,或约30分钟。在一些实施例中,将水性测定样品与脂肪酶抑制剂一起温育减少或消灭了脂肪分解活性。在一些实施例中,将水性测定样品与脂肪酶抑制剂一起温育为检测脂肪分解活性提供了阴性对照。在于步骤(a)之前将水性测定样品与脂肪酶抑制剂一起温育的实施例中,预计所测量的荧光会低,即表明脂肪分解活性低或缺乏。脂肪酶抑制剂描述于本文。在一些实施例中,脂肪酶抑制剂是(s)-2-甲酰氨基-4-甲基-戊酸(s)-1-[[(2s,3s)-3-己基-4-氧代-2-氧杂环丁烷基]甲基]-十二烷基酯(奥利司他)。在一些实施例中,脂肪酶抑制剂在组合物中为约1μm至约50μm。在一些实施例中,脂肪酶抑制剂在组合物中为约5μm至约25μm。
[0119]
在一些实施例中,对照样品与水性测定样品平行测量脂肪分解活性。在一些实施例中,本公开提供了一种检测水性测定样品中脂肪分解活性的方法,该方法包括(a)将包含蛋白质制剂的水性测定样品与包含4-甲基伞形酮油酸酯(4muo)的有机溶剂组合以形成测定组合物;(b)将包含蛋白质制剂和脂肪酶抑制剂的对照样品与包含4-甲基伞形酮油酸酯(4muo)的有机溶剂组合以形成对照组合物;以及(c)通过荧光测量测定组合物和对照组合物中油酸酯和4-甲基伞形酮(4mu)的形成。在一些实施例中,(a)的蛋白质制剂和(b)的蛋白质制剂由同一蛋白质制剂提供。例如,蛋白质制剂可以从中取出两个等分试样的细胞培养物。一个等分试样可以是水性测定样品的蛋白质制剂,并且另一个等分试样可以是对照样品的蛋白质制剂。在一些实施例中,(a)的蛋白质制剂和(b)的蛋白质制剂包含基本相同的组分。在一些实施例中,预计(a)的蛋白质制剂和(b)的蛋白质制剂具有相同的脂肪分解活性水平。在一些实施例中,除了对照样品中的脂肪酶抑制剂外,水性测定样品和对照样品具有基本相同的组分。在一些实施例中,包含脂肪酶抑制剂的对照样品是阴性对照样品,即预计不会检测到荧光。在一些实施例中,该方法进一步利用阳性对照样品,即其中预计有荧光。在一些实施例中,阳性对照样品包含已知数量的4mu。在一些实施例中,阳性对照样品包含已知数量的4muo和已知数量的活性脂肪酶。
[0120]
正如本文所讨论的,具有脂肪分解活性的脂肪酶可以干扰蛋白质制剂的组分。在一些实施例中,具有脂肪分解活性的脂肪酶水解存在于蛋白质制剂中的脂肪酸和/或酯。在
一些实施例中,具有脂肪分解活性的脂肪酶水解存在于蛋白质制剂中的表面活性剂。在一些实施例中,表面活性剂的水解降低蛋白质制剂的稳定性。通过使用本文提供的方法测量脂肪分解活性的量,然后可以根据测量的脂肪分解活性的量确定蛋白质制剂中已经发生的水解水平,从而确定蛋白质制剂的稳定性。在一些实施例中,本公开提供了一种确定蛋白质制剂稳定性的方法,其包括(a)将包含蛋白质制剂的水性测定样品与包含4-甲基伞形酮油酸酯(4muo)的有机溶剂组合;(b)通过荧光测量油酸酯和4-甲基伞形酮(4mu)的形成;以及(c)根据测量的荧光来确定蛋白质制剂的稳定性。例如,相对于对照而言,荧光的增加将表明脂肪酶的存在,表明赋形剂,例如表面活性剂,如聚山梨酯,已经被水解,从而形成非极性的并且因此不溶性的长链脂肪酸,其可能使蛋白质制剂中的蛋白质不稳定。在一些实施例中,方法用来确定用于药物调配物的蛋白质制剂的稳定性。
[0121]
在一些实施例中,本公开提供了适合于提供本发明的组合物的试剂盒。在一些实施例中,本公开提供了一种可用于完成本发明的方法的试剂盒。例如,在一些实施例中,本公开进一步提供了一种试剂盒,其包含在两个或更多的容器中的:(a)有机溶剂;(b)4-甲基伞形酮油酸酯(4muo);和(c)脂肪酶抑制剂。
[0122]
任何合适的容器都可以用在本文所述的试剂盒中。在一些实施例中,容器是小瓶。在一些实施例中,容器是瓶子。在一些实施例中,每个容器是多隔室容器的隔室。在一些实施例中,有机溶剂和4muo在第一个容器中,并且脂肪酶抑制剂在第二个容器中。在一些实施例中,有机溶剂和脂肪酶抑制剂在第一个容器中,并且4muo在第二个容器中。在一些实施例中,脂肪酶抑制剂和4muo在第一个容器中,并且有机溶剂在第二个容器中。在一些实施例中,脂肪酶抑制剂和有机溶剂在第一个容器中,并且4muo和有机溶剂在第二个容器中。在一些实施例中,4muo作为固体提供,例如,粉末。在一些实施例中,4muo提供在溶液中,例如,在有机溶剂中。在一些实施例中,脂肪酶抑制剂作为固体提供,例如,粉末,如冻干粉。在一些实施例中,脂肪酶抑制剂提供在溶液中,例如,在有机溶剂中。在上述任一实施例中,(a)有机溶剂;(b)4-甲基伞形酮油酸酯(4muo);和/或(c)脂肪酶抑制剂可以包括在它们各自的容器中,以接收预定的特定数量的蛋白质制剂,其中每个组分的数量足以实践本文所述的确定脂肪分解活性的方法。在一些实施例中,试剂盒进一步包含如本文所述的方法中的利用该试剂盒确定脂肪分解活性的说明。
[0123]
在一些实施例中,试剂盒进一步包含缓冲剂、盐或两者。合适的缓冲剂和盐描述于本文。在一些实施例中,试剂盒的用户提供了与试剂盒一起使用的蛋白质制剂。在一些实施例中,用户的蛋白质制剂是在不适合与试剂盒一起使用的缓冲剂中,例如,促进4muo的自动水解和/或脂肪酶抑制剂降解的缓冲剂。在一些实施例中,试剂盒提供了缓冲剂交换柱。在一些实施例中,缓冲剂交换柱将用户的蛋白质制剂的缓冲剂交换成适合用于本文提供的试剂盒的缓冲剂。缓冲剂交换柱的实例包括但不限于来自thermo fisher的zeba柱,来自ge healthcare的pd-10、sephadex、hiprep和hitrap柱,来自sartorius的vivaflow和vivaspin浓缩器,来自bio-rad的bio-spin和econo柱,以及来自g-biosciences的spinout柱。
[0124]
本文所述试剂盒的柱可以用来交换缓冲剂体系。用于此目的的柱是技术人员已知的。例如,柱可用于将蛋白质制剂中的缓冲剂交换为更适合于实施本文所述的确定脂肪分解活性的方法的缓冲剂。
[0125]
在一些实施例中,本公开提供了一种试剂盒,其包含:(a)包含4-甲基伞形酮油酸
酯(4muo)的有机溶剂;(b)适合交换蛋白质制剂缓冲剂的柱;以及(c)脂肪酶抑制剂。
[0126]
适用于本公开的试剂盒的有机溶剂包括本文所述的有机溶剂。在一些实施例中,有机溶剂是醇、亚砜、腈或其组合。在一些实施例中,有机溶剂是二甲亚砜(dmso)。在一些实施例中,有机溶剂包含乙腈。在一些实施例中,有机溶剂包含醇。在一些实施例中,有机溶剂是c
1-c6醇。在一些实施例中,有机溶剂是甲醇、乙醇、丙醇、异丙醇、丁醇、仲丁醇、异丁醇、叔丁醇,或其组合。在一些实施例中,有机溶剂包含乙腈和异丙醇的混合物。
[0127]
适用于本公开的试剂盒的脂肪酶抑制剂包含本文所述的脂肪酶抑制剂。在一些实施例中,脂肪酶抑制剂是(s)-2-甲酰氨基-4-甲基-戊酸(s)-1-[[(2s,3s)-3-己基-4-氧代-2-氧杂环丁烷基]甲基]-十二烷基酯(奥利司他)。在一些实施例中,在实践本文所述的确定脂肪分解活性的方法时,将脂肪酶抑制剂用作对照。
[0128]
适用于本公开的试剂盒的盐包括本文所述的盐。在一些实施例中,盐是氯化钠、氯化钙或其组合。在一些实施例中,盐是氯化钠和氯化钙。
[0129]
适用于本公开的试剂盒的缓冲剂包含本文所述的缓冲剂。在一些实施例中,缓冲剂是tris。在一些实施例中,缓冲剂是bis-tris。
[0130]
在一些实施例中,试剂盒进一步包含进行测定以确定脂肪分解活性的说明。在一些实施例中,测定包括本文所述的方法。
[0131]
本文引用的所有参考文献,包括专利、专利申请、论文、教科书等,以及其中引用的参考文献,在它们尚未被并入的范围内,通过引用以其整体并入本文。
[0132]
实例
[0133]
本文所述实验的化学品和试剂如下。
[0134]
2-丙醇(ipa,99.9%)、乙腈(acn,hplc plus,≥99.9%)、氯化钙(≥97%)、triton x-100(实验室级)、一水磷酸二氢钠(acs试剂,≥95%)、二甲亚砜(dmso,reagent plus,≥99.5%)获自sigma-aldrich(现在是merck kgaa)。4-甲基伞形酮(4mu,≥98%)和n-苯基-1-萘胺(npn,试剂级,98%)获自aldrich。氯化钠(bioreagent,≥99%),盐酸盐(试剂级,99.0%),碱(一级标准品和缓冲剂,≥99.9%),猪胰腺脂肪酶(ppl,ii型,100-500u/mg),bis-tris盐酸盐(≥99.0%(滴定)),4-甲基伞形酮油酸酯(4muo,适合荧光,≥95%(hpce))和p 188(适合细胞培养)获自sigma。乙腈(lc-ms级)获自thermo fisher。乙醇(etoh,液相色谱的梯度级)和25%v/v的盐酸获自merck。蔗糖(usp/nf,ep,jp,高纯度)获自pfanstiehl。氢氧化钠1m溶液获自honeywell flukatm。氯化钠(usp,multi compendial)、l-组氨酸(usp,multi compendial)、l-组氨酸单盐酸盐(fcc,multi compendial)、ps20(nf)和ps80(nf)获自j.t.baker。高度纯化的水,在下文中称为“水”,通过使用水纯化系统(barnsteadtm genpuretm pro,thermo fisher)制备。ph使用ph计(780ph计,metrohm)和pt ph电极(unitrode pt1000,metrohm)测量。由表达非治疗性单克隆抗体(mab 1)的专有cho细胞系产生的含有脂肪酶混合物作为hcp一部分的细胞培养收获液(cchf)以及mab 1获自lonza biologics,slough,uk。
[0135]
实例1a.脂肪酶测定开发i:ph
[0136]
根据kurihara等人,《生物与制药公报(biol pharm bull 26383-385(2003)中描述的方法利用4-甲基伞形酮油酸酯(4muo)作为脂肪酶的底物开发脂肪酶测定。
[0137]
猪胰腺脂肪酶(ppl)用于测定开发。在这个实验中,将500nm ppl和4muo在四个不
同的缓冲剂体系中的一个中温育22小时,并测试4muo的荧光淬灭和自动水解:(a)10.4mm tris ph 8.1,(b)10.4mm bis-tris ph 6,(c)41.6mm bis-tris ph 6,(d)104mm bis-tris ph 6。
[0138]
图1a-1b和表1的结果显示与ph 8相比,4muo在ph 6下的自动水解减少。图1c显示,ph 8时的自动水解率几乎是ph 6时的两倍。与ph 6相比,脂肪酶在ph 8中的活性略高(《20%)。缓冲剂浓度似乎对自动水解和脂肪酶活性没有大影响。脂肪分解活性似乎在41.6mm bis-tris缓冲剂中最高。在104mm bis-tris缓冲剂中观察到荧光淬灭。
[0139]
表1
[0140][0141]
进一步研究了4muo的自动水解。4mu的pka约为7.7。图1d显示了测量4mu的ph范围(图表转载自zhi等人,《光谱学杂志(j spectrosc)》1(2013)doi:10.1155/2013/147128)。图1e显示了4mu在各种ph范围内的四种形式(转载自zhi等人,2013)。形式ii是普遍并且,并且在λ
ex
为320nm和λ
em
为445nm处显示其激发和发射。
[0142]
实例1b.脂肪酶测定开发i:ph
[0143]
进行进一步研究以评估各种缓冲剂和脂肪酶测定缓冲剂的ph。应用以下体积比(均为v/v):样品(75%),高浓度基质缓冲剂(hcmb)(20%),有机溶剂(5%)。混合物在约24小时至约300小时的时间框架内温育。将测定组分转移到96孔板中,并分析荧光强度。对于4mu校准曲线,参考标准品4mu以在有机溶剂中的浓度为0μm、0.2μm、1μm、2μm、5μm、10μm、20μm、50μm和100μm制备,并以5%(v/v)掺入其他测定组分中至最终浓度为0μm、0.1μm、0.05μm、0.1μm、0.25μm、0.5μm、1μm、2.5μm和5μm。可以看出,校准曲线的斜率从低校准范围(0.01-0.5μm)向高校准范围(直至5μm)轻微移动。因此,4mu在直至0.5μm的浓度范围内的定量结果用0.01-0.5μm的简化校准曲线计算。图19a和19b中显示了4mu校准曲线。
[0144]
在这项研究中,“样品”是安慰剂调配物缓冲基,其包含20mm l-组氨酸,ph 6(通过添加25%(w/v)hcl或1m naoh进行ph值调整),250mm蔗糖,0.5%细胞培养收获液(cchf)或约0.0025mg/ml猪胰脂肪酶(ppl)。hcmb包含ph为7和8的tris(208mm)或ph为6的bis-tris(208mm)(通过添加25%(w/v)hcl或1m naoh进行ph调整),nacl(200mm、600mm或1800mm),cacl2(0.52mm、5.2mm或52mm)。有机溶剂为含有100μm的4muo的甲醇(meoh)、二甲亚砜(dmso)或异丙醇(ipa),并添加5%(v/v)的有机溶剂/底物。将测定组分转移到96孔板中,并分析荧光强度。
[0145]
为了进行荧光分析,将样品转移到96孔微孔板(thermo scientific
tm nunc
tm f96 microwell
tm
黑色聚苯乙烯板)。荧光测量用molecular devices spectramax id3读板仪和smp 7.1软件进行。使用softmax pro 7.1(smp 7.1)波长优化模式对4mu的中间浓度进行优化后,最大激发波长(λ
ex
)和发射波长(λ
em
)分别为330nm和495nm。在大约24小时至大约300小时的温育时间内读取荧光信号,并且通过将200μl液体(包括样品、hcmb和有机溶剂)转移到每个孔中为每次读取准备新的96孔微孔板。荧光测量在环境温度下进行。
[0146]
在ph 6、ph 7或ph 8下对两种不同的缓冲剂(tris或bis-tris)的评价结果显示在图11。通过监测4mu的荧光强度来测量4muo向4mu的转化。评价含有ppl或cchf的样品以及4muo自动水解。观察到ph改变对自动水解(ah)的影响最显著,当将ph从8降到6时,自动水解(ah)下降了约5倍。不同ph的样品中的4mu浓度根据相同ph的参考样品中的4mu的校准曲线测量,即,观察到的趋势不是由于不同ph下4mu荧光的不同反应,而是由于不同的反应速率。当将ph从8降到6时,ppl活性几乎增加了2倍,而cchf脂肪分解活性则不受影响。ppl的ph依赖性先前报道于li等人,“猪胰脂肪酶在棒状sba-15介孔材料上的吸附和催化活性”,《胶体和表面a:物理化学和工程方面(colloids and surfaces a:physicochem eng aspects)》2009;341:79
–
85。然而,对于可能存在于ds池中含有的hcp中的任何其他类型的脂肪酶,这种ph依赖性可能并不相同。还从以下角度来看ph 6被认为是最合适的:其中观察到并报告了聚山梨酯降解的许多治疗性蛋白质调配物通常保持在微酸性的ph,并且因此假设将测定ph调整到~6以涵盖负责引起脂肪酶介导的水解聚山梨酯降解的原因(例如,脂肪酶)。因此,选择浓度为200mm的bis-tris添加到hcmb中,以在ph 6时产生40mm的最终测定浓度。
[0147]
实例2a.脂肪酶测定开发ii:cacl2[0148]
研究脂肪酶测定缓冲剂中的氯化钙浓度。在3个不同的cacl2浓度下进行使用500nm ppl和4muo的脂肪酶测定以研究4muo的荧光淬灭和自动水解:(a)0.104mm cacl2;(b)1.04mm cacl2;和(c)10.4mm cacl2。
[0149]
图2a-2c和表2的结果显示,没有发生4muo自动水解,并且没有观察到氯阴离子导致的荧光淬灭。在1.3mm cacl2中,脂肪酶活性最高。
[0150]
表2
[0151][0152]
实例2b.脂肪酶测定开发ii:cacl2[0153]
在进一步的实验中研究了脂肪酶测定缓冲剂中的氯化钙浓度。样品、hcbm组成和实验程序如实例1b所述,其中cacl2以0.52mm、5.2mm或52mm包含在hcmb中,如实例1b所述。
[0154]
图12显示了用含有ppl或cchf的样品评价在hcmb中不同cacl2浓度的结果。据观察,在cacl2的最高浓度下,ppl的活性略有下降。考虑到hcmb需要为各种药物物质/药物产品基质建立类似的测定条件,选择将5mm cacl2添加到hcmb中以产生1mm cacl2的最终测定浓度。
[0155]
实例3a.脂肪酶测定开发iii:nacl
[0156]
研究脂肪酶测定缓冲剂中的氯化钠浓度。在3个不同的nacl浓度下进行使用500nm ppl和4muo的脂肪酶测定以研究4muo的荧光淬灭和自动水解:(a)40mm nacl;(b)120mm nacl;和(c)360mm nacl。
[0157]
图3a-3c和表3的结果显示,没有发生4muo自动水解并且没有观察到氯阴离子导致的荧光淬灭。在120mm nacl中,脂肪酶活性最高。
[0158]
表3
[0159][0160]
实例3b.脂肪酶测定开发iii:nacl
[0161]
在进一步的实验中研究了脂肪酶测定缓冲剂中的氯化钠浓度。样品、hcbm组成和实验程序如实例1b所述。如实例1b所述,nacl以200mm、600mm或1800mm包含在hcmb中。
[0162]
图13显示了用含有ppl或cchf的样品评价在hcmb中不同nacl浓度的结果。据观察,在nacl的最高浓度下,ppl的活性略有下降。考虑到hcmb需要为各种药物物质/药物产品基质建立类似的测定条件,选择将600mm nacl添加到hcmb中以产生120mm nacl的最终测定浓度。
[0163]
实例4a.脂肪酶测定开发iv:有机溶剂
[0164]
研究脂肪酶测定缓冲剂中的有机溶剂。使用3种不同的有机溶剂进行使用500nm ppl和4muo的脂肪酶测定以研究4muo的荧光淬灭和自动水解:(a)dmso;(b)异丙醇(ipa);和(c)甲醇(meoh)。
[0165]
图4a-4c和表4的结果显示,观察到在三种溶剂中,异丙醇的自动水解最低,但有轻微的荧光淬灭。然而,甲醇有类似的结果。此外,glogauer等人,《微生物细胞工厂(microb cell fact)》10:54(2011)表明甲醇可能具有增强活性的能力。
[0166]
表4
[0167][0168]
实例4b.脂肪酶测定开发iv:有机溶剂
[0169]
在进一步的实验中研究脂肪酶测定缓冲剂中的有机溶剂。样品、hcbm组成和实验程序如实例1b所述。含有100μm 4muo的有机溶剂甲醇(meoh)、二甲亚砜(dmso)或异丙醇(ipa)被包含在实例1b所述的测定反应中。
[0170]
用含有ppl或cchf的样品评价不同有机溶剂的结果显示在图14中。不同于之前glogauer等人,“通过元基因组方法分离的新的真正的脂肪酶的鉴定和表征”《微生物细胞工厂(microb cell fact)》2011;10:54报道的结果,其报道了不同溶剂对通过元基因组方法从大肠杆菌分离的lipc12脂肪酶的强烈影响。在glogauer等人中,meoh以及较低程度的ipa显示出活化作用,将lipc12脂肪酶活性增加大于10倍。然而,所研究的细菌酶可能具有非常不同的特性,例如,如与实例1b中的结果相比活性的最佳ph不同所证明的。基于图14中的结果,选择将meoh添加到hcmb中。
[0171]
实例5a.脂肪酶测定开发v:表面活性剂
[0172]
研究了在存在表面活性剂的情况下脂肪酶测定缓冲剂的性能。使用2种不同浓度的2种表面活性剂进行使用500nm的ppl和4muo的脂肪酶测定以研究4muo的荧光淬灭和自动水解:(a)triton x-100 0.012%w/v,(b)triton x-100 0.06%w/v,(c)kolliphor p188 0.032%w/v,和(d)kolliphor p188 0.16%w/v。还测试了不含表面活性剂的对照。
[0173]
图5a-5c和表5的结果显示,含有表面活性剂的样品具有最低的自动水解,但观察到荧光淬灭。脂肪分解活性似乎也随着表面活性剂的使用而降低。
[0174]
表5
[0175][0176]
实例5b.脂肪酶测定开发v:表面活性剂
[0177]
进行进一步研究以评估表面活性剂对ppl和cchf的脂肪分解活性的影响。评价了表面活性剂聚山梨酯-20(ps20)和聚山梨酯-80(ps80),它们可以在生物制药的药物产品调配物中找到。还测试了泊洛沙姆,因为以前的工作(gupta等人,“简化的脂肪酶和酯酶的棕榈酸对硝基苯酯测定”《分析生物化学(anal biochem)》2002;311:98-99)表明,表面活性剂使难溶的底物如棕榈酸对硝基苯酯溶解。
[0178]
样品含有20mm l-组氨酸,ph 6,250mm蔗糖,表面活性剂(聚山梨酯-20(ps20)、聚山梨酯-80(ps80)或泊洛沙姆,0.02%或0.06%(均为w/v),或作为不含表面活性剂的对照),0.5%cchf或0.0025mg/ml ppl。hcmb含有208mm bis-tris,ph 6,600mm nacl,5.2mm cacl2。将5%(v/v)的含100μm 4meo的有机溶剂meoh添加到测定中。将测定组分转移到96孔板中,并如上面对实例1b所述分析荧光强度。
[0179]
表面活性剂对脂肪分解活性的影响结果显示在图15中。表面活性剂的存在对脂肪分解活性有明显的影响。聚山梨酯极大地减少了4mu的形成,对ppl来说4mu形成降低》90%,并且对cchf来说4mu形成降低~80%,并且与ps20相比,ps80减少4mu的形成略为明显。
[0180]
这些观察有几个可能的原因:(1)由脂肪酸酯组成的聚山梨酯是脂肪酶的竞争性底物/抑制剂,和/或(2)非极性底物4muo被纳入聚山梨酯的胶束结构中,从而降低了在水性介质中的浓度,并因此对酶的速率常数产生了负面影响,这与底物浓度相关(根据例如michaelis-menten动力学的概念)和/或(3)脂肪酶在结构上受到影响,可能导致解折叠,并且从而导致活性下降。
[0181]
有趣的是,聚山梨酯的浓度似乎对cchf的脂肪分解活性有影响,较高的聚山梨酯浓度产生较低的活性,而ppl在两种聚山梨酯的两种不同选择浓度下活性类似。另一方面,泊洛沙姆以非常不同的方式影响了ppl和cchf的脂肪分解活性。与对照相比,ppl的活性降低到约50%,并且如在聚山梨醇中已经看到的那样,所选择的表面活性剂的浓度没有显示出酶活性的明显变化。至少在表面活性剂浓度为0.02%时,cchf的脂肪分解活性受到泊洛沙姆的积极影响,并且在浓度为0.06%时显然不受影响。虽然不受任何特定理论的约束,但在表面活性剂存在下的酶行为以及浓度依赖性的一个原因可能是超过一个原因的组合。例如,脂肪酶的动力学和机理调查是困难的,因为酶催化难溶于水的底物例如甘油三酯和其他脂肪上的反应。在水/脂肪界面,酶通过盖状结构的移动被激活,盖状结构在封闭形式下保护活性部位,而在开放形式下允许底物进入活性部位。参见例如,lowe,“胰腺的甘油三酯脂肪酶”,《脂质综述杂志(j lipid res)》2002;43(12):2007-2016。
[0182]
值得注意的是,聚山梨酯对模型脂肪酶ppl和cchf的脂肪分解活性有负面的影响。
在表面活性剂的存在下,4mu水解产物的荧光强度也受到影响(减少约20%)(参见图15b),这也导致4mu产物信号强度下降,如图15a所示。
[0183]
实例6a.脂肪酶测定开发vi:脂肪酶抑制剂
[0184]
选择脂肪酶抑制剂奥利司他用于脂肪酶测定对照实验,并且因此用不同浓度的抑制剂评价测定性能。奥利司他被开发为基于机制的抑制剂以与胰腺脂肪酶的活性部位丝氨酸共价结合,从而抑制该酶。这种作用方式使它成为一种口服药物,用于治疗肥胖症和基于胃肠道脂肪水解的相关症状。没有系统地研究哪些脂肪酶类别可以被奥利司他抑制的已发表研究。然而,以前曾报道,除了哺乳动物外,细菌脂肪酶,例如来自龟裂链霉菌(streptomyces rimosus)的脂肪酶,可以在毫摩尔奥利司他浓度下被抑制,并且通过活性部位丝氨酸的共价修饰发生抑制。参见例如,hadv
á
ry等人,“脂肪酶抑制剂四氢利泼斯汀与胰脂肪酶推定的活性部位丝氨酸共价结合”《生物化学杂志(j biol chem)》1991;266(4):2021-2027;heck等人,“奥利司他,一种用于管理肥胖症的新脂肪酶抑制剂”《药物治疗(pharmacotherapy)》2000;20(3):270-279;asler等人,“在龟裂链霉菌脂肪酶的催化丝氨酸上共价结合的四氢利泼斯汀的质谱证据”《生物化学与生物物理学(biochim biophys acta)》2007;1770:163
–
170。在以前的此类研究中,需要在最终测定中的50%(v/v)的大体积比有机溶剂来引入这种高浓度的疏水抑制剂。在目前的脂肪酶测定中没有预见到如此高的有机溶剂浓度,因为它可能会损害其他的测定组分,例如药物活性蛋白质的沉淀,所以选择使用较低的溶剂浓度以及较低的抑制剂浓度。这不一定会对测定读数产生负面影响,因为哺乳动物的脂肪酶被发现在更低的,即纳摩尔的奥利司他浓度下被抑制。参见例如,lewis等人,“使用溶解连接体外测定直接测量奥利司他的脂肪酶抑制”《临床药理生物药学(clin pharmacol biopharm)》2012;1(3)。1-3.
[0185]
用3种浓度的奥利司他(脂肪酶抑制剂)对含有500nm ppl的样品进行共同处理和预处理后,测试脂肪酶活性以研究4muo荧光淬灭和自动水解:(a)共同处理25μm奥利司他,(b)共同处理15μm奥利司他,(c)共同处理5μm奥利司他,(d)预处理25μm奥利司他,(e)预处理15μm奥利司他,和(f)预处理5μm奥利司他。还测试了不含奥利司他的对照样品。
[0186]
图6a-6b和表6的结果显示,用25μm的奥利司他预处理(30分钟)完全消灭了脂肪分解活性。在较低的奥利司他浓度下观察到了残留的活性。没有观察到荧光淬灭。
[0187]
表6
[0188][0189]
实例6b.脂肪酶测定开发vi:脂肪酶抑制剂
[0190]
在进一步的实验中评价脂肪酶抑制剂奥利司他的浓度。样品、hcmb组成和实验程序如实例1b所述执行。抑制剂在meoh中制备,浓度为200、600和1000μm。对于预温育实验,将抑制剂溶液以2.5%(v/v)补充到测定中,并进行30分钟的预温育。然后将含有200μm的4muo
的meoh以2.5%(v/v)添加到测定中。对于共同温育实验,以5%(v/v)添加含有100μm 4muo和奥利司他(100μm、300μm和500μm)的meoh。使用0.0335mg/ml的高ppl浓度。
[0191]
测试了三种浓度的奥利司他,即5μm、15μm和25μm(相对于最终测定量),其中“最坏的情况”即0.0335mg/ml ppl的非常高的脂肪酶浓度。在这些浓度下,最终的测定溶液是清澈的,并且没有因为抑制剂的潜在不溶性而显示出浑浊。此外,还研究了当奥利司他与5%(v/v)的meoh中的底物一起直接呈递到测定中,与预先将奥利司他添加到2.5%(v/v)meoh中的含酶样品中,并在添加另一个2.5%(v/v)体积分数的meoh中的底物之前温育30分钟相比时,对脂肪酶活性的影响。
[0192]
脂肪酶抑制剂的评价结果显示在图16中。由于上述高ppl浓度,在没有奥利司他的情况下,4muo在24小时内几乎完全被水解。也可以看出奥利司他抑制ppl,并且抑制作用与奥利司他的浓度相关,即观察到25μm的奥利司他的抑制作用最高。酶与抑制剂的预温育具有有益效果,即与同时添加底物和抑制剂的样品相比,在25μm的最高测试奥利司他浓度时,预处理的样品中的酶活性降低了约50%。因此,选择以高浓度将奥利司他补充到阴性对照中,即25μm,并且阴性对照在添加底物之前将与抑制剂预温育约30分钟。
[0193]
实例7.脂肪酶测定开发vii:脂肪酸产物抑制
[0194]
在脂肪酶测定中使用油酸和月桂酸,在理论上降解的ps20和ps80的2个浓度下测试脂肪酸产物抑制:(a)0.1%和(b)0.001%。在这个实验中,ppl的浓度为800nm。
[0195]
图7a-7d和表7的结果显示,高于8.5μm的月桂酸抑制脂肪酶活性,8.5μm和850μm之间没有大的差别。对于油酸,在780μm时观察到显著的产物抑制。
[0196]
表7
[0197][0198]
实例8.脂肪酶测定开发viii:淬灭作用
[0199]
研究聚山梨酯80的淬灭作用。针对含有800nm ppl且没有ps80的对照测试含有800nm ppl和新鲜ps80的样品。图8的结果显示,ps80降低了每个标准品的rfu值,表明有温和的淬灭作用。
[0200]
实例9.脂肪酶测定评价:cchf
[0201]
为了评价在实例1-8中开发的测定在研究药物物质/药物产品中的脂肪分解活性方面的适用性,在可能导致聚山梨酯降解的脂肪酶浓度下在药物产品中会观察到此类降解的时间框架内例如在1个月内评价该测定。
[0202]
该研究的样品含20mm l-组氨酸,ph 6,250mm蔗糖,0.02%(w/v)的表面活性剂ps20或ps80,以及各种浓度的cchf(0%、0.001%、0.005%、0.01%、0.05%、0.1%、0.5%、1%、2%,均为v/v)。样品在室温和2-8℃下储存1个月。通过如下文所述的hplc-fma和本文的脂肪酶测定对样品进行分析。对于测定阳性对照,样品中补充了0.055mg/ml的ppl。hcmb含有208mm bis-tris,ph 6,600mm nacl,5.2mm cacl2。将含有100μm 4muo的5%(v/v)的有
机溶剂meoh添加到测定中。对于含有奥利司他的阴性对照,在meoh中以1000μm制备抑制剂,并将2.5%(v/v)补充到测定中,并进行30分钟的预温育。然后将含有200μm的4muo的meoh以2.5%(v/v)添加到测定中。将测定组分转移到96孔板中,并如实例1b所述分析荧光强度。
[0203]
完整的ps20和ps80的定量分析使用高效液相色谱(hplc)系统(waters alliance e2695)进行,该系统配有等度泵、自动取样器、紧密的反应器螺旋管(1ml;supelco#57410-u)和荧光检测器(waters 2475flr检测器)。样品被注入含有5μm n-苯基-1-萘胺(npn)、15ppm(w/v)35的溶于150mm nacl、50mm tris、5%(v/v)acn,ph 8的溶液中的流动相中。在λ
ex
=350nm和λ
em
=420nm处测量荧光。empower 3色谱数据系统(cds)用于峰值整合和分析。
[0204]
表9总结了测试的样品:
[0205]
表9
[0206][0207][0208]
hcmb=高浓度基质缓冲剂:208mm bis-tris ph 6,600mm nacl,5.2mm cacl2[0209]
hplc-fma的结果显示在图9a和9b中,并且表明在cchf浓度大于或等于0.10%时观察到聚山梨酯降解。ps20样品更容易降解,在约0.10%的cchf时看到作用。更高的浓度显示了表观聚山梨酯浓度的下降。与2-8℃相比,这一趋势在25℃下更为明显。含ps20的样品显然比含ps80的样品更容易降解,其中只有在0.5%的cchf下才能检测到信号强度下降。在之前描述的表面活性剂评价实验中可以看出,与ps20相比,ps80对含有cchf的样品中的脂肪分解活性的负面作用略有增强,并且因此,作为最坏的情况,使来自hplc-fma测定的含有ps80的样品经历脂肪酶测定。
[0210]
本文开发的脂肪酶测定的理论读数显示在图9c中,实际结果显示在图9d中。实际结果与预期读数相当。含有不同浓度的cchf的样品显示4mu的形成与cchf浓度相关。这一酶活性高于三个阴性对照的酶活性,即自动水解和两个掺有奥利司他的cchf样品。该测定足
够敏感以在hplc-fma方法尚未检测到聚山梨酯降解的浓度下检测脂肪酶活性,即在cchf浓度《0.1%时检测脂肪酶活性。
[0211]
图10a-10h显示了在从0.001%至2%的不同浓度范围的cchf中用ps80进行的其他脂肪酶测定测量。指示浓度的cchf和聚山梨酯在添加4muo和缓冲剂之前。
[0212]
脂肪酶测定结果总结在图18中。掺有ppl的1%cchf样品(测定阳性对照)比未掺有ppl的相同cchf浓度的样品显示出更高的活性。4mu的形成与cchf的浓度相关,并且这种脂肪分解活性高于自动水解和其他掺有奥利司他的阴性对照的脂肪分解活性。最值得注意的是,该测定足够敏感以在其中hplc-fma方法尚未检测到聚山梨酯降解的《0.1%cchf浓度下区分脂肪酶活性和自动水解以及阴性对照,即在0.01%和0.05%的cchf浓度下可以用脂肪酶测定检测到脂肪分解活性。
[0213]
实例10.脂肪酶测定评价:含蛋白质的调配物
[0214]
可能受到脂肪分解活动负面影响的生物制药药物产品调配物含有生物治疗性蛋白质。用含有蛋白质的调配物测试在实例1-8中开发的脂肪酶测定。
[0215]
样品含有20mm l-组氨酸,ph 6,250mm蔗糖,0.02%ps80,10mg/ml mab1(专有的igg 1),0.5%cchf或0.025mg/ml ppl。hcmb由208mm bis-tris,ph 6,600mm nacl,5.2mm cacl2组成。将含有100μm 4muo的5%(v/v)的有机溶剂meoh添加到测定中。对于含有奥利司他的阴性对照,在meoh中以1000μm制备抑制剂,并将2.5%(v/v)补充到测定中,并进行30分钟的预温育。然后将含有200μm的4-muo的meoh以2.5%(v/v)添加到测定中。将测定组分转移到96孔板中,并如实例1b所述分析荧光强度。表10总结了测试的样品:
[0216]
表10
[0217][0218]
不同时间点(1小时、24小时、72小时、168小时和336小时)的测定结果显示在图17a。正如预期的那样,含有cchf和ppl二者的测定阳性对照显示出最高的4mu释放。测定阴性对照显示出强烈的活性减弱,表明ppl和cchf脂肪酶都受到奥利司他的抑制。样品和调配物阳性对照(高活性)可以看到同样的趋势,而样品阴性对照和调配物阴性对照则被奥利司他抑制(低活性)。自动水解对照和调配物阴性对照在所有时间点都显示出类似的在图17a中无法区分的读数。图17b显示了阴性对照的缩放图,表明两个阴性对照中的活性是相似的。
[0219]
与自动水解/调配物阴性对照相比,在测定/样品阴性对照的表观活性中可以观察到偏移。在不含底物的空白样品中观察到同样的偏移(数据未显示),表明含有蛋白质的样品已经具有独立于4mu的荧光反应。在研究脂肪分解活性的时间框架内,即在336小时内,偏移增加,表明在cchf和ppl中最初被抑制的脂肪酶慢慢地被重新激活,尽管在调配物阴性中显然未被重新激活。
[0220]
lookene等人以前报道了奥利司他不仅是一种基于机制的抑制剂,而且是脂蛋白脂肪酶的真正底物,具有快速的抑制作用,即在活性部位丝氨酸形成共价的酶-奥利司他-复合物,以及这种复合物的缓慢水解(参见例如,lookene等人,“脂蛋白脂肪酶与活性部位抑制剂四氢利泼斯汀(奥利司他)r的相互作用”,《欧洲生物化学杂志(eur j biochem.)》1994;222:395-403)。对于本测定及其在评价药物物质/药物产品中的脂肪分解活性方面的
应用,这一点是有意义的:如果作为药物物质/药物产品中hcp残留级分的一部分以及负责降解聚山梨酯的原因(例如脂肪分解酶)可以被奥利司他抑制,则它们可能被重新激活。如果无法区分样品和样品阴性对照之间的脂肪分解活性,则这可能表明或者样品中的脂肪分解活性低,或者存在不能被奥利司他抑制的脂肪分解酶。在第一种情况下,如果4mu的形成与自动水解对照相比没有太大的增加,则这表明脂肪分解活性低,药物物质/药物产品中聚山梨酯降解的风险低。如果在样品中看到与自动水解相比的高4mu形成,则这表明存在脂肪分解酶,但不能被奥利司他抑制。
[0221]
本文引用的所有参考文献,包括专利、专利申请、论文、教科书等,以及其中引用的参考文献,在它们尚未被并入的范围内,通过引用以其整体并入本文。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。