1.本发明属于微生物和生物技术领域。更具体的说,本发明涉及红色糖多孢菌中sace_3478基因扰动对于提升红霉素产量的应用,更具体涉及将红色糖多孢菌中编码长链脂肪酸辅酶a连接酶的sace_3478基因利用基因工程手段进行敲减,可显著提高红霉素的产量的应用。
背景技术:
2.红霉素是由红色糖多胞菌(saccharopolyspora erythraea)产生的大环内酯类抗生素,其抗菌谱广,对于葡萄球菌、肺炎链球菌等革兰氏阳性菌,以及流感嗜血杆菌、痢疾杆菌等革兰氏阴性菌等均有较强的抑制作用,因此具有重要的应用价值。红霉素是我国需求最大的抗生素之一,但生产能力仍显不足,对于红霉素产量提升的工作也一直在进行中。目前,针对红霉素效价提升的工作主要集中在随机诱变获得高产突变株,以及培养基成分改进,发酵过程优化等方面,缺乏基因组水平上的理性设计和基因改造,这一现状极大的制约了红霉素生产菌株的改造和在工业上的应用。
3.红霉素是红色糖多孢菌的次级代谢产物,其生物合成基因簇ery中缺乏途径特异性转录调控因子,这使得无法通过常规的调控因子工程来理性提高红霉素产量。但除了转录调控外,前体供应、副产物竞争、生物合成基因的适配表达等因素也会极大的影响次级代谢产物的产量,因此相关基因和途径也可能成为理性改造菌株的靶点。1分子红霉素的生物合成需要使用初级代谢过程产生的1分子丙酰辅酶a和6分子甲基丙二酰辅酶a小分子前体,前体的供应直接影响了次级代谢产物的产量。通过选择调控细胞内代谢流向不同途径的流动,可以作为理性设计改造菌株提升红霉素产量的重要途径。
4.反义rna抑制策略是近年来常用的下调基因表达水平的方法之一,其原理是通过设计表达一段与靶标基因反向互补的小rna(srna)序列,使其与靶基因的mrna结合,从而使mrna无法与核糖体结合而启动翻译过程,诱导mrna自发降解,以达到敲减靶标基因表达水平的目的。此方法的优点是无需基因敲除就可以对靶标基因的功能进行研究,构建周期更短,对于研究基因敲除导致细胞死亡的必需基因尤其适合,并且基因下调的强度可以通过调整质粒拷贝数和srna前启动子的强度来调节。
技术实现要素:
5.本发明的目的在于克服现有技术的不足,提供一个理性改造红霉素生产菌提升产量的目标改造位点。
6.本发明是通过以下技术方案实现的:步骤一、通过对于红霉素生产的原始菌株和多个高产突变菌株的发酵和基因组序列比对,找到高产菌株共有的突变位点;步骤二、通过反义rna抑制策略构建目标基因敲减菌株以及含有空质粒的对照菌株;
步骤三、对原始菌株、对照菌株、敲减菌株进行24孔板发酵;步骤四、用化学显色法测定各菌株的红霉素效价,并总结目标基因对于红霉素生物合成的影响。
7.优选的是,所述的红色糖多孢菌中sace_3478基因敲减对于提升红霉素产量的应用中,所述步骤一、二、三、四中,红霉素生产的原始菌株及各个突变及改造株的出发菌株均为saccharopolyspora erythraea nrrl23338或者它的突变株。
8.优选的是,所述的红色糖多孢菌中sace_3478基因敲减对于提升红霉素产量的应用中,所述步骤二中,对于目标基因功能验证的方法及构建敲减菌株的方法是反义rna抑制策略。但除此之外,其他可用的基因改造手段,如双交换、crispr介导的基因失活等也同样可以达到此目的。
9.优选的是,所述的红色糖多孢菌中sace_3478基因敲减对于提升红霉素产量的应用中,所述步骤四中,发酵时间为7 d。
10.其中,培养所述菌株的发酵培养基含有淀粉、糊精、黄豆粉、豆饼粉为碳氮源。优选地,发酵培养基的配方是:淀粉20 g/l,糊精20 g/l,豆饼粉15 g/l,硫酸铵4 g/l,碳酸钙6 g/l,豆油5 ml/l。培养所述菌株的种子培养基配方是:葡萄糖10 g/l,蛋白胨4 g/l,酵母提取物4 g/l,硫酸镁0.5 g/l,磷酸二氢钾2 g/l,磷酸氢二钾4 g/l。
11.本发明的优点和有益效果为:在本发明中,鉴定了红霉素生产菌中编码长链脂肪酸辅酶a连接酶的sace_3478基因对于红霉素的生物合成有负向调控作用,说明了脂肪酸合成途径与红霉素生物合成之间存在竞争关系,有利于将此基因及相关途径作为改造靶点,通过对菌株进行理性改造以提升红霉素产量。
附图说明
12.图1为本发明实施例一中红霉素原始菌株s0和6个高产株1-a6,5-a3,1-a2,b4,b5和c2的效价情况;图2为本发明实施例一中细胞中乙酰辅酶a代谢流向示意图;图3为本发明实施例二中靶向sace_3478基因的反义rna抑制质粒pset152-hyg-sace_3478-srna的构建示意图;图4为本发明实施例四中表示红霉素浓度与483 nm下吸光度关系的标准曲线图;图5为本发明实施例四中原始菌株s0,对照菌株s0/pset152-hyg和敲减菌株s0/pset152-hyg-sace_3478-srna的24孔板发酵的效价情况。
具体实施方式
13.为了使本技术领域的人员更好地理解本发明方案,下面结合具体实施例进一步说明本发明的技术方案。
14.实施例一红霉素原始株和高产株的效价比较和基因组序列分析前期从原始菌株saccharopolyspora erythraea s0(其是由nrrl23338继代培养而来)出发,通过随机诱变和筛选获得了6个红霉素高产株1-a6,5-a3,1-a2,b4,b5和c2,其红霉素效价相对s0均有显著提高,提高比例分别为26.9%(p=0.016),27.3%(p=0.042),
38.4%(p=0.00094),68.2%(p=0.00023),62.4%(p=0.00024)和62.6%(p=0.00087)(图1)(具体实验过程参照后面的实施例三和四的操作)。
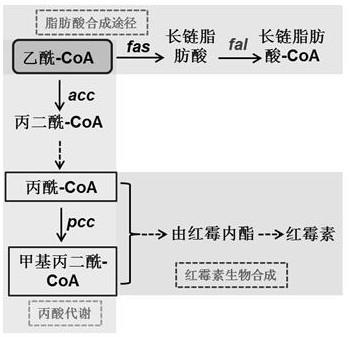
15.以原始菌株s0为参照,对6个高产株进行基因组测序并分析它们相对原始菌株所产生突变位点,发现sace_3478基因(ncbi参考基因组序列:nc_009142.1)的突变同时存在于6个高产突变株中。sace_3478(fal)基因全长564 bp,编码187 aa的长链脂肪酸辅酶a连接酶,其前四分之一处的119 bp至139 bp的21 bp中缺失了4 bp,会造成移码突变,从而使其编码产物丧失功能。通过对于ncbi基因组库的搜索,发现已知的野生型saccharopolyspora erythraea nrrl23338及其衍生的突变株的基因组上均有此基因。因为此突变被多个红霉素高产株共享,且其失活会造成突变株高产红霉素,因此推测此基因所编码的长链脂肪酸辅酶a连接酶对于红霉素的生物合成具有负调控的作用。乙酰辅酶a作为细胞内初级代谢与次级代谢的关键节点,会流入不同的代谢的途径:它既可以通过丙酸代谢途径生成红霉素生物合成所需要的丙酰辅酶a和甲基丙二酰辅酶a前体分子,也可以流入脂肪酸合成途径生成长链脂肪酸coa,再进一步生成磷脂等细胞所需要的脂类分子。长链脂肪酸coa连接酶的失活会造成脂肪酸合成途径中代谢流的减弱,从而使乙酰辅酶a更多的流入丙酸代谢途径来生成红霉素前体,进而提升了红霉素的产量(图2)。
16.实施例二sace_3478反义抑制菌株s0/pset-hyg-sace_3478-srna的构建为了验证sace_3478对于红霉素生产的作用,本发明使用反义rna抑制策略在s0菌株中对此基因的表达进行敲减。以s0菌株基因组为模板,用引物对sace_3478-srna-f和sace_3478-srna-r扩增含有j23119启动子(启动子序列来自文献:liu y, et al, a crispr-cas9 strategy for activating the saccharopolyspora erythraea erythromycin biosynthetic gene cluster with knock-inbidirectional promoters, acs synth. biol. 2019, 8, 1134
−
1143)、sace_3478基因反义序列、上下游发卡结构、fd终止子的srna表达模块片段(srna cassette)。将此片段与pset152-hyg骨架通过体外同源重组相连,得到质粒pset-hyg-sace_3478-srna(图3)。
17.将空质粒pset152-hyg和sace_3478基因反义抑制质粒pset152-hyg-sace_3478-srna质粒分别转化到et12567/puz8002菌株中,再通过种属间接合转移将质粒转化至红色糖多孢菌s0中,得到整合了空质粒的对照菌株s0/pset152-hyg和整合了sace_3478基因反义抑制质粒的敲减菌株s0/pset152-hyg-sace_3478-srna。本发明中使用及构建的菌株如表1所示,构建质粒时所使用的引物如表2所示。
18.表1 本发明中使用及构建的菌株菌株特征s.erythraeas0红霉素生产菌,原始菌株s0/pset152-hyg整合了空质粒pset152-hyg的对照菌株,潮霉素抗性s0/pset152-hyg-sace_3478-srna整合了sace_3478基因反义抑制质粒pset152-hyg-sace_3478-srna的敲减菌株,潮霉素抗性escherichiacoliet12567/puz8002结合转移辅助菌株,携带puz8002质粒,氯霉素、卡纳霉素抗性表2实施例中使用的引物
19.实施例三敲减菌株的24孔板发酵分别刮取原始菌株s0,对照菌株s0/pset152-hyg和敲减菌株s0/pset152-hyg-sace_3478-srna的孢子接3 ml种子培养基中,于32℃,250 rpm下培养3天。然后,取300μl种子液接于3 ml发酵培养基中,继续在32℃,250 rpm下培养7天结束发酵。对于每个菌株,均设置至少3个生物平行样品以保证实验准确。其中,种子培养基的配方为:葡萄糖10 g/l,蛋白胨4 g/l,酵母提取物4 g/l,硫酸镁0.5 g/l,磷酸二氢钾2 g/l,磷酸氢二钾4 g/l。发酵培养基的配方为:淀粉20 g/l,糊精20 g/l,豆饼粉15 g/l,硫酸铵4 g/l,碳酸钙6 g/l,豆油5 ml/l。
20.实施例四化学比色法测定红霉素效价用化学比色法对发酵样品进行效价测定。首先绘制483 nm下的吸光度随不同浓度红霉素标品而变化的标准曲线。具体操作方法为:用甲醇溶解精密称取的红霉素标准品,并用水稀释至不同摩尔浓度,等体积加入8 m的硫酸溶液,在50℃水浴中保温30 min后取出,用酶标仪测量各样品在483 nm下的吸光度值。以吸光度(a
483nm
)为纵坐标,浓度(mg/l)为横坐标,绘制标准曲线,得到的线性方程为:y=0.0012x 0.0656,r2=0.9834(图4)。
21.发酵结束后,对样品进行处理并测定各样品的红霉素效价,具体操作方法如下:静置发酵液使菌丝沉降,取上清液100μl于1.5 ml离心管中,加入400 μl质量浓度为0.35%的碳酸钾溶液,均匀混合后,加入250μl乙酸丁酯震荡萃取,离心后取上层有机相转移到另一干净的1.5 ml离心管中。再向其中加入300 μl0.1 m的盐酸溶液震荡萃取,离心后转移下层150 μl水相于另一干净的1.5 ml离心管中。最后向其中加入等体积的8 m浓硫酸,混匀后在50℃水浴条件下加热30 min,测定其在483 nm下的吸光度。将测定的数值拟合到标准曲线中,计算各样品的效价。
22.三个菌株效价的测定结果表明,原始菌株s0效价为832.7
±
34.4 mg/l,对照菌株s0/pset152-hyg效价为871.0
±
30.3 mg/l,相比原始菌株无显著性差异(p=0.3027),而敲减菌株s0/pset152-hyg-sace_3478-srna效价为1146.5
±
40.2 mg/l,相较对照菌株提升了31.6%,且具有显著性差异(p=0.0015)(图5)。此结果说明,sace_3478基因编码的长链脂肪酸辅酶a连接酶对于红霉素的生物合成具有负向作用,可以作为理性改造红霉素生产菌以提升产量的关键靶点,并且在红色糖多孢菌中通过反义rna抑制的策略敲减sace_3478基因的表达可以有效的提升红霉素的产量。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。