1.本发明涉及比酶活与热稳定性提高的胰蛋白酶突变体,属于基因工程技术领域。
背景技术:
2.胰蛋白酶作为一种多肽水解酶能够专一性地切割肽链中精氨酸或赖氨酸的羧基端,是工业用蛋白酶的重要组成部分,其消耗量约占工业酶制剂市场的3%。胰蛋白酶在皮革加工、医药领域、食品加工以及农业领域都有广泛的应用前景。
3.胰蛋白酶是皮革加工过程中的重要酶制剂之一,应用于皮革的浸水、脱毛、局部处理与脱灰软化的步骤。而胰蛋白酶特异性分解蛋白质的特性使其具有促进脓液、痰液、血凝块分解溶化的功能,同时血清中含有的胰蛋白酶抑制剂能防止或抑制胰蛋白酶对正常组织造成损伤。此外胰蛋白酶还可以作为工具酶,用于切割基因工程生产的人胰岛素前体,生产具有活性的成熟胰岛素。在食品加工领域胰蛋白酶可用于水解各类动植物蛋白也可以在保健食品以及食品添加剂行业中用于增强乳清蛋白的胶凝性、热稳定性和乳化性等性质。此外胰蛋白酶还是多肽质谱、蛋白组学分析的重要工具酶。
4.异源表达微生物来源的灰色链霉菌胰蛋白酶(sgt)能够避免动物来源胰蛋白酶的免疫原性等问题具有重要的应用价值。与常用的商品化猪源胰蛋白酶和牛源胰蛋白酶相比,sgt具有更显著的切割效率。但是,目前包括sgt在内的各类胰蛋白酶的热稳定性都很差,极易失活,无法应用于高温的生产条件。
5.目前对于sgt异源分泌表达过程中稳定性差的问题,还没有很好的解决方案。如果能够提升sgt在异源表达中的稳定性,将能显著提高该酶的生产应用价值,更有助于工业化生产。
技术实现要素:
6.为解决上述问题,本发明提供了热稳定性提高的胰蛋白酶突变体,以及能够表达所述胰蛋白酶突变体的毕赤酵母工程菌。
7.前期研究工作中,发明人已获得一种高酶活的胰蛋白酶重组毕赤酵母工程菌,该酵母菌表达氨基酸序列如seq id no.1所示的胰蛋白酶(称其为wt1),编码所述胰蛋白酶的核苷酸序列如seq id no.2所示。本发明在亲本氨基酸的基础上对其进行了适当的突变,从而获得了稳定性、酶活提高的突变体,为胰蛋白酶在产业上的应用提供了广阔的前景。
8.本发明提供了胰蛋白酶突变体,所述突变体以氨基酸序列如seq id no.1所示的胰蛋白酶为亲本,分别将其第40位或124位的氨基酸进行突变。
9.在一种实施方式中,编码所述亲本的基因的核苷酸序列如seq id no.2所示。
10.在一种实施方式中,将亲本第40位丝氨酸突变为脯氨酸。
11.在一种实施方式中,将亲本第124位谷氨酰胺突变为脯氨酸。
12.本发明提供了编码所述突变体的基因。
13.本发明提供了携带权利要求3所述基因的载体。
14.在一种实施方式中,所述载体为ppic9k、phil
‑
s1、ppicza、pyam75p6中的任意一种。
15.本发明提供了表达所述突变体,或含有所述基因的微生物细胞。
16.在一种实施方式中,所述微生物细胞包括但不限于毕赤酵母、大肠杆菌、枯草芽孢杆菌。
17.在一种实施方式中,所述微生物细胞为毕赤酵母gs115、km71、km71h和/或x33。
18.本发明提供了一种提高胰蛋白酶热稳定性的方法,所述方法为将胰蛋白酶的第40位氨基酸突变为脯氨酸,或第124位氨基酸突变为脯氨酸。
19.本发明提供了一种提高胰蛋白酶酶活的方法,所述方法为将氨基酸序列如seq id no.1所示的胰蛋白酶的第40位氨基酸突变为脯氨酸,或第124位氨基酸突变为脯氨酸。
20.本发明提供了一种提高胰蛋白酶比活力的方法,所述方法为将氨基酸序列如seq id no.1所示的胰蛋白酶的第40位氨基酸突变为脯氨酸,或第124位氨基酸突变为脯氨酸。
21.本发明提供了所述突变体,或所述基因,或所述载体,或所述宿主细胞在工业、医药、生化、食品领域中的应用。
22.本发明提供了所述突变体,或所述基因,或所述载体,或所述宿主细胞在切割肽链中精氨酸或赖氨酸的羧基端中的应用。
23.本发明的有益效果:
24.本发明在一种高酶活灰色链霉菌(streptomyces griseus)胰蛋白酶基础上,通过定点突变生物技术改造胰蛋白酶分子结构,实际突变验证后最终获得两株热稳定性调高的突变菌株s40p,q124p。两株突变体在热稳定显著提高同时酶的活性不受影响甚至提高了酶活。突变体q124p的50℃水浴30min后的残余酶活提升与比酶活都最显著,分别是43.71%和2453.59u
·
mg
‑1,较对照分别提高了598%和60.58%。突变体s40p的50℃水浴30min后的残余酶活与比酶活分别是43.74%与1506.17
±
38.35u
·
mg
‑1。得到的突变体能够在较高温度下进行工业生产,利于生产工艺的灵活性,具有良好的工业应用前景。
附图说明
25.图1为定点突变改造的胰蛋白酶表达载体构建图;
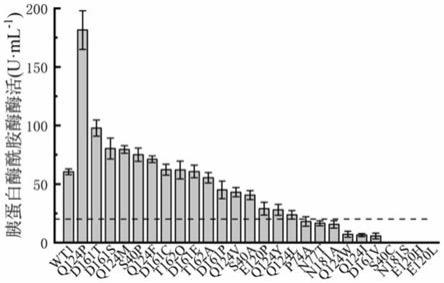
26.图2为胰蛋白酶突变体s40a、s40c、s40p、p74a、n77t、e120h、e120l、e120p、q124f、q124i、q124l、q124m、q124p、q124v、q124y、d161c、d161e、d161p、d161t、d161s、d161v、t162a、t162q、n181a、n181s的摇瓶酶活;
27.图3为突变体s40a、s40c、s40p、e120p、q124f、q124l、q124m、q124p、q124v、q124y、d161c、d161e、d161p、d161t、d161s、t162a、t162q的比酶活与50℃水浴保温30min后残余酶活。
具体实施方式
28.1、胰蛋白酶的纯化
29.1)离心样品后收集上清,用1m naoh调节ph至7.4,以9000
×
g离心15min,弃掉菌体沉淀;12000
×
g离心20min,去除杂质,收集上清;过0.22μm滤膜,将样品放置冰上备用。
30.2)准备上样缓冲液(a液)50mm tris
‑
hcl(ph7.4含0.5mnacl),洗脱缓冲液(b液)
50mm甘氨酸
‑
hcl缓冲液(ph 3.0)。
31.3)纯化流程:用超纯水清洗管道及纯化柱,然后用超纯水洗脱系统,2个柱体积;分别用上样缓冲液、洗脱缓冲液清洗a、b泵,上样缓冲液清洗上样泵,然后用上样缓冲液柱洗系统,2个柱体积;切换至上样泵自动上样,上样结束后用上样缓冲液柱洗,直到uv吸收值降低至初始值后再柱洗一个柱体积,使得胰蛋白酶充分与填料中的benzamidine结合;20%洗脱缓冲液柱洗1个柱体积,40%洗脱缓冲液柱洗1.5个柱体积;60%洗脱缓冲液柱洗1.5个柱体积;80%洗脱缓冲液柱洗1.5个柱体积;100%洗脱缓冲液柱洗2个柱体积。
32.4)收集胰蛋白酶样品,用1mtris缓冲液调收集样品的ph至3.0并进行透析。
33.2、胰蛋白酶酰胺酶酶活测定方法
34.在37℃下,测定100μl粗酶液同900μl bapna(na
‑
苯甲酰
‑
dl
‑
精氨酸
‑
对硝基酰胺盐酸盐)溶液在光径0.5cm的反应池中,在410nm下10min内的吸光值变化,得到a410nm/min。酶活定义为:在37℃下,δa410nm/min升高0.1所需要的酶量为1个酰胺酶水解单位。
35.实施例1:胰蛋白酶突变体的重组载体的构建
36.1)突变体重组质粒的构建
37.以氨基酸序列为seq id no.1所示的胰蛋白酶为亲本,分别将其第40位的s突变为a、c、p,将第74位的p突变为a,将第77位的n突变为t,将第120位的e突变为h、l、p,将第124位的q突变为f、i、l、m、p、v、y,将第161位的d突变为c、e、p、t、s、v、a、q,将第181位的n突变为a、s。
38.①
以将氨基酸序列为seq id no.1所示的胰蛋白酶第40位突变为脯氨酸(s40p)的质粒构建为例,将连接有seq id no.2所示的序列的ppic
‑
9k载体(购自赛默飞世尔科技有限公司)为模板(图1),以s40p
‑
f、s40
‑
r为引物,进行pcr得到编码氨基酸序列第40位丝氨酸突变为脯氨酸的突变体(s40p)的核苷酸序列;
39.②
将上一步得到的含有重组基因的pcr产物用dpn i酶切去除模板,将酶切产物进行纯化,将纯化后的产物化学法转化至jm109感受态细胞,得到转化液;
40.③
将转化液涂布于含100μg/l卡那霉素的lb培养基,在37℃培养至长出单菌落,挑取单菌落至含100μg/l卡那霉素lb液体培养基中,37℃培养8
‑
10h,提取菌液中的质粒,进行测序验证,验证正确的即为构建的重组质粒,并将其命名为ppic9k
‑
exmt s40p。
41.利用表1中的引物及与步骤(1)相同的方法,构建得到突变体s40a、s40c、s40p、p74a、n77t、e120h、e120l、e120p、q124f、q124i、q124l、q124m、q124p、q124v、q124y、d161c、d161e、d161p、d161t、d161s、d161v、t162a、t162q、n181a、n181s的重组质粒,分别命名为ppic9k
‑
exmt s40a、ppic9k
‑
exmts40c、ppic9k
‑
exmts40p、ppic9k
‑
exmtp74a、ppic9k
‑
exmtn77t、ppic9k
‑
exmte120h、ppic9k
‑
exmte120l、ppic9k
‑
exmte120p、ppic9k
‑
exmtq124f、ppic9k
‑
exmtq124i、ppic9k
‑
exmtq124l、ppic9k
‑
exmtq124m、ppic9k
‑
exmtq124p、ppic9k
‑
exmtq124v、ppic9k
‑
exmtq124y、ppic9k
‑
exmtd161c、ppic9k
‑
exmtd161e、ppic9k
‑
exmtd161p、ppic9k
‑
exmtd161t、ppic9k
‑
exmtd161s、ppic9k
‑
exmtd161v、ppic9k
‑
exmtt162a、ppic9k
‑
exmtt162q、ppic9k
‑
exmtn181a、ppic9k
‑
exmtn181s。
42.表1实施例1中所使用的引物
43.[0044][0045]
实施例2:产成熟胰蛋白酶突变体的酵母工程菌构建
[0046]
将实施例1得到的重组质粒ppic9k
‑
exmt s40p用sal i线性化,将线性化片段回收并电击转化pichiapastoris gs115感受态细胞,具体方法如下:
[0047]
1)将在ypd平板活化的pichia pastoris gs115接种至于含ypd培养基的25ml/250ml三角瓶,30℃过夜培养;将过夜培养后的菌液以1ml/100ml的接种量接种至含ypd培养基的50ml/500ml三角瓶,培养菌体浓度od
600
为1.3~1.5;
[0048]
2)5000r/min,4℃离心10min收集菌体,分别用50ml、25ml无菌水悬浮细胞;
[0049]
3)5ml1m山梨醇重悬上述细胞,5000r/min,4℃离心10min收集菌体;
[0050]
4)500μl1m山梨醇重悬上述细胞,分装80μl/1.5ml ep管用于电转化感受态细胞;
[0051]
5)20μl线性化质粒与上述80μl感受态细胞混合,冰上静置15min;
[0052]
6)上述混合物加入预冷的无菌电转化杯(0.2cm),1500v、25μf、200ω电击一次,再向其中加入1ml1m山梨醇;
[0053]
7)取步骤6得到的混合物150μl涂布md平板,30℃培养3天;
[0054]
8)挑取上述平板中白色菌落,验证正确的重组菌:分别点种在1、2、3、4mg/ml(遗传霉素)ypd平板中,挑选在4mg/ml遗传霉素平板中的单菌落用于摇瓶发酵,测胰蛋白酶酶活,挑选酶活最高的重组菌,命名为重组菌gs115
‑
s40p。
[0055]
将实施例1的中构建得到的其他重组质粒以相同的方法转化至pichiapastoris gs115感受态细胞,构建得到含有胰蛋白酶突变体的重组毕赤酵母菌株gs115 s40a、gs115s40c、gs115s40p、gs115p74a、gs115tn77t、gs115te120h、gs115e120l、gs115e120p、gs115q124f、gs115q124i、gs115q124l、gs115q124m、gs115q124p、gs115q124v、gs115q124y、gs115d161c、gs115d161e、gs115d161p、gs115d161t、gs115d161s、gs115d161v、gs115t162a、gs115t162q、gs115n181a、gs115n181s。
[0056]
实施例3:胰蛋白酶突变体的酶活及热稳定性
[0057]
将实施例2构建得到的含有胰蛋白酶突变体的重组毕赤酵母,分别接种至50ml ypd培养基,在30℃下、活化24h,将活化后的菌液在3000g下、离心5min收集菌体,弃去上清液,加入35ml的发酵培养基重悬。
[0058]
发酵培养基(g/l):k2hpo4·
3h2o 1.51;kh2po
4 5.91;生物素0.2;ynb(酵母无氨基酸氮源)13.4;胰蛋白胨10;酵母粉5;生物素4
×
10
‑4;甲醇1ml/100ml。
[0059]
在30℃,220rpm的条件下,每24h补加一次甲醇,使得甲醇在发酵体系中的浓度为1ml/100ml,培养120h,收集发酵液并测定其粗酶活(见图2),选择酶活大于20u
·
ml
‑1的突变体将其进行纯化,得到纯化后的蛋白。分别测定蛋白的酶活,另取一定量的纯酶液于ph 8.0tris
‑
hcl缓冲液50℃水浴热处理,分别在处理前及处理30min后测定剩余酶的酶活,以未经过高温处理的纯酶液的酶活为参比,得到残余酶活百分比,突变体的比酶活与热处理30min后的剩余酶活如图3所示。
[0060]
突变体s40p,q124p在热稳定性显著提高的前提下比酶活同时提高,其催化活性与热稳定性如表2。
[0061]
表2胰蛋白酶突变体热处理后剩余酶活(u/ml)
[0062][0063][0064]
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。