一种广谱性狂犬病病毒样颗粒抗原的设计及其稳定表达细胞株hek-293
技术领域
1.本发明属于疫苗技术领域,具体涉及一种广谱性狂犬病病毒样颗粒(rvlps)抗原的设计 及其稳定表达细胞株hek-293的筛选和鉴定。
背景技术:
2.狂犬病(rabies)是一种古老的且最容易被忽略的人畜共患病,主要由致死性病原体 ——狂犬病病毒(rabies virus,rabv)引发(zhao r q,shan y,li m h,et al.novel strategyfor expression and characterization of rabies virus glycoprotein[j].protein expression andpurification,2020,168:105567.liu,zhao w,he w t,et al.generation of monoclonalantibodies against variable epitopes of the m protein of rabies virus[j].viruses,2019,11(4).)。 犬类是rabv最主要的宿主,超过99%的人类狂犬病是由狗介导的(navid m t,li yy, zhou m,et al.comparison of the immunogenicity of two inactivated recombinant rabiesviruses overexpressing the glycoprotein[j].archives of virology,2016,161(10):2863-2870.), 其唾液中的rabv通过伤口处的皮肤或黏膜经突触扩散到周围神经,并逆行至中枢神经 系统(central nervous system,cns),在大脑中快速复制并导致脑损伤,致亡率几乎 100%(johnsona n,cunningham a f,fooks a r.the immune response to rabies virusinfection and vaccination[j].vaccine,2010,28(23):3896-3901.)。
[0003]
rabv是一种强烈的嗜神经性负链rna病毒,属于弹状病毒科(rhabdoviridae family) rabv属(lyssavirus genus)。rabv的基因组(12kb左右)由不分节段的单股负链rna组 成,依次编码rvnp、rvpp、rvmp、rvgp和rvlp 5种结构蛋白(navid m t,li y y,zhoum,et al.comparison of the immunogenicity of two inactivated recombinant rabies virusesoverexpressing the glycoprotein[j].archives of virology,2016,161(10):2863-2870.)。rvgp 是唯一暴露在rabv表面具有诱导机体产生病毒中和抗体(virus netralizing antibody,vna) 的抗原。rvmp将核糖核蛋白复合物(ribonucleoprotein complexes,rnps)定位于质膜,并 将rvgp结合到出芽的rabv粒子中,参与rabv从出芽、复制以及形成子弹形态的整 个过程(liu,zhao w,he w t,et al.generation of monoclonal antibodies against variableepitopes of the m protein of rabies virus[j].viruses,2019,11(4).)。即使不存在rabv的其 他成分,rvmp也能与rvgp自组装成病毒样颗粒(virus like particle,vlp)结构。
[0004]
虽然狂犬病是疫苗可预防性疾病,但仍造成每年全世界约6万人死亡,其中儿童占 40-50%[5]。由于现有疫苗的免疫效果等方面存在不足,需要多次给药,成本效益有待提 高。
[0005]
vlp是通过病毒的一种或几种结构蛋白自组装形成的不含核酸,与原始病毒形貌和 结构相似的纳米颗粒(nanoparticles,nps)。vlp作为包含病毒关键抗原的多蛋白超分
子结 构,以重复的形式将高密度抗原表位展示在其表面,促进了b淋巴细胞受体(b cell receptor, bcr)的交联,可以诱导强大的b细胞反应(rybicki e p.plant molecular farming ofvirus-like nanoparticles as vaccines and reagents[j].wiley interdisciplinaryreviews-nanomedicine and nanobiotechnology,2020,12(2):e1587.)。此外,vlp的颗粒结 构可以促进抗原递呈细胞(antigen presenting cell,apc)的摄取,刺激先天性和适应性免疫 反应(ludwig c,wagner r.virus-like particles-universal molecular toolboxes[j].currentopinion in biotechnology,2007,18(6):537-545.)。
[0006]
许多研究表明,由酵母,昆虫和植物细胞表达的rvgp作为抗原不能提供足够的保 护(ong h k,tan w s,ho k l.virus like particles as a platform for cancer vaccinedevelopment[j].peerj,2017,5:e4053.zhang y c,zhou m,li y y,et al.recombinant rabiesvirus with the glycoprotein fused with a dc-binding peptide is an efficacious rabiesvaccine[j].oncotarget,2018,9(1):831-841.wang s j,liu h q,zhang x y,et al.intranasaland oral vaccination with protein-based antigens:advantages,challenges and formulationstrategies[j].protein cell,2015,6(7):480-503.brune k d,howarth m.new routes andopportunities for modular construction of particulate vaccines:stick,click,and glue[j]. frontiers in immunology,2018,9:1432.kato t,deo v k,park e y.functional virus-likeparticles production using silkworm and their application in life science[j].journal ofbiotechnology & biomaterials,2012,s9(1):1-7.scotti n,rybicki e p.virus-like particlesproduced in plants as potential vaccines[j].expert review of vaccines,2013,12(2):211-224.), 这显然是由于与真核细胞不同的糖基化结构所致。目前,许多研究致力于通过用病毒载体 感染hek-293细胞来生产含有rvgp的vlp疫苗,这可以保护小鼠免受病毒攻击并实现 大规模生产。但是这类疫苗可能存在具有感染性的载体病毒污染。
技术实现要素:
[0007]
本发明针对上述问题进行,致力于开发一种有足够安全性和广谱性的rvlps,通过 筛选获得稳定细胞株hek-293以期实现rvlps的大规模生产。
[0008]
为了实现上述目的,本发明所采用的技术方案如下:
[0009]
本发明先利用cvs株狂犬病病毒(rabies virus,rabv)的糖蛋白(rabies virusglycoprotein,rvgp)和基质蛋白(rabies virus matrix protein,rvmp)自组装成的rvlps为抗 原,设计一种广谱性狂犬病病毒样颗粒抗原;然后将rvgp、rvmp和egfp共同构建到 真核表达载体pcdna3.1( )中,命名为pcdna3.1( )-rvlps-egfp。每个蛋白都具有独立 的启动子(cmv)、核糖体结合位点(kozak序列)和ploya尾(pa),以保证每个蛋白的表水 平,同时利用egfp实时监测目的蛋白的表达,构建真核重组表达质粒;而后将真核重组 表达质粒转染hek-293细胞,细胞经扩增和传代后,进行筛选和鉴定,筛选得到稳定高 效表达rvlps的阳性单克隆细胞株hek-293/rvlps。获得抗原具有哺乳动物细胞的翻译 后修饰,克服了细菌、酵母、昆虫以及植物细胞来源的rvlps由于糖基化修饰不正确而 表现出低免疫原性,为
rvlps抗原的规模化生产奠定了基础。
[0010]
本发明的第一方面,提供了一种广谱性狂犬病病毒样颗粒抗原,包括cvs株狂犬病病毒糖蛋白rvgp和基质蛋白rvmp。cvs株狂犬病病毒糖蛋白rvgp经密码子优化的多核苷酸序列如seqidno.1所示,基质蛋白rvmp经密码子优化的多核苷酸序列如seqidno.2所示。
[0011]
优选的,cvs株狂犬病病毒糖蛋白rvgp具有4个可能的n-糖基化位点asn56、asn266、asn338和asn484,前3个位于rvgp的胞外域,第4个位于rvgp的胞质尾区;cvs株狂犬病病毒糖蛋白rvgp的胞外域含有b细胞表位、clt细胞表位和th细胞表位,并且asn56和asn266包含于b细胞表位中,asn338包含于ctl细胞表位中。
[0012]
该广谱性狂犬病病毒样颗粒抗原的设计方法,包括如下步骤:
[0013]
(1)利用在线网站ncbi(https://www.ncbi.nlm.nih.gov/)获取csv株rvgp和rvmp的蛋白序列。
[0014]
(2)通过在线软件abcpredpredictionserver(http://crdd.osdd.net/raghava/abcpred/)预测rvgp抗原序列中b细胞表位,帮助定位抗原表位区域,这些区域可用于确定候选疫苗。
[0015]
(3)通过在线软件bioxgem.pacomplex(http://pacomplex.life.nctu.edu.tw./)和syfpeithi(http://www.syfpeithi.de/bin/mhcserver.dll/findyourmotif.htm)预测rvgp中潜在的ctl表位。
[0016]
(4)通过在线软件rankpep(https://omictools.com/rankpep-tool)预测rvgp中潜在的th表位。
[0017]
(5)通过在线软件netnglyc1.0server(http://www.cbs.dtu.dk/services/netnglyc/)预测rvgp中的n-糖基化位点。
[0018]
(6)通过(2)-(4)中的生物信息学软件以及pymol软件分析糖基化位点突变后rvgp的抗原表位和三级结构的改变。
[0019]
(7)从ncbi获取34株从中国不同地区分离的rvgp氨基酸序列,利用dnaman软件对获取的rvgp与csv株rvgp进行序列比对,确定候选rvgp与中国来源的rvgp的序列一致性,进而判定其是否可以作为中国动物用orv的候选抗原。
[0020]
本发明的第二方面,提供了含有上述的广谱性狂犬病病毒样颗粒抗原的真核重组表达质粒。
[0021]
该真核重组表达质粒的构建方法,包括如下步骤:
[0022]
1)以真核质粒pcdna3.1( )为模板,分别扩增启动子(cmv)、sv40pa和绿色荧光蛋白egfp;
[0023]
2)以启动子、sv40pa为模板,重叠延伸pcr扩增目的片段sv40pa-cmv和sv40pa-cmv;
[0024]
3)以sv40pa-cmv和荧光蛋白为模板,重叠延伸pcr扩增目的片段sv40pa-cmv-egfp。
[0025]
优选的,真核重组表达质粒中,rvgp、rvmp以及荧光蛋白都具有独立的启动子(cmv)、核糖体结合位点(kozak序列)和ploya尾(pa)。
[0026]
本发明的第三方面,提供了一种广谱性狂犬病病毒样颗粒抗原的真核表达系统,
该真 核表达系统是hek-293细胞或其他能实现哺乳动物糖翻译后修饰的哺乳动物细胞。
[0027]
稳定表达上述广谱性狂犬病病毒样颗粒抗原的hek-293细胞的筛选和鉴定方法,包 括如下步骤:
[0028]
1)将真核质粒sv40 pa-cmv-egfp转染到hek-293细胞中,并培养该细胞用于稳 定表达rvlps的细胞株筛选;
[0029]
2)转染48h后,通过wb和qpcr检测rvlps的蛋白和mrna水平;
[0030]
3)采用2mg/ml的g418筛选稳定表达广谱性狂犬病病毒样颗粒抗原的hek-293细 胞株,培养和富集后,实现阳性克隆株的扩增和传代;
[0031]
4)将阳性单克隆细胞株消化,用流式检测egfp阳性细胞的比例和平均荧光强度, 并利用wb检测rvlps的表达情况,选择egfp阳性细胞比例大于99%的细胞株作为候 选的稳定细胞株,最优的选择平均荧光强度和rvlps表达量最高的细胞株作为稳定细胞 株,命名为hek-293/rvlps;
[0032]
5)将hek-293/rvlps进行传代培养,消化第10代细胞,一部分接种到共聚焦培养 皿中培养,12h后,用4%多聚甲醛室温固定,随后用hoechest 33342染核10min,pbs 洗净后,利用激光共聚焦显微镜观察egfp阳性细胞比例;一部分细胞用于流式检测egfp 阳性细胞比例;一部分细胞以不同密度接种到24孔板,wb鉴定目的蛋白表达水平;同 时收集hek-293/rvlps细胞,用于细胞超薄切片;收集培养基,提取hek-293/rvlps 细胞总蛋白,进行蔗糖密度梯度离心,实现rvlps的鉴定和纯化。
[0033]
优选的,转染48h后,采用流式细胞仪检测转染效率,然后进行步骤(2),利用wb 和qpcr检测rvlps的蛋白和mrna水平。
[0034]
优选的,转染48h后,可先暂时不进行步骤2),根据根据mtt的结果,选择2mg/ml 的g418进行稳定细胞株的筛选,最优的g418浓度为2.235
±
0.206mg/ml,之后进行步 骤(3)。
[0035]
步骤3)中,进行阳性单克隆细胞株的培养时,每隔2天更换一次含有2mg/ml g418 的新鲜dmem培养基,共14天;进行阳性单克隆细胞株的富集时,胰酶消化细胞,并 稀释至1个/200μl,混匀取200μl加入96孔板中,每隔3天更换一次含1mg/ml的新鲜 dmem培养基,进行阳性单克隆细胞株的富集,共7天。
[0036]
优选的,步骤5)中,进行细胞超博切片检测时,方法如下:
[0037]
①
消化收集得到绿豆大小的细胞沉淀;pbs洗涤3次后用2.5%多聚甲醛4℃过夜固 定;
[0038]
②
固定好的细胞用浓度递增的乙醇溶液脱水处理后,包埋在环氧树脂中。送电镜室进 行超薄细胞切片并固定到铜网上;
[0039]
③
1%磷钨酸负染20-30s后,透射电镜(transmission electron microscope,tem)(电压 200kv)下观察rvlps在细胞内的定位。
[0040]
进行rvlps的鉴定和纯化时的方法如下:
[0041]
①
收获培养hek-293/rvlps细胞培养基,0.45μm滤膜过滤后30kda超滤管浓缩, 浓缩上清液于-80℃保存;
[0042]
②
提取hek-293/rvlps细胞总蛋白;
[0043]
③
将
①
和
②
中的上清在4℃,30000rpm下离心3h,沉淀用pbs在4℃过夜溶解;
[0044]
④
配制浓度为20%、40%和60%的蔗糖溶液,0.45μm滤膜过滤;
[0045]
⑤
将蔗糖溶液按照由低到高的顺序加入超速离心管中,形成20%-40%-60%的密度梯 度,加入溶解后的离心产物,4℃,35000rpm离心2h;
[0046]
⑥
收集位于40%-60%蔗糖层间的白色条带,于pbs中4℃,30000rpm离心3h进行 脱糖处理,沉淀用pbs在4℃过夜溶解;
[0047]
⑦
用bca试剂盒测定rvlps的浓度,-80℃保存备用;
[0048]
⑧
利用wb鉴定不同蔗糖层间的rvlps蛋白;
[0049]
⑨
取10μl纯化后的rvlps样品滴加到铜网上静置15-20min,滤纸吸干残留液体, 1%的磷钨酸负染20-30s,吸掉多余液体,静置至铜网干燥,然后用tem(电压120kv) 观察样品。
[0050]
本发明的有益效果如下:
[0051]
抗原方面:本发明将由csv毒株rvgp和rvmp组装成rvlps作为预防中国犬类狂 犬病的广谱性抗原。生物信息学软件分析结果表明rvgp的胞外域含有全部抗原表位和3 个主要的n-糖基化位点;胞外域的n-糖基化位点的突变会导致rvgp空间表位的丢失和 结构的改变;候选rvgp与34株中国其他地区来源的rvgp序列的一致性达到了97.25%, 主要的抗原结合位点和所有的糖基化位点都是高度保守的,表明所选的rvgp可以作为针 对中国犬类狂犬病的候选抗原。
[0052]
细胞株选择方面:本发明通过将含有rvgp和rvmp的真核质粒转染到hek-293细 胞,筛选得到了稳定高效表达rvlps的阳性单克隆细胞株hek-293/rvlps。wb和tem 结果表明rvlps可以在细胞内和培养基中检测到,经20%-40%-60%蔗糖密度梯度离心, 分离得到的rvlps主要位于40%-60%的蔗糖层,为非典型的子弹状形态,而是成圆形或 椭圆形结构,分析可能是由于天然的rvlps除了含有rvmp和rvgp外,内部还含有rnps 复合体,它们紧密相连,在rvlps内部起着一定的支撑作用。
[0053]
因此,本发明构建的rvlps缺乏内部的其他元件,没有支撑作用,故形态上与天然的 rvlps有一定的区别。hek-293细胞作为表达系统,具有完善的ptm机制,能保证rvgp 获得正确的糖基化结构,使得其免疫原性得到了保证。构建的hek-293/rvlps稳定细胞 株,为生产高免疫原性rvlps奠定了基础。
附图说明
[0054]
图1为候选rvgp的序列分析及比对。
[0055]
图2为csv株rvgp的n-糖基化位点的预测;
[0056]
图3为rvgp抗原表位和n-糖基化位点分析结果;
[0057]
图4为n-糖基化位点对rvgp抗原性和三级结构的影响;
[0058]
图5为34株中国狂犬病毒株与cvs株rvgp蛋白序列比对结果;
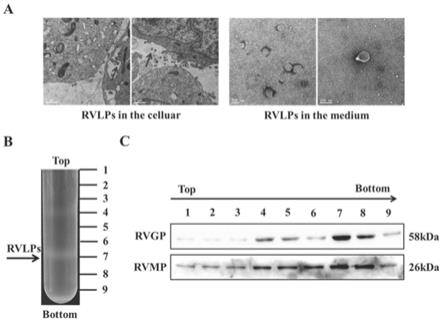
[0059]
图6为pcdna3.1( )-rvlps-egfp构建电泳图;
[0060]
图7显示了pcdna3.1( )-rvlps-egfp的构建及稳定表达rvlps的hek-293细胞株 的获得流程。
[0061]
图8为pcdna3.1( )-rvlps-egfp质粒转染hek-293细胞:其中,(a)荧光图;(b) 转染效率。
[0062]
图9为hek-293细胞中rvlps(a)mrna和(b)蛋白水平;
[0063]
图10为hek-293/rvlps阳性细胞株的筛选和富集,其中:(a)hek-293细胞的转染 效率;(b)hek-293细胞经不同浓度g418作用48h后的细胞存活率和ic50值;(c)经 2mg/ml g418处理的hek-293细胞的形态变化及荧光分布。
[0064]
图11为hek-293/rvlps的阳性单克隆细胞株的鉴定,其中:(a)不同阳性克隆细胞 的比例;(b)平均荧光强度和(c)rvlps的蛋白水平。
[0065]
图12为hek-293/rvlps细胞株的传代稳定性,其中:(a)hek-293/rvlps细胞株 的clsm呈像;(b)hek293/rvlps细胞中的egfp水平;(c)不同汇合度hek-293/rvlps 细胞中rvlps的表达水平。
[0066]
图13为rvlps的表征,其中:(a)tem观察rvlps在细胞和培养基中分布;(b) 蔗糖密度梯度离心纯化rvlps;(c)wb分析蔗糖密度梯度离心样品。
具体实施方式
[0067]
下面结合本发明的附图和实施例对本发明的实施作详细说明,以下实施例是在以本发 明技术方案为前提下进行实施,给出了详细的实施方式和具体操作过程,但本发明的保护 范围不限于下述的实施例。
[0068]
为了更好地理解本发明而不是限制本发明的范围,在本技术中所用的表示用量、百分 比的所有数字、以及其他数值,在所有情况下都应理解为以词语“大约”所修饰。因此,除 非特别说明,否则在说明书和所附权利要求书中所列出的数字参数都是近似值,其可能会 根据试图获得的理想性质的不同而加以改变。各个数字参数至少应被看作是根据所报告的 有效数字和通过常规的四舍五入方法而获得的。
[0069]
实施例1 广谱性狂犬病病毒样颗粒(rvlps)抗原设计
[0070]
1.rvgp的序列分析
[0071]
从ncbi数据库获取csv株rvgp和rvmp的核苷酸序列,分别如seq id no.1 和seq id no.2所示。候选rvgp的序列分析及比对结果如图1所示。
[0072]
利用生物信息学软件测得到的rvgp的b细胞表位(表1)、clt细胞表位和th细胞 表位(表2),全部位于成熟rvgp的胞外域。
[0073]
表1 csv株rvgp的b细胞表位分析
认最佳的转染方式。转染48h后,先通过倒置荧光显微镜定性观察转染情况(图8a),再 通过fcm对转染效率进行定量分析(图8b)。结果表明两种试剂的转染效率都达到60%以 上,当dna:pei=1:4时,转染效率最高(65.7%),其次是脂质体(65.1%),且脂质体的 细胞毒性小于pei,故采用脂质体作为转染试剂来筛选过表达rvlps的hek-293稳定细 胞株(图8)。
[0098]
3、rvlps的检测
[0099]
收集pcdna3.1( )-rvlps-egfp转染48h后的hek-293细胞和培养基,利用qpcr 检测细胞中的rvlps的mrna水平,利用wb检测细胞和培养基中rvlps的蛋白水平, 具体方法如下:
[0100]
(1)wb检测rvlps的蛋白水平
[0101]
①
细胞培养基用30kda超滤管浓缩;
[0102]
②
胰酶消化细胞后,1000rpm离心5min收集细胞。
[0103]
③
pbs洗涤3次后,添加含有1%pmsf的ripa细胞裂解液在4℃裂解30min。
[0104]
④
4℃,12000rpm离心10min,吸取上清液于-80℃保存。
[0105]
⑤
用bca法测定培养基和细胞裂解上清中的蛋白浓度,以30μg上样量进行 sds-page。
[0106]
⑥
切取目的蛋白所在位置的凝胶,裁剪对应的大小的pvdf膜置于无水甲醇中活化 5min;
[0107]
⑦
向阴极板上按顺序叠放经转膜缓冲液浸泡过的海绵-3层滤纸-凝胶-pvdf膜-3层滤 纸-海绵,扣好阳极板,放入转膜装置中,4℃,200ma电转1.5h。
[0108]
⑧
1.5h后,取出pvdf膜,用3%脱脂奶粉室温封闭2h,然后用tbst洗涤3次, 5min/次;
[0109]
⑨
用封闭液分别以1:200和1:500的比例稀释鼠抗rvgp单抗和兔抗rvmp多抗, 与pvdf膜在4℃摇晃过夜,再以tbst洗膜3次,5min/次;
[0110]
⑩
用封闭液以1:6000倍稀释hrp标记的羊抗兔/鼠igg,室温与pvdf膜摇晃孵育 1h;用tbst洗3次,10min/次,然后进行ecl化学发光成像。
[0111]
(2)qpcr检测rvlps的mrna水平
[0112]
①
qpcr引物序列见表3。
[0113]
②
引物稀释为10μm,按照表4在冰上配制qpcr反应液,震荡至充分混匀,离心进 行qpcr反应。
[0114]
③
用bio-rad cfx96 qpcr仪进行反应,反应程序简述为:预变性:95℃,5s;pcr 反应:[95℃,5s;55℃,10s;72℃,20s]
×
40个循环,获得溶解曲线。
[0115]
④
qpcr结果采用2-δδct分析目的基因表达水平。公式如下:表达水平=2-δδct,其 中
△△
ct=[(ctgene in test cell line-ctgene in control cell line)-(ctβ-actin in test celllines-ctβ-actin in control cell line)]。
[0116]
表3 qpcr引物列表
[0117][0118]
表4 qpcr反应体系
[0119][0120]
由图9可知,rvgp和rvmp的转录水平基本一致,且hek-293细胞内和培养基中 均可检测到rvgp和rvmp蛋白。由于培养基浓缩后培养基的体积是细胞裂解上清的100 倍,表明由rvgp和rvmp组装成的rvlps大部分被分泌到培养基中。
[0121]
4、阳性单克隆细胞株hek-293/rvlps的筛选和鉴定
[0122]
mtt实验结果表明g418对hek-293细胞的ic50为2.235
±
0.206mg/ml(图10b)。因 此,选择2mg/ml g418进行hek-293/rvlps细胞株的筛选。pcdna3.1( )-rvlps-egfp 转染hek-293细胞48h后,一组细胞用fcm检测,转染效率为65.66%(图10a)。另一组 细胞用含2mg/ml g418的dmem培养基连续筛选14天,使阳性细胞富集(图10c)。然 后,利用有限稀释法让阳性单克隆细胞在96孔板中扩增,通过fcm筛选出egfp阳性 细胞比例大于99%的细胞株,命名为hek-293/rvlps clone 1/2/4/5/8/10/11/12(图11a)。 fcm和wb结果表明,clone 11的平均荧光强度和蛋白表达水平显著高于其它阳性单克 隆细胞株(p《0.05)(图11b和c)。因此,clone 11将被用于后续的研究,命名为 hek-293/rvlps。
[0123]
5、hek-293/rvlps细胞株的传代稳定性
[0124]
将得到的rvlps高效表达细胞株hek-293/rvlps传至第10代,消化并接种到共聚 焦培养皿中,4%多聚甲醛固定后,利用hoecst 33342染料进行核染,clsm观察并拍照。 clsm结果显示每个细胞都表达egfp,并且主要定位于细胞质(图12a)。fcm结果显示 egfp阳性细胞比例为100%(图12b)。剩余的细胞继续培养,倒置荧光显微镜观察结果显 示细胞中并没有出现绿色荧光的丢失,wb检测不同汇合度下hek-293/rvlps细胞蛋白 表达水平,结
果表明rvlps胞内表达水平并没有降低(图12c)。
[0125]
6、rvlps的表征
[0126]
胰酶消化收获t25培养瓶中的hek-293/rvlps细胞进行超薄细胞切片,方法如下:
[0127]
①
消化收集得到绿豆大小的细胞沉淀;pbs洗涤3次后用2.5%多聚甲醛4℃过夜固 定;
[0128]
②
固定好的细胞用浓度递增的乙醇溶液脱水处理后,包埋在环氧树脂中。送电镜室进 行超薄细胞切片并固定到铜网上;
[0129]
③
1%磷钨酸负染20-30s后,透射电镜(transmission electron microscope,tem)(电压 200kv)下观察rvlps在细胞内的定位。
[0130]
同时,利用tem观察经蔗糖密度梯度离心纯化的rvlps,方法如下:
[0131]
①
收获培养hek-293/rvlps细胞培养基,0.45μm滤膜过滤后30kda超滤管浓缩, 浓缩上清液于-80℃保存;
[0132]
②
提取hek-293/rvlps细胞总蛋白;
[0133]
③
将
①
和
②
中的上清在4℃,30000rpm下离心3h,沉淀用pbs在4℃过夜溶解;
[0134]
④
配制浓度为20%、40%和60%的蔗糖溶液,0.45μm滤膜过滤;
[0135]
⑤
将蔗糖溶液按照由低到高的顺序加入超速离心管中,形成20%-40%-60%的密度梯 度,加入溶解后的离心产物,4℃,35000rpm离心2h;
[0136]
⑥
收集位于40%-60%蔗糖层间的白色条带,于pbs中4℃,30000rpm离心3h进行 脱糖处理,沉淀用pbs在4℃过夜溶解;
[0137]
⑦
用bca试剂盒测定rvlps的浓度,-80℃保存备用;
[0138]
⑧
利用wb鉴定不同蔗糖层间的rvlps蛋白;
[0139]
⑨
取10μl纯化后的rvlps样品滴加到铜网上静置15-20min,滤纸吸干残留液体, 1%的磷钨酸负染20-30s,吸掉多余液体,静置至铜网干燥,然后用tem(电压120kv) 观察样品。
[0140]
如13a左图所示,在hek-293/rvlps细胞囊泡中和细胞外均观察到大小在180-200nm 之间的rvlps,表明rvlps表达后可以分泌至培养基中;有大小在180-200nm之间的圆 形或椭圆形粒子(图13a右)。rvlps经密度梯度离心后主要位于40%-60%的蔗糖层(图 13b),结合wb的结果,可以充分说明观察到的nps是由rvgp和rvmp自组装成 rvlps(图13c)。虽然自组装的rvlps具有不同的沉降系数,但是大部分rvlps位于 40-60%的蔗糖层,说明大部分rvlps是按照病毒本身的组装比例去自组装的。
[0141]
综上,本专利将由csv毒株rvgp和rvmp组装成rvlps作为预防中国犬类狂犬 病的广谱性抗原。生物信息学软件分析结果表明rvgp的胞外域含有全部抗原表位和3 个主要的n-糖基化位点;其次,胞外域的n-糖基化位点的突变会导致rvgp空间表位的 丢失和结构的改变;最后,候选rvgp与34株中国其他地区来源的rvgp序列的一致性 达到了97.25%,主要的抗原结合位点和所有的糖基化位点都是高度保守的,表明所选的 rvgp可以作为针对中国犬类狂犬病的候选抗原。
[0142]
本发明通过将含有rvgp和rvmp的真核质粒转染到hek-293细胞,筛选得到稳定 高效表达rvlps的阳性单克隆细胞株hek-293/rvlps。wb和tem结果表明rvlps可 以在细胞内和培养基中检测到,经20%-40%-60%蔗糖密度梯度离心,分离得到的rvlps 主要位于
40%-60%的蔗糖层,为非典型的子弹状形态,而是成圆形或椭圆形结构,分析 可能是由于天然的rvlps除了含有rvmp和rvgp外,内部还含有rnps复合体,它们 紧密相连,在rvlps内部起着一定的支撑作用。本研究构建的rvlps缺乏内部的其他元 件,没有支撑作用,故形态上与天然的rvlps有一定的区别。
[0143]
hek-293细胞作为表达系统,具有完善的ptm机制,能保证rvgp获得正确的糖基 化结构,使得其免疫原性得到了保证。为了加强rvlps的免疫效果,本章还构建并表达 黏膜免疫佐剂ltb,其能够与大多数细胞表面的gmi受体结合,增强口服rvlps的体液、 细胞和黏膜免疫应答。总之,我们建立的hek-293/rvlps稳定细胞株,为生产高免疫原 性rvlps奠定了基础,黏膜佐剂的使用,进一步加强rvlps的免疫原性。
[0144]
本发明中,经密码子优化的rvgp的编码序列(seq id no.1)
[0145][0146]
其中,aagctt为hind iii限制性酶切位点,为kpn i限制性酶切位点, gcggccgc为not i限制性酶切位点,为核糖体结合位点,gtcgac为sal i 限制性酶切位点,为bamhi限制性酶切位点,gaattc为ecor i限制性酶切 位点。
[0147]
经密码子优化的rvmp的编码序列(seq id no.2)
[0148][0149]
其中,gctagc为nhe i限制性酶切位点;为核糖体结合位点,aagctt为hind iii限制性酶切位点。
[0150]
以上已对本发明创造的较佳实施例进行了具体说明,但本发明创造并不限于所述实施 例,熟悉本领域的技术人员在不违背本发明创造精神的前提下还可作出种种的等同的变型 或替换,这些等同的变型或替换均包含在本技术权利要求所限定的范围内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。