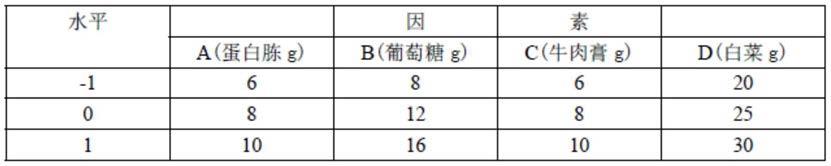
1.本发明涉及生物工程技术领域,特别是涉及一种增加基因组突变率的碱基编辑系统及碱基编辑方法。
背景技术:
2.酿酒酵母(saccharomyces cerevisiae)作为第一个全基因组测序的模式真核生物,也是最早被应用于酿酒、食品等方面的微生物之一,如今已经被广泛应用于各种食品、化工产品和药品的大规模生产。酿酒酵母具有遗传背景清楚、遗传操作性强、发酵性能好等优点,是优良的代谢工程底盘细胞。随着合成生物学的发展,各种微生物,包括毕赤酵母(pichia pastoris)、大肠杆菌(escherichia coli)、罗尔斯通氏菌(ralstonia eutropha)等,都已经被开发成生产天然产品的细胞工厂。
3.然而,由于生物系统的复杂性,诸如胁迫耐受性等受到多基因调控的复杂表型,单基因理性改造方法很难实现预定的目标。为了克服这一主要限制,微生物细胞工厂需构建一种强大的多功能工具——基因组突变,以满足工业生产需求(夏思杨;江丽红;蔡谨;黄磊;徐志南;连佳长,酿酒酵母基因组进化的研究进展.合成生物学2020,1(05),556
‑
569.)。
4.载脂蛋白b mrna编辑酶催化多肽
‑
1(apobec1)能介导胞嘧啶的脱氨基化反应,但催化apob mrna c
‑
to
‑
u过程中需要辅助蛋白结合特异性识别序列,固定apob mrna,并将dna单链与apobec1催化活性中心相互靠近,才能最终发挥脱氨基活性([1]komor,a.c.;kim,y.b.;packer,m.s.;zuris,j.a.;liu,d.r.,programmable editing of a target base in genomic dna without double
‑
stranded dna cleavage.nature 2016,533(7603),420
‑
4.;[2]sui,y.;qi,l.;zhang,k.;saini,n.;klimczak,l.j.;sakofsky,c.j.;gordenin,d.a.;petes,t.d.;zheng,d.q.,analysis of apobec
‑
induced mutations in yeast strains with low levels of replicative dna polymerases.proceedings of the national academy of sciences 2020,117(17),201922472.)。当apobec1与特异性单链dna结合蛋白结合时,能够随机定位至单链的dna上,实现单胞嘧啶的脱氨基化反应,造成碱基突变,随着基因组中随机突变的累积,底盘细胞的性状和功能发生变化,根据工业生产需求,对基因组突变后的菌株进行性状筛选和定向进化。
技术实现要素:
[0005]
针对现有技术中存在的上述问题,本发明提供了一类增加基因组突变率的碱基编辑系统及应用,能够简单、高效地提高基因组突变率。
[0006]
一种增加基因组突变率的碱基编辑系统,包括编码胞嘧啶脱氨酶的基因和编码特异性单链dna结合蛋白的基因。优选的,编码胞嘧啶脱氨酶的基因是哺乳动物的胞嘧啶脱氨酶apobec1。更优选的,编码胞嘧啶脱氨酶的基因是大鼠的胞嘧啶脱氨酶apobec1,基因序列如seq id no.1所示。优选的,编码特异性单链dna结合蛋白的基因是以下一种:
[0007]
(1)酿酒酵母的dna单链结合蛋白3个亚基rfa1、rfa2、rfa3中的至少一个,rfa1、
rfa2、rfa3的基因序列分别如seq id no.2、seq id no.3、seq id no.4所示;
[0008]
(2)酿酒酵母的dna引物酶pri1,基因序列如seq id no.5所示;
[0009]
(3)酿酒酵母的解旋酶hcs1,基因序列如seq id no.6所示;
[0010]
(4)酿酒酵母的拓扑异构酶top1,基因序列如seq id no.7所示;
[0011]
(5)毕赤酵母的单链结合蛋白亚基rpa,基因序列如seq id no.8所示;
[0012]
(6)大肠杆菌的dna单链结合蛋白ssb,基因序列如seq id no.9所示;
[0013]
(7)罗尔斯通氏菌的单链结合蛋白h16_a0402,基因序列如seq id no.10所示。
[0014]
优选的,所述的碱基编辑系统,将编码胞嘧啶脱氨酶的基因和编码特异性单链dna结合蛋白的基因克隆到同一表达载体中进行共表达。
[0015]
本发明又提供了所述的碱基编辑系统在提高菌株基因组突变率中的应用。
[0016]
本发明又提供了所述的碱基编辑系统在菌株性状筛选和定向进化中的应用。
[0017]
本发明还提供了一种增加基因组突变率的碱基编辑方法,将所述碱基编辑系统中编码胞嘧啶脱氨酶的基因和编码特异性单链dna结合蛋白的基因同时转入宿主细胞中进行外源表达获得重组表达细胞。优选的,编码胞嘧啶脱氨酶的基因是大鼠的胞嘧啶脱氨酶apobec1,基因序列如seq id no.1所示。优选的,当宿主细胞是酿酒酵母时,编码特异性单链dna结合蛋白的基因是以下一种:
[0018]
(1)酿酒酵母的dna单链结合蛋白3个亚基rfa1、rfa2、rfa3中的至少一个,rfa1、rfa2、rfa3的基因序列分别如seq id no.2、seq id no.3、seq id no.4所示;
[0019]
(2)酿酒酵母的dna引物酶pri1,基因序列如seq id no.5所示;
[0020]
(3)酿酒酵母的解旋酶hcs1,基因序列如seq id no.6所示;
[0021]
(4)酿酒酵母的拓扑异构酶top1,基因序列如seq id no.7所示,
[0022]
当宿主细胞是毕赤酵母时,编码特异性单链dna结合蛋白的基因是毕赤酵母的单链结合蛋白亚基rpa,基因序列如seq id no.8所示,
[0023]
当宿主细胞是大肠杆菌时,编码特异性单链dna结合蛋白的基因是大肠杆菌的dna单链结合蛋白ssb,基因序列如seq id no.9所示;
[0024]
当宿主细胞是罗尔斯通氏菌时,编码特异性单链dna结合蛋白的基因是罗尔斯通氏菌的单链结合蛋白h16_a0402,基因序列如seq id no.10所示。
[0025]
利用本发明构建的碱基编辑系统,对酿酒酵母基因组进行进化,在操作上具有简单,效率高等优点,在功能上,能提高β
‑
胡萝卜素的产量、提高对有机试剂的耐受性。并且本发明构建的基因组碱基编辑系统在毕赤酵母、大肠杆菌以及罗尔斯通氏菌等大部分工业菌株中同样适用。
[0026]
所以,使用本发明碱基编辑系统能够用于提高菌株的基因组突变率,基因组中突变碱基累积,造成菌体性状和功能的多样性,根据工业生产要求,可对某一性状进行连续性状筛选和定向进化。
附图说明
[0027]
图1为增加基因组突变率的碱基编辑系统的原理图。
[0028]
图2为p415
‑
apobec的质粒图谱。
[0029]
图3为pgap
‑
apobec
‑
rpa的质粒图谱。
[0030]
图4为pgex
‑
apobec
‑
ssb的质粒图谱。
[0031]
图5为pbbr1
‑
apobec
‑
h16_a0402的质粒图谱。
[0032]
图6为在酿酒酵母中不同基因组突变系统导致的基因突变率的结果。
[0033]
图7为酿酒酵母基因组突变菌株在含不同浓度异丁醇的培养基中的生长情况。
[0034]
图8酿酒酵母基因组连续进化菌株在含8%和9%异丁醇培养基中的生长情况。
[0035]
图9为酿酒酵母基因组突变菌株在含不同浓度的乙酸盐的培养基中的生长情况。
[0036]
图10为酿酒酵母中不同基因组突变系统导致的β
‑
胡萝卜素的产量差异。
[0037]
图11毕赤酵母基因组突变菌株在含7%甲醇的培养基中的生长情况。
[0038]
图12罗尔斯通氏菌基因组突变菌株在含5g/l甲酸钠培养基中的生长情况。
[0039]
图13为大肠杆菌基因组突变菌株在含1%乙酸钠的培养基中的生长情况。
具体实施方式
[0040]
质粒p415购买自snapgene。用于构建质粒的大肠杆菌dh5α购自北京擎科生物科技有限公司。酿酒酵母saccharomyces cerevisiae by4741、毕赤酵母pichia pastoris gs115、大肠杆菌escherichia coli dh5α和罗尔斯通氏菌ralstonia eutropha h16购买自中国工业微生物菌种保藏中心(cicc)。dnapolymerase、限制性内切酶与t4连接酶购买自neb公司。质粒提取试剂盒购买自axygen有限公司,pcr产物核酸纯化试剂盒购买自thermo scientific公司。
[0041]
大肠杆菌的培养基使用lb培养基,配方为:蛋白胨10g、酵母提取物5g、nacl 10g,去离子水1l。
[0042]
酿酒酵母的培养基使用scd
‑
leu培养基,配方为:无氨基酵母氮源(difco,boom,the netherlands)1.7g,硫酸铵5g,cms
‑
leu(mp biomedicals,solon,ohio)0.69g,葡萄糖20g,琼脂粉20g,去离子水1l。
[0043]
酿酒酵母的培养基使用scd
‑
leu
‑
arg canavanine培养基,配方为:无氨基酵母氮源(difco,boom,the netherlands)1.7g,组氨酸0.02g,甲硫氨酸0.02g,尿嘧啶0.02g,苯丙氨酸0.05g,酪氨酸0.05g,硫酸铵5g,葡萄糖20g,刀豆氨酸60mg,琼脂粉20g,去离子水1l。
[0044]
罗尔斯通氏菌使用mm培养基,配方为:9g/lna2hpo4·
12h2o,1.5g/l kh2po4,1g/l(nh4)2so4,80mg/l mgso4·
7h2o,1mg/l caso4·
2h2o,0.56mg/l niso4·
7h2o,0.4mg/l柠檬酸铁,200mg/l nahco3,1ml/l微量元素,以10mg/ml果糖为碳源。
[0045]
毕赤酵母使用的sed培养基的配方为:1.7g/lynb,1.107g/l谷氨酸钠,20g/l葡萄糖为碳源。毕赤酵母使用的sem培养基的配方为:1.7g/l ynb,1.107g/l谷氨酸钠,6%甲醇为碳源。
[0046]
图1为本发明增加基因组突变率的碱基编辑系统的原理图。下述实施例或应用例中用到的引物序列如表1所示,本发明所用的基因序列如表2所示。
[0047]
表1本发明所用的引物序列表
[0048]
引物名称序列(5
’‑3’
)apobec
‑
foratgagctcagagactggcccaapobec
‑
revggatccaccagaagaaccaccagaactttcgggap
‑
fortttttgtagaaatgtcttggt
gap
‑
revatagttgttcaattgattgaapgex
‑
forgaatactgtttcctgtgtgaapgex
‑
revgccaccgctgagcaataactarfa1
‑
forccgaaagttctggtggttcttctggtggatccatgagcagtgttcaactttcgrfa1
‑
revataaatcataagaaattcgcctcggtttctcgagttaagctaacaaagccttggataacrfa2
‑
fornnnnnggatccatggcaacctatcaaccatataacgaatattcrfa2
‑
revnnnnnctcgagtcatagggcaaagaagttattgtcrfa3
‑
fornnnnnggatccatggccagcgaaacaccaagrfa3
‑
revnnnnnctcgagctagtatatttctgggtatttcttacatagpri1
‑
forccgaaagttctggtggttcttctggtggatccatgaccaattcagtaaagactpri1
‑
revaatcataaatcataagaaattcgcctcggtttctcgagtcagaaatctaaagaagccgghcs1
‑
forccgaaagttctggtggttcttctggtggatccatgaacaaagaattggcttcthcs1
‑
revcataaatcataagaaattcgcctcggtttctcgagttacaaataatcgtcaatgtttop1
‑
forccgaaagttctggtggttcttctggtggatccatgactattgctgatgcttcctop1
‑
revcataaatcataagaaattcgcctcggtttctcgagttaaaacctccaattttcatcssb
‑
forccgaaagttctggtggttcttctggtggatccatggccagcagaggcgtaaacssb
‑
revcataaatcataagaaattcgcctcggtttctcgagtcagaacggaatgtcatcatcrpa
‑
forccgaaagttctggtggttcttctggtggatccatgacagagttcagtaaaggtrpa
‑
revcataaatcataagaaattcgcctcggtttctcgagttaattaaccttgacaccctch16_a0402
‑
forccgaaagttctggtggttcttctggtggatccgcatcggtcaacaaagtcatth16_a0402
‑
revcataaatcataagaaattcgcctcggtttctcgagtcagaacgggatatcgtcgtc
[0049]
表2本发明所用的基因序列表
[0050][0051][0052]
在下文和附图中,y415代表转化了质粒p415的酿酒酵母作为对照1;yapobec代表转化了质粒p415
‑
apobec的酿酒酵母,作为对照2;yrfa1代表转化了质粒p415
‑
apobec
‑
rfa1的酿酒酵母;yrfa2代表转化了质粒p415
‑
apobec
‑
rfa2的酿酒酵母;yrfa3代表转化了质粒p415
‑
apobec
‑
rfa3的酿酒酵母;ypri1代表转化了质粒p415
‑
apobec
‑
pri1的酿酒酵母;yhcs1代表转化了质粒p415
‑
apobec
‑
hcs1的酿酒酵母;ytop1代表转化了质粒p415
‑
apobec
‑
top1的酿酒酵母。
[0053]
实施例1:一类增加基因组突变率的碱基编辑系统及应用
[0054]
1、基因组表达载体,其制备过程如下:
[0055]
(a)扩增apobec序列(基因序列如seq id no.1所示):
[0056]
pcr反应体系如下:50μl反应体系中含有q5 dna polymerase mix 25μl,上游引物与下游引物各2.5μl,模板1μl以及ddh2o 19μl。pcr循环程序为预变性98℃2min;变性98℃10s,退火55℃10s,延伸72℃4min,循环31次;延伸72℃2min,保存4℃。特异性dna单链结合蛋白扩增pcr循环程序为预变性98℃2min;变性98℃10s,退火55℃10s,延伸72℃2kb/min,循环30次;延伸72℃2min,保存4℃。pcr得到的片段经pcr产物纯化试剂盒纯化回收。
[0057]
用于扩增的引物为apobec
‑
for(本发明所用引物见表1)和apobec
‑
rev,模板为xcas9(3.7)
‑
be4(http://www.addgene.org/search/catalog/plasmids/?q=108381),按上述反应扩增包含gap启动子和apobec1(不含终止密码子)的apobec序列。
[0058]
(b)以各菌株的基因组为模板,扩增相应的特异性dna单链结合蛋白编码的基因序列:
[0059]
pcr反应体系同上。在酿酒酵母中,用于rfa1(基因序列如seq id no.2所示)扩增的引物为rfa1
‑
for和rfa1
‑
rev;用于rfa2(基因序列如seq id no.3所示)扩增的引物为rfa2
‑
for和rfa2
‑
rev;用于rfa3(基因序列如seq id no.4所示)扩增的引物为rfa3
‑
for和rfa3
‑
rev;用于pri1(基因序列如seq idno.5所示)扩增的引物为pri1
‑
for和pri1
‑
rev;用于hcs1(基因序列如seq id no.6所示)扩增的引物为hcs1
‑
for和hcs1
‑
rev;用于top1(基因序列如seq id no.7所示)扩增的引物为top1
‑
for和top1
‑
rev;
[0060]
用于扩增毕赤酵母rpa(基因序列如seq id no.8所示)的引物为rpa
‑
for和rpa
‑
rev。
[0061]
用于扩增大肠杆菌ssb(基因序列如seq id no.9所示)的引物为ssb
‑
for和ssb
‑
rev。
[0062]
用于扩增罗尔斯通氏菌h16_a0402(基因序列如seq id no.10所示)的引物为h16_a0402
‑
for和h16_a0402
‑
rev。
[0063]
(c)制备各菌株相应适用的质粒骨架:
[0064]
用于酿酒酵母碱基编辑的质粒骨架;以质粒p415为模板,用限制性内切酶pst1和sca1双酶切,并通过凝胶电泳分离、纯化骨架片段,即本系统在酿酒酵母中应用的质粒骨架;
[0065]
扩增用于毕赤酵母碱基编辑的质粒骨架;基于gu等(construction of a series of episomal plasmids and their application in the development of an efficient crispr/cas9 system in pichia pastoris,may2019,world journal of microbiology and biotechnology 35(6),10.1007/s11274
‑
019
‑
2654
‑
5)研究中构建的含有panars复制子的黄色荧光表达载体,利用bglii和noti将aox1启动子和黄色荧光蛋白基因除去,插入从毕赤酵母基因组上pcr扩增得到的gap启动子,所用引物为gap
‑
for和gap
‑
rev,即本系统在毕赤酵母中应用的质粒骨架;
[0066]
设计引物pgex
‑
for和pgex
‑
rev,扩增用于大肠杆菌碱基编辑的质粒骨架;以实验室已有质粒pgex
‑
6p
‑
1为模板,pcr扩增包含ori复制起始位点、氨苄青霉素抗性基因ampr、半乳糖操纵子等元件的质粒骨架,即本系统在大肠杆菌中应用的质粒骨架;
[0067]
扩增用于罗尔斯通氏菌碱基编辑的质粒骨架,以实验室已有质粒pbbr1
‑
para
‑
rfp
为模板,用xhoi和bamhi双酶切,并通过凝胶电泳分离、纯化骨架片段,即本系统在罗尔斯通氏菌中应用的质粒骨架;
[0068]
(d)酶连质粒骨架和apobec,利用gibson技术,同源重组连接上述片段,得到所述基因组碱基编辑表达载体。
[0069]
纯化后的apobec1(步骤a得到)、特异性dna单链结合蛋白(步骤b得到)和质粒骨架(步骤c得到)按0.03pmol:0.03pmol:0.03pmol的比例加入gibson assembly反应体系中,加入gibson assembly mix 15μl,并加入ddh2o使得最终反应体系为20μl;50℃温育60min。热击转化e.coli dh5α感受态细胞;均匀涂布100μg/ml氨苄青霉素的lb固体培养基上,37℃倒置培养16h;挑选阳性克隆子,提取质粒即为基因组碱基编辑表达载体。用于酿酒酵母的表达载体如图2所示,用于毕赤酵母的表达载体如图3所示,用于大肠杆菌的表达载体如图4所示,用于罗尔斯通氏菌的表达载体如图5所示。
[0070]
2、基因组碱基编辑系统功能验证
[0071]
基因组碱基编辑过程如下:提取基因组碱基编辑系统表达质粒并转化酿酒酵母,培养、筛选,获得转化子;
[0072]
a.将基因组碱基编辑系统和对照组的表达质粒从e.coli中提出,分别转化至酿酒酵母by4741中,将转化后的酿酒酵母在scd
‑
leu固体培养基上筛选;
[0073]
b.每个固体培养基上挑取3个单菌落,分别接种至scd
‑
leu液体培养基中培养,待菌液生长至稳定期,进行传代培养;
[0074]
c.菌液连续培养2代并至菌液生长至稳定期后,每个样品测od
660
值,并将菌液稀释至每毫升107个细胞,取1ml菌液,其中5μl菌液稀释至每毫升105个细胞,涂布于5μl菌液至scd
‑
leu固体培养基上,另外995μl菌液离心后重悬于100μl灭菌水中,涂布于scd
‑
leu
‑
arg canavanine固体培养基上,接菌后的培养基在30℃的培养箱中培养3
‑
7天;
[0075]
d.分别统计各个样品在scd
‑
leu和scd
‑
leu
‑
arg canavanine培养基上生长的单菌落数量,计算基因突变率。
[0076]
e.挑取scd
‑
leu
‑
arg canavanine培养基上的单菌落,对其can1基因进行测序,验证突变类型。
[0077]
f.该实验重复三次后,进行数据的统计分析。
[0078]
实验结果如图6所示,该碱基编辑系统显著提高了can1基因的突变率,与yapobec相比,其中yrfa1和yhcs1提高了6倍,yrfa2和ytop1提高了12倍,yrfa3和ypri1分别提高了21倍和25倍。由此可以证明该系统能显著提高酿酒酵母基因组的突变率。
[0079]
应用例1:基因组突变菌株对异丁醇的耐受性测试
[0080]
一类增加基因组突变率的碱基编辑系统,加速酿酒酵母基因组定向进化,提高其对异丁醇的耐受性。
[0081]
a.取上述2.c(实施例1第2.c节)各样品连续传2代并生长稳定的菌液,接种等量菌液至含有不同浓度异丁醇的scd
‑
leu液体培养基中培养,培养基中异丁醇的浓度分别为:0%、1%、2%、3%、4%、5%;
[0082]
b.每24h测菌液od
660
值,比较不同菌株在含不同浓度异丁醇的培养基中的生长情况;
[0083]
实验结果表明,异丁醇在培养基中的浓度为0
‑
2%时,不同菌株的生长速率没有差
异,在浓度为3%时,如图7所示,y415的生长速率小于其他菌株;当异丁醇浓度为4%时,如图7所示,各菌株的生长速率产生了差距,其中生长最快的是yrfa2和ytop1,其次是yrfa3和ypri1,且两者生长较为稳定,而yrfa1、yhcs1和yapobec生长速率较慢,y415生长受限最大;异丁醇浓度为5%时,如图7所示,菌株ytop1、yrfa3、ypri1以及yhcs1生长速率较高,其次是yrfa2,而yapobec和yrfa1生长受限较大,y415完全无法生长。综上所述,菌株ytop1、yrfa3和ypri1对异丁醇的耐受性最好,而这三个菌株的突变率在各菌株中相对最高,推测在酿酒酵母中,高突变率有利于进化对异丁醇耐受性。
[0084]
应用例2:基因组连续进化菌株对异丁醇的耐受性测试
[0085]
a.根据应用例1的测试结果和推论,选取突变率最高且在含5%异丁醇的培养基中生长速率较高的yrfa3菌液,接种至在含更高浓度异丁醇的培养基中进行传代培养,接种量为1%。
[0086]
b.连续传代接种至含更高浓度异丁醇的培养基中,直至菌株无法生长,连续进化后,yrfa3菌株耐受异丁醇的最高浓度为9%。
[0087]
c.保存对异丁醇耐受性最高菌液,即基因组连续进化后的酿酒酵母yrfa3,在固体培养基上分离单菌株,同时在固体培养基上分离上述2.a转化后未经传代培养的yrna3单菌株,即基因组连续进化前后的酿酒酵母菌株,各挑选3个单菌落接种至含异丁醇的液体培养基中,异丁醇浓度浓度设置为0%、3%、6%、8%、9%,每24h测菌液od
660
值,比较基因组连续进化前后的酿酒酵母对异丁醇的耐受性和耐受稳定性。同时接种y415和yapobec各3个单菌落作为对照。
[0088]
实验结果表明,对照组y415和yapobec在更高浓度异丁醇的培养基中无法存活;在异丁醇浓度为8
‑
9%时,如图8所示,未进化的yrfa3菌株无法存活;实验组,即连续进化后的yrfa3’菌株能耐受并快速生长。
[0089]
应用例3:基因组突变菌株对乙酸盐的耐受性测试
[0090]
一类增加基因组突变率的碱基编辑系统,加速酿酒酵母基因组定向进化,提高其对乙酸盐的耐受性。
[0091]
a.取上述2.c(实施例1第2.c节)各样品连续传2代并生长稳定的菌液,接种等量菌液至含有不同浓度乙酸盐的scd
‑
leu液体培养基中培养,培养基中乙酸盐的浓度分别为:2g/l、4g/l、6g/l、8g/l、10g/l、12g/l;
[0092]
b.每24h测菌液od
660
值,比较不同菌株在含不同浓度乙酸盐的培养基中的生长情况。
[0093]
实验结果表明,在低浓度乙酸盐的培养基中,各菌株的生长速率没有明显差别;培养基中的乙酸盐浓度为6
‑
8g/l时,如图9所示,yhcs1、yrfa2、yrfa3、yrfa1的菌液浓度最高,ypri1、yapobec和ytop1生长速率较低,而y415的生长开始受到限制;培养基中乙酸盐浓度达到10g/l时,如图9所示,yrfa3、yrfa2、yryfa1和yhcs1的生长速率最高,ypri1、ytop1和yapobec的生长受到抑制,y415完全被抑制;当乙酸盐的浓度达到12g/l时,如图9所示,耐受性最好的是yhcs1、yrfa2和yrfa1,其次是yrfa3,其他菌株的生长受到显著抑制。综上所述,菌株yhcs1、yrfa2和yrfa1对乙酸盐的耐受性最好,而这三个菌株的突变率在各菌株中属于中等水平,推测在酿酒酵母中,中等突变率有利于进化对乙酸盐的耐受性。
[0094]
应用例4:基因组突变后的菌株对β
‑
胡萝卜素产量的影响
[0095]
一类增加基因组突变率的碱基编辑系统,加速酿酒酵母基因组定向进化,提高菌株胞内β
‑
胡萝卜素的产量。
[0096]
a.将基因组碱基编辑系统和对照组的表达质粒从e.coli抽提后,分别转化至基因组中整合了β
‑
胡萝卜素合成基因(crte、crtyb以及crti三个外源基因)的酿酒酵母by4741中,将转化后的菌株分别接种至scd
‑
leu液体培养基中培养,待菌液生长至稳定期,进行传代培养。
[0097]
c.菌液连续培养2代并至菌液生长至稳定期后,将菌液稀释至相同浓度,并涂布至scd
‑
leu的固体培养基上,培养基置于30℃的培养箱中,培养48h。
[0098]
d.在scd
‑
leu固体培养基上筛选橙色较深的单菌落,转接菌落至scd
‑
leu液体培养基中培养48h。
[0099]
e.每个样品取1ml菌液,测其od
660
值,并萃取胞内的β
‑
胡萝卜素。
[0100]
f.用hplc测β胡萝卜素标品,并制作标准曲线,流动相为50%乙腈 30%甲醇 20%异丙醇。
[0101]
g.用hplc测各样品在450nm的吸收波峰,根据标准曲线计算β
‑
胡萝卜素的产量。
[0102]
实验结果如图10所示,对照组y415和yrfa1菌株的β
‑
胡萝卜素产量是104.71和108.94mg/l,yrfa2的平均产量是p415的1.63倍,yhcs1的平均产量是y415的1.87倍,ytop1的平均产量是y415的2.42倍。综上所示,ytop1、yhcs1和yrfa2显著提高了b
‑
胡萝卜素的产量,推测在酿酒酵母中,基因组中等突变率有利于进化胡萝卜素的合成途径。
[0103]
实验证明,利用本发明构建的基因组碱基编辑系统,对酿酒酵母的基因组进行改造,具有简单,高效等优点,能够快速、高效用于改造酿酒酵母,使其提高对有机试剂的耐受性,提高目标产物的产量。
[0104]
应用例5:该碱基编辑系统在不同工业微生物的测试和应用
[0105]
一类增加基因组随机突变率的碱基编辑系统及应用。本发明构建的基因组碱基编辑系统具有普适性,可用于大部分工业菌株的连续进化,能够显著提高工业菌株的鲁棒性和生产性能。将该碱基编辑系统在毕赤酵母、大肠杆菌以及罗尔斯通氏菌中进行系统构建和功能验证。
[0106]
a.在不同工业菌株中,一类增加基因组随机突变率的碱基编辑系统的构建,同实施例1。
[0107]
b.一类增加基因组随机突变率的碱基编辑系统在毕赤酵母中的测试:将转化了基因组突变系统的毕赤酵母(mt)30μl菌液接入3ml的sed培养基中,连续培养2代,每次传代的接种量为1%。将毕赤酵母野生菌(wt)和进化菌株分别接种1%至含7%甲醇的sem培养基中,每个菌株设置3个重复,30℃培养20h,测试菌液的od
600
值。
[0108]
实验结果如图11所示,在甲醇浓度为7%时,毕赤酵母基因组突变菌株的细胞od
600
值是野生菌株的2.10倍。毕赤酵母野生菌的生长受到抑制,而基因组突变的菌株具有更高的甲醇耐受性。
[0109]
c.一类增加基因组随机突变率的碱基编辑系统在罗尔斯通氏菌中的测试:将转化了基因组突变系统的罗尔斯通氏菌(mt)30μl菌液接入3ml的mm培养基中,连续培养2代,每次传代的接种量为1%。将野生型菌株(wt)和进化菌株分别接种1%至无机培养基mm中,以5g/l的甲酸钠为唯一碳源,每个菌株设置3个重复,30℃培养48h,测试菌液的od
600
值。
[0110]
实验结果如图12所示,在甲酸钠浓度为5g/l时,罗尔斯通氏菌基因组突变菌株的细胞od
600
值是野生菌株的3.56倍。罗尔斯通氏菌野生菌的生长受到抑制,而基因组突变的菌株具有更高的甲酸钠耐受性。
[0111]
d.一类增加基因组随机突变率的碱基编辑系统在大肠杆菌中的测试:将转化了基因组突变系统的大肠杆菌(mt)30μl菌液接入3ml的lb培养基中,连续培养2代,每次传代的接种量为1%。将大肠杆菌野生菌(wt)和进化菌株分别接种1%至含0.1%乙酸钠的lb培养基中,每个菌株设置3个重复,37℃培养48h,测试菌液的od
600
值。
[0112]
实验结果如图13所示,在乙酸钠浓度为0.1%时,大肠杆菌基因组突变菌株的细胞od
600
值是野生菌株的2.72倍。大肠杆菌野生菌的生长受到抑制,而基因组突变的菌株具有更高的甲醇耐受性。
[0113]
实验结果表明该增加基因组随机突变率的碱基编辑系统提高了毕赤酵母、大肠杆菌、罗尔斯通氏菌等菌株对有机试剂的耐受性,验证了该加基因组随机突变率的碱基编辑系统在大部分工业菌株中的适用性。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。