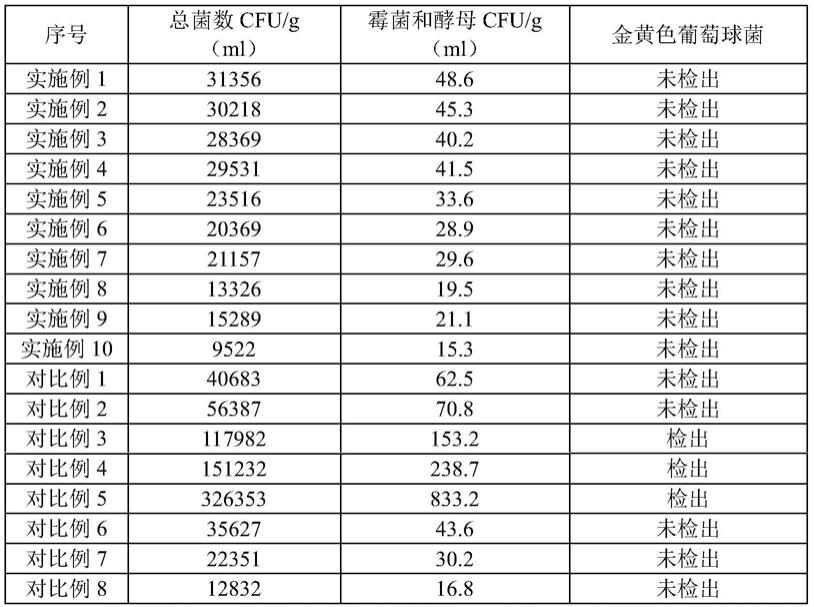
1.本发明属于食品营养及医药领域,涉及高螯合活性的小分子肽螯合亚铁及制备方法和补铁剂应用。
背景技术:
2.在全球范围内,铁缺乏被认为是三种隐性饥饿(微量营养素缺乏)之首。全世界约20%的人患有缺铁性贫血,其中孕妇和老年人所占比例较大,而成年男性的患病率也有10%。严重的铁缺乏状况促使各类补铁剂应用于食品、医药工业。目前,继第一代硫酸亚铁等无机补铁剂、第二代乳酸亚铁等有机补铁剂之后,肽金属离子螯合物作为第三代补铁剂,在膳食补充剂及医药中的应用正成为一个新的热点。
3.有研究表明,低分子肽具有抗氧化性、提高机体免疫能力、降血压、抗糖尿病活性、对癌细胞具有一定抑制及预防作用等。chen等研究发现低分子量肽(lwmp)处理有助于再生弹性纤维和胶原网络,增加大鼠血清中的超氧化物歧化酶(sod)并显着降低脂质过氧化物(mda);eckert等从丝瓜蛋白酶水解的蛋黄蛋白中提取的丝瓜蛋白酶种子可以分离出肽swv,swve和diln,显示出ace的ic 50抑制值分别为36.2、33.88和73.44μg/ml。dpp-iv酶负责使肠降血糖素激素葡萄糖依赖性促胰岛素多肽和glp-1失活,因此其抑制作用对控制高血糖症和2型糖尿病很重要;garc
í
a等研究了一富含海参水解物的食品,并报告了在小鼠肠组织中测试的抗炎、抗氧化和血管紧张素转化酶抑制活性以及高生物利用度。这项研究中还提到的其他研究显示出低分子量肽具有抗衰老和防癌作用。
4.肽金属螯合物具有较高的生物利用度,而且具有吸收快、营养性强等优势。同时,肽金属螯合物具有一些其他营养元素补充剂没有的生物活性,如抗氧化,抗菌,免疫调节等。已知的研究发现,小分子肽的吸收机制具有这些特点:小分子肽吸收快速,耗能低且载体不易饱和,而且哺乳动物对肽中氨基酸残基的吸收速度大于对游离氨基酸的吸收速度,所以小分子肽金属螯合物更适合用作营养元素的补充剂。由于绿豆的大分子蛋白质不易消化,且含有抗营养因子,直接食用其营养吸收及活性功能较低。因此,有必要对绿豆蛋白进行水解,获得小肽,不仅能提高其生物利用度,还能产生新的活性功效。
5.现阶段,对金属螯合活性肽的分离纯化技术仍面临产物纯度不高、螯合活性相对较低等问题,而固定化金属螯合亲和层析是分离具有金属螯合活性肽的最重要的一种纯化方法。林等采用金属亲和色谱从罗非鱼皮中获得tscip肽段,王等通过固定化金属亲和层析(imac-zn
2
)从芝麻水解物中鉴定出六种锌螯合肽,崔等采用固定金属亲和度色谱(imac)从南极磷虾中分离肽段,研究其结构特征,由此可实现高螯合活性肽的纯化。
6.本发明以固定化金属螯合亲和层析方法从绿豆肽中分离纯化出高螯合活性的小分子肽,并与亚铁盐进行高效螯合,同时加入保护剂,防止fe
2
氧化成fe
3
从而失去补铁功效,不仅可以制备出新型铁补充剂,还可以为绿豆营养功能的开发与深度利用提供新的途径。
技术实现要素:
7.本发明提供了六种高螯合活性的小分子肽螯合亚铁,由小分子肽与亚铁盐螯合而成,所述小分子肽包括按以下氨基酸序列组成的小分子肽中的一种或多种,分别为:
8.(1)ala-glu-asn-asn-gln-arg-asn-phe;
9.(2)ile-thr-pro-glu-lys-asn-pro-gln;
10.(3)glu-asn-leu-ala-arg-pro;
11.(4)ala-glu-phe-ala-glu-val-ser-lys;
12.(5)asn-asp-asn-leu-met-lys;
13.(6)gln-asp-thr-pro-arg-val。
14.进一步,所述小分子肽与亚铁盐的亚铁离子换算的质量比3.6:1~32.1:1。
15.进一步,所述亚铁盐包括七水合硫酸亚铁,四水合氯化亚铁,六水合硫酸亚铁铵和硫酸亚铁。
16.同时,本发明也提供高螯合活性的小分子肽螯合亚铁的制备方法,其具体是将小分子肽与亚铁盐混合后,在ph为6.0~8.0、温度45-50℃的条件下反应30-40min,用无水乙醇沉淀螯合物,抽滤,分离出的沉淀不断用无水乙醇洗涤,至滤液与菲啰嗪不产生颜色反应,干燥得到高螯合活性的小分子肽螯合亚铁;其中,所述小分子肽包括一种或多种由以下的氨基酸序列组成的小分子肽,其氨基酸序列分别为:
17.(1)ala-glu-asn-asn-gln-arg-asn-phe;
18.(2)ile-thr-pro-glu-lys-asn-pro-gln;
19.(3)glu-asn-leu-ala-arg-pro;
20.(4)ala-glu-phe-ala-glu-val-ser-lys;
21.(5)asn-asp-asn-leu-met-lys;
22.(6)gln-asp-thr-pro-arg-val。
23.其中,所述小分子肽从绿豆分离蛋白酶解水解而成,其制备方法包括以下步骤:
24.以绿豆分离蛋白为原料,加入去离子水溶解配制成4~6%(w/w)的绿豆蛋白溶液,在ph 9.6~10.5、温度为50
±
2℃的条件下通过碱性蛋白酶酶解,得到酶解混合液;
25.酶解后的混合液置于沸水浴中加热,并进行抽滤,收集滤液;
26.采用分子量100~200da的透析袋和去离子水透析滤液,直至无沉淀产生为止;
27.用ni-ida琼脂糖凝胶亲和层析和na2hpo4水溶液的洗脱对绿豆蛋白酶解产物分离纯化,收集螯合活性最强峰对应的流出液,即获得所述小分子肽。
28.所述将小分子肽与亚铁盐混合后,还加入盐酸羟胺亚铁保护剂。
29.本发明制备的小分子肽螯合亚铁可以用于制备补铁剂,其具有螯合性高,抗胃蛋白酶和胰蛋白酶的消化,稳定性强的特点,显著好于一代、二代补铁剂。
30.有益效果
31.本发明与现有技术相比,具有如下技术效果:
32.小分子肽的金属离子螯合肽已经有很多研究,但不同结构的小分子肽与金属离子结合的稳定程度与其螯合活性有着一定的相关性。经过酶解后的绿豆肽,不同分子量的肽其金属离子的螯合活性有很大的区别,本发明利用固定化金属螯合亲和层析法分离纯化绿豆蛋白酶解液,实验结果表明,本发明分离出来的小分子肽,其金属离子螯合活性非常高。
该方法分离的高螯合活性绿豆肽与亚铁离子螯合后,得到的小分子绿豆肽-亚铁螯合物在模拟胃肠道消化液中具备良好的稳定性,其在小肠的吸收利用率显著高于一代、二代补铁剂。
33.本发明是一种高螯合活性的绿豆小分子肽亚铁制备方法,按此方法制备出的高纯度的小分子肽和与亚铁离子的螯合活性得到大幅度提升,高达61μg/mg;原料为绿豆蛋白或绿豆分离蛋白,具有丰富的氨基酸含量,营养均衡,且相较于动物源蛋白,植物源蛋白是一种可持续、价廉和更健康的选择;分离、制备方法均在温和的条件下进行,环保节能,重现性好。
34.本发明制备的小分子肽螯合亚铁的食用安全性好,无毒无害,可以抵御制备时存在的氧化剂干扰,对亚铁离子起到很好的保护作用,同时体外消化吸收率高于一代、二代补铁剂,可以应用于食品保健品、医药等高效补铁剂。
附图说明
35.图1是绿豆肽含量标准曲线;
36.图2是微量亚铁离子含量标准曲线;
37.图3是亚铁离子含量标准曲线;
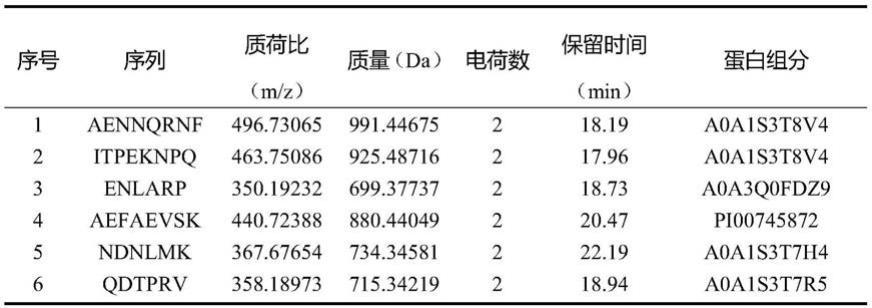
38.图4是f
ni-3
组分的g-15葡聚糖凝胶过滤及分子量的测定结果;
39.图5是氨基氮含量标准曲线;
40.图6是绿豆肽-亚铁螯合物及绿豆肽的消化稳定性评估结果图;
41.图7是组分m3总离子流图;
42.图8是本发明3条肽段的ms/ms谱图;
43.图9是本发明另外3条肽段的ms/ms谱图;
44.图10是不同补铁剂组的小鼠体重增长(a)、脾脏系数(b)情况;
45.图11是不同补铁剂的小鼠血清铁(a)、血红蛋白(b)、血细胞数(c)及红细胞压积(d)水平。
具体实施方式
46.本发明提供了一种高螯合活性绿豆肽的分离方法。
47.下面通过结合实施例和试验例对本发明的技术方案做进一步说明,以便更好理解本发明,但不理解为对本发明的限制:
48.实施例1
49.取50g绿豆蛋白溶于950ml去离子水中,配制成5%(w/w)的绿豆蛋白溶液。将其置于恒温磁力搅拌器上,温度设定为50
±
2℃,用1mol/l的hcl和naoh溶液调整绿豆蛋白溶液ph至10,加入1.875g碱性蛋白酶,水解2h后,将混合液置于沸水浴中加热10min。后将混合液冷却至室温抽滤,收集滤液。用透析袋对滤液进行脱盐处理,截留分子量为100的透析袋,用去离子水清洗干净,装入滤液10ml,并用夹子封紧透析袋两端,置于1l去离子水中。在4℃环境下每4h更换一次透析液,并在透析液中滴加0.1mol/l的agno3溶液至无白色沉淀析出为止,约12h后脱盐结束。将透析后的滤液,冷冻干燥制成绿豆肽干粉,于-20℃下保存。取用碱性蛋白酶制备的绿豆肽干粉制备成10mg/ml的储备液,用带有0.22μm微孔滤膜的进样器进
样1ml。调整流速为1ml/min,流动相为na2hpo4,每5min收集一管,共80管。从收集分离得到的第54管至第63管,冷冻干燥,制得亚铁螯合活性肽;取0.8g绿豆肽粉加入5ml去离子水溶解,与5mlfecl2·
4h2o(2%,w/w)溶液加入0.1g盐酸羟胺亚铁保护剂,所述绿豆肽与fecl2·
4h2o的亚铁离子换算的质量比28.6:1,将反应ph调至8.0,并将混合液置于磁力搅拌器上45℃,反应40min。结束后,用无水乙醇沉淀螯合物,抽滤,分离出的沉淀不断用无水乙醇洗涤,至滤液与菲啰嗪不产生颜色反应,将沉淀物冷冻干燥,即为绿豆肽亚铁,其螯合率为87.11%。
50.高螯合活性小分子绿豆亚铁螯合肽的质谱鉴定
51.对高亚铁螯合活性组分进行nano lc-ms/ms质谱鉴定,得到总离子流图见图7。根据ms/ms图谱中产生的正离子模式的碎片离子峰,经pfind软件分析并通过uniprotkb绿豆蛋白库(种属:绿豆(vigna radiata var.radiata(mung bean)(phaseolus aureus)),共35564条序列。进行搜索比对,该组分通过nano lc-ms/ms分析出6种肽段的氨基酸序列见图8和图9,这些肽的结构信息见表1。
52.由图8、9及表1中的结果综合,集中收集与fe
2
螯合活性最优组分,经lc-ms/ms鉴定出6条亚铁螯合肽段,其均含有6-8个氨基酸,分子量均在1000da以下,其氨基酸序列为:ala-glu-asn-asn-gln-arg-asn-phe(aennqrnf)、ile-thr-pro-glu-lys-asn-pro-gln(itpeknpq)、glu-asn-leu-ala-arg-pro(enlarp)、ala-glu-phe-ala-glu-val-ser-lys(aefaevsk)、asn-asp-asn-leu-met-lys(ndnlmk)和gln-asp-thr-pro-arg-val(qdtprv)。
53.表1 6条肽段的质谱鉴定结果
[0054][0055]
实施例2
[0056]
取8g绿豆蛋白溶于192ml去离子水中,配制成4%(w/w)的绿豆蛋白溶液。将其置于恒温磁力搅拌器上,温度设定为50
±
2℃,用1mol/l的hcl和naoh溶液调整绿豆蛋白溶液ph至10.6,加入0.25g碱性蛋白酶,水解2h后,将混合液置于沸水浴中加热10min。后将混合液冷却至室温抽滤,收集滤液。用透析袋对滤液进行脱盐处理,截留分子量为100的透析袋,用去离子水清洗干净,装入滤液10ml,并用夹子封紧透析袋两端,置于1l去离子水中。在4℃环境下每4h更换一次透析液,并在透析液中滴加0.1mol/l的agno3溶液至无白色沉淀析出为止,约12h后脱盐结束。将透析后的滤液,冷冻干燥制成绿豆肽干粉,于-20℃下保存。取用碱性蛋白酶制备的绿豆肽干粉制备成10mg/ml的储备液,用带有0.22μm微孔滤膜的进样器进样1ml。调整流速为1ml/min,流动相为na2hpo4,每5min收集一管,共80管。从收集分离得到的第54管至第63管,冷冻干燥48h,制得亚铁螯合活性肽;取0.4g绿豆肽粉加入5ml去离子水溶
解,与5mlfeso4(1%,w/w)溶液加入0.05g盐酸羟胺亚铁保护剂,将反应ph调至6.0,并将混合液置于磁力搅拌器上40℃,反应30min。结束后,用无水乙醇沉淀螯合物,抽滤,分离出的沉淀不断用无水乙醇洗涤,至滤液与菲啰嗪不产生颜色反应,将沉淀物冷冻干燥,即为绿豆肽亚铁,其螯合率为96.19%。
[0057]
经过检测,本实施例制得的绿豆肽亚铁中的绿豆肽的氨基酸序列为:ala-glu-asn-asn-gln-arg-asn-phe(aennqrnf)、ile-thr-pro-glu-lys-asn-pro-gln(itpeknpq)、glu-asn-leu-ala-arg-pro(enlarp)、ala-glu-phe-ala-glu-val-ser-lys(aefaevsk)、asn-asp-asn-leu-met-lys(ndnlmk)和gln-asp-thr-pro-arg-val(qdtprv)。与实施例1相同。
[0058]
实施例3
[0059]
取4g绿豆蛋白溶于94ml去离子水中,配制成6%(w/w)的绿豆蛋白溶液。将其置于恒温磁力搅拌器上,温度设定为50
±
2℃,用1mol/l的hcl和naoh溶液调整绿豆蛋白溶液ph至9.6,加入0.1875g碱性蛋白酶,水解2h后,将混合液置于沸水浴中加热10min。后将混合液冷却至室温抽滤,收集滤液。用透析袋对滤液进行脱盐处理,截留分子量为200的透析袋,用去离子水清洗干净,装入滤液10ml,并用夹子封紧透析袋两端,置于1l去离子水中。在4℃环境下每4h更换一次透析液,并在透析液中滴加0.1mol/l的agno3溶液至无白色沉淀析出为止,约12h后脱盐结束。将透析后的滤液,冷冻干燥制成绿豆肽干粉,于-20℃下保存。取用碱性蛋白酶制备的绿豆肽干粉制备成20mg/ml的储备液,用带有0.22μm微孔滤膜的进样器进样0.5ml。调整流速为1ml/min,流动相为na2hpo4,每5min收集一管,共80管。从收集分离得到的第54管至第63管,冷冻干燥,制得亚铁螯合活性肽;取0.7g绿豆肽粉加入5ml去离子水溶解,与5mlfeso4·
7h2o(2%,w/w)溶液加入0.1g盐酸羟胺亚铁保护剂,将反应ph调至8.0,并将混合液置于磁力搅拌器上45℃,反应40min。结束后,用无水乙醇沉淀螯合物,抽滤,分离出的沉淀不断用无水乙醇洗涤,至滤液与菲啰嗪不产生颜色反应,将沉淀物冷冻干燥,即为绿豆肽亚铁,其螯合率为89.20%。
[0060]
经过检测,本实施例制得的绿豆肽亚铁中的绿豆肽的氨基酸序列为:ala-glu-asn-asn-gln-arg-asn-phe(aennqrnf)、ile-thr-pro-glu-lys-asn-pro-gln(itpeknpq)、glu-asn-leu-ala-arg-pro(enlarp)、ala-glu-phe-ala-glu-val-ser-lys(aefaevsk)、asn-asp-asn-leu-met-lys(ndnlmk)和gln-asp-thr-pro-arg-val(qdtprv)。与实施例1相同。
[0061]
小分子肽分子量分布测定试验
[0062]
使用g-15葡聚糖凝胶过滤色谱法测定分子量分布。
[0063]
g-15葡聚糖凝胶预处理:将50g葡聚糖干粉与200ml蒸馏水混合,在沸水浴中加热2h,期间不断用玻璃棒搅拌使葡聚糖颗粒受热均匀并充分溶胀。待冷却后,除去悬浮在上层清液中的细小葡聚糖颗粒,并使其在室温下静置24h待用。
[0064]
g-15葡聚糖凝胶层析柱的填装:用玻璃棒不断搅拌并将凝胶转移进玻璃层析柱(16
×
200mm)中,待凝胶在柱内沉降完毕形成柱床后,打开出样口,使多余的蒸馏水在重力下自然流出。继续装柱至柱床高度为18cm时结束。打开恒流泵使流速为1.0ml/min,用10倍柱体积蒸馏水淋洗除去柱床中的杂质及原始储存液。结束后将流速调整为2ml/min,用5倍柱体积的0.1mol/lnacl溶液平衡柱床。直到流出液通过紫外检测器在220nm波长下的吸光
值稳定。
[0065]
分别取标准分子量对照品杆菌肽(1422.69da),氧化型谷胱甘肽(612.63da)及谷胱甘肽(307.32da)各50mg溶解在10ml蒸馏水中配制成5mg/ml的混合标准液。取1ml标液加进层析柱中,调整流速为0.3ml/min,用0.1mol/l的nacl溶液进行洗脱,记录不同分子量标品在220nm波长下的出峰时间。
[0066]
配制5mg/ml的高亚铁螯合活性的绿豆肽溶液,取1ml样液上柱并按照上述方法进行洗脱。并通过紫外检测器记录其在220nm波长下的洗脱曲线。与标准分子量的出峰时间进行对照确定分子量分布。
[0067]
从图7和表2中可看出通过g-15葡聚糖凝胶过滤色谱,高亚铁螯合活性组分f
ni-3
被分成了4个馏分。通过分子量划分发现,由亲和层析分离得到的f
ni-3
组分的相对分子质量主要集中在1422da以下。而亚铁螯合活性较高的两个馏分f
ni-3-1和f
ni-3-2的相对分子量集中在307-1422da,含量占到f
ni-3组分的72.36%。低于307da的部分的亚铁螯合活性相对较低,含量仅占f
ni-3组分的27.64%。综上所述,具有高亚铁螯合活性的绿豆肽分子量主要集中在300-1400da之间。
[0068]
表2凝胶过滤色谱各馏分的百分含量及亚铁螯合活性
[0069][0070]
体外稳定性验证试验
[0071]
将实施例1~3制备得到的小分子肽的亚铁螯合物在模拟消化液的稳定性。
[0072]
将50mg实施例1~4制备的螯合物样品用50ml去离子水溶解。用1mol/lhcl溶液调节ph为2.0,加入1mg胃蛋白酶,混合液在恒温磁力搅拌器上于37℃下加热2h以模拟胃液消化;反应结束后,用1mol/l的naoh溶液调节混合液ph为8.0使胃蛋白酶失活并加入0.34g kh2po4以营造肠液环境,然后加入2mg胰蛋白酶于混合液中开始模拟胰液消化。37℃下消化4h后停止反应并调节温度至90℃。没有添加螯合物的模拟胃肠液作为对照进行相同的试验。
[0073]
游离态氨基氮和游离态亚铁离子测定方法
[0074]
螯合物及绿豆肽的总氨基氮通过凯氏定氮法测得。并利用茚三酮比色法来检测消化过程前后螯合物及绿豆肽中游离态氨基氮的含量,计算得出每个阶段反应前后游离态氨基氮的增加量。而每个阶段反应前后游离态亚铁离子的释放量通过菲啰嗪比色法测得。每阶段释放出的游离态氨基氮和亚铁离子占总氮及总铁含量的百分比计算公式如下(氨基氮含量标准曲线如图5所示):
[0075]
[0076][0077]
从图6中可以看出对照组绿豆肽经模拟胃液消化后,游离氨基氮含量增加了21.25
±
1.22%;模拟胰液进一步消化后,游离氨基氮含量增加了13.11
±
0.98%。对于实施例1~3的绿豆肽-亚铁螯合物,模拟胃液使游离亚铁增加10.25
±
0.23%,游离氨基氮增加5.79
±
0.34%;模拟胰腺消化后,游离亚铁仅增加3.51
±
0.11%,游离氨基氮增加7.11
±
0.77%。
[0078]
通过上述数据可以看出,绿豆肽-亚铁螯合物在经过模拟胰液消化过后,其游离态氨基氮和亚铁离子的释放量显著低于模拟胃液消化时的数值。因为在肠液的微碱性环境下,螯合物较为稳定,在胰蛋白酶的作用下,仅有极少部分的螯合物发生了分解,释放出了游离态氨基氮和亚铁离子。
[0079]
这些结果表明,在体外模拟胃肠道消化过程中,绿豆肽-亚铁螯合物无论在模拟胃液消化还是模拟肠液消化中其稳定性均高于其他小分子肽和绿豆肽。其中螯合物在模拟肠液消化时的稳定性要显著高于其在模拟胃液消化时的稳定性。
[0080]
绿豆肽亚铁螯合物食用后经消化道进入胃液然后进入小肠被小肠上皮细胞所吸收利用。试验证明绿豆肽亚铁螯合物在模拟胃肠消化液中保持较高的稳定性,可以让其以完整的结构进入小肠上皮细胞的肽转运通道进入细胞被消化利用。这种形式的消化吸收速率远高于游离亚铁通过主动运输机制消化吸收的速率,且避免了不同金属离子在消化吸收时产生的拮抗作用。
[0081]
实施例4
[0082]
按照实施例1~3得到的绿豆肽的氨基酸序列,申请人按照所述的氨基酸序列采用固相合成法人工合成了以下的小分子肽(南京肽谷生物科技公司),六种小分子肽的氨基酸组成为:ala-glu-asn-asn-gln-arg-asn-phe(aennqrnf)、ile-thr-pro-glu-lys-asn-pro-gln(itpeknpq)、glu-asn-leu-ala-arg-pro(enlarp)、ala-glu-phe-ala-glu-val-ser-lys(aefaevsk)、asn-asp-asn-leu-met-lys(ndnlmk)和gln-asp-thr-pro-arg-val(qdtprv)。
[0083]
取0.5g合成小分子肽纯品加入5ml去离子水溶解,与fe(nh4)2·
(so4)2·
6h2o(2%,w/w)溶液加入0.1g盐酸羟胺亚铁保护剂,经过计算所述小分子肽与fe(nh4)2·
(so4)2·
6h2o的亚铁离子换算的质量比3.6:1~32.1:1,将反应ph调至7.0,并将混合液置于磁力搅拌器上45℃,反应40min,反应结束后用无水乙醇沉淀螯合物,抽滤,分离出的沉淀不断用无水乙醇洗涤,至滤液与菲啰嗪不产生颜色反应,将沉淀物冷冻干燥,即为小分子肽亚铁,人工合成的所述小分子肽亚铁的螯合率为88.69~96.19%之间。
[0084]
所述小分子肽亚铁的螯合物用于制备补铁类药品,其具有吸收率高,稳定性强,损失率少的特点。
[0085]
表3不同小分子肽亚铁螯合物的稳定性
[0086][0087]
实施例5
[0088]
本实施例将实施例1制备的绿豆肽亚铁螯合物对大鼠缺铁性贫血(ida)的改善作用功效验证。采用三周龄icr小鼠喂养以缺铁性饲料4周获得缺铁性贫血模型,小鼠体重增长与脾脏系数结果如图10所示,模型组体重增加幅度相比于正常空白组有所降低,而脾脏系数模型组相较于空白组有显著增加;经过铁补充期28天后,高剂量绿豆肽亚铁螯合物(h mph-fe)体重增加幅度相比于模型组有显著上升,甘氨酸亚铁、hmph-fe和mph协同fe
2
吸收组脾脏系数相比于模型组有显著降低,然而低剂量组与模型组无显著性差异(p《0.05)。ida小鼠脾脏出现肥大现象,结果显示补铁可逆转脾的肥厚。
[0089]
对于血液学指标,本实验检测了血清铁(si)、血红蛋白(hb)、血细胞数(rbc)和红细胞压积(hct)。如图11所示,喂养缺铁饲料的正常小鼠四周后si水平显著低于空白组和补铁组,h mph-fe和mph协同fe
2
吸收组小鼠的si水平显著升高。h mph-fe组和mph协同fe
2
吸收组si水平显著高于模型组和甘氨酸亚铁组,与正常空白组(p》0.05)无显著性差异。hb是缺铁性贫血症的重要血液指标之一,本实验发现ida显著降低小鼠hb水平。与模型组相比,h mph-fe组ida小鼠hb水平显著升高。高剂量组小鼠hb水平显著高于阳性对照甘氨酸亚铁组(p《0.05)。图11c&d结果显示,与模型组相比,缺铁对其他各组小鼠rbc和hct水平均有显著影响(p《0.05)。与模型组相比,高剂量和mph协同fe
2
吸收组小鼠rbc和hct水平显著升高;高剂量、甘氨酸亚铁和mph协同fe
2
吸收组小鼠与正常空白组之间无显著差异(p《0.05)。
[0090]
本研究血液参数指标数据显示,绿豆肽亚铁螯合物对小鼠ida的治疗有积极作用,可能是铁缺乏的潜在铁源,尤其是达到有效剂量后有显著效果;绿豆肽亚铁螯合物和绿豆肽协同fe
2
吸收在缓解缺铁性贫血方面均具有效作用,且均优于有机补铁剂甘氨酸亚铁的效果。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。