z选择性烯烃复分解催化剂的新合成
1.相关申请的交叉引用
2.本技术要求2019年7月17日提交的美国专利申请号62/875,156的优先权,该美国专利申请的内容出于所有目的全文以引用方式并入本文。
3.政府权利
4.本发明是在由美国国家卫生研究院授予的授权号gm031332和由美国国家科学基金会授予的授权号che1502616下在政府支持下进行的。政府在本发明中享有某些权利。
技术领域
5.本公开涉及制备钌化合物的方法,该钌化合物可用于复分解反应中,优选地用于制备空间位阻钌催化剂,用于导致z-烯烃优先形成的复分解反应中;由此类方法产生的化合物;以及此类化合物作为烯烃复分解中的催化剂的用途。这些化合物可用于催化、有机合成、聚合物化学的领域中以及工业应用,诸如精细化学品和药物中。
背景技术:
6.烯烃复分解是用于碳-碳双键形成的高度有价值的合成方法。钌复分解催化剂技术已经使几个研究平台具有广泛应用,包括开环复分解聚合(ring opening metathesis polymerization,romp)、开环交叉复分解(ring opening cross metathesis,rocm)、交叉复分解(cross metathesis,cm)、闭环复分解(ring closing metathesis,rcm)、和无环二烯复分解(acyclic diene metathesis,admet)。在这些应用中的大多数应用中,形成了内烯烃作为反应产物。
7.内烯烃是现代药物、农用化学品和功能性材料中的重要构件,并且是用于复杂目标合成的方便途径。内烯烃的构型,通常定义为e或z,确定了分子的整体构型,从而影响分子的物理、化学和生物特性。考虑到与e/z烯烃混合物的分离相关联的一般困难,在从实验室研究到工业生产的各种应用中,特别是在最小化浪费和精简合成方面,非常需要以精确构型控制来选择性构建内烯烃。
8.常规的烯烃复分解催化剂通常提供混合物z-烯烃和e-烯烃的混合物。在这些情况中的许多情况下,e-烯烃是主要产物。当产物由热力学平衡产生时,两种异构体之间的能量差产生为约5:1至约9:1的e-:z-比率。
9.grubbs组在2011年报告掺入某种类型的碳螯合n-杂环碳烯(n-heterocyclic carbene,nhc)配体产生了催化高度z选择性烯烃复分解的grubbs z选择性钌烯烃复分解催化剂(endo,k.;grubbs,r.h.chelated ruthenium catalysts for z-selective olefin metathesis j.am.chem.soc.2011,133,8525-8527),诸如ru-1和ru-2(图1)。
[0010][0011]
具有碳螯合nhc配体的grubbs z选择性钌烯烃复分解催化剂的合成依赖于nhc配体的分子内c-h键活化。这是形成必需的螯合以实现适当的z选择性的关键步骤,并且因此是整个合成的关键步骤。
[0012]
为了实现此,grubbs组开发了一种涉及在二氯化钌前体与新戊酸银之间进行阴离子配体取代以形成二新戊酸盐化合物的方法(endo,k.;grubbs,r.h.chelated ruthenium catalysts for z-selective olefin metathesis j.am.chem.soc.2011,133,8525-8527)。然后使产生的二新戊酸钌经历同时c-h键活化以形成键ru-c键以及期望的螯合。然而,新戊酸银的使用非常昂贵,尤其是在商业规模上。此外,虽然此方法对于化合物(诸如在nhc(ar=mes)上具有小均三甲苯基基团的ru-1)的合成是有效的,但是此种方法无法用于制备具有较庞大的侧基的化合物(诸如具有较大的2,6-二异丙基苯基(ar=dipp)的ru-2),由于银诱导的分解,在许多情况下,这种具有较庞大的侧基的化合物是更有效和更具选择性的催化剂。在2013年,grubbs组报告了使用新戊酸钠代替新戊酸银的经改进的方法,该方法提供了ru-2及其相关催化剂的获得途径(rosebrugh,l.e.;herbert,m.b.;marx,v.m.;keitz,b.k.;grubbs,r.h.highly active ruthenium metathesis catalysts exhibiting unprecedented activity and z-selectivity j.am.chem.soc.2013,135,1276-1279);还参见美国专利号us 9,586,981。然而,这种经改进的方法仍然需要大量的昂贵试剂(新戊酸钠,10当量)和重大、耗时的反应条件(40℃持续4天),尤其是对于工业放大来说。更重要的是,总产率低(20%至30%),这不可避免地增加了催化剂生产的成本并显著延迟了这种类型的重要z选择性烯烃复分解催化剂的商业应用。另外,考虑到将需要空间的新戊酸根引入到空间位阻ru前体上极端困难,所以携带具有比dipp更大的ar的nhc的z选择性催化剂(其可以具有进一步改进的催化活性)先前尚未被成功合成(图2a至图2b)。
[0013]
因此迫切需要高效、高产且易于缩放的用于合成grubbs z选择性钌烯烃复分解催化剂的过程,特别是进行c-h键活化步骤以形成螯合。本公开解决了现有技术中的这些缺点中的一些缺点。
技术实现要素:
[0014]
为了满足该第一需求,发明人已经探索出了grubbs z-选择性钌烯烃复分解催化剂的新颖合成。特别地,通过使用较便宜的试剂(例如,在此以叔丁醇钾/吡唑酸锂(lithium pyrrolate)和新戊酸举例说明)以与现有过程相比更高的产率实现了c-h键活化。参见例如,图3。
[0015]
本公开涉及制备通式(c)的化合物,尤其是空间位阻化合物,或其立体异构体的方法
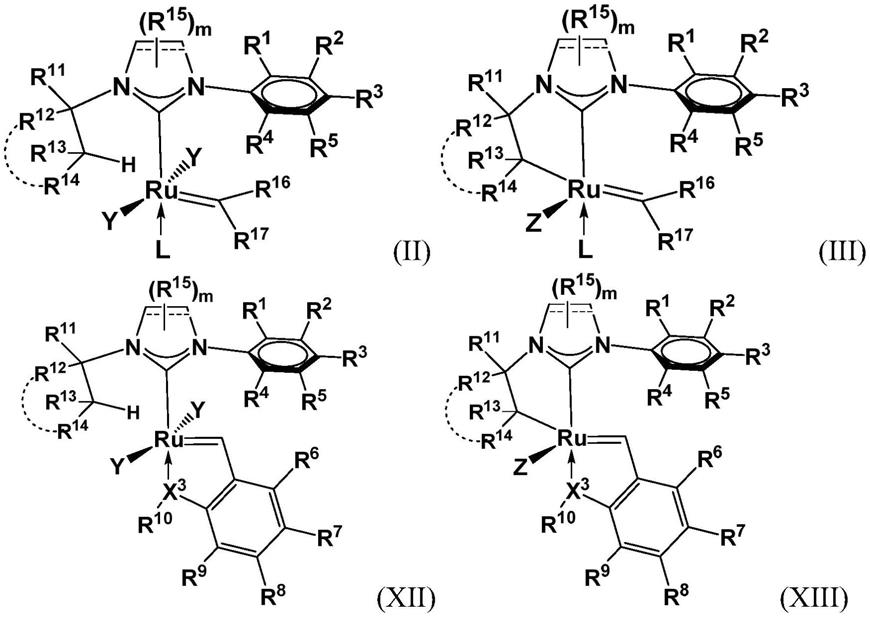
[0016][0017]
该方法包括一系列步骤,该一系列步骤包括使对应通式(b)的化合物与羧酸反应以形成通式(c)的化合物的步骤,其中二齿阴离子配体是羧酸根。通式(b)的化合物可以通过使具有对应通式(a)的二卤代化合物与阴离子碱反应来形成,该阴离子碱能够置换卤基配体并作为单齿配体配位至钌中心以形成任选地分离的中间体。后续反应可用于以其他二齿阴离子配体(例如硝酸根等)置换羧酸根配体。本文描述了被描述为nhc(n-杂环碳烯)的部分中的每个部分、芳香族侧基、空间位阻基团、碱、二齿阴离子配体、卤基、碳烯和配体。
[0018]
在此一般上下文中,某些实施方案包括那些制备式(iii)或(xiii)的化合物的方法,该方法包括分别使式(ii)或(xii)的化合物或其几何异构体与式z-h的羧酸接触,其中该接触导致分别形成式(iii)或(xiii)的化合物或其几何异构体:
[0019][0020][0021]
变量r1、r2、r3、r4、r5、r6、r7、r8、r9、r
10
、r
11
、r
12
、r
13
、r
14
、r
15
、和m定义了这些结构上的各种和任选的取代基。y独立地是作为配体配位至钌中心的碱性阴离子。z是任选经取代的羧酸根阴离子,优选地叔羧酸根阴离子,该z作为配体配位至钌中心。l是供体配体。x3是能
够充当钌中心的配体的杂原子。这些变量中的每个变量在本文中别处更明确地定义。
[0022]
其他实施方案包括这样的方法,这些方法包括使式(i)或(xi)的化合物或其几何异构体与式[m
][y-]的盐接触,其中该接触导致分别形成式(ii)或(xii)的化合物或其几何异构体:
[0023][0024]
其中:
[0025]
x1和x2独立地是卤基(例如,氯、溴、或碘);
[0026]m
是如本文所述的单阳离子当量阳离子。
[0027]
在该实施方案的一些方面中,方法可以与早期描述的方法独立地或串联地进行,该早期描述的方法涉及将式(ii)的化合物转化成式(iii)的化合物、或将式(xii)的化合物转化成式(xiii)的化合物。
[0028]
在各方面或实施方案中,m
根据碱金属阳离子、铵阳离子或其他基于氮的阳离子定义,但是也考虑其他阳离子选项(例如,二价或三价阳离子)。
[0029]
其他实施方案包括这样的方法,这些方法包括使式(iii)或(xiii)的化合物或其几何异构体与能够作为二齿配体对钌进行配位的三氟乙酸根、硝酸根、亚硝酸根、草酸根、磷酸根、亚硫酸根、或磺酸根、或其他强酸(h-q)的阴离子反应,以分别形成式(iv)或(xiv)的化合物或其几何异构体:
[0030][0031]
其中q是经配位的三氟乙酸根、硝酸根、亚硝酸根、草酸根、磷酸根、亚硫酸根、磺酸根、或其他强酸(h-q)的阴离子,这些离子能够作为二齿配体对钌进行配位。通常,这些阴离子作为二齿配体配位至钌。基于此类复合物的反应性,硝酸根似乎是优选的。这些阴离子的铵盐似乎是这些阴离子的合适种类。特别地,硝酸铵在本文中很好地起作用。
[0032]
在该实施方案的一些方面中,方法可以与早期描述的方法独立地或串联地进行,该早期描述的方法涉及将式(i)的化合物转化成式(ii)的化合物、将式(ii)的化合物转化成式(iii)的化合物、或将式(xi)的化合物转化成式(xii)的化合物、将(xii)的化合物转化成式(xiii)的化合物。在串联进行的情况下,可以进行方法,而无需分离式(ii)或(xii)的化合物。
[0033]
这些前述实施方案的各个方面包括阐述定义方法中所涉及的结构的若干变量的特定选项的那些方面。这些包括以下叙述的那些:
[0034]
(a)在正性叙述和排除两方面,芳香族侧基上的特定偏好取代基模式,包括大体积的烷基取代基和任选经取代的稠环系。以及
[0035]
(b)对取代基中的一些取代基的偏好,这些取代基包括r
10
(和/或r
10a
),和/或空间位阻基团包括直链、支链、环状或多环烷基。在一些方面中,从r
10
和/或r
10a
的定义中排除异丙基。
[0036]
其他实施方案包括可从本文所阐述的方法获得的那些钌化合物,包括式(xx-a)、(xx-b)、(xx-c)或(xx-d)的那些钌化合物:
[0037][0038]
其中变量r1、r2、r3、r4、r5、r6、r7、r8、r9、r
10
、r
11
、r
12
、r
13
、r
14
、r
15
、和m定义了这些结构上的各种和任选的取代基。g包括也与x1、x2相关联的变量,并且y作为配体配位至钌中心。l是供体配体。x3是能够充当钌中心的配体的杂原子。这些变量中的每个变量在本文中别处更明确地定义。这些化合物包括先前关于g的定义未知的那些化合物,以及先前主要但不仅仅是因为它们的配体的大体积而不可接近和未知的那些化合物。
[0039]
其他实施方案包括可从本文所阐述的方法获得的那些钌化合物,包括式(y-a)、(y-b)、(y-c)或(y-d)的那些钌化合物:
[0040]
[0041]
其中变量r1、r2、r3、r4、r5、r6、r7、r8、r9、r
10
、r
11
、r
12
、r
13
、r
14
、r
15
、和m定义了这些结构上的各种和任选的取代基。j包括但不限于也与x1、x2相关联的那些变量,y、q和z作为配体配位至钌中心。l是供体配体。x3是能够充当钌中心的配体的杂原子。这些变量中的每个变量在本文中别处更明确地定义。这些化合物包括先前关于j的定义未知的那些化合物,以及先前主要但不仅仅是因为它们的配体的大体积而不可接近和未知的那些化合物。
[0042]
其他实施方案包括在复分解反应中使用本文阐述的化合物中的任何化合物作为催化剂。在一些此类实施方案中,该方法包括使至少一种烯烃、炔烃或烯炔与本文所述的钌化合物中的任何钌化合物接触,该接触导致复分解,例如:
[0043]
(a)两种不同烯烃,或烯烃、炔烃和/或烯炔的交叉复分解(cm);
[0044]
(b)二烯的闭环复分解(rcm),从而导致形成环烯烃环;
[0045]
(c)两种烯烃的同二聚化
[0046]
(d)无环二烯复分解(admet),从而导致形成低聚物和/或聚合物;
[0047]
(e)开环交叉复分解(rocm),从而导致无环二烯;
[0048]
(f)环烯烃的开环复分解聚合(romp),从而导致聚合物;或
[0049]
(g)烯烃的e/z异构体混合物的乙烯醇分解以提供混合物的e烯烃烯烃含量的富集。
[0050]
在某些优选实施方案(例如,(a)至(f))中,催化剂提供一种或多种复分解反应的有利产物主要是z异构体烯烃。在(g)的情况下,有利的反应物是z异构体。
附图说明
[0051]
本技术在结合附图阅读时得以被进一步理解。为了说明主题,在附图中示出了主题的示例性实施方案;然而,当前公开的主题不限于所公开的特定方法、装置和系统。另外,附图不一定按比例绘制。在附图中:
[0052]
图1a示出了用于z选择性烯烃复分解和市售grubbs z催化剂的一般方案。图1b描绘导致有利的z选择性复分解途径的空间相互作用的一种可能表示
[0053]
图2a至图2b示出了通过直接与羧酸根阴离子进行阴离子交换形成催化剂的现有技术尝试,该现有技术尝试尤其对于大nhc来说是麻烦的。使用较庞大的ar基团(即,ar》dipp)时,反应是迟滞和低产的。当ar=mes时,naopiv和agopiv两者均得到高产率。当ar=dipp时,naopiv得到20%产率(10当量,4天,40℃),并且agopiv分解(参阅图2b)。当ar》dipp时,产品不可接近。
[0054]
图3示出了本公开的例示。
[0055]
图4a至图4c示出了本公开的各种通用/示例性方法步骤。
[0056]
图5是粗品ru-4的代表性1h-nmr光谱。
[0057]
图6是ru-5的代表性1h-nmr光谱。
[0058]
图7示出了ru-7的代表性1h-nmr光谱。
[0059]
图8是ru-8的代表性1h-nmr光谱。
[0060]
图9是ru-12的代表性1h-nmr光谱。
[0061]
图10提供生物活性化合物中的(z)-α,β-不饱和酰胺作为构件的示例。
[0062]
图11提供用于构建(z)-α,β-不饱和酰胺的现有技术中的方法和限制。
具体实施方式
[0063]
本公开涉及用于制备钌催化剂的方法,该钌催化剂包括grubbs z选择性钌烯烃复分解催化剂,该钌催化剂克服了引入新戊酸根和其他羧酸根和相关联的c-h键活化步骤的困难。先前,新戊酸钌中间体是通过直接卤离子-新戊酸根阴离子交换合成的,这被证明在使用需要空间的nhc配体时是麻烦的。在本文中,描述了一种新方法,该新方法在一个方面包括使用钌卤化物前体与强碱反应以生产钌碱复合物,然后将该钌碱复合物用新戊酸处理以产生双新戊酸钌,该双新戊酸钌经历同时c-h活化。通过碱的适当选择,第一步骤经显示在温和条件下以高产率平稳地进行,即使在存在需要空间的nhc(例如,其中ar至少就dipp而言是在空间上具有挑战性的)也如此。钌碱复合物与新戊酸之间的酸-碱猝灭提供了用于第二步骤的强热力学驱动力,从而允许第二步骤以高产率进行。除了高总产率之外,这种新方法还具有使用廉价试剂(例如,叔丁醇钾和吡唑酸锂作为碱(参见下文),和新戊酸)和工业友好的反应条件(例如在接近室温下)的特征。作为一个代表性示例,虽然先前的方法仅能够以20%至30%的产率产生ru-3(可商购获得的ru-2的前体),但是这种新方法通过使用廉价的吡唑酸锂和新戊酸作为试剂,导致从相同的二氯化钌起始材料产生了约70%产率。另外,这些方法还提供了带有具有大于dipp的ar的nhc的z选择性钌烯烃复分解催化剂的获得途径。如本文所述,在某些应用中,与现有的z选择性烯烃复分解催化剂相比,基于这些更需要空间的配体的催化剂提供了独特且更具选择性的催化活性(参见图3、图4a/图4b)。
[0064]
如本文别处所述,本公开涉及制备通式(c)的化合物,尤其是空间位阻化合物,或其立体异构体或几何异构体的方法
[0065][0066]
该方法包括一系列步骤,该一系列步骤包括使对应通式(b)的化合物与羧酸反应以形成通式(c)的化合物的步骤,其中二齿阴离子配体是羧酸根。通式(b)的化合物可以通过使具有对应通式(a)的二卤代化合物与阴离子碱反应来形成,该阴离子碱能够置换卤基配体并作为单齿配体配位至钌中心以形成任选地分离的中间体。后续反应可用于以其他二齿阴离子配体(例如硝酸根等)置换羧酸根配体。
[0067]
在此一般上下文中,存在用于本公开的方法和化合物的共同描述词集合。
[0068]
例如,根据式(i)或(xi)的化合物更具体地描述了上文阐述为通式(a)的化合物:
[0069][0070]
例如,根据式(ii)或(xii)的化合物更具体地描述了上文阐述为通式(b)的化合物:
[0071][0072]
例如,根据式(iii)、(xiii)、(iv)、和(xiv)的化合物更具体地描述了上文阐述为通式(b)的化合物:
[0073][0074]
然后,在这些上下文中的每一个上下文内,卤基可以由x1和x2表示,阴离子碱可以由y表示,羧酸根配体可以由z表示,其他二齿阴离子配体可以由q表示,所谓的nhc包括以下
结构芳香族侧基包括结构空间位阻基团包括结构并且钌
[0075]
碳烯/配体包括以下结构:
[0076]
因此,一些实施方案包括制备式(iii)或(xiii)的化合物的方法,每种方法包括分别使式(ii)或(xii)的化合物或其几何异构体与式z-h的羧酸接触,其中该接触导致分别形成式(iv)或(xiv)的化合物或其几何异构体。
[0077]
因此,一些其他实施方案包括制备式(ii)或(xii)的化合物的方法,每种方法包括使式(i)或(xi)的化合物或其几何异构体与式[m
][y-]的盐接触,其中该接触导致分别形成式(ii)或(xii)的化合物。
[0078]
因此,一些其他实施方案包括制备式(iv)或(xiv)的化合物的方法,每种方法包括使式(iii)或(xiii)的化合物或其几何异构体与能够作为二齿配体对钌进行配位的三氟乙酸根、硝酸根、亚硝酸根、草酸根、磷酸根、亚硫酸根、或磺酸根、或其他强酸(h-q)的阴离子反应,以分别形成式(iv)或(xiv)的化合物或其几何异构体。
[0079]
可用于影响这些转变的条件(时间、温度、溶剂和非氧化环境的性质)与此类化学品的领域中的技术人员通常考虑的那些一致,但是为了完整性,这些条件在本文中别处阐述。
[0080]
虽然本文阐述的结构通常以一个几何形状或立体化学表示,但是描述和权利要求并不旨在限于这些立体化学,并且化合物本身可以表示为替代异构体。
[0081]
在这些方法中,取代基r1、r2、r3、r4、r5、r6、r7、r8、r9、r
10
(和r
10a
)、r
11
、r
12
、r
13
、r
14
、r
15
、r
16
、r
17
、m、x1、x2、x3、l、y、z和q中的每一者在大多数情况下定义如下:
[0082]
r1、r2、r3、r4、r5、r6、r7、r8、和r9独立地为或包括氢、卤素、任选经取代的烷基、任选经取代的烯基、任选经取代的烷氧基、任选经取代的芳基、任选经取代的芳氧基、任选经取代的杂芳基、任选经取代的杂芳氧基、或硝基基团;和/或r1和r2、或r2和r3、或r3和r5、或r4和r5、或r6和r7、或r7和r8、或r8和r9中的一者或多者与其所结合的碳一起形成至少一个任选经取代的5元至7元环结构;
[0083]r11
、r
12
、r
13
、和r
14
独立地为或包括氢、卤素、任选经取代的烷基、任选经取代的烯基、任选经取代的烷氧基、任选经取代的芳基、任选经取代的杂芳基;和/或r
11
、r
12
、r
13
、和r
14
中的一对或多对独立地任选连接在一起以形成环状或多环结构;
[0084]r15
独立地为或包括任选经取代的烷基、任选经取代的烯基、任选经取代的烷氧基、任选经取代的芳基、任选经取代的芳氧基、任选经取代的杂芳基、任选经取代的杂芳氧基、卤基、氰基、硝基,或者r
15
中的任何两个r
15
可以连接以形成环状结构(例如,包括经连接的亚烷基或醚);
[0085]
m是0、1、2、3、或4;
[0086]r16
和r
17
独立地为或包括氢、卤素、任选经取代的烷基、任选经取代的烯基、任选经取代的烷氧基、任选经取代的烯基、任选经取代的芳基、任选经取代的芳氧基、任选经取代的杂芳基、或任选经取代的杂芳氧基;
[0087]
x1和x2独立地为氯、溴、或碘;
[0088]
x3是-o-、-s-、或-n(r
10a
)-;
[0089]r10
和r
10a
独立地为或包括任选经取代的直链、支链、环状或多环烷基、任选经取代的芳基、任选经取代的杂芳基;
[0090]
名称是指任选的双键的存在;
[0091]
l是连接到r
17
的供体配体,任选地中性电子供体配体,任选地中性电子供体溶剂或电子供体配体。
[0092]
m是0、1、2、3、或4;
[0093]r15
独立地为或包括任选经取代的烷基、任选经取代的烯基、任选经取代的烷氧基、任选经取代的芳基、任选经取代的芳氧基、任选经取代的杂芳基、任选经取代的杂芳氧基、卤基、氰基、硝基,或者r
15
中的任何两个r
15
可以连接以形成环状结构(例如,包括经连接的亚烷基或醚);
[0094]
y独立地为或包括作为配体配位至钌中心的碱性阴离子;
[0095]
[m
][y-]是y-的盐,其中m
是单阳离子当量阳离子,优选但不一定是碱金属、任选经取代的铵、或吡啶鎓阳离子。
[0096]
z是羧酸根,任选地具有式c(r
18
)(r
19
)(r
20
)c(=o)o-;
[0097]r18
、r
19
、和r
20
独立地为或包括氢、任选经取代的烷基、任选经取代的烯基、任选经取代的芳基、或任选经取代的杂芳基,前提条件是r
18
、r
19
、和r
20
不全是氢;和/或r
18
、r
19
、和r
20
中的两者或三者连接在一起以形成环状或多环结构;以及
[0098]
q是三氟乙酸根、硝酸根、亚硝酸根、草酸根、磷酸根、亚硫酸根、或磺酸根、或其他强酸(h-q)的阴离子,这些离子能够作为二齿配体对钌进行配位。在优选实施方案中,q是作为其铵盐、nh
4
盐递送的。
[0099]
这些定义的其他方面也在本文中别处提供,例如另外的取代基(包括按照“fn”描述的那些)、排除/前提条件、和示例性结构。
[0100]
例如,在nhc(n-杂环碳烯)和其芳香族侧基的情况下,尽管应当理解本公开不必限于这些结构,另外的实施方案还涵盖那些化合物,例如,其中nhc环是任选地被一个或多个r
15
取代基取代的6元环。
[0101]
另外,nhc核及其相关联的描述词的表示:
[0102]
至少包括环独立地且可替代地含有单键或双键的结构(如由指定的)。在(r
15
)m的情况下,差异还表现为本身具有不同电位位置和r
15
基团分布:
[0103][0104]
其中r
15
被重新定义为r
15a
(如果仅用于反映不存在非氢取代基,则为h)以包括另外的h存在。
[0105]
例如,在芳香族侧基的情况下,除了作为的描述和关于r1、r2、r3、r4、和r5的所述描述(其包括r1和r2、或r2和r3、或r3和r5、或r4和r5与它们所结合至的碳一起形成至少一个任选经取代的5元至7元环结构(例如,任选经取代的芳基、杂芳基、环状亚烷基、环状亚烯基、或与芳香族侧基稠合的杂环部分)的实施方案)之外,在某些实施方案中,芳香族侧基还本身是杂芳基部分,如在式(i)、(xi)、(ii)、(xii)、(iii)、(xiii)、(iv)、和(xiv)中所示稠合至或取代苯基。
[0106]
例如,在空间位阻基团侧接到nhc并且在一些情况下结合至钌中心的情况下,有时以以下结构呈现:
[0107]
除了在本文别处叙述的名称“fn”所涵盖的任选附加官能团外,描述r
11
、r
12
、r
13
、和r
14
中的任何两者或更多者可以经连接以形成环状或多环结构还指以下事实:除了任选经取代的金刚烷之外,这个基团还可以包括其他任选经取代的双环或多环结构,诸如任选经烷基取代的二环戊烷、二环己烷、二环庚烷、和二环辛烷或庞大的芳香族结构,例如:
[0108]
[0109]
例如,根据结构描述的钌碳烯/配体还涵盖其中6元碳环芳基被任选经取代的杂芳基取代的那些实施方案,例如(但不限于吡啶)。本说明书所涵盖的杂芳基的更完整的非限制性列表在本文别处阐述。
[0110]
应当理解的是,在l、r
16
、和r
17
的定义的完整上下文内,涵盖这些术语的结构表示根据x3、r6、r7、r8、r9、和r
10
定义的结构的属,并且涵盖这些结构。在属比物质结构更宽的情况下,其他物质包括涵盖两个基团之间的差异的那些结构;例如,包括在涵盖l、r
16
、和r
17
部分的属中,但不在由x3、r6、r7、r8、r9、和r
10
部分涵盖的物质中的那些化合物。例如,在某些实施方案中,这些碳烯独立地包括fischer型碳烯(其中r
16
或r
17
包含任选经取代的烷氧基、芳氧基、或杂芳氧基侧基)以及更具活性的“schrock型”同源物(congener)。在其他实施方案中,化合物可以包含其中单齿配体l不存在或被通过烷基或醚键连接至碳烯基团的杂环部分置换的结构。
[0111]
例如,l是根据连接到r
17
的供体配体,任选地中性电子供体配体,任选地中性电子供体溶剂或电子供体配体定义的。还包括在本公开的化合物的上下文中的是其中不存在l的那些化合物和结构;即,这个基团既不由碳烯侧基提供,也不单独存在,并且钌中心进一步配位不饱和。在存在时,l可以包括本文别处所述的中性电子供体配体中的任何一者或多者。
[0112]
贯穿本公开,y被描述为独立地为作为配体配位至钌中心的碱性阴离子(当作为配体缔合时),或者当根据盐[m
][y-]定义时为阴离子y-。在某些表征中,y可以看作不分解钌碳烯的相对弱亲核,但足够亲核以从对应的ru中心(如本文别处所示)置换卤离子并且足够碱性以被羧酸质子化。这些反应性的特定参数在本文别处阐述。在优选实施方案中,[m
][y-]是叔丁醇钾或吡唑酸锂,但是其他此类碱性盐也可用于此目的。
[0113]
在一些实施方案中,y独立地为氢氧根离子,c1-12醇盐、酰胺酸根阴离子、取代或未取代的酚盐、取代或未取代的吡唑酸根、取代或未取代的吲哚酸根、取代或未取代的异吲哚酸根、或取代或未取代的咪唑酸根。这些类别的一些优选示例在本文别处阐述。
[0114]
贯穿本公开,z是羧酸根,并且z-h是对应的羧酸。在本公开中,z通常根据式c(r
18
)(r
19
)(r
20
)cooh描述,其中r
18
、r
19
、和r
20
在本文别处提供。在优选实施方案中,z是为至少仲碳基团的碳基团的羧酸根。较庞大的叔羧酸根似乎是优选的。这些羧酸根的代表性示例在本文别处阐述。
[0115]
在一些实施方案中,与羧酸根的接触伴随着附加使用对应的羧酸盐,优选地碱金属羧酸盐。
[0116]
其他实施方案包括可从本文所阐述的方法获得的那些钌化合物,包括式(xx-a)、(xx-b)、(xx-c)或(xx-d)的那些钌化合物:
[0117][0118]
其中变量r1、r2、r3、r4、r5、r6、r7、r8、r9、r
10
、r
11
、r
12
、r
13
、r
14
、r
15
、和m与先前或别处对这些术语的描述一致。g包括也与x1、x2相关联的变量,并且y作为配体配位至钌中心。这些化合物包括先前关于g的定义未知的那些化合物,以及先前主要但不仅仅是因为它们的配体的大体积而不可接近和未知的那些化合物。
[0119]
其他实施方案包括可从本文所阐述的方法获得的那些钌化合物,包括式(y-a)、(y-b)、(y-c)或(y-d)的那些钌化合物:
[0120][0121][0122]
其中变量r1、r2、r3、r4、r5、r6、r7、r8、r9、r
10
、r
11
、r
12
、r
13
、r
14
、r
15
、和m定义与这些术语的先前描述一致。j包括但不限于也与x1、x2相关联的那些变量,y、q和z作为配体配位至钌中
心。这些化合物包括先前关于j的定义未知的那些化合物,以及先前主要但不仅仅是因为它们的配体的大体积而不可接近和未知的那些
[0123]
其他实施方案包括在复分解反应中使用本文阐述的化合物中的任何化合物作为催化剂。在一些此类实施方案中,该方法包括使至少一种烯烃、炔烃或烯炔与本文所述的钌化合物中的任何钌化合物接触,该接触导致复分解,例如:
[0124]
(a)两种不同烯烃,或烯烃、炔烃和/或烯炔的交叉复分解(cm),例如:
[0125][0126]
(b)二烯的闭环复分解(rcm),从而导致形成环烯烃环,例如
[0127][0128][0129]
(c)两种烯烃的同二聚化,例如:
[0130][0131]
(d)无环二烯复分解(admet),从而导致形成低聚物和/或聚合物,例如
[0132][0133]
(e)开环交叉复分解(rocm),从而导致无环二烯;
[0134]
[0135]
(f)环烯烃的开环复分解聚合(romp),从而导致聚合物,例如
[0136]
或者
[0137]
(g)烯烃的e/z异构体混合物的乙烯醇分解以提供混合物的e烯烃含量的富集,例如
[0138][0139]
关于此最后提及的过程,存在许多用于制备二取代的e烯烃的方法,诸如horner
‑‑
wadsworth-emmons反应和烯烃交叉复分解。虽然已经证明这些反应是高度可靠和实用的,但是非期望的z异构体通常难以通过色谱或蒸馏分离。在本公开中,本发明所描述的钌化合物的用途可用于通过z异构体的选择性乙烯醇分解来从ae/z混合物提供实际上纯的或至少基本上富集的e烯烃。使用本发明的烯烃复分解催化剂和常规烯烃复分解催化剂之间的差异不仅仅是空间:(a)z选择性乙烯醇分解不是z至e异构化反应
‑‑
替代地,其优先将z烯烃转化为末端烯烃(不是e烯烃),并且优先地使e烯烃不被接触;(b)这些更受阻的催化剂可以给出》95%(或甚至》98%)的e异构体,这是由催化剂通过动力学控制进行的。常规z至e异构化给出了5:1至10:1的e/z混合物,这在大多数情况下由两种异构体之间的固有热力学差异决定。
[0140]
在某些优选实施方案(例如,(a)至(f))中,催化剂提供一种或多种复分解反应的有利产物主要是z异构体烯烃。在(g)的情况下,有利的反应物是z异构体,从而导致其从混合物中优先去除。
[0141]
术语
[0142]
通过参考以下结合附图和实施例进行的描述,可以更容易地理解本公开,所有附图和实施例都形成本公开的一部分。应理解,本公开不限于本文描述或示出的特定产品、方法、条件或参数,并且本文所使用的术语是出于仅以举例方式描述特定实施方案的目的,并且不旨在限制任何要求保护的公开内容。类似地,除非另有说明,否则关于可能机制或作用模式或改进原因的任何描述仅是说明性的,并且本文公开的任何发明不受任何此类建议的机制或作用模式或改进原因的正确性或不正确性的约束。在整个文本中,应认识到描述是指组合物和制备和使用所述组合物的方法。也就是说,在本公开描述或要求保护与组合物或制造或使用组合物的方法相关联的特征或实施方案的情况下,应当理解,此类描述或权利要求旨在将这些特征或实施方案扩展到这些上下文中的每一个上下文中的实施方案(即,组合物、制造方法、以及使用方法)。
[0143]
在本公开中,除非上下文另外明确指出,否则单数形式“一(a/an)”和“该(the)”包括多个指代物,并且对特定数值的引用至少包括该特定值。因此,例如,对“一材料”的引用是对本领域技术人员已知的此类材料和其等同物中的至少一者的引用,等等。
[0144]
当值通过使用描述词“约”表示为近似值时,应当理解的是特定值形成另一实施方案。通常,术语“约”的使用指示近似值,该近似值可以根据所公开的主题寻求获得的期望特性而变化,并且应根据该近似值的功能在使用该近似值的特定上下文中解释。本领域技术
人员将能够将这解释为按常规。在一些情况下,用于特定值的有效数字的位数可以是确定词语“约”的程度的一种非限制性方法。在其他情况下,以一系列值使用的梯度可用于确定术语“约”对每个值可用的预期范围。在存在时,所有范围都是包含性的并且可组合的。也就是说,对范围中所述值的引用包括该范围内的每个值。
[0145]
应当理解的是,为了清楚起见,在单独实施方案的上下文中描述的本公开的某些特征也可以在单个实施方案中组合提供。也就是说,除非明显不相容或特别排除,否则每个单独实施方案被认为是可与任何其他实施方案组合的,并且此类组合被认为是另一实施方案。相反,为了简洁起见,在单个实施方案的上下文中描述的本公开的各种特征也可以单独提供或以任何子组合提供。还应注意的是,权利要求书可以经起草以排除任何任选的元件。因此,此声明旨在用作使用与权利要求要素的叙述或“否定”限制的叙述结合的这类排他性术语如“只是”、“仅”的先行基础。最后,虽然实施方案可以被描述为一系列步骤的一部分或更一般结构的一部分,但是每个所述步骤本身也可以被认为是可与其他实施方案组合的独立实施方案。
[0146]
过渡术语“包含”、“基本上由
……
组成”和“由
……
组成”旨在暗示其在专利术语中的公认含义;也就是说,(i)“包含”与“包括”、“含有”或“特征在于”同义,是包含性的或开放式的,并且不排除另外的未列举的元件或方法步骤;(ii)“由
……
组成”排除权利要求中未指定的任何元件、步骤、或成分;并且(iii)“基本上由
……
组成”将权利要求的范围限制为指定的材料或步骤,以及不实质上影响所要求保护的发明的基本和新颖特性的那些材料或步骤。根据短语“包括”(或其等同词)描述的实施方案也提供根据“由
……
组成”和“基本上由
……
组成”独立描述的那些实施方案作为实施方案。对于根据“基本上由
……
组成”提供的那些实施方案,基本和新颖的特征是在与所叙述的条件相当的条件下方法(或此类方法中使用的系统)的易于操作性。
[0147]
当列表被呈现时,除非另有说明,否则应当理解的是,该列表的每个单独要素和该列表的每个组合都是单独的实施方案。例如,呈现为“a、b、或c”的实施方案列表应解释为包括实施方案“a”、“b”、“c”、“a或b、“a或c”、“b或c”、或“a、b、或c”。
[0148]
在整个说明书中,词语将提供如相关领域的技术人员将理解的其正常含义。除非另外定义,否则本文所使用的所有技术和科学术语具有与本文所公开的任何发明所属领域的普通技术人员通常所理解的相同含义。尽管与本文所描述的那些类似或等同的任何方法和材料也可以用于所公开的本发明的实践或测试中,但是本文描述了代表性的说明性方法和材料。
[0149]
如本文所用的术语“烷基”是指直链、支链、环状、双环或多环饱和烃基(并且提及“烷基”通常涵盖这些中的每一者作为单独的实施方案),通常但不一定含有1至约24个碳原子,优选地1至约12个碳原子,诸如甲基、乙基、正丙基、异丙基、正丁基、异丁基、叔丁基、戊基、己基、庚基、辛基、癸基等,以及环烷基,诸如环丙基、环丁基、环戊基、环己基、环庚基等。对支链烷基的引用包括例如2-丙基(异丙基)、仲丁基、叔丁基、和异丁基、2-戊基、3-戊基、2-甲基丁基、3-甲基丁基、新戊基、2-己基、3-己基、4-己基、2-庚基、3-庚基、4-庚基等。双环或多环烷烃包括例如双环戊烷、双环己烷、双环庚烷、双环辛烷、和金刚烷。对“烷基”的引用还涵盖这些链长度中的每一个链长度作为单独的实施方案。
[0150]
对“直链、支链、环状、双环或多环c
3-24
烷基”的引用也旨在被解释为这样的烷基,
该烷基具有提供相应烷基类型所必需的最小数目的碳原子至至多24个碳(例如,支链c
3-24
烷基、环状c
3-24
烷基、双环c
6-24
烷基、或多环c
6-24
烷基)。一般来讲,但同样不是必要的,本文的烷基基团含有1至约12个碳原子。术语“低级烷基”被涵盖作为术语“烷基”的单独子集实施方案,意指具有1至6个碳原子的烷基。特定术语“环烷基”也被涵盖作为术语“烷基”的单独子集实施方案,意指通常具有3至8个,优选地6或7个碳原子的环烷基。如本文别处所述,术语“取代的烷基”是指被一个或多个取代基基团取代的烷基,并且术语“含杂原子烷基”和“杂烷基”是指其中碳链中的至少一个碳原子被杂原子取代的烷基。后者的示例包括烷基醚、烷基聚醚(包括聚乙二醇)、烷基硫醇醚、和仲或叔烷基胺。通常,如果没有另外指出,则术语“烷基”和“低级烷基”分别包括直链、支链、环状、未取代、取代和/或含杂原子烷基和低级烷基。
[0151]
如本文所用,术语“亚烷基”是指双官能的直链、支链或环烷基基团,其中“烷基”如上定义。
[0152]
如本文所用的术语“烯基”是指包含至少一个双键的具有2至约24个碳原子的直链、支链或环状烃基团,诸如乙烯基、正丙烯基、异丙烯基、正丁烯基、异丁烯基、戊烯基、己烯基、庚烯基、辛烯基、癸烯基、十四烯基、十六烯基、二十烯基、二十四烯基等。本文的优选的烯基基团包含2至约12个碳原子。术语“低级烯基”被涵盖作为术语“烯基”的单独子集实施方案,意指具有2至6个碳原子的烯基,并且特定术语“环烯基”被涵盖作为术语“烯基”的单独子集实施方案,意指优选具有5至8个碳原子的环烯基。术语“取代的烯基”是指被一个或多个取代基取代的烯基,并且术语“含杂原子烯基”和“杂烯基”是指其中碳链中的至少一个碳原子被杂原子取代的烯基。后者的示例包括烯基醚、烯基聚醚(包括聚乙二醇)、烯基硫醇醚、和仲或叔烯基胺。如果没有另外指出,则术语“烯基”和“低级烯基”分别包括直链、支链、环状、未取代、取代和/或含杂原子烯基和低级烯基。
[0153]
如本文所用,术语“亚烯基”是指双官能的直链、支链或环烯基基团,其中“烯基”如上定义。
[0154]
如本文所用,术语“炔基”是指包含至少一个三键的具有2至约24个碳原子的直链或支链烃基团,诸如乙炔基、正丙炔基等。本文的优选的炔基基团包含2至约12个碳原子。术语“低级炔基”是指具有2至6个碳原子的炔基基团。术语“取代的炔基”是指被一个或多个取代基取代的炔基,并且术语“含杂原子的炔基”和“杂炔基”是指其中碳链中的至少一个碳原子被杂原子取代的炔基。如果没有另外指出,则术语“炔基”和“低级炔基”分别包括直链、支链、未取代、取代和/或含杂原子的“炔基”和低级“炔基”。
[0155]
如本文所用,术语“烷氧基”是指通过单个末端醚键键合的烷基基团;即,“烷氧基”基团可表示为-o-烷基,其中烷基如上定义。“低级烷氧基”基团是指如上所述含有1至6个碳原子的烷氧基基团。类似地,“烯氧基”和“低级烯氧基“分别是指通过单个末端醚键键合的烯基和低级烯基基团,并且“炔氧基”和“低级炔氧基”分别是指通过单个末端醚键键合的如上所述的炔基和低级炔基基团。
[0156]
术语“芳香族”是指满足芳香性的h
ü
ckel 4n 2规则的环部分,并且包括芳基(即,碳环)和杂芳基(也称为杂芳族)结构两者,包括芳基、芳烷基、烷芳基、杂芳基、杂芳烷基、或烷杂芳基部分。
[0157]
如本文所用,并且除非另外指明,否则术语“芳基”是指含有单个芳族环或稠合在
一起、直接连接的或间接连接(使得不同的芳族环键合到共同基团诸如亚甲基或亚乙基部分)的多个芳族环的芳族取代基或结构。除非另有修饰,否则术语“芳基”是指碳环结构。优选的芳基基团含有6至24个碳原子,并且特别优选的芳基基团含有6至14个碳原子。示例性芳基基团含有一个芳族环或两个稠合或连接芳族环,例如苯基、萘基、联苯基、二苯醚、二苯胺、二苯甲酮等。术语“取代的芳基”是指被一个或多个取代基基团取代的芳基部分,并且术语“含杂原子芳基”和“杂芳基”是指其中至少一个碳原子被杂原子替换的芳基取代基,如将在下文中进一步详细描述的。
[0158]
如本文所用,术语“芳氧基”是指通过单个末端醚键键合的芳基基团,其中“芳基”如上定义。“芳氧基”基团可表示为-o-芳基,其中芳基如上定义。优选的芳氧基基团包含6至24个碳原子,并且特别优选的芳氧基基团包含6至14个碳原子。芳氧基基团的示例包括但不限于,苯氧基、邻卤代苯氧基、间卤代苯氧基、对卤代苯氧基、邻甲氧基苯氧基、间甲氧基苯氧基、对甲氧基苯氧基、2,4-二甲氧基苯氧基、3,4,5-三甲氧基苯氧基等。
[0159]
术语“烷芳基”是指具有烷基取代基的芳基基团,并且术语“芳烷基”是指具有芳基取代基的亚烷基基团,其中“芳基”和“烷基”如上定义。因此,烷芳基和芳烷基分别代表一种类型的经取代的芳基和烷基。优选的烷芳基和芳烷基基团包含7至25个碳原子,并且特别优选的烷芳基和芳烷基基团包含7至17个碳原子。烷芳基基团包括例如对甲基苯基、2,4-二甲基苯基、对环己基苯基、2,7-二甲基萘基、7-环辛基萘基、3-乙基-环戊-1,4-二烯等。芳烷基基团的示例包括但不限于,苄基、2-苯基-乙基、3-苯基-丙基、4-苯基-丁基、5-苯基-戊基、4-苯基环己基、4-苄基环己基、4-苯基环己基甲基、4-苄基环己基甲基等。术语“烷芳氧基”和“芳烷氧基”是指式-or的取代基,其中r分别为烷芳基或芳烷基,如刚刚所定义的。
[0160]
术语“酰基”是指具有式-(co)-烷基、-(co)-芳基或
–
(co)-芳烷基的取代基,并且术语“酰氧基”是指具有式-o(co)-烷基、-o(co)-芳基、或-o(co)-芳烷基的取代基,其中“烷基”、“芳基”和“芳烷基”如上所定义。
[0161]
术语“环状”和“环”是指脂环族或芳族基团,其可或可不被取代和/或含有杂原子,并且可为单环、双环或多环。以常规含义使用的术语“脂环族”是指脂族环状部分,其与芳族环状部分相对,并且可为单环、双环或多环。术语“无环”是指其中双键可以或可以不包含在环结构内的结构。
[0162]
术语“卤基”、“卤离子”和“卤素”以常规含义使用以指代氯、溴、氟或碘取代基。
[0163]
术语“含杂原子”是指其中一个或多个碳原子被不是碳的原子(例如,氮、氧、硫、磷或硅,通常是氮、氧或硫)替代的烃分子。类似地,术语“杂烷基”是指含杂原子的烷基取代基,术语“杂环”是指含杂原子的环状取代基,术语“杂芳基”和“杂芳族”分别是指在芳环结构中含有至少一个杂原子的“芳基”和“芳族”取代基。应当注意“杂环”基团或化合物可以或可以不是芳族的,并且还应当注意“杂环”可以为单环、双环、或多环,如上文关于术语“芳基”所述的。
[0164]
术语“杂环”等是指杂芳环(也称为杂芳基)和杂环烷基环(也称为杂脂环基)两者,每个杂环环在其环系中含有4至10个原子,并且在环中含有一至四个杂原子(例如,o、n、s、和si),前提条件是没有环含有两个相邻的o或s原子。非芳香族杂环基团(也称为杂环烷基)包括在其环系中仅具有3个原子的基团,但是芳香族杂环基团必须在其环系中具有至少5个原子以具有本文别处描述的芳香族特征。杂环基团还可以包括苯并稠环系和吡啶基稠环
系。氮丙啶基和氮杂环丁烷基分别是3元和4元杂环基的示例。
[0165]
杂芳基取代基的非限制性示例包括任选经取代的呋喃基、任选经取代的吡啶基、任选经取代的吡嗪基、任选经取代的嘧啶基、任选经取代的哒嗪基、任选经取代的噻吩基(thiophenyl/thienyl)、任选经取代的吡咯基、任选经取代的咪唑基、任选经取代的噻唑基、任选经取代的噁唑基、任选经取代的吡唑基、任选经取代的异噻唑基、任选经取代的1,2,3-三唑基、任选经取代的1,2,4-三唑基、任选经取代的1,3,4-三唑基、任选经取代的四唑基、任选经取代的1,2,3-噻二唑基、任选经取代的1,2,3-噁二唑基、任选经取代的1,3,4-噻二唑基、任选经取代的1,3,4-噁二唑基、任选经取代的吲哚基、任选经取代的吲哚啉基、任选经取代的喹啉基、任选经取代的四氢喹啉基、任选经取代的1,2,3,4-四氢异喹啉基、任选经取代的噌啉基、任选经取代的喹噁啉基、任选经取代的喹唑啉基、任选经取代的酞嗪基、任选经取代的1,8-萘啶基、任选经取代的1,4-苯并二噁英基、任选经取代的香豆素、任选经取代的二氢香豆素、任选经取代的1,5-萘啶基、任选经取代的苯并呋喃基、任选经取代的2,3-二氢苯并呋喃基、任选经取代的1,2-苯并异噁唑基、任选经取代的苯并噻吩基、任选经取代的苯并噁唑基、任选经取代的苯并噻唑基、任选经取代的嘌呤基、任选经取代的苯并咪唑基、任选经取代的苯并三唑基、任选经取代的硫代黄嘌呤基、任选经取代的咔唑基、任选经取代的咔啉基、任选经取代的吖啶基、任选经取代的吡咯啶基、或任选经取代的喹嗪啶基。
[0166]
含杂原子的脂环族取代基的示例包括但不限于吡咯烷基、四氢呋喃基、二氢呋喃基、四氢噻吩基、噁唑烷酮基、四氢吡喃基、二氢吡喃基、四氢噻喃基、哌啶基、吗啉基、硫代吗啉基、氧硫杂环己基(thioxanyl)、哌嗪基、氮丙啶基、氮杂环丁烷基、环氧乙烷基、氧杂环丁烷基、硫杂丙环基(thiiranyl)、硫杂环丁烷基(thietanyl)、高哌啶基、氧杂环庚烷基(oxazepinyl)、二氮杂卓基、硫氮杂卓基(thiazepinyl)、1,2,3,6-四氢吡啶基、吡咯啉-2-基、吡咯啉-3-基、吲哚啉基、2h-吡喃基、4h-吡喃基、二噁烷基、1,3-二氧戊环基、吡唑啉基、二硫杂环己烷基(dithianyl)、和二硫杂环戊基(dithiolanyl)。
[0167]
如在“取代的烷基”、“取代的芳基”等中的所谓的“取代的”,如在前述定义中的一些中顺便提及的,意指在烷基、芳基或其他部分中,键合到碳(或其他)原子的至少一个氢原子被一个或多个非氢取代基替代。此类取代基的示例包括但不限于:在本文中称为“fn”的官能团,包括卤基、c
1-c
24
烷氧基、c
2-c
24
烯氧基、c
6-c
24
芳氧基、c
7-c
24
芳烷氧基、c
7-c
24
烷芳氧基、酰基(包括c
1-c
25
烷基羰基(-co-c
1-c
24
烷基)和c
7-c
25
芳基羰基(-co-c
6-c
24
芳基)、酰氧基(-o-酰基,包括c
2-c
25
烷基羰氧基(-o-co-c
1-c
24
烷基)和c
7-c
25
芳基羰氧基(-o-co-c
6-c
24
芳基))、c
2-c
25
烷氧羰基((co)-o-c
1-c
24
烷基)、c
7-c
25
芳氧羰基(-(co)-o-c
6-c
24
芳基)、氰基(-c≡n)、氰酰基(-o-c=n)、硫氰基(-s-c=n)、或硝基(-no2)。
[0168]
术语“fn”还包括烃部分c
1-c
24
烷基(优选c
1-l2
烷基,更优选c
1-6
烷基)、c
1-l2
亚烷基,更优选c
1-6
亚烷基)、c
2-24
烯基(优选c
2-12
烯基,更优选c
2-6
烯基)、c
2-24
亚烯基(优选c
2-12
亚烯基,更优选c
2-6
亚烯基)、c
2-24
炔基(优选c
2-12
炔基,更优选c
2-6
炔基)、c
6-24
芳基(优选c
6-12
芳基)、c
6-24
亚芳基(优选c
6-12
亚芳基)、c
7-24
烷芳基(优选地包括c
6-12
芳基)、和c
6-c
24
芳烷基(优选地包括c
6-12
芳基)。在这些取代基结构内,“烷基”、“亚烷基”、“烯基”、“亚烯基”、“炔基”、“亚炔基”、“烷氧基”、“芳香族”、“芳基”、“芳氧基”、“烷芳基”和“芳烷基”部分任选地是氟化的或全氟化的。
[0169]
在本文中,“fn”包括但不限于金刚烷基、氯、氟、支链或环状c
3-12
烷基、部分或完全
氟化的烷基(例如,-cf3)、c
1-6
亚烷基、部分或完全氟化的烷芳基(例如,4-苯基-cf3)。
[0170]
如在“官能化烷基”、“官能化烯烃”、“官能化环状烯烃”等中的所谓“官能化”意指在烷基、烯烃、环状烯烃或其他部分中,至少一个键合到碳(或其他)原子的氢原子被一个或多个官能团诸如上文所述的那些替代。术语“官能团”意指包括适于本文所述用途的任何官能物质。
[0171]
此外,如果具体官能团允许,则上述官能团可进一步被一个或多个附加官能团或一个或多个烃基部分诸如上文具体列举的那些取代。类似地,上述烃部分可进一步被一个或多个官能团或附加烃部分诸如具体地列举的那些取代。
[0172]“中性电子供体配体”是任何配体,该配体当以其闭合壳电子组态从金属中心去除时具有中性电荷,即,是路易斯碱。在独立实施方案中,中性电子供体包括膦、磺化膦、亚磷酸盐、单氧亚膦盐、亚膦酸盐、胂、锑化氢、醚、胺、酰胺、亚胺、亚砜、羧基、羰基、亚硝酰基、含氮的杂环(例如,吡啶)、硫(例如,噻吩)、氧(例如,四氢呋喃)或它们的混合物(例如,噁唑啉)、或硫醚。在一些实施方案中,l是膦、磺化膦、亚磷酸盐、单氧亚膦盐盐、亚膦酸盐、胂、锑化氢、醚(包括环状醚)、胺、酰胺、亚胺、亚砜、羧基、亚硝酰基、吡啶、经取代的吡啶、咪唑、经取代的咪唑、吡嗪、经取代的吡嗪、或硫醚。示例性配体为三取代的膦。其他示例在本文别处叙述。
[0173]“任选的”或“任选地”是指随后描述的情况可以或可以不发生,使得所述说明包括其中情况发生的例子和情况不发生的例子。例如,短语“任选经取代的”是指非氢取代基可以或可以不存在于给定原子上,并且因此,该描述包括其中存在非氢取代基的单独实施方案和其中不存在非氢取代基的那些实施方案。
[0174]
在一些实施方案中,l是含有氮、硫、氧或它们的混合物的杂环。适用于l的含氮杂环的示例包括吡啶、哒嗪、嘧啶、吡嗪、1,3,5-三嗪、1,2,4-三嗪、1,2,3-三嗪、吡咯、2h-吡咯、3h-吡咯、吡唑、2h-咪唑、1,2,3-三唑、1,2,4-三唑、吲哚、3h-吲哚、1h-异吲哚、环戊(b)吡啶、吲唑、喹啉、双喹啉、异喹啉、双异喹啉、噌啉、喹唑啉、萘啶、哌啶、哌嗪、吡咯烷、吡唑烷、奎宁环、咪唑烷、吡啶亚胺(picolylimine)、嘌呤、苯并咪唑、和双咪唑。另外,含氮杂环可以任选地被取代。
[0175]
适用于l的含硫杂环的示例包括噻吩、1,2-二硫醇、1,3-二硫醇、硫杂卓、苯并(b)噻吩、苯并(c)噻吩、苯并噻吩、二苯并噻吩、2h-噻喃、4h-噻喃和硫代蒽(thioanthrene)。
[0176]
适用于l的含氧杂环的示例包括2h-吡喃、4h-吡喃、2-吡喃酮、4-吡喃酮、1,2-二噁英、1,3-二噁英、氧杂环庚烷、呋喃、2h-1-苯并吡喃、香豆素、古马隆、色烯、苯并二氢吡喃-4-酮、异色烯-1-酮、异色烯-3-酮、(夹)氧杂蒽、四氢呋喃、1,4-二氧杂环己烷和二苯并呋喃。
[0177]
适用于l的混合杂环的示例包括异噁唑、噁唑、噻唑、异噻唑、1,2,3-噁二唑、1,2,4-噁二唑、1,3,4-噁二唑、1,2,3,4-噁三唑、1,2,3,5-噁三唑、3h-1,2,3-二噁唑、3h-1,2-氧硫杂环戊二烯、1,3-氧硫杂环戊二烯、4h-1,2-噁嗪、2h-1,3-噁嗪、1,4-噁嗪、1,2,5-噁噻嗪、邻异噁嗪、吩噁嗪、吩噻嗪、吡喃并[3,4-b]吡咯、茚噁嗪(indoxazine)、苯并噁唑、蒽醌(anthranil)和吗啉
[0178]
以下实施方案旨在补充任何先前的描述,而不是置换或取代任何先前的描述。因此,它们代表总体公开,但不限制本文阐述的具体示例。
[0179]
实施方案1.本公开涉及制备通式(c)的化合物,尤其是空间位阻化合物的方法
[0180][0181]
该方法包括一系列步骤,该一系列步骤包括使对应通式(b)的化合物与羧酸反应以形成通式(c)的化合物的步骤,其中二齿阴离子配体是羧酸根。通式(b)的化合物可以通过使具有对应通式(a)的二卤代化合物与阴离子碱反应来形成,该阴离子碱能够置换卤基配体并作为单齿配体配位至钌中心以形成任选地分离的中间体。后续反应可用于以其他二齿阴离子配体置换羧酸根配体。每个过程步骤被单独地视为本公开的独立方面。另选地或除此之外,两个或更多个过程步骤当被认为在一起时,被认为是本公开的单独方面。在这些通式(a)和(b)中表示的一般描述词中的每一个描述词在本文别处阐述,并且由这些描述词的任何组合产生的每个结构都被认为是本公开的在组合物和方法步骤方面的独立方面。
[0182]
在此一般上下文中,此实施方案的某些方面包括那些制备式(iii)或(xiii)的化合物的方法,该方法包括分别使式(ii)或(xii)的化合物或其几何异构体与式z-h的羧酸接触,其中z-h为c(r
18
)(r
19
)(r
20
)cooh,其中该接触导致分别形成式(iv)或(xiv)的化合物或其几何异构体:
[0183][0184]
其中:
[0185]
r1、r2、r3、r4、r5、r6、r7、r8、和r9独立地为或包括氢、卤素、任选经取代的烷基、任选经取代的烯基、任选经取代的烷氧基、任选经取代的芳基、任选经取代的芳氧基、任选经取代的杂芳基、任选经取代的杂芳氧基、或硝基基团;
[0186]
和/或r1和r2、或r2和r3、或r3和r5、或r4和r5、或r6和r7、或r7和r8、或r8和r9中的一者或多者与其所结合的碳一起形成至少一个任选经取代的5元至7元环结构;
[0187]
x3是-o-、-s-、或-n(r
10a
)-;
[0188]r10
和r
10a
独立地为或包括任选经取代的直链、支链、环状或多环烷基、任选经取代的芳基、或任选经取代的杂芳基;
[0189]r11
、r
12
、r
13
、和r
14
独立地为或包括氢、卤素、任选经取代的烷基、任选经取代的烯基、任选经取代的烷氧基、任选经取代的芳基、任选经取代的杂芳基;并且/或者
[0190]r11
、r
12
、r
13
、和r
14
中的一对或多对独立地任选连接在一起以形成环状或多环结构;
[0191]
名称是指任选的双键的存在;
[0192]
m是0、1、2、3、或4;
[0193]r15
独立地为或包括任选经取代的烷基、任选经取代的烯基、任选经取代的烷氧基、任选经取代的芳基、任选经取代的芳氧基、任选经取代的杂芳基、任选经取代的杂芳氧基、卤基、氰基、硝基,或者r
15
中的任何两个r
15
可以连接以形成环状结构(例如,包括经连接的亚烷基或醚);
[0194]
y独立地为或包括作为配体配位至钌中心的碱性阴离子;
[0195]r16
和r
17
独立地为或包括氢、卤素、任选经取代的烷基、任选经取代的烯基、任选经取代的烷氧基、任选经取代的烯基、任选经取代的芳基、任选经取代的芳氧基、任选经取代的杂芳基、或任选经取代的杂芳氧基;
[0196]
z是羧酸根,任选地具有式c(r
18
)(r
19
)(r
20
)c(=o)o-;
[0197]
其中r
18
、r
19
、和r
20
独立地为或包括氢、任选经取代的烷基、任选经取代的烯基、任选经取代的芳基、或任选经取代的杂芳基,前提条件是r
18
、r
19
、和r
20
不全是氢;并且/或者
[0198]r18
、r
19
、和r
20
中的两者或三者连接在一起以形成环状或多环结构;并且
[0199]
l是连接到r
17
的供体配体,任选地中性电子供体配体,任选地中性电子供体溶剂或电子供体配体。
[0200]
如此实施方案中并且贯穿本公开关于本文别处阐述的其他方面和实施方案所示,在某些方面中,钌化合物是根据特定nhc(n-杂环碳烯)和其芳香族侧基呈现的,但是应当理解的是,本公开不必限于这些结构,并且还涵盖例如其中nhc环是任选地被一个或多个r
15
取代基取代的6元环的化合物。
[0201]
如全文所用,nhc核及其相关联的描述词的表示:
[0202]
至少包括环独立地且可替代地含有单键或双键的结构。在(r
15
)m的情况下,差异还表现为本身具有不同电位位置和r
15
基团分布:
[0203][0204]
当这些特定位置如此表示时,r
15
被重新定义为r
15a
(如果仅用于反映不存在非氢取代基则为h),其包括与r15相同的选项,但附加选项是r
15a
可以是h,包括r
15a
中的任何两个r
15a
可以连接以形成环状结构。这些部分结构中的每个部分结构被认为是彼此独立的,并且它们的定义可以包括这些结构中的任何一个或多个结构,包括这些结构中的所有结构,或者可以根据可以排除这些独立结构中的一个或多个独立结构的组来定义。
[0205]
这些定义的非限制性示例包括:
[0206][0207]
如在此实施方案中并且贯穿本公开关于本文别处阐述的其他方面和实施方案所呈现,在某些方面中,r
15
和r
15a
通常根据独立地包含任选经取代的烷基、任选经取代的烯基、任选经取代的烷氧基、任选经取代的芳基、任选经取代的芳氧基、任选经取代的杂芳基、或任选经取代的杂芳氧基来描述,或者r
15
和r
15a
中的任何两者可以连接以形成环状结构。应当理解的是,尽管r
15
和r
15a
不必限于这些官能团,并且可以附加地或另选地为在本文别处指定为“fn”的官能团中的一个或多个官能团,包括例如氰基、卤基、羟基、硝基、和三氟甲烷。
[0208]
如在此实施方案中并且贯穿本公开关于本文别处阐述的其他方面和实施方案所示,在某些方面中,钌化合物是根据从nhc侧接的任选经取代的芳基呈现的,但是应当理解的是,本公开不一定限于这些结构,并且还涵盖例如其中芳香族侧基包含任选经取代的杂芳基以及所描绘的芳基的化合物。代表性杂芳基基团在本公开中的别处阐述。
[0209]
附加地或另选地,如本文所用,在芳香族侧基的上下文中,r1、r2、r3、r4、和r5的定义提供了r1和r2、或r2和r3、或r3和r5、或r4和r5与它们所结合的碳一起形成至少一个任选经取代的5元至7元环结构。此类任选经取代的5元至7元环结构包括例如与芳香族侧基稠合的任选经取代的芳基、杂芳基、环状亚烷基、环状亚烯基或杂环(例如,稠合的亚甲基、乙烯基或丙二醇)部分。
[0210]
进一步地,如在此实施方案中并且贯穿本公开关于本文别处阐述的其他方面和实施方案所示,在某些方面中,r1、r2、r3、r4、r5、r6、r7、r8、和r9通常叙述为独立地为氢、卤素、任选经取代的烷基(包括任选地氟化或全氟化的,例如-cf3)、任选经取代的烯基、任选经取代的烷氧基、任选经取代的芳基、任选经取代的芳氧基、任选经取代的杂芳基、任选经取代的杂芳氧基、或硝基。然而,这些变量的定义不一定限于这些官能团,并且可以附加地或另选
地为在本文别处指定为“fn”的官能团中的一个或多个官能团,包括例如氰基和羟基。
[0211]
如在此实施方案中并且贯穿本公开关于本文别处阐述的其他方面和实施方案所示,在某些方面中,侧接到nhc并且在一些情况下与钌中心结合的空间位阻基团有时以以下结构呈现:
[0212]
其中r
11
、r
12
、r
13
、和r
14
通常在本文中被定义为独立地为氢、卤素、任选经取代的烷基、任选经取代的烯基、任选经取代的烷氧基、任选经取代的芳基、任选经取代的杂芳基。然而,r
11
、r
12
、r
13
、和r
14
的定义不必限于这些官能团,并且可以附加地或另选地为在本文别处指定为“fn”的官能团中的一个或多个官能团,包括例如氰基、羟基、硝基、和三氟甲烷。
[0213]r11
、r
12
、r
13
、和r
14
还如上定义,和/或r
11
、r
12
、r
13
、和r
14
中的一对或多对独立地任选地连接在一起以形成环状或多环结构。接合r
12
和r
14
的虚线不应被视为限制性的,因为它代表一种可能的连接。再次,r
11
、r
12
、r
13
、和r
14
中的任何两者或更多者可以经连接以形成环状或多环结构。本公开的特征在于金刚烷作为衍生自这些选项的一种可能结构,但是其他任选经取代的双环或多环结构也可用于本发明方法中。例如,已知在钌复分解催化剂的情况下,已知任选经烷基取代的二环戊烷、二环己烷、二环庚烷和二环辛烷在此类化合物的上下文中使用,并且各自被认为是在该部分的定义范围内。在此上下文中的非限制性示例包括:
[0214][0215]
可替代地,r
11
、r
12
、r
13
、和r
14
还可以涵盖芳香族结构(例如,其中r
11
和r
12
形成芳香族基团的一部分),诸如:
[0216][0217]
如在此实施方案中并且贯穿本公开关于本文别处阐述的其他方面和实施方案所示,在某些方面中,钌化合物根据任选经取代的碳烯结构呈现为:
[0218]
但是应当理解,本公开不必限于这些芳基结构,并且还涵盖例
如其中6元碳环芳香族基团被任选经取代的杂芳基取代的化合物。代表性杂芳基基团在本公开中的别处阐述。在这种情况下,钌碳烯可以包含以下结构:
[0219][0220]
附加地或另选地,r6、r7、r8、和r9的定义提供了r6和r7、或r7和r8、或r8和r9与它们所结合的碳一起形成至少一个任选经取代的5元至7元环结构。换句话说,根据x3、r6、r7、r8、r9、和r
10
定义的碳烯结构涵盖其中指定的苯基(或吡啶基)基团包括例如稠合的任选经取代的芳基、杂芳基、环状亚烷基、环状亚烯基或杂环部分的那些结构。落入本说明书中的示例性的非限制性结构包括例如任选经取代的喹啉、(二)苯并呋喃、(二)苯并噻吩、(二)苯并吡咯、萘、蒽、菲、四氢萘、二氢萘、色烷、苯并二噁烷、二氢苯并二噁烷、茚、二氢化茚、苯并二氧杂环戊烯、二氢苯并呋喃、和二氢异苯并呋喃
[0221]
同样如如在此实施方案中并且贯穿本公开关于本文别处阐述的其他方面和实施方案所示,在某些方面中,钌碳烯根据以下两者呈现:
[0222][0223]
应当理解的是,在l、r
16
、和r
17
的定义的完整上下文内,涵盖这些术语的结构表示根据x3、r6、r7、r8、r9、和r
10
定义的结构的属,并且涵盖这些结构。在属比物质结构更宽的情况下,其他物质包括涵盖两个基团之间的差异的那些结构;例如,包括在涵盖l、r
16
、和r
17
部分的属中,但不在由x3、r6、r7、r8、r9、和r
10
部分涵盖的物质中的那些化合物。这些化合物包括其中钌碳烯部分包括fischer型碳烯(其中r
16
或r
17
包含任选经取代的烷氧基、芳氧基、或杂芳氧基侧基)的那些化合物,或其中单齿配体l不存在或被通过烷基或醚键与碳烯基团连接的杂环部分置换的结构,例如:
[0224]
[0225]
这些结构不被认为是对本公开的限制,而是代表由定义涵盖的较大范围的示例。
[0226]
同样如在此实施方案中并且贯穿本公开关于本文所述的化合物中的每种化合物所示,在各个方面中,l是根据连接至r
17
的中性电子供体配体、任选地中性电子供体溶剂或电子供体配体来定义的。还包括在本公开的化合物的上下文中的是其中不存在l的那些化合物和结构;即,这个基团既不由碳烯侧基提供,也不单独存在,并且钌中心进一步配位不饱和,例如在其他部分的空间堆积体积阻碍将l包含到钌中心的情况下。在存在时,l可以包括本文别处所述的中性电子供体配体中的任何一者或多者。在一些方面/实施方案中,l是任选经取代的杂芳基(诸如吡啶、咪唑、或吡嗪;其他杂芳基选项在本文别处阐述)、膦(包括烷基膦、芳基膦、和混合的烷基/芳基膦)、腈、醚(包括环醚)、硫醚、胺、一氧化碳、酮(例如,丙酮)、酰胺、亚砜、脲、硫脲、和n-杂环碳烯配体。在一些情况下,l可以由涉及这些化合物的反应中所使用的溶剂产生,并且因此l的定义也包括这些溶剂。
[0227]
同样如在这些方面中并且贯穿本公开针对本文所述的化合物中的每个化合物所呈现的,x3是根据-o-、-s-、或-n(r
10a
)定义的。应理解的是,在如此提供的每种情况下,x3的定义是根据-o-、-s-、或-n(r
10a
)单独地或作为该基团的一部分定义的。如果仅为了合成简单性,则其中x3是-o-的那些方面/实施方式看起来是优选的。
[0228]
也如在这些方面中并且贯穿本公开针对本文所阐述的化合物中的每一种化合物所呈现的,r
10
和r
10a
通常根据取代的烷基、任选经取代的芳基、或任选经取代的杂芳基独立地描述。然而,为了避免疑义,r
10
和r
10a
也可以更广泛地定义为包括任选经取代的c
1-24
烷基(优选c
1-l2
烷基,更优选c
1-6
烷基),包括直链、支链、环状和多环烷基(包括金刚烷基或其他双环烃)、任选经取代的c
2-24
烯基(优选c
2-12
烯基,更优选c
2-6
烯基)、任选经取代的c
2-24
炔基(优选c
2-12
炔基,更优选c
2-6
炔基)、任选经取代的c
6-24
芳基(优选c6芳基)、和任选经取代的5元至12元杂芳基(优选地5元或6元杂芳基)。这些结构可以任选地氟化或全氟化,或如本文所述以其他方式被一个或多个“fn”取代基取代。
[0229]
此外,虽然本文阐述的结构通常表示为例如:
[0230][0231]
但是描述和权利要求并不旨在限于这些立体构型,并且化合物本身可以作为替代几何异构体存在,例如:
[0232][0233]
并且描述涵盖所有在其他方式与结合一致的此类几何异构体/立体异构体。
[0234]
如在这些方面中并且贯穿本公开针对本文所述的化合物中的每种化合物所呈现的,特别是与式(ii)、(ii-a)、(xii)、和(xii-a)的化合物相关,y被描述为独立地为作为配体配位至钌中心配合的碱性阴离子。在该表征的某些方面中,y可以看作相对弱亲核的,但足够亲核以从对应的ru中心(如本文别处所示)置换卤离子并且足够碱性以被羧酸质子化。另选地或除此之外,这些碱的共轭酸在h2o中的pka范围优选在10至19的范围内。例如,在y是叔丁醇根或吡唑酸根的情况下、pka(叔丁醇)=17,并且pka(吡咯)=17.5。这将使它们足够碱性以与羧酸(pka 4至5)反应,但不太碱性以分解ru碳烯催化剂。
[0235]
另选地或除此之外,y可以独立地为氢氧根离子,c1-12醇盐、酰胺酸根阴离子、取代或未取代的酚盐、取代或未取代的吡唑酸根、取代或未取代的吲哚酸根、取代或未取代的异吲哚酸根、或取代或未取代的咪唑酸根。在某些方面中,y为醇盐、酰胺酸根阴离子、酚盐、取代或未取代的吡唑酸根、取代或未取代的吲哚酸根、取代或未取代的异吲哚酸根、或取代或未取代的咪唑酸根。y可以根据这些类型的阴离子中的任何一种或多种阴离子来定义,和/或选项列表可以排除一种或多种类型。在一些方面中,c
1-12
醇盐包括直链、支链或环状烷基醇盐,诸如甲醇盐、乙醇盐、正丙醇盐、异丙醇盐、仲丁醇盐、叔丁醇盐、2-五氧化物、3-五氧化物、四五氧化物、四六氧化物、环五氧化物、环六氧化物和(1s,4s)-双环并[2.2.1]六-1-氧化物。在本文中举例说明了叔丁醇。在一些方面中,酰胺酸根阴离子包括双(烷基/甲硅烷基)酰胺(诸如二异丙酰胺、双(三甲基甲硅烷基)酰胺)和烷基/芳基磺酰胺阴离子,诸如甲基磺酰胺阴离子(meso2nh2pka=17.5)或苯基磺酰胺阴离子。在一些方面中,经取代的酚盐是受阻酚盐,包括在2,6位置被取代的酚盐,诸如2,6-二甲基酚盐或2,6-二异丙基酚盐)。
[0236]
如在这些方面中并且贯穿本公开针对本文所述的化合物中的每种化合物所呈现的,特别是与式(iii)、(iii-a)、(xiii)和(xiii-a)的化合物相关,z是羧酸根,并且z-h是对应的羧酸。在本公开中,z通常根据式c(r
18
)(r
19
)(r
20
)cooh描述,其中r
18
、r
19
、和r
20
独立地为氢、任选经取代的烷基、任选经取代的烯基、任选经取代的芳基、或任选经取代的杂芳基,前提条件是r
18
、r
19
、和r
20
不全是氢;和/或r
18
、r
19
、和r
20
中的两者或三者连接在一起以形成环状或多环结构。在优选方面和实施方案中,z是至少仲碳基团的羧酸根,并且优选是叔碳基。较庞大的羧酸根在本文所阐述的方法中似乎是优选的,并且新戊酸在本文中例示为新戊酸根的羧酸源的来源。在这些实施方案的其他方面中,本文所阐述的化合物、结构和方法中的某些化合物、结构和方法包括其中z包括羧酸异丙酯、羧酸仲丁酯、羧酸叔丁酯、羧酸2-戊酯、羧酸3-戊酯、羧酸叔戊酯、羧酸叔己酯、羧酸环戊酯、羧酸环己酯、(1s,3s)-金刚烷-1-羧酸酯、(1s,4s)-二环并[2.2.1]庚烷-1-羧酸酯、和1-甲基环己烷-1-羧酸酯的那些化合物、结构和方法。
[0237][0238]
在该实施方案的一些方面中,与羧酸根的接触伴随着附加使用对应的羧酸盐,优选地碱金属羧酸盐。
[0239]
在此实施方案中,该方法被阐述为使式(ii)或(xii)的化合物与式z-h的羧酸接
触,其中该接触导致分别形成式(iii)或(xiii)的化合物。如本文所述,术语“接触”旨在反映使成分在一起以允许它们彼此反应的作用。替代语言可以包括使式(ii)或(xii)的化合物与式z-h的羧酸反应,其中该反应导致分别形成式(iii)或(xiii)的化合物。”实施例向本领域的技术人员提供了关于有机金属化学物质通常用于并且钌复分解催化剂特别地用于操作本文所阐述的方法的充分教导。本发明方法的典型反应包括使成分在可以从-20℃变化到60℃的范围内的一个或多个温度下反应持续可以从一分钟或多(若干)分钟到一天或多(若干)天变化的时间。反应优选地在惰性(例如,氩气或氮气)气氛下进行,例如使用schlenk或手套箱技术以避免暴露于空气。本领域中通常使用的那些溶剂在本文中是有用的,包括但不限于烷烃(诸如环己烷、己烷、庚烷、戊烷、石油醚)、脂肪族氯化溶剂(诸如二氯甲烷、二氯乙烷、氯仿、四氯化碳)、烷基酯(诸如乙酸乙酯)、脂肪族腈(例如,乙腈)、酰胺(诸如二甲基乙酰胺、二甲基甲酰胺、nmp)、六甲基磷酰胺、醚(诸如二乙醚、二甲基醚、1,2-二甲氧基-乙烷、二乙二醇二甲醚、甲基-叔丁基醚1,4-二噁烷、四氢呋喃、甲基-四氢呋喃)、醇(例如,c
1-12
烷醇、乙二醇)、酮(诸如丙酮)、任选经取代的芳香族烃(诸如苯、甲苯、氟代苯、氯代苯、二甲苯、五氟苯、六氟苯)、杂芳香族溶剂(诸如吡啶)、亚砜(例如,二甲亚砜)、硝基甲烷、或它们的混合物。
[0240]
实施方案2.根据实施方案1所述的方法,该方法还包括使式(i)或(xi)的化合物或其几何异构体与式[m
][y-]的盐接触,其中阴离子y-对应于至少在实施方案1中所述的y配体,其中该接触导致分别形成式(ii)或(xii)的化合物或其几何异构体:
[0241][0242]
其中:
[0243]
x1和x2独立地为氯、溴、或碘;
[0244]m
是单阳离子当量阳离子,诸如碱金属阳离子、铵阳离子、或其他基于氮的阳离子,或可以任选地为或包括本文所阐述的其他阳离子(例如,二价阳离子和三价阳离子)。
[0245]
在该实施方案的其他方面中,方法可以独立地进行;即,不与实施方案1串联。
[0246]
在本实施方案的某些方面中,以及在本文别处所阐述的化合物和方法中,如果仅由于制造二氯化合物的简单性和成本效益,则氯对于x1和x2两者都是优选的。
[0247]
同样在本实施方案的某些方面中,y-阴离子对应于如在实施方案1中所示的y配体,如式(ii)、(ii-a)、(xii)、和(xii-a)的化合物,并且这些公开内容并入本文。同样,如在实施方案1中针对这些结构阐述的与nhc、芳香族侧基、空间位阻基团、碳烯和配体的通式结构相关联的描述也适用于对应的式(i)、(i-a)、(xi)、和(xi-a)的化合物。此外,实施方案1中所阐述的关于时间、温度、溶剂和氧化保护的反应条件在此也适用。
[0248]
在该实施方案的各方面中,m
是根据单阳离子当量阳离子(诸如碱金属阳离子、铵阳离子、或其他基于氮的阳离子)定义的。在此上下文中,在这些方面中的某些方面中,li
、na
、k
、rb
、cs
,任选地烷基化/芳基化的铵、或任选经取代的吡啶鎓阳离子是有用的。使用给定y-阴离子时特定m
阳离子的特定选择更多地取决于来源的便利性而不是所匹配的对的特定性质。li
、na
、k
是优选的阳离子。在本文的一些方面中,[m
][y-]包括叔丁醇钾和吡唑酸锂的使用。在其他方面中,在该实施方案中阐述的反应可以在不存在或存在阳离子螯合剂(诸如穴醚或冠醚)的情况下进行。
[0249]
在该实施方案的一些方面中,m
单阳离子当量阳离子的定义不必限于本实施方案和贯穿全文所呈现的那些(即,碱金属阳离子、铵阳离子、或其他基于氮的阳离子),并且其他阳离子可以用于代替它们。在其他方面中,m
单阳离子当量阳离子还可以包括具有或没有其他相关配体的其他金属阳离子,例如ag
、cu
、cu
2
、zn
2
、mg
2
、和al
3
。术语“单阳离子当量阳离子”是指存在足够的电荷以抵抗单阴离子y-,例如如在1/2(zn
2
)(y-)2中为1/2zn
2
。
[0250]
实施方案3.根据实施方案1或2所述的方法,该方法还包括使式(iii)或(xiii)的化合物或其几何异构体与能够作为二齿配体对钌进行配位的三氟乙酸根、硝酸根、亚硝酸根、草酸根、磷酸根、亚硫酸根、或磺酸根、或其他强酸(h-q)的阴离子反应,以分别形成式(iv)或(xiv)的化合物或其几何异构体:
[0251][0252]
其中q是经配位的三氟乙酸根、硝酸根、亚硝酸根、草酸根、磷酸根、亚硫酸根、磺酸根、或其他强酸(h-q)的阴离子,这些离子能够作为二齿配体对钌进行配位。通常,这些阴离子作为二齿配体配位至钌。基于此类复合物的反应性,硝酸根似乎是优选的。这些阴离子的铵盐似乎是这些阴离子的合适种类。特别地,硝酸铵在本文中很好地起作用。
[0253]
在该实施方案的其他方面中,方法可以独立地进行;即,不与实施方案1和/或2串联。
[0254]
在此实施方案中,如在先前实施方案中,如在实施方案1中针对这些结构阐述的与nhc、芳香族侧基、空间位阻基团、碳烯和配体的通式结构相关联的描述也适用于式(iii)、(iii-a)、(xiii)、和(xiii-a)的对应化合物。此外,实施方案1中所阐述的关于时间、温度、溶剂和氧化保护的反应条件在此也适用。
[0255]
实施方案4.根据实施方案2或3所述的方法,其中使式(i)或(xi)的化合物与式[m
][y-]的盐接触从而导致分别形成式(ii)或(xii)的化合物的步骤,以及分别使式(ii)或(xii)的化合物与式z-h的羧酸接触从而导致形成式(iii)或(xiii)的化合物的后续步骤,分别在不分离式(ii)或(xii)的化合物的情况下进行。
[0256]
实施方案5.根据实施方案1至4中任一项所述的方法,其中r1和r4是任选经取代的c
1-6
烷基,优选地支链c
3-6
烷基,支链c
4-6
烷基、或苯基,并且r2、r3、和r5独立地为氢或任选经取代的c
1-6
烷基,优选地支链c
3-6
烷基。在其他方面中,r1、r2、r3、r4和r5的定义中的一个或多个定义被从这些术语的一般定义中排除。
[0257]
实施方案6.根据实施方案1到4中任一项所述的方法,其中r1、r4、和任选的r3独立地为c
1-6
烷基,优选地支链c
3-6
烷基、支链c
4-6
烷基、或苯基。在本实施方案的某些方面中,r2和r5是h。在其他方面中,r1、r2、r3、r4和r5的定义中的一个或多个定义被从这些术语的一般定义中排除。
[0258]
实施方案7.根据实施方案1至4中任一项所述的方法,其中该芳香族侧基:
[0259][0260][0261]
其中r
21
是卤素、任选经取代的c
1-12
烷基、任选经取代的c
2-12
烯基、任选经取代的c
1-12
烷氧基、任选经取代的c
6-24
芳基、任选经取代的c
3-24
杂芳基、或硝基;并且
[0262]
n在每次出现时独立地为0至4。
[0263]
实施方案8.根据实施方案1至4中任一项所述的方法,其中该芳香族侧基:
[0264][0265]
实施方案9.根据实施方案1至8中任一项所述的方法,其中该x3是-o-。
[0266]
实施方案10.根据实施方案1至9中任一项所述的方法,其中r
10
和/或r
10a
是取代或未取代的苯基或支链c
3-24
烷基、环状c
3-24
烷基、双环c
6-24
烷基、或多环c
6-24
烷基,例如异丙基、叔丁基、或金刚烷基。在本实施方案的其他方面中,取代或未取代的苯基或支链c
3-6
烷基,包括异丙基,被从r
10
和/或r
10a
的定义中排除。
[0267]
实施方案11.根据实施方案1至10中任一项所述的方法,其中该空间位阻基团:
[0268]
包含任选经烷基取代的金刚烷基部分。
[0269]
实施方案12.根据实施方案1至11中任一项所述的方法,其中:
[0270]
(a)所述式(ii)的化合物是式(ii-a)的化合物,并且所述式(iii)的化合物是式(iii-a)的化合物:
[0271][0272]
以及
[0273]
(b)所述式(xii)的化合物是式(xii-a)的化合物,并且所述式(xiii)的化合物是式(xiii-a)的化合物:
[0274][0275]
在该实施方案的一些方面中,芳香族部分通过在r1和r4位置中存在更大的取代基(例如,具有大于4个碳的支链烷基;芳基或杂芳基)或存在稠合c
5-7
环系而在空间上比dipp(2,6-二异丙基苯基,即r1=r4=异丙基)更庞大。
[0276]
实施方案13.根据实施方案2至12中任一项所述的方法,其中:
[0277]
(a)所述式(i)的化合物是式(i-a)的化合物:
[0278]
或者
[0279]
(b)所述式(xi)的化合物是式(xi-a)的化合物:
[0280][0281]
在该实施方案的一些方面中,芳香族部分通过在r1和r4位置中存在更大的取代基(例如,具有大于4个碳的支链烷基;芳基或杂芳基)或存在稠合c
5-7
环系而在空间上比dipp(2,6-二异丙基苯基,即r1=r4=异丙基)更庞大。
[0282]
实施方案14.根据实施方案3至13中任一项所述的方法,其中:
[0283]
(a)所述式(iv)的化合物是式(iv-a)的化合物:
[0284][0285]
(b)所述式(xiv)的化合物是式(xiv-a)的化合物:
[0286][0287]
在该实施方案的一些方面中,芳香族部分通过在r1和r4位置中存在更大的取代基(例如,具有大于4个碳的支链烷基;芳基或杂芳基)或存在稠合c
5-7
环系而在空间上比dipp(2,6-二异丙基苯基,即r1=r4=异丙基)更庞大。
[0288]
实施方案15.一种式(xx-a)、(xx-b)、(xx-c)或(xx-d)的钌化合物:
[0289][0290]
其中:
[0291]
r1、r2、r3、r4、r5、r6、r7、r8、和r9独立地为氢、卤素、任选经取代的烷基、任选经取代的烯基、任选经取代的烷氧基、任选经取代的芳基、任选经取代的芳氧基、任选经取代的杂芳基、任选经取代的杂芳氧基、或硝基基团;
[0292]
和/或r1和r2、或r2和r3、或r6和r7、或r7和r8、或r8和r9中的一者或多者与其所结合的碳一起形成至少一个任选经取代的5元至7元环结构;
[0293]
x3是-o-、-s-、或-n(r
10a
)-;
[0294]r10
和r
10a
是任选经取代的直链、支链、环状、双环或多环c
3-24
烷基、任选经取代的芳基、或任选经取代的杂芳基;
[0295]r11
、r
12
、r
13
、和r
14
独立地为氢、卤素、任选经取代的烷基、任选经取代的烯基、任选经取代的烷氧基、任选经取代的芳基、任选经取代的杂芳基;并且/或者
[0296]r11
、r
12
、r
13
、和r
14
中的一对或多对独立地任选连接在一起以形成环状或多环结构;
[0297]
名称是指任选的双键的存在;
[0298]
m是0、1、2、3、或4;
[0299]r15
独立地为任选经取代的烷基、任选经取代的烯基、任选经取代的烷氧基、任选经取代的芳基、任选经取代的芳氧基、任选经取代的杂芳基、任选经取代的杂芳氧基、卤基、氰基、硝基,或者r
15
中的任何两个r
15
可以连接以形成环状结构(例如,包括经连接的亚烷基或醚);
[0300]r16
和r
17
独立地为氢、卤素、任选经取代的烷基、任选经取代的烯基、任选经取代的烷氧基、任选经取代的烯基、任选经取代的芳基、任选经取代的芳氧基、任选经取代的杂芳基、或任选经取代的杂芳氧基;g独立地为:
[0301]
(a)氯、溴、或碘、或它们的组合;
[0302]
(b)碱性阴离子,所述碱性阴离子作为配体配位至钌中心,每个碱性阴离子包含氢氧根离子,c
1-12
醇盐、酰胺酸根阴离子、取代或未取代的酚盐、取代或未取代的吡唑酸根、取
代或未取代的吲哚酸根、取代或未取代的异吲哚酸根、或取代或未取代的咪唑酸根;以及
[0303]
l是连接到r
17
的中性电子供体配体,任选地中性电子供体溶剂或电子供体配体。
[0304]
在该实施方案的一些方面中,以下前提条件适用:
[0305]
当g是氯、溴或碘或它们的组合时,则r1和r4独立地为任选经取代的c
4-12
、c
5-12
、c
6-12
、c
7-12
、或c
8-12
烷基,任选经取代的芳基,任选经取代的杂芳基,或任选经取代的杂芳氧基;和/或r1和r2、或r2和r3、或r3和r5、或r4和r5中的一者或多者与其所结合的碳一起形成至少一个任选经取代的5元至7元环结构。
[0306]
在本实施方案的其他方面中,当g是氯、溴、或碘或它们的组合时,则r1和r4独立地为经取代的支链c
4-12
、c
5-12
、c
6-12
、c
7-12
、或c
8-12
烷基。
[0307]
在本实施方案的其他方面中,当g是氯、溴、或碘或它们的组合时,则r
10
和r
10a
都不是异丙基或任选经取代的苯基。
[0308]
在本实施方案中针对r1、r2、r3、r4、r5、r6、r7、r8、r9、r
10
、r
10a
、r
11
、r
12
、r
13
、r
14
、r
15
、r
16
、r
17
、r
18
、r
19
、r
20
、g、l和m阐述的定义不一定旨在限制这些组合物。例如,本文的g的定义包括先前实施方案中与x1、x2和y相关联的那些方面、定义和描述。更一般地,在本实施方案的某些方面中,如在先前实施方案中的任何实施方案中阐述的与nhc、芳香族侧基、空间位阻基团、碳烯和配体的通式结构相关联的描述也适用于式(xx-a)、(xx-b)、(xx-c)、和(xx-d)的对应化合物,包括针对r1、r2、r3、r4、r5、r6、r7、r8、r9、r
10
、r
10a
、r
11
、r
12
、r
13
、r
14
、r
15
、r
16
、r
17
、r
18
、r
19
、r
20
、g、l和m的定义中的某些定义呈现的特定排除。
[0309]
实施方案16.一种式(y-a)、(y-b)、(y-c)、或(y-d)的钌化合物:
[0310][0311][0312]
其中:
[0313]
r1、r2、r3、r4、r5、r6、r7、r8、和r9独立地为氢、卤素、任选经取代的烷基、任选经取代
的烯基、任选经取代的烷氧基、任选经取代的芳基、任选经取代的芳氧基、任选经取代的杂芳基、任选经取代的杂芳氧基、或硝基基团;
[0314]
和/或r1和r2、或r2和r3、或r6和r7、或r7和r8、或r8和r9中的一者或多者与其所结合的碳一起形成至少一个任选经取代的5元至7元环结构;
[0315]
x3是-o-、-s-、或-n(r
10a
)-;
[0316]r10
和r
10a
是任选经取代的直链、支链、环状、双环或多环c
3-24
烷基、任选经取代的芳基、或任选经取代的杂芳基;
[0317]r11
、r
12
、r
13
、和r
14
独立地为氢、卤素、任选经取代的烷基、任选经取代的烯基、任选经取代的烷氧基、任选经取代的芳基、任选经取代的杂芳基;并且/或者
[0318]r11
、r
12
、r
13
、和r
14
中的一对或多对独立地任选连接在一起以形成环状或多环结构;
[0319]
名称是指任选的双键的存在;
[0320]
m是0、1、2、3、或4;
[0321]r15
独立地为任选经取代的烷基、任选经取代的烯基、任选经取代的烷氧基、任选经取代的芳基、任选经取代的芳氧基、任选经取代的杂芳基、任选经取代的杂芳氧基、卤基、氰基、硝基,或者r
15
中的任何两个r
15
可以连接以形成环状结构(例如,包括经连接的亚烷基或醚);
[0322]
j独立地为:
[0323]
(a)单齿配体,诸如在本文别处针对x1或y所述的那些,例如至少在其2,6-位被取代的酚盐;
[0324]
(b)羧酸根[任选地具有式c(r
18
)(r
19
)(r
20
)c(=o)o-],其中r
18
、r
19
、和r
20
独立地为氢、任选经取代的烷基、任选经取代的烯基、任选经取代的芳基、或任选经取代的杂芳基,前提条件是r
18
、r
19
、和r
20
不全是氢;和/或r
18
、r
19
、和r
20
中的两者或三者连接在一起以形成环状或多环结构;或
[0325]
(c)三氟乙酸根、硝酸根、亚硝酸根、草酸根、磷酸根、亚硫酸根、磺酸根、或其他强酸(h-q)的阴离子,这些离子能够作为二齿配体对钌进行配位;
[0326]r16
和r
17
独立地为氢、卤素、任选经取代的烷基、任选经取代的烯基、任选经取代的烷氧基、任选经取代的烯基、任选经取代的芳基、任选经取代的芳氧基、任选经取代的杂芳基、或任选经取代的杂芳氧基;以及
[0327]
l是连接到r
17
的中性电子供体配体,任选地中性电子供体溶剂或电子供体配体。
[0328]
在本实施方案的一些方面中,以下前提条件适用:当j是能够作为二齿配体对钌进行配位的经取代的酚盐,式c(r
18
)(r
19
)(r
20
)c(=o)o-的羧酸根、或三氟乙酸根、硝酸根、亚硝酸根、草酸根、磷酸根、亚硫酸根、磺酸根、或其他强酸(h-q)的阴离子时,则芳香族侧基比dipp(2,6-二异丙基苯基)更庞大,例如,则r1和r4独立地为任选经取代的c
4-12
烷基、任选经取代的芳基、任选经取代的杂芳基、或任选经取代的杂芳氧基;和/或r1和r2、或r2和r3、或r3和r5、或r4和r5中的一者或多者与其所结合的碳一起形成至少一个任选经取代的5元至7元环结构。
[0329]
在本实施方案的一些方面中,以下前提条件适用:当j是能够作为二齿配体对钌进行配位的经取代的酚盐,式c(r
18
)(r
19
)(r
20
)c(=o)o-的羧酸根、或三氟乙酸根、硝酸根、亚硝酸根、草酸根、磷酸根、亚硫酸根、磺酸根或其他强酸(h-q)的阴离子时,则r
10
比异丙基更
庞大,例如为任选经取代的c
4-12
烷基、任选经取代的芳基、任选经取代的杂芳基、或任选经取代的杂芳氧基。
[0330]
在本实施方案中针对r1、r2、r3、r4、r5、r6、r7、r8、r9、r
10
、r
10a
、r
11
、r
12
、r
13
、r
14
、r
15
、r
16
、r
17
、r
18
、r
19
、r
20
、j、l和m阐述的定义不一定旨在限制这些组合物。例如,本文的j的定义还包括先前实施方案中与x1、y、q和z相关联的那些方面、定义和描述。更一般地,在本实施方案的某些方面中,如在先前实施方案中的任何实施方案中阐述的与nhc、芳香族侧基、空间位阻基团、碳烯和配体的通式结构相关联的描述也适用于式(y-a)、(y-b)、(y-c)、和(y-d)的对应化合物,包括针对r1、r2、r3、r4、r5、r6、r7、r8、r9、r
10
、r
10a
、r
11
、r
12
、r
13
、r
14
、r
15
、r
16
、r
17
、r
18
、r
19
、r
20
、q和z的定义中的某些定义呈现的特定排除。
[0331]
基于本文的描述,本实施方案的一些示例性方面包括:
[0332][0333]
其中ar是比dipp更庞大的芳香族侧基,或者其中r
10
是任选经取代的芳香族基团。
[0334]
实施方案17.一种方法,该方法包括使至少一种烯烃、炔烃或烯炔与根据实施方案15或16所述的钌化合物或通过根据实施方案1至14中任一项所述的方法制备的钌化合物接触,该接触导致反应,该反应包括:
[0335]
(a)两种不同烯烃,或烯烃、炔烃和/或烯炔的交叉复分解(cm);
[0336]
(b)二烯的闭环复分解(rcm),从而导致形成环烯烃环;
[0337]
(c)两种烯烃的同二聚化
[0338]
(d)无环二烯复分解(admet),从而导致形成低聚物和/或聚合物;
[0339]
(e)开环交叉复分解(rocm),从而导致无环二烯;
[0340]
(f)环烯烃的开环复分解聚合(romp),从而导致聚合物;或
[0341]
(g)烯烃的e/z异构体混合物的乙烯醇分解以提供该混合物的e烯烃含量的富集。
[0342]
每个反应过程,当关于本实施方案中阐述的钌化合物进行独立表示时,是如本文别处所述的本实施方案的独立方面,如同被独立列举一样。
[0343]
在该实施方案的某些方面中,尤其是与(a)至(f)中所阐述的反应相关,对应反应的产物主要是z异构体烯烃。例如,在反应产物是或包括e异构体和z异构体的混合物的情况下,z异构体含量大于e/z异构体混合物的50mol%。在本实施方案的独立方面中,z异构体含量是e/z异构体混合物的55mol%或更高、60mol%或更高、65mol%或更高、70mol%或更高、75mol%或更高、80mol%或更高、85mol%或更高、90mol%或更高、95mol%或更高、97mol%或更高、98mol%或更高、99mol%或更高、或实际上100mol%。
[0344]
与(g)中所阐述的乙烯醇分解相关,与该方法相关联的反应提供用于从混合物中优先反应和去除z烯烃。在该实施方案的某些独立方面中,接触导致优先去除z烯烃,使得剩余e/z烯烃混合物中e烯烃的最终比例为至少95%、96%、97%、98%、99%、99.5%、99.8%、或实际上纯的e烯烃(即,z烯烃已完全从混合物中去除)
[0345]
虽然本文所述的催化剂被认为对于其影响提供z异构体产物的转化的能力被认为是唯一的,但是针对这些grubbs型催化剂来说,用于进行这些转化的复分解反应和条件是众所周知的。技术人员将能够进行这些反应并识别这些钌化合物在方法中使用的优点,而无需过度实验。参见例如,montgomery等人,“recent advancements in stereoselective olefin metathesis using ruthenium catalysts,”catalysts,2017,7(3),87。
[0346]
实施例
[0347]
提供以下实施例以说明本公开内描述的概念中的一些概念。虽然每个实施例被认为提供组合物的具体单独实施方案、制备方法和用途,但是任何实施例都不应被视为限制本文所述的更一般实施方案。
[0348]
在以下实施例中,已经努力确保所用数值的准确性(例如量、温度等),但应当考虑到一些实验误差和偏差。除非另有说明,温度以摄氏度为单位,压力为大气压或接近大气压。
[0349]
实施例1:通用信息
[0350]
除非另有说明,否则所有反应均在干燥玻璃器具中在惰性气氛(例如,氮气或氩气)下使用标准schlenk管线技术进行,或在氮气气氛下在手套箱中进行。化学品从商业来源接收并按照本领域的标准实践进行纯化。标准nmr光谱实验在varian mercury(1h,300mhz)光谱仪、varian inova 400mhz光谱仪、配备有autox探针的varian 500mhz光谱仪、或配备有triax探针的varian 600mhz光谱仪上进行。通过使用残余溶剂峰值作为内标,以ppm前场为单位从me4si报告化学位移。使用mestrenova分析和处理光谱。
[0351]
以下反应(如在描述和附图中阐述的各种实施方案中所表示)是在从-20℃变化至40℃的温度下,在惰性气氛(氮气或氩气)下进行的。反应时间从几分钟至几个小时变化,部分取决于组合物的性质或在一些情况下仅仅是为了方便。如下描述了若干代表性实施例,但是这些过程可以如本领域技术人员所理解的那样修改,并且因此应被认为是示例性的而不是限制性的。
[0352]
实施例2:z烯烃复分解催化剂ru-5的制备:根据以下方案制备ru-5,其本身是z选择性烯烃复分解催化剂并且还是ru-1的前体:
[0353][0354]
在第一反应中,阴离子配体交换通过用两批次的叔丁醇钾处理二氯化钌而达到完全转化,从而以83%产率提供了钌双叔丁氧化物(ru-4)。在第二反应中,于-20℃用新戊酸处理ru-4导致干净地形成瞬时双新戊酸钌物质,其在升温至室温时平稳地经历c-h活化,从而以74%产率和》98%的纯度产生了ru-5。
[0355]
更具体地,将ko-叔-bu(1.5mmol,3当量,168mg)一次性加入到于20ml小瓶中的起始二氯化钌(0.5mmol,1.0当量,322mg)在苯(8ml)中的溶液中。将悬浮液在室温下搅拌5小时,然后滤过短硅藻土垫进入另一20ml小瓶中,向该小瓶中装入ko-叔-bu(0.75mmol,1.5当量,84mg)。将所得悬浮液进一步搅拌过夜,然后真空浓缩。将残余物溶解于戊烷(8ml)中,通过短硅藻土垫,并真空浓缩以产生呈棕色固体的ru-4(约90%至95%的纯度)(300mg,83%产率)。ru-4的代表性1h-nmr光谱提供于图5中。
[0356]
接下来,向8ml小瓶中装入一部分ru-4(72mg,0.1mmol,1.0当量)在thf中的溶液(2ml,溶液a)。向4ml小瓶中装入pivoh(21.4mg,0.21mmol,2.1当量)在thf中的溶液(1.5ml,溶液b)。将两个小瓶置于手套箱冰箱(-20℃)中15分钟。通过使用3ml注射器将溶液b快速转移到溶液a中,并将所得混合物放回冰箱中,并且在不搅拌的情况下静置1.5小时。然后将混合物取出并在室温下搅拌15分钟,然后真空浓缩。将残余物转移到短硅藻土柱上,并用戊烷(3.5ml)冲洗以去除褐色条带,然后用苯(7ml)冲洗以获得呈紫色溶液的产物。去除溶剂得到了呈紫色固体的ru-5(纯度》97%)(50mg,74%产率)。ru-5的代表性1h-nmr光谱提供于图6中。
[0357]
实施例3:实施例2中所阐述的过程还适用于具有快速引发配体的新类型的z选择性烯烃复分解催化剂的合成,
[0358][0359]
从对应的第一代grubbs钌烯烃复分解催化剂开始,分四个步骤以43%的总产率以及》99%的纯度合成了ru-7,而ru-8是分五个步骤以30%的总产率以及》99%的纯度合成的。使用该新方法,关键新戊酸根交换和c-h键活化步骤在两个步骤中以64%产率平稳地发生。在第一反应中,阴离子交换在用三当量的叔丁醇钾处理二氯化钌前体后达到完全转化,从而以95%产率提供了钌双叔丁氧化物(ru-6)。在第二反应中,于-20℃用新戊酸处理ru-6产生了在纯化后产率为67%的ru-7。在室温下用12当量的nh4no3的thf溶液进一步处理ru-7以70%产率提供了ru-8。关键步骤的详细过程类似于实例3中描述的关键步骤的详细过程。ru-7和ru-8的代表性1h-nmr光谱分别如图7和图8所示。
[0360]
实施例4:
[0361][0362]
此过程也可用于显著改善ru-10的合成,ru-10本身是z选择性烯烃复分解催化剂,并且也是商业化的ru-2的前体。在第一反应中,阴离子交换通过在室温下用3.5当量的吡唑酸锂的thf溶液处理二氯化钌前体而达到完全转化,从而导致以82%产率生成双吡唑酸钌(ru-9)。在第二反应中,在室温下用新戊酸处理ru-9导致以85%产率形成ru-10。该序列的总产率为70%,这显著高于先前的途径。详细的实验过程与实施例1中描述的相似。通过以
下过程制备吡唑酸锂:将经烘干的烧瓶配备搅拌棒和橡胶隔膜并在ar下循环。穿过隔膜向此烧瓶中加入干己烷(6ml)和吡咯(248mg,2.7mmol,1.0当量)。用干冰/丙酮浴将溶液冷却至-78℃,并且滴加n-buli(1.5ml,2.45m的己烷溶液,3.6mmol,0.98当量)。将反应物搅拌15分钟,并去除冷浴。在再搅拌4小时后,将溶液转移到手套箱中的玻璃离心管中,并加入戊烷(10ml)。将试管离心并去除上清液。再重复该冲洗三次,并使用高真空去除残留溶剂以产生》90%产率的灰白色粉末。
[0363]
实施例5:
[0364][0365]
该过程也用于合成ru-12,其是与商业化的ru-2相比具有更大nhc配体的z选择性烯烃复分解催化剂。在第一反应中,阴离子交换通过在室温下用3.0当量的叔丁醇钾处理二氯化钌前体而达到完全转化,从而导致以80%产率生成双叔丁醇钌(ru-11)。在第二反应中,于-20℃用新戊酸处理ru-11导致以80%产率形成ru-12。详细的实验过程与实施例2中描述的相似。ru-12的代表性1h-nmr光谱如图9所示。
[0366]
实施例6:
[0367][0368]
该过程也可用于合成ru-14,其是另一种与商业化的ru-2相比具有更大nhc配体的z选择性烯烃复分解催化剂。在第一反应中,阴离子交换通过在室温下用3.5当量的吡唑酸锂的thf溶液处理二氯化钌前体而达到完全转化,从而导致以90%产率生成双吡唑酸钌(ru-13)。在第二反应中,在室温下用新戊酸的苯溶液处理ru-13导致以70%产率形成ru-14。详细的实验过程与实施例2中描述的相似。通过遵循实施例4中描述的过程来制备吡唑酸锂。
[0369]
实施例7:从二氯化合物一锅合成所选化合物。
[0370][0371]
所公开的方法还包括用于本文所表示的反应的一锅过程。需注意,在一些情况下,还需要对应的碱金属羧酸盐以确保起始材料或中间体的完全转化。
[0372]
如以上方案中所表示的,应用此一锅过程来在上述条件下制备ru-5。ru-5以通过1h-nmr测得的66%产率形成,并以47%产率分离。
[0373]
将ko-叔-bu(0.3mmol,3.0当量,30.4mg)加入到于4ml小瓶中的起始二氯化钌(0.1mmol,1.0当量,64.3mg)在苯(1.4ml)中的溶液中。将悬浮液在室温下搅拌7.5小时,然后滤过短硅藻土垫进入20ml小瓶中,该小瓶中预装有naopiv(0.2mmol,2.0当量,24.8mg)。使用1.5ml thf洗涤硅藻土垫,将其与苯滤液合并(溶液a)。向另一个4ml小瓶中装入pivoh(25mg,0.25mmol,2.5当量)在thf中的溶液(1.5ml,溶液b)。将两个小瓶置于手套箱冰箱(-20℃)中5分钟。通过使用3ml注射器将溶液b快速转移到溶液a中,并将所得混合物放回冰箱中,并且在不搅拌的情况下静置1.5小时。然后将混合物取出并在室温下搅拌过夜,然后真空浓缩。将残余物转移到短硅藻土垫上。将硅藻土垫用戊烷(3ml)和meoh(1.25ml)冲洗以去除褐色条带,然后用苯(4.5ml)冲洗以获得呈紫色溶液的产物。去除溶剂得到了呈紫色固体的ru-5(31.4mg,47%产率)。
[0374]
实施例8:复分解反应。
[0375]
实施例8.1:以一系列实验展示了相对于现有催化剂,这些催化剂对某些官能团的耐受性和对r
10
位置中的空间堆积体积的影响。代表性催化剂(ru-5)显示为高效地催化丙烯酸叔丁酯与1-十二碳烯之间的交叉复分解。产物在2小时内以53%产率产生,具有》50:1的z:e选择性,并且最终产率为80%,具有40:1的z:e选择性。形成强烈对比,在本公开中所阐述的那些催化剂之前,最佳现有催化剂(ru-2)仅可在反应26小时后以46%产率生成产物。
[0376][0377]
实施例8.2:在第二系列实验中,代表性催化剂(ru-7)显示为高效催化n-苄基丙烯酰胺与1-十二碳烯之间的交叉复分解。产物在16小时内以78%产率生成,具有》96:4的z:e选择性。在本公开中所阐述的那些催化剂之前,最佳现有催化剂(ru-2)仅可在反应2天后以40%产率生成产物。
[0378][0379]
实施例8.3:发明人已经发现,通过新方法制造的新钌催化剂中的一些新钌催化剂已经进一步显示出与现有的z选择性烯烃复分解催化剂相比在选择性和反应性两方面增加的催化活性。例如,在廉价的丙烯酰胺与常规末端烯烃之间的z选择性交叉复分解表示用于构建(z)-α,β-不饱和酰胺(生物活性分子和构件中的常见基序,参见图10)的高度期望的方法,因为其他常见的替代方法通常需要使用高级合成中间体、昂贵的起始材料、或苛刻的反应条件(例如,图11)。通过一系列受控实验,发明人已经辨识出ru-12(其合成是通过本文所公开的方法实现的),其与商业催化剂ru-2相比表现出显著更高的反应性和更高的对交叉复分解的选择性:
[0380][0381][0382]
本公开中引用或描述的每个专利、专利申请和公开案出于所有目的或者至少出于引用或参考其的目的据此以引用方式并入本文,或者在引用或参考其的上下文中并入。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。