institution of washington)似乎在时间上对应于胎盘哺乳动物中皮肤再生的丧失(walmsley,g.g等2015.scarless wound healing:chasing the holy grail plast reconstr surg.135(3):907-17)。物种之间的相关性显示胚胎或幼虫状态下的再生潜力增加(综述于morgan,t.h.(1901).regeneration(new york:the macmillan company);以及sanchez alvarado,a.,和tsonis,p.a.(2006)bridging the regeneration gap:genetic insights from diverse animal models.nat.rev.genet.7,873-884)。这表明组织再生,与瘢痕形成相反,反映了胚胎表型而不是胎儿或成人表型的存在,尽管关于表变态组织再生是胚胎(出生前,更具体地说,胎儿前)基因表达模式的结果目前在科学界尚未达成共识。在某些物种的情况下,发育时机的变化(异时性)与深刻的再生潜力相关,例如在墨西哥蝾螈(a.mexicanum)中观察到的幼虫发育(异时性)和肢体再生的发育停滞的情况(voss,s.r.等,thyroid hormone responsive qtl and the evolution of paedomorphic salamanders.heredity(2012)109,293-298)。
9.我们之前公开了用于将分化的哺乳动物体细胞重编程为多能性的组合物和方法,所述方法包含涉及将哺乳动物细胞暴露于能够将所述体细胞重编程为多能性的细胞质因子的那些方法,包括使用来自表达高水平重编程因子的未分化细胞的细胞质泡(其运输所述重编程因子),其中重编程因子例如barx1、croc4、dnmt3b、h2afx、hhex、histih2ab、histih4j、hmgb2、hsa-mir-18a、hsa-mir-18b、hsa-mir-20b、hsa-mir-96、hsa-mir-106a、hsa-mir-107、hsa-mir-141、hsa-mir-183、hsa-mir-187、hsa-mir-203、hsa-mir-211、hsa-mir-217、hsa-mir-218-1、hsa-mir-218-2、hsa-mir-302a、hsa-mir-302c、hsa-mir-302d、hsa-mir-330、hsa-mir-363、hsa-mir-367、hsa-mir-371、hsa-mir-372、hsa-mir-373、hsa-mir-496、hsa-mir-50b、hsa-mir-512-3p、hsa-mir-512-5p、hsa-mir-515-3p、hsa-mir-515-5p、hsa-mir-516-5p、hsa-mir-517、hsa-mir-517a、35hsa-mir-518b、hsa-mir-51bc、hsa-mir-518e、hsa-mir-51ge、hsa-mir-520a、hsa-mir-520b、hsa-mir-520e、hsa-mir-520g、hsa-mir-520h、hsa-mir-523、hsa-mir-524、hsa-mir-525、hsa-mir-526a-l、hsa-mir-526a-2、leftb、lhx1、lhx6、lin28、mybl2、myc、mycn、nanog、nfix、oct3/4(pou5f1)、oct6(pou3f1)、otx2、phc1、sall4、sox2、terfl、tert、tgif、ventx2、zic2、zic3、zic5和znf206(methods of reprogramming animal somatic cells,美国专利申请公开2017/0152475,在此通过引用整体并入)。
10.此外,我们公开了哺乳动物物种中eft的标志物及其在将哺乳动物成人或胎儿体细胞类型部分地重编程为出生前或甚至胎儿前基因表达模式,但无需将细胞重编程为多能性以调节组织再生和癌症进展中的用途,其描述于国际专利申请公开号wo2014/197421,标题为“compositions and methods for induced tissue regeneration in mammalian species”,通过引用将其整体并入本文和国际专利申请公开号wo2017/214342,标题为“improved methods for detecting and modulating the embryonic-fetal transition in mammalian species”中,通过引用将其整体并入本文。此外,我们还公开了eft和nt的小分子调节剂(国际专利申请pct/us2019/028816,标题为“improved methods for inducing tissue regeneration and senolysis in mammalian cells”,通过引用将其整体并入本文)。上述组合物和方法部分基于允许hps细胞衍生的胚胎祖细胞系的克隆扩增的方法,其提供了一种扩增可用于以无疤痕方式再生组织(例如皮肤)的具有出生前和甚至胎儿前基
因表达模式的新型多样化和高度纯化的细胞谱系的方式。此类细胞类型在研究中和用于基于细胞的疗法的制造中具有重要应用(参见2006年4月11日提交的国际专利申请pct/us2006/013519,且其标题为“novel uses of cells with prenatal patterns of gene expression”;2006年11月21日提交的美国专利申请系列号11/604,047,且其标题为“methods to accelerate the isolation of novel cell strains from pluripotent stem cells and cells obtained thereby”;和2009年7月16日提交的美国专利申请系列号12/504,630,且其标题为“methods to accelerate the isolation of novel cell strains from pluripotent stem cells and cells obtained thereby”,其中每一个在此通过引用整体并入)。然而,需要用于体内递送可用于调节eft和nt的所述重编程因子的另外的和改进的方法和组合物。本发明教导了与人细胞衍生的细胞外囊泡的配制、制造、储存和递送相关的组合物和方法,所述细胞外囊泡递送设计用于调节eft和nt以用于哺乳动物再生疗法和多种类型恶性肿瘤的治疗的分子负载(molecular cargo)。
11.细胞外囊泡(ev),也称为细胞外液泡[美国专利申请公开号2017/0152475,标题为“methods of reprogramming animal somatic cells”,其通过引用整体并入本文)通常分为三个子类别:1)直径范围为30-150nm的外泌体;2)50nm-1.0μm范围内的微囊泡或胞外体(ectosome);和凋亡小泡,也称为凋亡小体,范围为50nm-5.0μm。外泌体与胞外体的区别在于它们的生物发生,外泌体因多泡体的胞吐作用而脱落,而胞外体通过细胞膜的出芽过程而产生(trends cell biol2015,25(6):364-72)。ev被认为包含重要的信号传导分子,这些分子可能提供负责在细胞替代疗法中看到的一些再生益处的营养因子的来源。因此,它们将提供一些基于细胞的疗法的替代方案,其规模制造成本较低,免疫排斥风险较低,并可能影响多种细胞类型,从而允许复杂的组织再生,其中涉及不容易作为基于细胞的疗法引入的复杂的细胞相互作用。因此,ev可以为基于细胞的疗法和基于细胞的再生医学提供有吸引力的替代方案或辅助手段。
[0012]
外泌体是由多种哺乳动物细胞类型分泌的30至150nm的ev。keller等(2006)immunol lett.107(2):102;camussi等(2010)kidney international 78:838。囊泡被脂质双层包围,大于具有22nm大小的ldl,但小于直径为6000至8000nm、厚度为2000nm的红细胞。keller等(2006)immunol lett.107(2):102。
[0013]
在体外和体内生长的细胞中都发现外泌体。它们可以从组织培养介质以及体液(如血浆、尿液、乳汁和脑脊液)中分离出来。george等(1982)blood 60:834;martinez等(2005)am j physiol health cir physiol 288:h1004。外泌体起源于内体膜区室。它们储存在晚期内体的多泡体内的腔内囊泡中。多泡体源自早期内体区室,并且其内包含较小的囊泡体,包括外泌体。当多泡体与质膜融合时,外泌体从细胞中释放出来。从细胞中分离外泌体的方法已有描述,参见例如,美国专利申请公开2012/0093885。
[0014]
外泌体含有多种分子,包括蛋白质、脂质和核酸,例如dna、mrna和mirna。它们的内容物被认为在细胞-细胞间通讯中起作用,涉及从一个细胞释放外泌体以及外泌体与第二胞的结合/融合,其中外泌体区室的内容物在第二个细胞内释放。
[0015]
据报道,源自人类成人循环内皮祖细胞的外泌体可用作细胞间mrna转运的载体。这些外泌体被证明通过与α4β1整联蛋白相互作用而并入到正常内皮细胞中。一旦并入内皮细胞中,外泌体就会刺激血管生成程序。deregibus等(2007)blood 110:2440。使用严重联
合免疫缺陷小鼠在体内获得了类似的结果。外泌体刺激皮下植入被组织成与鼠脉管系统相连的专利血管网络的matrigel(一种鼠肉瘤提取物)中的内皮细胞。deregibus,同上。bruno等(2009)j am soc nephrol 20:1053;herrera等(2010)jcell mol med 14:1605。
[0016]
在外泌体的各种分子负载中,mirna最近由于在基因表达中的调节作用而引起了很多关注。mirna是小的非编码调节rna,其可以对多个rna靶标产生广泛的影响,因此有可能比编码rna具有更大的表型影响。外泌体的mirna谱通常与其亲本细胞不同。谱分析研究表明,mirna不是随机整合到外泌体中的,而是mirna子集优先包装到外泌体中,这表明外泌体mirna的主动分选机制。guduric-fuchs等(2014)nucleic acid res.42:9195;ohshima等(2010)plos one 5(10):el3247。
[0017]
因为外泌体包含多种分子,其中许多被认为在细胞信号传导中起重要作用,外泌体将在研究和工业中被证明是有用的,并将具有作为治疗剂、诊断剂和在筛选试验中的应用。然而,通常可重复的、基本相同的外泌体群体的可用性通常受到以下事实的限制:大多数外泌体来源是衰老的细胞,并因此复制能力有限。因此,需要来自具有扩展的复制能力的克隆来源的外泌体,其复制能力大于大多数成人或胎儿来源的细胞。下文描述的发明满足了这种需要以及本领域的其他需要。
[0018]
使用在文献中描述的部分重编程通过病毒和其他基因治疗载体来强制表达重编程因子的年龄逆转方法具有不需要的基因修饰的风险和不需要的细胞生长(例如肿瘤形成)的可能性。
[0019]
外泌体的生产可能更安全且更具成本效益。有一些外泌体治疗的方法,其不使用克隆祖细胞系或考虑调节eft标志物。
[0020]
本领域需要改进的机制来调节与eft和nt相关的基因表达的整体改变,以诱导细胞和组织再生和重编程并改变癌症的进程。因此,进一步需要配制eft和nt发育重编程因子的改进方法,其既具有成本效益又能够在体内系统地分布该因子。
[0021]
发明概述
[0022]
本发明的一个方面是组合物和方法,其中一种或多种细胞外囊泡用于在体内诱导哺乳动物的组织再生。
[0023]
在一个优选的实施方式中,本发明的组合物和方法中的细胞外囊泡由胚胎祖细胞系产生。在一个实施方式中,所述胚胎祖细胞系可以是人多能干细胞衍生的克隆胚胎祖细胞系,其缺乏胎儿-成人标志物cox7a1的表达、缺乏nt标志物adirf的表达并且表达胚胎标志物pcdhb2。
[0024]
本发明的另一方面是由细胞外囊泡诱导的再生细胞或组织,而不使用基于转基因的多能性因子的强制表达。
[0025]
本发明的另一方面是由分离的细胞外囊泡诱导的再生细胞或组织,所述细胞外囊泡在分离后加载有重编程因子。
[0026]
本发明的一个方面是一种或多种用于诱导组织再生的外泌体。
[0027]
在一个优选的实施方式中,本发明的组合物和方法中的外泌体由胚胎祖细胞系产生。在一个实施方式中,所述胚胎祖细胞系可以是人类多能干细胞衍生的克隆胚胎祖细胞系,其缺乏胎儿-成人标志物cox7a1的表达、缺乏nt标志物adirf的表达并且表达胚胎标志物pcdhb2。
[0028]
本发明的另一方面是由外泌体诱导的再生细胞或组织,而不使用基于转基因的多能性因子的强制表达。
[0029]
本发明的另一方面是由分离的外泌体诱导的再生细胞或组织,所述分离的外泌体在分离后加载有重编程因子。
[0030]
在一个优选的实施方式中,本发明的组合物和方法中的细胞外囊泡由胚胎性癌细胞系产生。在一个实施方式中,所述胚胎性癌细胞系可以是缺乏胎儿-成人标志物cox7a1的表达、缺乏nt标志物adirf的表达并且表达多能性标志物(例如,oct4和tert)的胚胎性癌细胞系。
[0031]
本发明的另一方面是由源自胚胎性癌细胞系的细胞外囊泡诱导的再生细胞或组织,而不使用基于转基因的重编程因子的强制表达。
[0032]
本发明的另一方面是由源自胚胎性癌细胞系的分离的细胞外囊泡诱导的再生细胞或组织,所述细胞外囊泡在分离后已经加载选自以下列表的重编程因子:barx1、croc4、dnmt3b、h2afx、hhex、histih2ab、histih4j、hmgb2、hsa-mir-18a、hsa-mir-18b、hsa-mir-20b、hsa-mir-96、hsa-mir-106a、hsa-mir-107、hsa-mir-141、hsa-mir-183、hsa-mir-187、hsa-mir-200、hsa-mir-203、hsa-mir-211、hsa-mir-217、hsa-mir-218-1、hsa-mir-218-2、hsa-mir-290、hsa-mir-294、hsa-mir-295、hsa-mir-302a、hsa-mir-302b、hsa-mir-302c、hsa-mir-302d、hsa-mir-330、hsa-mir-363、hsa-mir-367、hsa-mir-371、hsa-mir-372、hsa-mir-373、hsa-mir-496、hsa-mir-50b、hsa-mir-512-3p、hsa-mir-512-5p、hsa-mir-515-3p、hsa-mir-515-5p、hsa-mir-516-5p、hsa-mir-517、hsa-mir-517a、35hsa-mir-518b、hsa-mir-51bc、hsa-mir-518e、hsa-mir-51ge、hsa-mir-520a、hsa-mir-520b、hsa-mir-520e、hsa-mir-520g、hsa-mir-520h、hsa-mir-523、hsa-mir-524、hsa-mir-525、hsa-mir-526a-l、hsa-mir-526a-2、leftb、lhx1、lhx6、lin28、mybl2、myc、mycn、nanog、nfix、oct3/4(pou5f1)、oct6(pou3f1)、otx2、phc1、sall4、sox2、terfl、tert、tgif、ventx2、zic2、zic3、zic5和znf206。
[0033]
本发明的一个方面是一种或多种源自胚胎性癌细胞系的外泌体,用于诱导组织再生。
[0034]
本发明的另一方面是在体内重编程为胚胎/前胎儿样状态(前eft(胚胎到胎儿过渡))但未重编程为多能性(现在在文献中描述为“部分重编程”)的细胞。在一个优选的实施方式中,重编程或前eft状态由eft标志物cox7a1和nt标志物adirf(1)的减少指示。
[0035]
在根据本发明的方法中,将来自被筛选赋予前eft基因表达模式的能力的胚胎祖细胞或多能性细胞(如hes细胞或hec细胞)的细胞外囊泡(如外泌体)与胎儿/成人细胞和/或组织接触以在体内恢复受试者的再生能力。所述受试者可以是人类或非人类哺乳动物。在一个实施方式中,受试者是老龄或老年人。在进一步的实施方式中,该方法防止、减缓或逆转老化的成体细胞和/或组织的再生能力的丧失。在另一个优选实施方式中,根据本发明的方法可以部分或完全重置或改善衰老的各种标志,例如表观遗传谱、端粒长度和/或线粒体对胚胎状态的适配性。
[0036]
附图简述
[0037]
为了更全面地理解本发明的性质和优点,应结合附图参考以下详细说明,其中:
[0038]
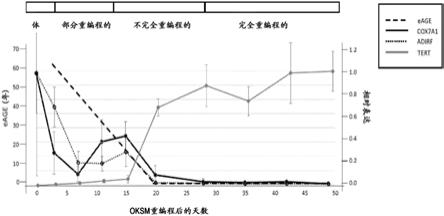
图1是显示eft标志物cox7a1在oksm重编程过程早期下调的图表。将cox7a1的基因
表达数据(来自ohnuki等(9))绘制在eage变化与重编程的图表上,改编自olova等(10)的图1a。当细胞部分重编程和第20天当细胞达到表观遗传年龄0(黑色粗虚线)且不完全重编程时,cox7a1表达(黑色实线)达到最大值的~10%。cox7a1的表达在第28-49天(完全重编程)最小。新生儿/成人itr标志物adirf的表达在重编程早期也迅速下降。相比之下,胚胎干细胞标志物tert从第20天开始(此时细胞被重置为接近零的表观遗传年龄)表达增加并继续在重编程为多能性的细胞中表达。
[0039]
图2a和2b是显示来自内皮胚胎祖细胞的条件培养基赋予胎儿/成人内皮细胞胚胎表型的图表,如eft标志物cox7a1所指示的。将huvec细胞(图2a)或hbmvec细胞(图2b)与来自30-mv2-10、30-mv2-17和30-mv2-19 eepc的条件培养基孵育72小时后,cox7a1表达降低。
[0040]
图3a和3b是显示来自内皮胚胎祖细胞的外泌体制剂赋予胎儿/成人内皮细胞胚胎表型的图表,如eft标志物cox7a1所指示的。使用来自胚胎内皮祖细胞的富含外泌体的条件培养基(30-mv2-10、30-mv2-14和30-mv2-19)处理(图3a)huvec或(图3b)hbmec(人脑微血管内皮细胞)6天后cox7a1表达降低。当huvec或hbmec细胞分别用来自huvec或hbmec的富含其自身外泌体的条件培养基处理时,没有看到显著影响。
[0041]
发明详述
[0042]
缩写
[0043]
ac-成体衍生的细胞
[0044]
amh-抗mullerian激素
[0045]
asc-成体干细胞
[0046]
cgmp-当前良好生产工艺
[0047]
cm-癌症成熟
[0048]
cns-中枢神经系统
[0049]
dmem-dulbecco改良的eagle培养基
[0050]
dmso-二甲基亚砜
[0051]
dnam-dna甲基化的变化,其提供细胞和组织年龄的标志物或“时钟”。
[0052]
dpbs-dulbecco磷酸盐缓冲盐水
[0053]
ed细胞-胚胎衍生细胞;hed细胞是人类ed细胞
[0054]
edta-乙二胺四乙酸
[0055]
eft-胚胎-胎儿过渡
[0056]
eg细胞-胚胎生殖细胞;heg细胞是人类eg细胞
[0057]
ep-胚胎祖细胞
[0058]
es细胞-胚胎干细胞;hes细胞是人类es细胞
[0059]
esc-胚胎干细胞
[0060]
evs-细胞外囊泡
[0061]
facs-荧光激活细胞分选
[0062]
fbs-胎牛血清
[0063]
fpkm-来自rna测序的每百万映射阅读的每千碱基转录本片段。
[0064]
gfp-绿色荧光蛋白
[0065]
gmp-良好生产规范
[0066]
haec-人主动脉内皮细胞
[0067]
hec细胞-人胚胎癌细胞
[0068]
hed细胞-人胚胎衍生细胞
[0069]
heg细胞
‑“
人胚胎生殖细胞”是源自胎儿组织的原基生殖细胞的干细胞。
[0070]
hesc-人胚胎干细胞,包括人es样细胞,因此是启动的(primed)和幼稚的多能干细胞。
[0071]
hips细胞
‑“
人诱导多能干细胞”是在暴露于hes-特异性转录因子(例如sox2、klf4、oct4、myc或nanog、lin28、oct4和sox2)之后获自体细胞的与hes细胞特性相似的细胞。
[0072]
hps细胞-人多能干细胞,例如hes细胞、hips细胞、ec细胞和人孤雌干细胞。
[0073]
hse
‑“
人皮肤等效物”是为测试目的或用于促进伤口修复的治疗应用而制造的细胞混合物和生物或合成的基质。
[0074]
icm-诱导的癌症成熟。
[0075]
ips细胞
‑“
诱导多能干细胞”是暴露于es-特异性转录因子(如sox2、klf4、oct4、myc或nanog、lin28、oct4和sox2、klf4、oct4、myc和(lin28a或lin28b)或者oct4、sox2、klf、nanog、esrrb、nr5a2、cebpa、myc、lin28a和lin28b的其他组合)之后获自体细胞的与hes细胞特性相似的细胞。
[0076]
is-csc
‑“
诱导的癌症干细胞的衰老溶解”是指难以通过化学治疗剂或放射疗法消融的恶性肿瘤中的细胞的处理,其中所述is-csc治疗使所述难治细胞恢复到胎儿前基因表达模式并对化学治疗剂或放射治疗变得敏感。
[0077]
itm-诱导的组织成熟
[0078]
itr-诱导的组织再生
[0079]
mem-最低必需培养基
[0080]
msc-间充质干细胞
[0081]
nt-新生儿过渡
[0082]
pbs-磷酸盐缓冲盐水
[0083]
ps成纤维细胞
‑“
瘢痕前成纤维细胞”是源自妊娠早期皮肤或源自ed细胞的成纤维细胞,其显示出出生前基因表达模式,因为它们促进皮肤伤口的快速愈合而不形成瘢痕。
[0084]
rfu-相对荧光单位
[0085]
rna-seq-rna测序
[0086]
sfm-无血清培养基
[0087]
st.dev.-标准差
[0088]
tr-组织再生
[0089]
定义
[0090]
术语“分析重编程技术”是指将体细胞的基因表达模式重编程为更多能的状态,例如ips、es、ed、ec或eg细胞的状态的多种方法,其中重编程以多个和离散的步骤发生并且不简单地依赖于体细胞向卵母细胞中的转移和该卵母细胞的激活(参见2001年11月26日提交的美国申请号60/332,510;2002年11月26日提交的美国申请号10/304,020;2003年11月26日提交的pct申请号pct/us02/37899;2005年8月3日提交的美国申请号60/705625;2005年8
月20日提交的美国申请号60/729173;2006年7月5日提交的美国申请号60/818813;2006年8月3日提交的pct/us06/30632,其中每一个的公开内容均通过引用并入本文)。
[0091]
术语“卵裂球/桑椹细胞”是指哺乳动物胚胎中的卵裂球或桑椹细胞或者体外培养的卵裂球或桑椹细胞,有或没有额外的细胞,包括那些细胞的分化衍生物。
[0092]
术语“诱导的癌症干细胞的衰老溶解”(is-csc)是指难以通过化学治疗剂或放射疗法消融的难治的恶性肿瘤中的细胞的处理,其中所述is-csc处理导致所述难治细胞恢复至胎儿前基因表达模式并对化学治疗剂或放射疗法变得敏感。
[0093]
术语“表达基因x的细胞”、“基因x在细胞中表达”(或细胞群)或其等同物是指使用提供了阳性结果的特定测定平台对细胞的分析。反之亦然(即,不表达基因x的细胞或等同物是指使用提供了阴性结果的特定测定平台对细胞进行的分析)。因此,本文所述的任何基因表达结果都与用于所指示基因的测定平台(或多个平台)中使用的一个或多个特异性探针相关联。
[0094]
术语“外泌体”是指大小范围为30-100nm的细胞外囊泡,其由细胞分泌并将分子成分的混合物作为负载运输,所述混合物包含rna(其中包含mirna)、脂质和蛋白质的组合。
[0095]
术语“胞外体”或“微粒体”是指大小范围为50nm-1.0μm的细胞外囊泡,其由细胞分泌并将分子成分的混合物作为负载运输,所述混合物包含rna(其中包含mirna)、脂质和蛋白质的组合。
[0096]
术语“凋亡小体”是指大小范围为50nm-5.0μm的细胞外囊泡,其由细胞凋亡产生并将分子成分的混合物作为负载运输,所述混合物包含rna(其中包含mirna)和蛋白质的组合。
[0097]
术语“细胞质泡”或“细胞外囊泡”是一个通用术语,指的是被完整的或者透化的但在其他方面完整的质膜结合但缺乏细胞核的细胞的细胞质。所有包含在术语“细胞质泡”或“细胞外囊泡”中的囊泡亚型包括外泌体、胞外体/微粒体和凋亡小体。这些术语还可以与术语“去核细胞浆”和“去核(的)细胞质”互换使用并同义,除非在已经去除质膜的提取物的上下文中明确使用术语“去核细胞质”。
[0098]
术语“细胞系”是指能够体外繁殖和扩增的会死的或永生的细胞群体。
[0099]
术语“克隆”是指通过将单个细胞扩增为全部源自原始单细胞且不含其他细胞的细胞的群体而获得的细胞群体。
[0100]
术语“分化细胞”当用于指通过本发明的方法从多能干细胞制备的细胞时是指与亲本多能干细胞相比具有降低的分化潜能的细胞。本发明的分化细胞包含可以进一步分化的细胞(即,他们可能不终末分化)。
[0101]
术语“胚胎性”或“胚胎发育阶段”是指细胞、组织或动物的出生前发育阶段,具体而言,与胎儿和成体细胞相比细胞的胚胎性发育阶段。在人类物种的情况下,从胚胎发育到胎儿发育的过渡发生在出生前发育的大约8周,在小鼠中发生在性交后大约16天,而在大鼠物种中发生在性交后大约17.5天。(http://php.med.unsw.edu.au/embryology/index.php?title=mouse_timel ine_detailed)。
[0102]
术语“胚胎干细胞”(es细胞)是指衍生自囊胚、卵裂球或桑葚胚的内细胞团的细胞,它们作为细胞系连续传代而同时保持未分化状态(例如,表达tert、oct4,及ssea和tra抗原,其对物种的es细胞是特异性的)。es细胞可能源自卵细胞用精子或dna的受精、核移
植、孤雌生殖,或通过产生在mhc区域中具有半合性或纯合性的hes细胞的方法。虽然es细胞历来被定义为在移植到植入前胚胎中时能够分化成所有体细胞类型以及生殖系的细胞,但来自许多物种(包含人类)的候选es培养物在培养中具有更扁平的外观,和通常不造成生殖系分化,并因此被称为“es样细胞”。人们普遍认为人类es细胞实际上是“es样”,然而,在本技术中,我们将使用术语es细胞来指代es和es样细胞系。
[0103]
术语“人类孤雌生殖干细胞”是指源自未受精但活化的卵母细胞的多能干细胞。
[0104]
术语“tr的全局调节剂”或“itr的全局调节剂”是指能够调节多种itr基因或itm基因的多样性的试剂,包含但不限于能够在源自胎儿或成人来源的细胞中下调cox7a1同时上调pcdhb2或者下调naaladl1同时上调amh,和能够响应于组织损伤或退行性疾病诱导导致增加的无疤痕组织再生的基因表达模式的试剂。
[0105]
术语“人胚胎来源”(“hed”)细胞是指卵裂球衍生细胞、桑椹胚衍生细胞、包括内细胞团的细胞的囊胚衍生细胞、胚盾或外胚叶,或早期胚胎的其他全能或多能干细胞,包括原始内胚层、外胚层、中胚层和神经嵴及其衍生物,直至达到与正常人类发育的前八周的等同相关的分化状态,但不包含源自已作为细胞系传代的hes细胞的细胞(参见,例如,thomson的美国专利7,582,479;7,217,569;6,887,706;6,602,711;6,280,718;和5,843,780)。hed细胞可以源自植入前胚胎,其通过用精子或dna使卵细胞受精、核移植或染色质移植、通过孤雌生殖诱导形成孤雌生殖生物的卵细胞、分析重编程技术或通过产生在hla中具有半合性或纯合性的hes细胞的方法产生。术语“人胚胎生殖细胞”(heg细胞)是指来源于胎儿组织的初生生殖细胞或者成熟中或成熟的生殖细胞如卵母细胞和精原细胞的多能干细胞,其可以在体内分化为各种组织。heg细胞也可以来源于由产雌或产雄方式产生的多能干细胞的方法,即其中多能细胞源自仅包含男性或女性来源的dna的卵母细胞并因此将包含所有女性来源或男性来源的dna的方法。
[0106]
术语“人胚胎干细胞”(hes细胞)是指人es细胞。
[0107]
术语“人胚胎癌细胞”(hec细胞)是指源自胚胎性癌的细胞系,其包含表达多能性标志物但具有染色体畸变并且本质上是恶性的畸胎癌。
[0108]
术语“人诱导多能干细胞”是指具有类似于hes细胞的特性的细胞,包括当移植到免疫功能低下的小鼠体内时形成所有三个胚层的能力,其中所述ips细胞源自暴露于去分化因子后的不同体细胞谱系的细胞,例如hes细胞特异性转录因子组合:klf4、sox2、myc;oct4或sox2、oct4、nanog和lin28;或oct4、sox2、klf4、nanog、esrrb、nr5a2、cebpa、myc、lin28a和lin28b的各种组合,或者其他诱导体细胞以获得具有类似于hes细胞的特性的多能干细胞状态的方法。然而,通过体细胞核移植(scnt)对体细胞进行重编程通常被称为nt-es细胞,而不是ips细胞。
[0109]
术语“诱导的癌症成熟”是指导致癌前细胞或恶性细胞的表型发生变化的方法,使得在所述诱导之后,细胞表达通常在与胚胎阶段相反的胎儿或成人发育阶段的该细胞类型中表达的标志物。
[0110]
术语“诱导的组织再生”是指使用本发明的方法来改变胎儿或成年哺乳动物细胞的分子组成,使得所述细胞在该组织受损后能够再生功能性组织,其中所述再生在该物种的动物中不是正常结果。虽然在功能上itr旨在看到损伤或退行性疾病时产生新的组织形成或诱导csc或老化细胞的衰老细胞裂解,但本发明的发明人教导,itr实际上逆转细胞中
衰老的许多方面,包括标志物如dnam,但不恢复端粒酶活性。将端粒酶活性与itr一起添加在本发明中也定义为“itr”。
[0111]
术语“itr相关细胞衰老裂解”是指在具有显著dna损伤(包括但不限于来自细胞衰老(端粒缩短))的老化组织的细胞中诱导细胞凋亡,其通过将所述受损细胞重编程为胚胎基因表达模式。
[0112]
术语“分离的”是指(i)通常通过涉及人工的过程与通常在自然界中发现的至少一些其他物质分离,(ii)人工生产(例如,化学合成),和/或(iii)存在于人工环境或背景中(即,通常在自然界中不存在的环境或背景)的物质。
[0113]
术语“icm因子”是指以导致肿瘤中cm以达到治疗效果的方式改变cm激活剂和cm抑制剂的水平的分子。
[0114]
术语“icm基因”是指当表达改变时可在肿瘤中引起cm以达到治疗效果的基因。
[0115]
术语“is-csc因子”是指以导致tr和相关的暴露于化疗或放射疗法的癌细胞的凋亡敏感性增加的方式改变tr激活剂和tr抑制剂的水平的分子。
[0116]
术语“itr因子”是指以在天然不能tr的组织中导致tr的方式改变tr激活剂和tr抑制剂的水平的分子。所述itr因子也指个体因子的组合。因此,在本技术中,本文描述的因子的混合物被认为是“itr因子”。
[0117]
术语“itr基因”是指当表达改变时可在通常不能进行此类再生的组织中引起诱导的组织再生的基因。
[0118]
术语“核酸”与“多核苷酸”可互换使用,并且在各种实施方式中包含天然存在的核苷聚合物,例如dna和rna,以及非天然存在的核苷或核苷类似物的聚合物。在一些实施方式中,核酸包含标准核苷(缩写为a、g、c、t、u)。在其他实施方式中,核酸包含一种或多种非标准核苷。在一些实施方式中,一种或多种核苷是非天然存在的核苷或核苷酸类似物。核酸可以包含修饰的碱基(例如,甲基化碱基)、修饰的糖(2'-氟核糖、阿拉伯糖或己糖)、修饰的磷酸酯基团或者核苷或核苷类似物之间的其他连接(例如,硫代磷酸酯或5'-n-亚磷酰胺键)、锁核酸或吗啉代。在一些实施方式中,核酸包含通过磷酸二酯键连接的核苷,如在dna和rna中。在一些实施方式中,至少一些核苷通过非磷酸二酯键连接。核酸可以是单链、双链或部分双链的。至少部分双链的核酸可具有一个或多个突出端,例如5'和/或3'突出端。本领域已知在用于研究或治疗目的的rna干扰(rnai)、适体或基于反义的分子的背景下有用的核酸修饰(例如,核苷和/或骨架修饰,包含非标准核苷的使用)预期用于本发明的各种实施方式中。参见,例如crooke,st(编辑)antisense drug technology:principles,strategies,and applications,boca raton:crc press,2008;kurreck,j.(编辑)therapeutic oligonucleotides,rsc biomolecular sciences.cambridge:royal society of chemistry,2008。在一些实施方式中,相对于相同长度和链性质(strandedness)的rna或dna,修饰增加了核酸的半衰期和/或稳定性,例如在体内。在一些实施方式中,相对于相同长度和链性质的rna或dna,修饰降低了核酸的免疫原性。在一些实施方式中,核酸的一条或两条链中5%至95%的核苷被修饰。修饰可以均匀地或不均匀地定位,并且可以选择修饰的位置(例如,靠近中间、靠近或在末端、交替等)以增强期望的特性。核酸可包含可检测标记,例如荧光染料、放射性原子等。“寡核苷酸”是指相对短的核酸,例如,长度通常在约4至约60个核苷酸之间。当本文提及多核苷酸时,应理解提供dna、rna以及在每种情况下的单链和双
链形式(以及每个单链分子的互补物)。
[0119]
如本文所用,“多核苷酸序列”可以指多核苷酸材料本身和/或序列信息(即用作碱基缩写的字母序列)(其生化表征特定核酸)。除非另有说明,本文中呈现的多核苷酸序列以5'到3'的方向呈现。
[0120]
术语“寡克隆”是指源自表现为具有相似的特征的一小群细胞,通常为2-1000个细胞的细胞群体,相似的特征例如形态学或不同于相同培养物中的其他细胞的分化标志物的存在或不存在。寡克隆细胞从不具有这些共同特征的细胞中分离,并允许增殖,从而产生基本上完全源自原始的相似细胞群体的细胞群体。
[0121]
术语“多能干细胞”是指能够分化成多于一种分化细胞类型的动物细胞。此类细胞包括hes细胞、卵裂球/桑椹胚细胞及其衍生的hed细胞、hips细胞、heg细胞、hec细胞和成人衍生细胞,包括间充质干细胞、神经元干细胞和骨髓衍生干细胞。多能干细胞可以遗传修饰或未遗传修饰。遗传修饰的细胞可以包含标志物,例如荧光蛋白,以利于它们在卵子中的识别。
[0122]
术语“多肽”是指氨基酸的聚合物。术语“蛋白质”和“多肽”在本文中可互换使用。肽是相对较短的多肽,长度通常在约2到60个氨基酸之间。本文使用的多肽通常包含标准氨基酸(即,最常见于蛋白质中的20个l-氨基酸)。然而,在某些实施方式中,多肽可以包含一个或多个非标准氨基酸(其可以是天然存在的或非天然存在的)和/或本领域已知的氨基酸类似物。多肽中的一个或多个氨基酸可以被修饰,例如,通过添加化学实体例如碳水化合物基团、磷酸酯基团、脂肪酸基团、用于缀合、功能化的接头等。具有与其共价或非共价结合的非多肽部分的多肽仍被认为是“多肽”。多肽可以从天然来源纯化,使用重组dna技术生产,通过化学方法合成,例如常规固相肽合成等。本文使用的术语“多肽序列”或“氨基酸序列”可以指多肽材料本身和/或生物化学表征多肽的序列信息(即用作氨基酸名称缩写的字母或三个字母代码的序列)。除非另有说明,否则本文中呈现的多肽序列以n-端到c-端的方向呈现。多肽可以是环状的或包含环状部分。当本文讨论天然存在的多肽时,将理解本发明包含涉及其任何异形体的实施方式(例如,由于mrna的选择性剪接或编辑或者由于基因的不同等位基因,例如,一个或多个单核苷酸多态性不同的等位基因(通常,此类等位基因与参考或共有序列至少95%、96%、97%、98%、99%或更多相同)而由同一基因产生的不同蛋白质)。多肽可包含将其靶向用于分泌或靶向至特定细胞内区室(例如细胞核)的序列和/或靶向多肽进行翻译后修饰或降解的序列。某些多肽可以合成为经过翻译后切割或其他加工以成为成熟多肽的前体。在某些情况下,这种切割可能仅在特定的激活事件时发生。在相关的情况下,本发明提供了涉及前体多肽的实施方式和涉及多肽成熟形式的实施方式。
[0123]
术语“合并的克隆”是指通过组合两个或更多的克隆群体以产生具有与克隆群相似的标志物(例如,基因表达标志物)均一性的细胞群体而获得的细胞群体,但不是其中所有细胞均来源于相同的原始克隆的群体。所述合并的克隆系可以包含单一或混合基因型的细胞。在克隆系相对较早分化或在其增殖寿命早期以不希望的方式改变的情况下,合并的克隆系特别有用。
[0124]
术语“出生前”是指胎盘哺乳动物的胚胎发育阶段,在此之前,动物脱离子宫不能存活。
[0125]
术语“原生干细胞”统称为能够分化为所有三个原始胚层:内胚层、中胚层和外胚
层,以及神经嵴的细胞的多能干细胞。因此,原生干细胞的实例包含但不限于人类或非人类哺乳动物es细胞或细胞系、卵裂球/桑椹胚细胞及其衍生的ed细胞、ips和eg细胞。
[0126]
术语“纯化的”是指已经从与它们在自然界中或最初产生时结合的大部分组分分离的试剂或实体(例如,化合物)。一般来说,这种纯化涉及人手的作用。纯化的试剂或实体可以是部分纯化的、基本纯化的或纯的。此类试剂或实体可以是例如,至少50%、60%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或超过99%纯的。在一些实施方式中,核酸或多肽被纯化以使得其构成存在于制剂中的分别总的核酸或多肽材料的至少75%、80%、85%、90%、95%、96%、97%、98%、99%或更多。纯度可以基于例如干重、色谱示踪的峰大小、分子丰度、凝胶上条带的强度或与分子丰度相关的任何信号的强度,或任何本领域接受的量化方法。在一些实施方式中,水、缓冲液、离子和/或小分子(例如,前体如核苷酸或氨基酸)可以任选地存在于纯化的制剂中。纯化的分子可以通过将其与其他物质(例如,其他细胞材料)分离来制备,或通过以实现所需程度的纯度的方式产生来制备。在一些实施方式中,纯化的分子或组合物是指使用任何本领域接受的纯化方法制备的分子或组合物。在一些实施方式中,“部分纯化”是指由细胞产生的分子不再存在于细胞内,例如,细胞已被裂解,并且任选地,至少一些细胞材料(例如,细胞壁、细胞膜、细胞器)已被移除。
[0127]
在本文中使用的术语“rna干扰”(rnai)与其在本领域中的含义一致,是指双链rna(dsrna)触发与dsrna的一条链具有互补性的相应mrna的序列特异性降解或翻译抑制的现象。应当理解,dsrna的链和mrna之间的互补性不必是100%,而只需要足以介导基因表达的抑制(也称为“沉默”或“敲除”)。例如,互补性程度使得该链可以(i)指导rna诱导沉默复合物(risc)中mrna的切割;或(ii)引起mrna的翻译抑制。在某些实施方式中,rna的双链部分长度小于约30个核苷酸,例如长度在17和29个核苷酸之间。在某些实施方式中,dsrna的第一条链与靶mrna至少80%、85%、90%、95%或100%互补并且dsrna的另一条链与第一条链至少80%、85%、90%、95%或100%互补。在哺乳动物细胞中,可以通过将合适的双链核酸引入细胞中或在细胞中表达核酸然后细胞内加工以在其中产生dsrna来实现rnai。能够介导rnai的核酸在本文中被称为“rnai剂”。能够介导rnai的示例性核酸是短发夹rna(shrna)、短干扰rna(sirna)和微rna前体。这些术语是众所周知的并且在本文中与其在本领域中的含义一致地使用。sirna通常包含两条单独的核酸链,它们彼此杂交以形成双链体。它们可以在体外合成,例如使用标准核酸合成技术。sirnas通常是双链寡核苷酸,每一条链中具有16-30个,例如16、17、18、19、20、21、22、23、24、25、26、27、28、29或30个核苷酸(nt),其中双链寡核苷酸包含长度15和29个核苷酸之间的双链部分,并且其中一条或两条链可以包含例如1-5个核苷酸长的3'突出端,或者一个或两个末端可以是钝的。在一些实施方式中,sirna包含长度19至25nt之间,例如21至23之间的核苷酸的链,其中一条或两条链包含1-2个核苷酸的3'突出端。sirna的双链部分的一条链(称为“引导链”或“反义链”)是基本互补的(例如,至少80%或更多,例如85%、90%、95%或100%),与mrna中的靶区域互补(例如,具有3、2、1或0个错配核苷酸),并且另一双链部分与第一双链部分基本互补。在许多实施方式中,引导链与mrna中的靶区域100%互补,而另一条过客链与第一双链部分100%互补(应理解,在各种实施方式中,当引导链与mrna杂交时,引导链的3'突出端部分(如果存在)可能与mrna互补或不互补)。在一些实施方式中,shrna分子是包含茎环的核酸分子,其中双链茎长16-30个核苷酸并且环长约1-10个核苷酸。sirna可以包含广泛多样的修饰核
苷、核苷类似物并且可以包含化学或生物修饰的碱基、修饰的骨架等。非限制的,可以使用本领域公认为对rnai有用的任何修饰。一些修饰导致稳定性、细胞摄取、效力等增加。一些修饰导致免疫原性或清除率降低。在某些实施方式中,sirna包含长度为约19-23(例如,19、20、21、22或23)个核苷酸的双链体,以及任选地,一个或两个长度为1-5个核苷酸的3'突出端,其可以是由脱氧核糖核苷酸组成。shrna包含单一核酸链,该链包含由主要非自身互补区域分隔的两个互补部分。互补部分杂交以形成双链体结构,和非自身互补区形成连接双链体一条链的3'端和另一条链的5'端的环。shrna经历细胞内加工以产生sirna。通常,环的长度在1和8个核苷酸之间,例如,2-6个核苷酸。
[0128]
微rnas(mirnas)是大约21-25个核苷酸(在哺乳动物系统中)的小的、天然存在的、非编码的、单链rna,其以序列特异性方式抑制基因表达。它们由具有特征性二级结构的前体(前-mirna)在细胞内产生,该二级结构由含有通常包含一个或多个不完全互补的区域的双链体的短发夹(长度约70个核苷酸)组成,而其又由较大的前体(pri-mirna)产生。天然存在的mirna通常仅与其靶mrna部分互补,并且通常通过翻译抑制起作用。以内源性mirna或mirna前体建模的rnai剂可用于本发明的某些实施方式中。例如,sirna可以被设计成使得一条链以一个或多个错配或凸起与靶mrna杂交,模拟由mirna及其靶mrna形成的双链体。这种sirna可以称为mirna模拟物或mirna样分子。mirna模拟物可由前体核酸编码,其结构模拟天然存在的mirna前体的结构。
[0129]
在某些实施方式中,rnai剂是载体(例如,质粒或病毒),其包含用于sirna(例如,作为可以彼此杂交的两条独立链)、shrna或微rna前体的转录的模板。如本领域已知的,通常编码sirna、shrna或mirna前体的模板与表达控制序列(例如,启动子)可操作地连接。此类载体可用于将模板引入脊椎动物细胞,例如哺乳动物细胞中,并导致sirna、shrna或mirna前体的瞬时或稳定表达。前体(shrna或mirna前体)在细胞内加工以生成sirna或mirna。
[0130]
一般而言,小rnai剂(例如sirna)可以化学合成或者可以在体外或体内从dna模板转录为两条独立的链,其然后杂交,或者为shrna,其然后被加工以产生sirna。rnai剂,尤其是包含修饰的那些,通常是化学合成的。寡核苷酸的化学合成方法是本领域公知的。
[0131]
如本文所用,术语“小分子”是质量小于约2千道尔顿(kda)的有机分子。在一些实施方式中,小分子小于约1.5kda,或小于约1kda。在一些实施方式中,小分子小于约800道尔顿(da)、600da、500da、400da、300da、200da或100da。通常,小分子的质量至少为50da。在一些实施方式中,小分子包含多个碳-碳键并且可以包含一个或多个杂原子和/或一个或多个对于与蛋白质的结构相互作用(例如氢键)重要的官能团,例如胺、羰基、羟基或羧基,并且在一些实施方式中,至少两个官能团。小分子通常包含一个或多个环状碳或杂环结构和/或芳族或多芳族结构,任选地被一个或多个上述官能团取代。在一些实施方式中,小分子是非聚合的。在一些实施方式中,小分子不是氨基酸。在一些实施方式中,小分子不是核苷酸。在一些实施方式中,小分子不是糖。
[0132]
术语“受试者”可以是任何多细胞动物。通常受试者是脊椎动物,例如哺乳动物或鸟类。示例性哺乳动物包含例如人类、非人类灵长类动物、啮齿动物(例如小鼠、大鼠、兔)、有蹄类动物(例如绵羊、牛、马、山羊物种)、犬科动物和猫科动物。通常,受试者是向其递送化合物的个体,例如用于实验、诊断和/或治疗目的,或从其获得样品或对其执行诊断程序
(例如,将用于评估组织损伤和/或评估本发明化合物的作用的样本品程序)的个体。
[0133]
术语“组织损伤”在本文中用于指对细胞、组织、器官或其他身体结构的任何类型的损伤或伤害。在各种实施方式中,该术语包含由于疾病引起的退化、由于物理创伤或手术引起的损伤、由于暴露于有害物质引起的损伤以及细胞、组织、器官或其他身体结构的结构和/或功能的其他破坏。
[0134]
术语“组织再生”或“tr”是指组织、器官或其他身体结构或其部分在损失、损伤或退化之后的至少部分再生、替换、恢复或再生长,其中如果没有本发明中描述的方法,所述组织再生将不会发生。组织再生的实例包含断指或肢的再生长(包括软骨、骨骼、肌肉、肌腱和韧带的再生长),由于受伤或疾病而丧失的骨骼、软骨、皮肤或肌肉的无疤痕再生长,以及受伤或患病器官的大小和细胞数量的增加,使得该组织或器官接近该组织或器官的正常大小或其在受伤或疾病之前的大小。根据组织类型,组织再生可以通过多种不同的机制发生,例如,预先存在的细胞和/或组织的重排(例如,通过细胞迁移)、成体干细胞或其他祖细胞的分裂和至少它们的一些后代的分化,和/或细胞的去分化、转分化和/或增殖。
[0135]
术语“部分重编程”被认为与itr同义。
[0136]
术语“tr激活基因”是指其在胎儿和成体细胞中缺乏表达但其在胚胎发育阶段的表达促进tr的基因。
[0137]
术语“tr抑制基因”是指其在胎儿和成年动物中的表达抑制tr的基因。
[0138]
术语“治疗”、“处理”、“疗法”、“治疗性”和关于受试者的类似术语是指提供受试者的医学和/或手术管理。治疗可以包含但不限于向受试者施用化合物或组合物(例如,药物组合物)。根据本发明对受试者的治疗通常展开以试图促进再生,例如在已经遭受组织损伤或预期遭受组织损伤(例如,将接受手术的受试者)的受试者中。治疗的效果通常包含增加再生、减少疤痕和/或改善组织损伤后的结构或功能结果(与没有治疗的结果相比),和/或可以包含逆转或降低退行性疾病的严重程度或进展。
[0139]
应用于特定多肽的术语“变体”是指与此类多肽(有时称为“原始多肽”)的不同之处在于一个或更多的氨基酸改变的多肽,例如添加、删除和/或替代。有时,原始多肽是天然存在的多肽(例如,来自人类或非人类动物)或与其相同的多肽。变体可以是天然存在的或使用例如重组dna技术或化学合成产生的。添加可以是多肽内的插入或者在n-或c-末端的添加。在一些实施方式中,被取代、删除或添加的氨基酸的数量可以是,例如约1至30个,例如约1至20个,例如约1至10个,例如约1至5个,例如1、2、3、4或5个。在一些实施方式中,变体包含其序列与原始多肽的序列在至少50个氨基酸、至少100个氨基酸、至少150个氨基酸或更多个处直至原始多肽的全长上同源的多肽(但在序列上与原始多肽不相同),例如变体多肽的序列为与原始多肽的序列在至少50个氨基酸、至少100个氨基酸、至少150个氨基酸或更多直至原始多肽的全长上的序列至少50%、60%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或更多相同。在一些实施方式中,变体包含在原始多肽长度的至少50%、60%、70%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%上与原始多肽至少50%、60%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、99.5%或更多相同的多肽。在一些实施方式中,变体包含至少一个功能或结构域,例如在国家生物技术信息中心(national center for biotechnology information,www.ncbi.nih.gov)的保守结构域数据库(conserved domain database,
cdd)中如此鉴定的域,例如,ncbi审定的域。
[0140]
在一些实施方式中,变体或片段的一种、多于一种或所有生物学功能或活性与原始分子的相应生物学功能或活性基本相似。在一些实施方式中,功能变体保留至少10%、20%、30%、40%、50%、60%、70%、80%、90%、95%、96%、97%、98%、99%或更多的原始多肽的活性,例如大约相等的活性。在一些实施方式中,变体的活性高达原始分子活性的约100%、约125%或约150%。在其他非限制性实施方式中,如果产生特定效果所需的变体的量或浓度在产生这种效果所需的原始分子的量或浓度的0.5至5倍之内,则认为变体或片段的活性与原始分子的活性基本相似。
[0141]
在一些实施方式中,变体中的氨基酸“置换”是用具有相似结构和/或化学特性的另一种氨基酸取代一个氨基酸的结果,即保守氨基酸置换。“保守的”氨基酸置换可以基于所涉及残基的品种或特性如侧链大小、极性、电荷、溶解性、疏水性、亲水性和/或两亲性中的任一种的相似性来进行。例如,非极性(疏水)氨基酸包含丙氨酸、亮氨酸、异亮氨酸、缬氨酸、甘氨酸、脯氨酸、苯丙氨酸、色氨酸和甲硫氨酸。极性(亲水)、中性氨基酸包含丝氨酸、苏氨酸、半胱氨酸、酪氨酸、天冬酰胺和谷氨酰胺。带正电荷的(碱性)氨基酸包含精氨酸、赖氨酸和组氨酸。带负电荷的(酸性)氨基酸包含天冬氨酸和谷氨酸。在特定组内,某些置换可能特别令人感兴趣,例如,亮氨酸被异亮氨酸取代(或反之亦然)、丝氨酸被苏氨酸取代(或反之亦然)或丙氨酸被甘氨酸取代(或反之亦然)。当然,非保守置换通常也与保留功能相容。在一些实施方式中,置换或缺失不改变或缺失对活性重要的氨基酸。插入或缺失的大小范围可为约1至20个氨基酸,例如1至10个氨基酸。在某些情况下,可以在不显著影响功能的情况下去除较大的域。在本发明的某些实施方式中,可以通过对天然存在的酶的序列进行总共不超过5、10、15或20个氨基酸添加、缺失或置换来获得变体的序列。在一些实施方式中,相对于原始多肽,多肽中不超过1%、5%、10%或20%的氨基酸被插入、缺失或置换。可以通过将特定多肽的序列与同源多肽(例如,来自其他生物体)的序列进行比较并最小化在高同源性区域(保守区域)发生的氨基酸序列变化的数量或者通过用同源序列中发现的氨基酸替换氨基酸来获得确定哪些氨基酸残基可以被替换、添加或删除而不消除或显著降低感兴趣的活性的指南,因为在不同物种间保守的氨基酸残基比不保守的氨基酸更可能对活性是重要的。
[0142]
在一些实施方式中,多肽的变体包含异源多肽部分。异源部分通常具有不存在于原始多肽中或与其同源的序列。异源部分的长度可以是例如5至约5,000个氨基酸,或更长。通常它的长度在5到大约1,000个氨基酸之间。在一些实施方式中,异源部分包含在不同多肽中发现的序列,例如功能域。在一些实施方式中,异源部分包含可用于纯化、表达、溶解和/或检测多肽的序列。在一些实施方式中,异源部分包含多肽“标签”,例如,亲和标签或表位标签。例如,标签可以是亲和标签(例如,ha、tap、myc、6xhis、flag、gst)、荧光或发光蛋白(例如,egfp、ecfp、eyfp、cerulean、dsred、mcherry)、溶解度增强标签(例如,sumo标签、nusa标签、snut标签或噬菌体t7的ocr蛋白的单体突变体)。参见,例如,esposito d和chatterjee d k.curr opin biotechnol:,17(4):353-8(2006)。在一些实施方式中,标签可以提供多种功能。标签通常相对较小,例如,范围从几个氨基酸到大约100个氨基酸长。在一些实施方式中,标签的长度超过100个氨基酸,例如长达约500个氨基酸或更多。在一些实施方式中,多肽具有位于n-或c-末端的标签,例如作为n-或c-末端融合物。多肽可以包含多
个标签。在一些实施方式中,例如在n-末端存在6xhis标签和nus标签。在一些实施方式中,标签是可切割的,使得它可以从多肽中去除,例如,通过蛋白酶。在一些实施方式中,这通过在编码与原始多肽同源的部分的序列和标签之间包含编码蛋白酶切割位点的序列来实现。示例性蛋白酶包含例如凝血酶、tev蛋白酶、因子xa、prescission蛋白酶等。在一些实施方式中,使用“自切割”标签。参见,例如,pct/us05/05763。编码标签的序列可以位于编码多肽的多核苷酸的5'或3'(或两者)。在一些实施方式中,标签或其他异源序列通过多肽接头与多肽的其余部分分隔开。例如,接头可以是短多肽(例如,15-25个氨基酸)。接头通常由小氨基酸残基组成,例如丝氨酸、甘氨酸和/或丙氨酸。异源域可以包含跨膜域、分泌信号域等。
[0143]
在本发明的某些实施方式中,任选地排除异源部分(如果存在)的片段或变体与原始多肽具有足够的结构相似性,使得当其3维结构(实际或预测结构)叠加在原始多肽的结构上时,重叠的体积为原始多肽结构总体积的至少70%,优选至少80%,更优选至少90%。片段或变体的部分或完整3维结构可以通过使蛋白质结晶来确定,这可以使用标准方法来完成。或者,也可以使用标准方法生成nmr溶液结构。建模程序例如modeler(sali,a.和blundell,t l,j.mol.biol.,234,779-815,1993)或任何其他建模程序可用于生成预测的结构。如果相关多肽的结构或预测结构可得,则模型可以基于该结构。可以使用prospect-pspp程序套件(guo,j t等,nucleic acids res.32(web server issue):w522-5,jul.1,2004)。当本发明的实施方式涉及多肽的变体时,应理解提供了编码该变体的多核苷酸。
[0144]
术语“载体”在本文中用于指核酸或者病毒或其部分(例如,病毒衣壳或基因组),其能够介导核酸分子进入(例如,转移、转运等)细胞内,例如宿主细胞,例如hes细胞、hec细胞或产生ev的hes衍生的胚胎祖细胞系,其中载体是核酸,待转移的核酸分子通常连接到,例如插入到,载体核酸分子。核酸载体可以包含指导自主复制的序列(例如,复制起点),或可以包含足以允许部分或全部核酸整合到宿主细胞dna中的序列。有用的核酸载体包含,例如,dna或rna质粒、粘粒和天然存在或修饰的病毒基因组或其部分,或者可以包装到病毒衣壳中的核酸(dna或rna)。质粒载体通常包含复制起点和一种或多种选择标记。质粒可包含部分或全部病毒基因组(例如,病毒启动子、增强子、加工或包装信号等)。可用于将核酸分子引入细胞的病毒或其部分被称为病毒载体。有用的病毒载体包含腺病毒、腺相关病毒、逆转录病毒、慢病毒、痘苗病毒和其他痘病毒、疱疹病毒(例如,单纯疱疹病毒)等。当引入宿主细胞中时,病毒载体可以含有或不含用于产生感染性病毒的足够病毒遗传信息,即病毒载体可以是复制缺陷的,并且这种复制缺陷病毒载体可能优选用于治疗用途。当缺乏足够的信息时,它可以但不是必需由宿主细胞提供或由引入细胞中的另一个载体提供。待转移的核酸可以并入天然存在的或修饰的病毒基因组或其一部分中,或者可以作为单独的核酸分子存在于病毒或病毒衣壳内。应当理解,其中包含部分或全部病毒基因组的某些质粒载体在本领域有时也称为病毒载体,所述部分或全部病毒基因组通常包含足以指导可被包装到病毒衣壳中的核酸的转录和/或足以产生可以整合到宿主细胞基因组中的核酸和/或产生感染性病毒的病毒遗传信息。载体可包含一种或多种编码适用于鉴定和/或选择已经用载体转化或转染或者未用载体转化或转染的细胞的标记的核酸。标记包含,例如,增加或减少对抗生素的抗性或敏感性的蛋白质(例如,编码赋予对抗生素如嘌呤霉素、潮霉素或杀稻瘟素的抗性的蛋白质的抗生素抗性基因)或其他化合物、酶,其活性可通过本领域已知的测定法(例如,β-半乳糖苷酶或碱性磷酸酶)检测,和可检测地影响转化或转染细胞的表型的蛋
白质或rna(例如,荧光蛋白)。表达载体是其中包含足以指导可操作连接的核酸的转录的调控序列例如表达控制序列如启动子的载体。调控序列还可包含增强子序列或上游激活子序列。载体可以任选地包含5'前导序列或信号序列。载体可以任选地包含切割和/或聚腺苷酸化信号和/或3'非翻译区。载体通常包含一个或多个适当定位的限制酶位点,以促进将要表达的核酸引入载体中。表达载体包含足够的用于表达的顺式作用元件;宿主细胞或体外表达系统可以提供表达所需或有助于表达的其他元件。
[0145]
可以采用各种技术将核酸分子引入囊泡中。此类技术包含使用如磷酸钙的化合物、阳离子脂质、阳离子聚合物的化学促进转染、脂质体介导的转染、非化学方法如电穿孔、粒子轰击或显微注射,以及用含有目标核酸分子的病毒感染(有时称为“转导”)。标志物可用于识别和/或选择已经吸收载体并且通常表达核酸的囊泡。囊泡可保持在纯化(例如使用本文所述的过滤、离心或磁珠分离步骤)的适当介质中,以建立临床级制剂。
[0146]
使用重编程因子例如klf4、oct4、sox2和myc进行重编程可以重置各种衰老的标志,例如表观遗传特征、端粒长度和线粒体对胚胎状态的适配性(1)。因此,它提供了一种从老的供体细胞中得到年轻组织以作为用于组织再生的细胞来源的方法(2)。最近,一份关于在转基因小鼠的早衰模型中使用klf4、oct4、sox2和myc的脉冲体内表达进行部分重编程的报告显示,可响应于肌肉和胰腺损伤增加再生而不形成肿瘤(3)。然而,这种用于调节体内重编程因子表达的转基因方式存在实际障碍,尤其是在人类的情况下,以实现部分重编程而没有细胞身份的丢失、不受调节的生长和/或肿瘤形成。来自生殖系和多能细胞的细胞外囊泡(ev)先前已被我们公开为将人类体细胞重编程为多能性的一种手段(美国专利申请公开2017/0152475,标题为“methods of reprogramming animal somatic cells”,引入其全文供参考)。此外,我们之前公开了由胚胎祖细胞系产生的外泌体的用途(美国公开专利申请us2016/0108368al),其可用于诱导血管生成活性和稳定血管。
[0147]
来自生殖系和多能细胞的ev以及来自胚胎祖细胞系的ev在这里被描述为eft和nt的调节剂,用于诱导组织再生(itr),而不表达来自外源转基因的多能性因子。来自生殖系或多能细胞的ev包含从ec细胞纯化的外泌体。ec细胞是作为多能细胞衍生的ev来源的优选实施方式,因为易于遗传修饰、克隆扩增、细胞放大。在产生itr ev的情况下,通过外源性引入tert、lin28b、sox2、myc、nanog和oct4来修饰命名为recytel的ec细胞系,从而使相应mrna的表达水平比天然细胞至少高2倍或更优选至少高10倍,最优选至少高50倍。ev的免疫原性降低也可以通过敲除i类hla抗原来实现,例如通过敲除β2-微球蛋白和过表达hla-g。通过差速离心和然后超速离心,从在标准细胞培养容器或生物反应器中培养的所得细胞的细胞上清液中分离外泌体。本领域已知的其他分离方法包含使用密度梯度离心、使用缓冲垫、尺寸排阻过滤或沉淀。优选的纯化方法使用针对外泌体抗原如四跨膜蛋白c9或cd81的免疫磁性分离技术。
[0148]
来自胚胎祖细胞的外泌体用于将细胞重编程为“胚胎样”状态(前-eft(胚胎到胎儿过渡)),如后-eft标志物cox7a1的减少所示(4)。
[0149]
在本发明的一个方面,cox7a1基因表达被用作胚胎到胎儿过渡(eft)的标志物。
[0150]
cox7a1在将成纤维细胞重编程为多能干细胞的过程中很早被下调。多能干细胞(hes和ips)及其分化的后代几乎没有或没有cox7a1表达(4)。无论是在如胚胎祖细胞系中部分分化的后代(4),还是完全分化为成熟表型(如脂肪细胞)的后代(4,8),cox7a1水平都
保持最低。如果低cox7a1表达是胚胎状态的指标,那么预计重编程会将f/a细胞中观察到的较高cox7a1水平重置为胚胎干细胞和源自胚胎干细胞的细胞(胚胎祖细胞)中观察到的低水平。如果在成为多能性之前需要通过部分分化(祖细胞样状态),即使部分重编程的细胞也具有低的cox7a1水平。
[0151]
使用来自ohnuke的全转录组微阵列表达数据(9),cox7a1表达的变化随重编程开始后的时间绘制。cox7a1表达的变化用重编程阶段绘制,并包含如olova绘制的表观遗传年龄的变化(10)。如图1和表1所示,当细胞达到tanabe所描述的“部分重编程状态”时,cox7a1水平在第7天下降至起始水平的~10%,在该状态下它们已经开始表达多能性相关基因但仍然能够恢复到他们最初的细胞身份(11)。在第7天,重编程细胞的表观遗传年龄减少了约10年(图1和(10))。然后cox7a1水平在第10天和第15天增加,之后在第20天恢复到第7天水平(不完全重编程的状态)。因此,一周内cox7a1基因表达迅速下降~90%可用于识别已部分重编程并恢复到更年轻的表观遗传状态的细胞。部分重编程已被描述为更具再生性的状态,并在体内显示改善组织再生并减少疤痕形成,而不形成肿瘤(12-17)。在细胞完全重编程之前第11天和第15天cox7a1表达的瞬时增加表明,即使中等的cox7a1表达也与重编程状态不相容。
[0152]
本发明的细胞外囊泡虽然预期相对无免疫原性,但是通过降低i类hla抗原(包括β-2微球蛋白)的水平和/或在宿主细胞中表达hla-g,可能具有较低的免疫可观察性,国际专利申请公开wo/2014/022423,标题为“hla g-modified cells and methods”,其通过引用整体并入本文。
[0153]
其他发明的方法包括在活的、功能性组织、器官或含有细胞的组合物的离体生产中使用含有itr因子的ev来修复或替换因损伤而丢失的组织或器官。例如,从个体(未来接受者、同一物种的个体或不同物种的个体)取出的细胞或组织可以在体外培养,任选地与基质、支架(例如,三维支架)或模具(例如,包含生物相容的、任选可生物降解的材料,例如聚合物,例如hystem-c)一起,并且它们向功能性组织或器官的发育可以通过接触含有itr因子的ev促进。支架、基质或模具可以至少部分由天然存在的蛋白质(例如,胶原蛋白)、透明质酸或藻酸盐(或任何这些的化学改性衍生物),或者合成的乳酸、己内酯、乙醇酸等的聚合物或共聚物,或者自组装肽,或者来自如心脏瓣膜、肠粘膜、血管和气管的组织的脱细胞基质组成。在一些实施方式中,支架包含水凝胶。在某些实施方式中,支架可以用含有itr因子的囊泡包被或浸渍,其可以随时间从支架中扩散出来。在离体产生之后,将组织或器官移植到受试者体内或上。例如,组织或器官可以被植入,或者在某些组织例如皮肤的情况下,被放置在身体表面上。组织或器官可在体内继续发育。在一些实施方式中,至少部分离体产生的组织或器官是膀胱、血管、骨、筋膜、肝脏、肌肉、皮肤贴片等。合适的支架可以例如模拟细胞外基质(ecm)。
[0154]
任选地,在移植离体产生的组织或器官之前、期间和/或之后,将含有itr因子的ev施用于受试者。在一些方面,生物相容性材料是在所用浓度下对体外细胞基本上无毒的材料,或者在给予活体受试者的材料的情况下,在使用的量下和在使用的位置处对受试者的细胞基本上无毒并且不会对受试者引发或引起显著的有害或不利影响,例如免疫或炎症反应、不可接受的疤痕组织形成等的材料。应当理解,某些生物相容性材料可能在一小部分受试者中引起这类不良反应,通常小于约5%、1%、0.5%或0.1%。
[0155]
在一些实施方式中,向需要再生的受试者中植入ev包被或浸渍的基质或支架,例如装载有itr因子(包括能够引起itr基因表达的全局模式的那些)的外泌体,任选地与细胞组合。基质或支架可以是需要再生的组织或器官的形状。细胞可以是产生此类组织或器官的一种或多种和/或在此类组织或器官中发现的类型的干细胞。
[0156]
在一些实施方式中,将含有itr因子的ev直接施用至组织损伤部位或附近。“直接至组织损伤部位”包含将化合物或组合物注射到组织损伤部位或者扩散、倾倒或以其他方式将化合物或组合物直接接触组织损伤的部位。在一些实施方式中,如果施用发生在距组织损伤部位的可见或另外明显的边缘最多约10cm内或到至少部分位于受损组织或器官内的血管(例如动脉),则施用被认为是“组织损伤部位附近”。“组织损伤部位附近”的施用有时是在受损器官内施用,但在损伤不明显的位置施用。在一些实施方式中,在组织、器官或其他结构受损或丢失之后,将含有itr因子的ev应用于组织、器官或其他结构的剩余部分。在一些实施方式中,将含有itr因子的ev应用于保持附接在身体上的断指或肢体的末端,以增强已丢失部分的再生。在一些实施方式中,切断的部分通过外科手术重新附接,并且将含有itr因子的ev应用于伤口的任一面或两个面。在一些实施方式中,施用含有itr因子的ev以增强移植器官或其部分的植入或愈合或再生。在一些实施方式中,将含有itr因子的ev用于增强神经再生。例如,可以将含有itr因子的ev输注入切断的神经中,例如,在近端和/或远端残端附近。在一些实施方式中,将含有itr因子的ev放置在人工神经导管内,人工神经导管是一种由生物或合成材料组成的管,神经末端和中间间隙包围在其内。可以在基质中配制含有itr因子的ev,以篮球它们随时间的受控释放。所述基质可包含生物相容的、任选可生物降解的材料,例如聚合物,例如由透明质酸组成的聚合物,包含与pegda交联的交联透明质酸或羧甲基透明质酸,或通过pegda交联的羧甲基透明质酸与羧甲基改性明胶的混合物(hystem-c)。
[0157]
在一些实施方式中,含有itr因子的ev包含tert的mrna以及本文所述的lin28b、oct4、sox2、myc和nanog,并且可以d通过pegda交联的羧甲基透明质酸与羧甲基改性明胶(hystem-c)中配制或不配制用于定位和缓释以诱导itr。
[0158]
itm和icm因子(例如,cox7a1的mrna)可以类似地加载到源自胎儿或成体细胞的外泌体中,可以在生理溶液(例如,盐水)中施用,或在通过pegda交联的羧甲基透明质酸与羧甲基修饰的明胶(hystem-c)中缓慢释放,以诱导itm或icm。
[0159]
在一些实施方式中,其中包含itr因子或因子组合的ev被用于促进毛囊的产生和/或毛发的生长。在一些实施方式中,含有itr因子的ev触发毛囊从通常不形成毛发的上皮细胞再生。在一些实施方式中,含有itr因子的ev用于治疗男性或女性的脱发、头发稀疏、部分或完全秃头。在一些实施方式中,秃头是在通常生长之处(例如,在头的顶部、背部和/或侧面)没有或基本上没有头发或缺少头发的状态。在一些实施方式中,头发稀疏是头发少于正常或平均数的状态,或者在一些实施方式中,头发少于个人过去所拥有的头发,或者在一些实施方式中,头发少于个人认为需要的头发。在一些实施方式中,含有itr因子的ev用于促进眉毛或睫毛的生长。在一些实施方式中,含有itr因子的ev用于治疗雄激素性脱发或“男性型秃头”(其可影响男性和女性)。在一些实施方式中,含有itr因子的ev用于治疗斑秃(其涉及头皮上的斑片状脱发)、全秃(其涉及所有头发的脱落)或者全身脱发(其涉及头部和身体的所有毛发脱落)。在一些实施方式中,含有itr因子的ev应用于需要毛发生长的部位,例
如头皮或眉毛区域。在一些实施方式中,将含有itr因子的ev施用于眼睑边缘或附近,以促进睫毛生长。在一些实施方式中,含有itr因子的ev以液体制剂形式应用。在一些实施方式中,含有itr因子的ev以霜剂、软膏剂、糊剂或凝胶的形式应用。在一些实施方式中,含有itr因子的ev用于在烧伤、手术、化学疗法或其他导致毛发或承载毛发的皮肤损失的事件后促进毛发生长。
[0160]
在一些实施方式中,含有itr因子的ev施用于遭受年龄相关的退行性变化的组织,以再生年轻的功能。作为非限制性实例,所述年龄相关的退行性变化包含年龄相关的黄斑变性、冠心病、骨质疏松症、骨坏死、心力衰竭、肺气肿、外周动脉疾病、声带萎缩、听力损失、阿尔茨海默病、帕金森病、皮肤溃疡和其他年龄相关的退行性疾病。在一些实施方式中,所述含有itr因子的ev包含编码端粒酶催化组分的mrna以延长细胞寿命。
[0161]
在一些实施方式中,施用含有itr因子的ev以增强由于诸如化学疗法、辐射或毒素的损伤而丢失或损伤的细胞的替代。在一些实施方式中,此类细胞是实体器官和组织的基质细胞。
[0162]
本发明的治疗方法可以包含鉴定或提供患有或处于患疾病或病症风险中的受试者的步骤,其中增强再生对受试者有益。在一些实施方式中,受试者经历了组织或器官的损伤(例如,物理创伤)或损害。在一些实施方式中,损害是对肢体或手指。在一些实施方式中,受试者患有影响心血管、消化、内分泌、肌肉骨骼、胃肠、肝脏、外皮、神经、呼吸或泌尿系统的疾病。在一些实施方式中,组织损伤是对于组织、器官或结构,例如软骨、骨、心脏、血管、食道、胃、肝、胆囊、胰腺、肠、直肠、肛门、内分泌腺、皮肤、毛囊、牙齿、牙龈、嘴唇、鼻子、嘴巴、胸腺、脾脏、骨骼肌、平滑肌、关节、脑、脊髓、周围神经、卵巢、输卵管、子宫、阴道、乳腺、睾丸、输精管、精囊、前列腺、阴茎、咽、喉、气管、支气管、肺、肾、输尿管、膀胱、尿道、眼睛(例如,视网膜、角膜)或耳朵(例如,corti器官)。
[0163]
在一些实施方式中,在受试者遭受组织损害(例如,损伤或急性疾病相关事件,例如心肌梗塞或中风)后约2、4、8、12、24、48、72或96小时内向受试者至少施用一次含有itr因子的ev,并且任选地,其后至少一次。在一些实施方式中,在受试者遭受组织损害后约1-2周、2-6周或6-12周内向受试者至少施用一次含有itr因子的ev,并且任选地,其后至少一次。
[0164]
在本发明的一些实施方式中,通过例如去除皮肤、去除需要再生或从头发育的部位处的至少一些组织、磨损需要再生或从头发育的关节或骨表面和/或对受试者造成另一种类型的伤口来刺激或促进缺失或发育不良的组织、器官或结构的再生或从头发育可能是有用的。在组织损伤后再生的情况下,可能需要去除(例如,通过手术切除或清创术)至少一些受损组织。在一些实施方式中,在这种去除或磨损的部位处或附近施用含有itr因子的ev。
[0165]
在一些实施方式中,含有itr因子的ev用于增强受试者中组织或器官的生成,该受试者中由于先天性障碍例如遗传疾病而至少部分不存在此类组织或器官。许多先天性畸形会导致各种组织、器官或身体结构(如四肢或手指)发育不全或缺失。在其他情况下,导致组织、器官或其他身体结构发育不全的发育障碍在出生后变得明显。在一些实施方式中,向患有组织、器官或其他身体结构发育不全或缺失的受试者施用含有itr因子的ev,以刺激此类组织、器官或其他身体结构的生长或发育。在一些方面,本发明提供了一种在患有组织、器
官或其他身体结构发育不全或先天性缺失的受试者中增强此类组织、器官或其他身体结构生成的方法,该方法包含向受试者施用含有itr因子的ev。在一些实施方式中,在出生前,即在子宫内,向受试者施用含有itr因子的ev。在此描述的关于再生的本发明的各个方面和实施方式适用于组织、器官或其他身体结构的这种从头生成并且包含在本发明内。
[0166]
在一些方面,含有itr因子的ev用于在各种情况中的任一种情况下增强组织的生成,其中新组织生长在以前不存在此类组织的位置处是有用的。例如,在关节之间生成骨组织通常在脊柱或其他关节融合的情况下有用。
[0167]
可以在多种再生动物模型中测试含有itr因子的ev。一个方面,在鼠物种中测试含有itr因子的ev。例如,可使小鼠受伤(例如,通过切口、截肢、横切或去除组织碎片)。将含有itr因子的ev应用于伤口部位和/或移除的组织碎片,并评估其对再生的影响。脊椎动物tr的调节剂的作用可以在各种组织或器官再生的脊椎动物模型中进行测试。例如,可以在斑马鱼中评估鳍再生,例如,如(mathew l k,unraveling tissue regeneration pathways using chemical genetics.j biol chem.282(48):35202-10(2007))中所述,并且可以作为肢体再生模型。可用于测试治疗对组织和器官(例如心脏、肺、四肢、骨骼肌、骨骼等)再生的影响的啮齿动物、犬科动物、马科动物、山羊科动物、鱼类、两栖动物和其他动物模型广泛可用。例如,在tissue eng part b rev.16(1)(2010)中讨论了用于肌肉骨骼再生的各种动物模型。用于肝再生研究的常用动物模型包含手术切除较大部分的啮齿动物肝脏。其他肝脏再生模型包含由如四氯化碳的毒素引起的急性或慢性肝损伤或肝功能衰竭。在一些实施方式中,用于毛发再生或皮肤伤口愈合的模型包含例如从鼠切除一块皮肤。可以评估毛囊的再生、毛发生长、上皮再生、腺体形成等。
[0168]
可以通过任何合适的方式施用本文公开的和/或使用本文所述的方法和/或测定系统识别的化合物和组合物,例如口服、鼻内、皮下、肌肉内、静脉内、动脉内、肠胃外、腹膜内、鞘内、气管内、眼睛、舌下、阴道、直肠、皮肤或通过吸入,例如,作为气雾剂。当然,所选择的特定模式将取决于所选择的特定化合物、所治疗的特定病症和治疗功效所需的剂量。一般而言,可以使用医学上或兽医学上可接受的任何施用模式来实施本发明的方法,这意味着产生可接受的功效水平而不引起临床上不可接受的(例如,医学上或兽医上不可接受的)副作用的任何模式。一种或多种的化合物的合适制剂,例如基本上纯的制剂,可以与一种或多种的药学上可接受的载体或赋形剂等组合,以产生适合施用于受试者的合适的药物组合物。这种药学上可接受的组合物是本发明的一个方面。术语“药学上可接受的载体或赋形剂”是指不显著干扰组合物的活性成分的生物活性或有效性并且在使用或施用的浓度下对宿主没有过度毒性的载体(该术语包含载体、介质、稀释剂、溶剂、媒介等)或赋形剂。其他药学上可接受的成分也可以存在于组合物中。合适的物质及其用于配制药物活性化合物的用途是本领域众所周知的(参见,例如,“remington's pharmaceutical sciences",e.w.martin,19th ed.,1995,mack publishing co.:easton,pa.,及其更新的版本或译本,例如remington:the science and practice of pharmacy.21st edition.philadelphia,pa.lippincott williams&wilkins,2005,用于药学上可接受的物质和制备各种类型药物组合物的方法的进一步讨论)。此外,本发明的化合物和组合物可以与本领域中用于治疗感兴趣的特定疾病或病症的任何化合物或组合物组合使用。
[0169]
药物组合物通常被配制成与其预定的施用途径相容。例如,肠胃外施用的制剂包
含无菌水性或非水性溶液、悬浮液和乳液。水性载体包含水、醇/水溶液、乳液或悬浮液,包括盐水和缓冲介质,例如氯化钠溶液、林格氏葡萄糖、葡萄糖和氯化钠、乳酸林格氏液。非水性溶剂的实例是丙二醇、聚乙二醇、植物油(如橄榄油)和可注射的有机酯如油酸乙酯;不挥发油、聚乙二醇、甘油、丙二醇或其他合成溶剂;防腐剂,例如抗菌剂,例如苯甲醇或对羟基苯甲酸甲酯;抗氧化剂,如抗坏血酸或亚硫酸氢钠;螯合剂,如乙二胺四乙酸;缓冲剂,如醋酸盐、柠檬酸盐或磷酸盐,以及调节张力的试剂,如氯化钠或葡萄糖。ph值可以用酸或碱(例如盐酸或氢氧化钠)调节。这种肠胃外制剂可以封装在安瓿、一次性注射器或者玻璃或塑料制成的多剂量小瓶中。
[0170]
对于通过吸入施用,可以以气雾剂喷雾的形式从含有合适推进剂的压力容器或分配器递送本发明的组合物,例如气体如二氧化碳、碳氟化合物或雾化剂。可以使用液体或干气溶胶(例如干粉、大多孔颗粒等)。本发明还考虑使用鼻喷雾剂或其他形式的鼻施用来递送组合物。
[0171]
对于局部应用,可以将药物组合物配制成合适的软膏、洗剂、凝胶或乳膏,其含有悬浮或溶解在一种或多种适用于此类组合物的药学上可接受的载体中的活性成分。
[0172]
对于局部递送至眼睛,可将药学上可接受的组合物配制成在等渗、ph调节的无菌盐水中的溶液或微粉化悬浮液,例如用于滴眼剂或软膏,或用于眼内施用,例如,通过注射。
[0173]
可以配制药物组合物用于经粘膜或经皮递送。对于经粘膜或经皮施用,可在制剂中使用适合于待渗透屏障的渗透剂。这种渗透剂是本领域公知的。本发明的药物组合物可配制成栓剂(例如,用常规栓剂基质,例如可可脂和其他甘油酯)或配制为用于直肠递送的保留灌肠剂。
[0174]
在一些实施方式中,组合物包含一种或多种旨在保护活性剂免于从体内快速消除的药剂,例如控释制剂、植入物、微囊化递送系统等。组合物可以合并提高稳定性(例如,在胃肠道或血液中)和/或增强吸收的药剂。化合物可以被包封或并入到颗粒中,例如微粒或纳米颗粒。可以使用可生物降解的生物相容性聚合物,例如乙烯醋酸乙烯酯、聚酐、聚乙醇酸、plga、胶原蛋白、聚原酸酯、聚醚和聚乳酸。制备这种制剂的方法对本领域技术人员来说是显而易见的。例如但不限于,用于递送sirna的许多基于颗粒、脂质和/或聚合物的递送系统是本领域已知的。本发明考虑使用此类组合物。脂质体或其他基于脂质的颗粒也可用作药学上可接受的载体。
[0175]
药物组合物和用于此类组合物中的化合物可以在满足监管机构规定的标准、准则或指南的条件下制造。例如,此类组合物和化合物可根据良好生产规范(gmp)和/或经过适用于人类施用的药物制剂的质量控制程序制造,并且可提供由负责监管药物、手术或其他治疗上有用的产品的政府监管机构批准的标签。
[0176]
当出于治疗目的向受试者施用本发明的药物组合物时,优选地以足以治疗其施用用于治疗的疾病或病症的时间和量来施用。可以通过在细胞培养物或实验动物中的标准药物程序评估活性剂的治疗功效和毒性。从细胞培养试验和动物研究中获得的数据可用于制定适用于人类或其他受试者的剂量范围。可以如本领域已知的在人类临床试验中进一步测试用于人类施用的不同剂量。使用的剂量可以是最大耐受剂量或较低剂量。药物组合物中活性剂的治疗有效剂量可在约0.001mg/kg至约100mg/kg体重、约0.01至约25mg/kg体重、约0.1至约20mg/kg体重、约1至约10mg/kg体重的范围内。其他示例性剂量包含例如约1μg/kg
至约500mg/kg、约100μg/kg至约5mg/kg。在一些实施方式中,施用单剂量,而在其他实施方式中施用多剂量。本领域普通技术人员将理解,在任何特定情况下的适当剂量取决于所用药剂的效力,并且可以任选地针对特定接受者定制。用于受试者的特定剂量水平可以取决于多种因素,包括所用特定药剂的活性、特定疾病或病症及其严重程度、受试者的年龄、体重、总体健康状况等。可能需要以单位剂型配制药物组合物,特别是用于口服或肠胃外组合物的那些,以便于施用和剂量均一性。如本文所用的该术语,单位剂型是指适合作为用于待治疗受试者的单位剂量的物理离散单位;每一个单位含有与适当的药学上可接受的载体结合的经计算可产生所需的治疗效果的预定量的活性剂。应当理解,治疗方案可以包含在一段时间内施用多个剂量如单位剂型,该时间段可以长达数天、数周、数月或数年。在治疗期内,受试者可以每天接受一个或多个剂量,或者可以每隔一天或以更低频繁接受剂量。例如,施用可以是每两周、每周等。施用可以继续,例如,直到组织或器官的适当结构和/或功能已经至少部分恢复和/或直到化合物的连续施用似乎不再促进进一步的再生或改善。在一些实施方式中,受试者向自己施用一剂或多剂本发明的组合物。
[0177]
在一些实施方式中,例如为了增强再生的目的,联合施用两种或更多种化合物或组合物。联合施用的化合物或组合物可以在同一组合物中一起施用,或单独施用。在一些实施方式中,“联合”施用是指,对于第一和第二化合物或组合物的施用,进行的施用使得(i)在第一种药剂最近施用剂量的90%以上被代谢成无活性形式或从体内排出之前,施用第二化合物的剂量;或(ii)第一和第二化合物的剂量在彼此相隔48、72、96、120或168小时内施用;或(iii)药剂在重叠时间段内施用(例如,通过连续或间歇输注);或(iv)前述各项的任何组合。在一些实施方式中,施用两种或更多种表达端粒酶催化组分和itr因子的含有itr因子的ev。在一些实施方式中,将含有itr因子的ev与一种或多种的生长因子、生长因子受体配体(例如激动剂)、激素(例如类固醇或肽激素)或信号传导分子的组合联合施用,可用于促进再生和极性。特别有用的是可用于组织再生感受态细胞的组织中心分子,例如使用本发明的方法产生的那些。在一些实施方式中,生长因子是表皮生长因子家族成员(例如,egf,神经调节蛋白)、成纤维细胞生长因子(例如,fgf1-fgf23中的任一种)、肝细胞生长因子(hgf)、神经生长因子、骨形态发生蛋白(例如,bmp1-bmp7中的任一种)、血管内皮生长因子(vegf)、wnt配体、wnt拮抗剂、视黄酸、notum、卵泡抑素、音猬因子或其他组织中心因子。
[0178]
兽医应用
[0179]
本发明的组合物和方法适用于兽药中的同源应用,其中产生ev和mrna的宿主细胞来自相应物种。
[0180]
靶向和促融合修饰
[0181]
产生ev的宿主细胞也可以被遗传修饰以表达促进ev特异性靶向所需靶细胞类型的靶向和促融合,以及促进ev与靶细胞质膜融合的蛋白质。细胞类型特异性靶向蛋白的实例是提供细胞类型特异性粘附的成簇原钙粘蛋白基因。其他靶向肽和蛋白质包含生长因子,如fgf和egf,以及对结合和内化的细胞类型特异性抗原具有亲和力的抗体用于将携带itr因子的ev靶向特定细胞、组织或器官。选自在将编码靶向肽/蛋白质的基因与肽/蛋白质本身连接的遗传包(genetic package)上展示(噬菌体、核糖体和酵母展示)的大型组合肽文库的靶向肽、抗体和抗体片段是本领域公知的。例如,心脏靶向肽crppr用作靶向肽以富集对心脏的治疗剂累积(zhang等biomaterials(2008)29(12):1976-88)。促融合蛋白的实
例包含hpv16 e5蛋白。
[0182]
mrna的稳定化
[0183]
加载到分离的ev(例如本发明的外泌体)中的mrna可以被修饰,例如通过用假尿苷替代尿苷来增加它们的稳定性,减少先天免疫反应,并增加功能半衰期。
[0184]
实施例1:来自胚胎祖内皮细胞的条件培养基下调胎儿/成人血管内皮细胞中的cox7a1
[0185]
测试来自克隆胚胎内皮祖细胞eepc系的条件培养基中的分泌因子以测定它们是否可以将胚胎基因表达模式赋予胎儿/成人内皮细胞。在37℃、5%的o2、10%的co2下与细胞孵育72小时后收集来自3个克隆eepc细胞系(30-mv2-10、30-mv2-17和30-mv2-19)的培养基(补充有vegf、igf2和fgf2(vif)的egm-mv2基础培养基)。将约80%汇合的huvec(人脐带静脉细胞)或hbmvec(人脑微血管内皮细胞)用pbs洗涤2次,并将它们的生长培养基替换为来自30-mv2-10、30-mv2-17或30-mv2-19的条件培养基。在收获用于rna提取之前,将细胞在条件培养基中孵育72小时。使用标准方法分离rna并通过定量rtpcr评估基因表达。
[0186]
使用δδct方法计算cox7a1基因表达相对于其在生长培养基中培养的细胞中的表达的变化。使用单因素方差分析确定统计显著性。与正常生长培养基或无外泌体培养基(含有vif和5%无外泌体小牛血清的基础培养基)相比,huvec细胞在eepc条件培养基中的孵育导致cox7a1基因表达显著降低。hbmvec细胞与eepc条件培养基的孵育也导致cox7a1表达显著降低,而30-mv2-19条件培养基导致cox7a1表达的最大降低。这些结果表明胚胎祖细胞的分泌组包含能够赋予胎儿成体细胞更多胚胎性表型的因子,如eft标志物cox7a1所指示的。
[0187]
实施例2:来自胚胎祖细胞的外泌体下调成体内皮细胞中的cox7a1
[0188]
通过对如实施例1中所述制备的条件培养基超滤制备来自胚胎内皮祖细胞系(30-mv2-10、30-mv2-14和30-mv2-19)的条件培养基的外泌体富集级分。培养基在室温下以300xg离心5分钟,然后是1000xg10分钟。然后通过0.22um过滤器过滤。过滤后的培养基在4℃下以10,000xg离心10分钟。然后通过amicon ultra-70 100kda截止装置以1000xg离心1小时将培养基浓缩300x。huvec以~80%汇合度接种并在含有无外泌体fcs的egm-mv2培养基中孵育。
[0189]
在第0天和第3天,将来自胚胎或huvec细胞条件培养基的外泌体富集制剂添加至10x(1:30稀释)的终浓度。未暴露于细胞的条件培养基(无外泌体的培养基)和从huvec条件培养基中浓缩的外泌体用作对照。在第6天收获细胞用于rna制备。使用标准方法通过定量rtpcr评估基因表达,并使用δδot方法计算cox7a1的变化。如图3所示,与来自3种胚胎内皮祖细胞的外泌体富集培养基一起孵育导致cox7a1表达降低高达50%。
[0190][0191][0192]
实施例3.使用遗传修饰的人胚胎癌细胞作为用于itr的外泌体的来源
[0193]
ec细胞是作为多能细胞衍生的ev的来源的优选实施方式,因为它易于对细胞进行遗传修饰、克隆扩增、扩大规模。在从ec细胞产生itr ev的情况下,通过外源性引入tert、lin28b sox2、myc、nanog和oct4的组合而修饰指定为recytel的ec细胞系,使得相应mrna的表达水平比原始细胞至少高2倍,或更优选至少高10倍,最优选至少高50倍。通过β2-微球蛋白的敲除来敲除i类hla抗原功能和过表达hla-g,也实现降低的ev免疫原性。通过差速离心然后超速离心和使用针对外泌体抗原(例如跨膜蛋白c9或cd81)的免疫磁性分离技术,从在标准细胞培养容器或生物反应器中培养的所得细胞的细胞上清液中分离外泌体。所得外泌体可用于在人体中诱导组织再生,并且可用于诱导否则不能再生的组织中的再生的兽医学用途。
[0194]
实施例4.使用原始人胚胎癌细胞作为用于itr的外泌体的来源
[0195]
ec细胞是作为多能细胞衍生ev的来源的优选实施方式,因为细胞易于放大。在从ec细胞生产itr ev的情况下,命名为recytel的ec细胞系经过修饰以降低ev的免疫原性,并通过β2-微球蛋白的敲除来敲除i类hla抗原功能和过表达hla-g而实现。外泌体是通过差异化离心,然后是超速离心,并使用针对外泌体抗原(如四跨膜蛋白c9或cd81)的免疫磁性分离技术从在标准细胞培养容器或生物反应器中培养的所得细胞的细胞上清液中分离出来的。所得的外泌体随后加载用于tert、lin28b sox2、myc、nanog和oct4的组合的外源mrna,使得相应mrna的表达水平比原始细胞高至少2倍,或更优选高至少10倍,并且最优选地高至少50倍。最终加载的外泌体可用于诱导人类组织再生,并且可用于在否则不能再生的组织中诱导再生的兽医学应用。
[0196]
本发明的实施方式还包含:
[0197]
1.一种用于诱导细胞或组织再生的方法,其包括以下步骤:1)从表现出胎儿前基
因表达模式的宿主细胞中分离细胞外囊泡;2)在体内使细胞和/或组织与细胞外囊泡接触以恢复胎儿前基因表达模式并诱导组织再生,但不将所述细胞和组织重编程为多能性。
[0198]
2.如权利要求1所述的方法,其中重编程细胞和/或组织的cox7a1表达的降低指示更多胚胎性表型。
[0199]
3.如权利要求1所述的方法,其中所述细胞最初是成体人细胞。
[0200]
4.如权利要求1所述的方法,其中接触的细胞和/或组织在至少第20天时具有小于10%最大值的cox7a1表达。
[0201]
5.如权利要求1所述的方法,其中所述细胞外囊泡是外泌体。
[0202]
6.如权利要求1所述的方法,其中所述细胞外囊泡源自人胚胎性癌细胞或胚胎祖细胞。
[0203]
7.一种用于诱导细胞或组织再生的方法,其包括以下步骤:1)从经遗传修饰以过表达lin28b、sox2、nanog、oct4和myc的宿主胚胎性癌细胞中分离细胞外囊泡;2)在体内使细胞和/或组织与细胞外囊泡接触以恢复胎儿前基因表达模式并诱导组织再生,但不将所述细胞和组织重编程为多能性。
[0204]
8.如权利要求7所述的方法,其中重编程的细胞和/或组织的cox7a1表达的降低指示更多胚胎性表型。
[0205]
9.如权利要求7所述的方法,其中所述细胞最初是成体细胞。
[0206]
10.如权利要求7所述的方法,其中所述接触的细胞和/或组织在至少第20天时具有小于10%最大值的cox7a1表达。
[0207]
11.如权利要求7所述的方法,其中所述细胞外囊泡是外泌体。
[0208]
12.一种诱导细胞或组织再生的方法,其包括以下步骤:1)从表现出胎儿前基因表达模式的宿主细胞中分离细胞外囊泡;2)将lin28b、sox2、nanog、oct4和myc的mrna引入所述细胞外囊泡中;3)在体内使细胞和/或组织与细胞外囊泡接触以恢复胎儿前基因表达模式并诱导组织再生,但不将所述细胞和组织重编程为多能性。
[0209]
13.如权利要求12所述的方法,其中由来自重编程细胞和/或组织的cox7a1的表达降低指示所述更多胚胎性表型。
[0210]
14.如权利要求12所述的方法,其中所述细胞最初是成体细胞。
[0211]
15.如权利要求12所述的方法,其中所述接触的细胞和/或组织到至少第20天时具有小于10%最大值的cox7a1表达。
[0212]
尽管本文的描述包含许多细节,但这些不应被解释为限制本公开的范围,而应被解释为仅提供一些当前优选实施方式的说明。因此,应当理解,本公开的范围完全包含对本领域技术人员而言显而易见的其他实施方式。
[0213]
在本发明的上下文中,应当理解,本发明不限于所描述的特定实施方式,因此当然可以变化。还应当理解,这里使用的术语仅用于描述特定实施方式的目的,并不旨在限制,因为本发明的范围将仅由所附权利要求书限制。
[0214]
在提供值范围的情况下应理解,除非上下文另有明确规定,在该范围的上限和下限之间的每一个中间值,到下限单位的十分之一,以及该规定范围内的任何其他规定或中间值包含在本发明内。这些较小范围的上限和下限可以独立地包含在较小范围内并且也包含在本发明内,受所述范围内的任何具体排除的限制。在所述范围包含一个或两个限值的
res 120,1381-1383
[0235]
15.tamanini,s.,comi,g.p.和corti,s.(2018)in vivo transient and partial cell reprogramming to pluripotency as a therapeutic tool for neurodegenerative diseases.mol neurobiol 55,6850-6862
[0236]
16.beyret,e.,martinez redondo,p.,platero luengo,a.和izpisua belmonte,j.c.(2018)elixir of life:thwarting aging with regenerative reprogramming.circ res 122,128-141
[0237]
17.doeser,m.c.,scholer,h.r.和wu,g.(2018)reduction of fibrosis and scar formation by partial reprogramming in vivo.stem cells 36,1216-1225
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。