1.本发明属于微生物培养技术领域,具体而言,涉及一种屎肠球菌的高密度发酵培养方法。
背景技术:
2.乳酸菌是一种应用已久的益生菌,有200多余种,其中一些也是肠道微生物的固有益生菌群。屎肠球菌属于链球菌科,肠球菌属乳酸菌,革兰氏阳性,兼性厌氧。其具有优良的生物学特性,是肠道共生菌,可在肠道中形成优势菌群,由于其生长速度快,具有较好粘附力,产生乳酸以及一些抗菌物质,抑制有害菌,促进肠道健康,调节肠道的微生态平衡,效果与抗生素相当。因此,屎肠球菌在畜禽养殖业中有着广泛的应用前景,其微生态制剂因具有环境友好,无残留等优点被越来越多地应用于畜牧业生产,对养殖生态环境的保护及养殖业的可持续发展具有重要的意义。
3.然而传统的乳酸菌发酵多选用mrs培养基,价格昂贵,发酵活菌数低于1
×
109cfu/ml,在益生菌有效使用剂量固定的情况下,低发酵水平等于变相的增加了成本。此外,抗生素的持续饲喂导致细菌的耐药性、畜产品中的药物残留等问题日益加重。益生菌作为一种无毒、无残留、无抗药性的饲料添加剂,已成为有效的抗生素替代产品之一。因此,寻求一种低成本的培养基,能够低成本高效优化发酵工艺、提高其发酵活菌数对于推进益生菌发酵的产业化有重大指导及实践意义。
技术实现要素:
4.本发明提出一种屎肠球菌的高密度发酵培养基及其发酵工艺,该发酵培养基成本低,且能够高效优化发酵工艺、提高其发酵活菌数。
5.为达到此目的,本发明采用以下技术方案:
6.一种屎肠球菌高密度发酵培养方法,包括以下步骤:
7.(1)屎肠球菌一级种子液培养:取屎肠球菌平板单菌落,接种于一级种子培养基中,装液量50ml/150ml,37℃培养16小时,得到一级种子液;
8.(2)屎肠球菌二级种子液培养:将步骤1培养的屎肠球菌一级种子液接种于二级种子培养基中装液量540ml/1000ml,接种量3%,37℃培养4~8小时,得到二级种子液;
9.(3)屎肠球菌液体发酵:发酵培养基灭菌结束后通冷却水保温至37℃,接入二级种子液,接种量3%,搅拌速度150rpm,维持ph 6.0~7.5;发酵2h后开始流加补料培养基,补料培养基的补充体积为2l,发酵12h;
10.其中,步骤(3)发酵培养基组分及其用量为:糖蜜20g/l,胰蛋白胨10g/l,牛肉浸粉20g/l,乙酸钠6.42g/l,磷酸二氢钾2g/l,柠檬酸氢二铵2g/l,硫酸镁0.2g/l,硫酸锰0.04g/l。
11.进一步,所述屎肠球菌为屎肠球菌cgmcc no.12851。
12.进一步,所述一级种子培养基组分及其用量为:牛肉浸粉5g/l,蛋白胨10g/l,酵母
浸粉5g/l,氯化钠5g/l,葡萄糖10g/l。
13.进一步,所述二级种子培养基组分及其用量为:牛肉浸粉12.5g/l,蛋白胨5g/l,酵母浸粉2.5g/l,氯化钠2.5g/l,葡萄糖5g/l,糖蜜10g/l,胰蛋白胨5g/l,乙酸钠3.21g/l,磷酸二氢钾1g/l,柠檬酸氢二铵1g/l,硫酸镁0.1g/l,硫酸锰0.02g/l。
14.进一步,所述步骤(2)二级种子培养时间为5-6h。
15.进一步,所述步骤(3)液体发酵过程中维持ph 6.0-6.5。
16.进一步,所述补料培养基由25%糖蜜、17.5%玉米浆制成。
17.与现有技术相比,本发明的优点和积极效果在于:
18.本发明优化了屎肠球菌(enterococcus faecium)的高密度发酵的种子培养基和发酵培养基,通过发酵过程中控制发酵液的ph、溶氧量以及通过控制糖和氮源的含量采用流加的方式进行分批补料的策略,实现了屎肠球菌的低成本、高效率的生产。本发明的发酵培养基组成相较于mrs肉汤培养基的组成,原料更为廉价,更适用于菌株的工业化生产,而本发明菌株可以更好地利用发酵培养基进行发酵增值。与现有技术相比,本发明通过优化培养基显著提高了屎肠球菌的高密度发酵水平。
附图说明
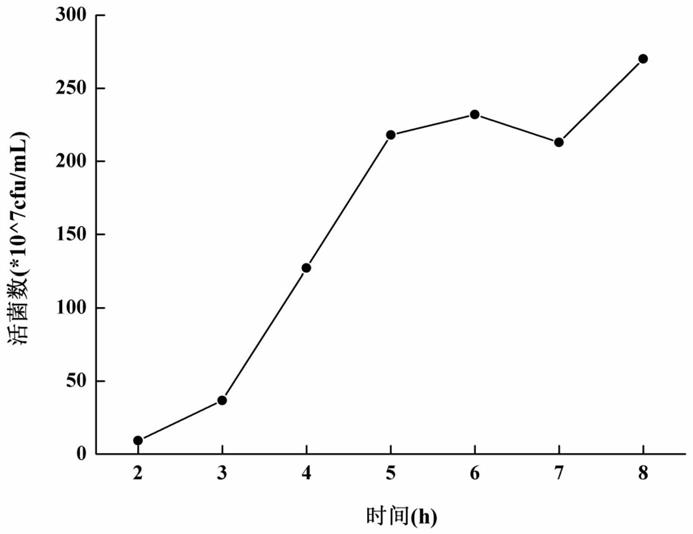
19.图1为屎肠球菌种龄变化曲线
20.图2不同发酵培养基对屎肠球菌液体发酵活菌数影响
具体实施方式
21.下面将结合实施例对本发明的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限制本发明的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购买获得的常规产品。
22.实施例1屎肠球菌发酵及培养基配制
23.1.培养基配制:
24.(1)一级种子培养基为bpy培养基,组成成分及含量为:牛肉浸粉5g/l,蛋白胨10g/l,酵母浸粉5g/l,氯化钠5g/l,葡萄糖10g/l,ph7.0-7.2。
25.(2)上罐发酵培养基组成成分及含量为:糖蜜20g/l,胰蛋白胨10g/l,牛肉浸粉20g/l,乙酸钠6.42g/l,磷酸二氢钾2g/l,柠檬酸氢二铵2g/l,硫酸镁0.2g/l,硫酸锰0.04g/l。
26.(3)二级种子培养基(bpy培养基和发酵培养基按1:1比例混匀)组成成分及含量为:牛肉浸粉12.5g/l,蛋白胨5g/l,酵母浸粉2.5g/l,氯化钠2.5g/l,葡萄糖5g/l,糖蜜10g/l,胰蛋白胨5g/l,乙酸钠3.21g/l,磷酸二氢钾1g/l,柠檬酸氢二铵1g/l,硫酸镁0.1g/l,硫酸锰0.02g/l,ph 6.0。
27.2.屎肠球菌高密度发酵方法
28.(1)屎肠球菌一级种子液培养
29.取屎肠球菌cgmcc no.12851平板单菌落,接种于一级种子培养基中,装液量50ml/150ml,37℃培养16小时,得到一级种子液。
30.(2)屎肠球菌二级种子液培养
31.将步骤1培养的屎肠球菌一级种子液接种于二级种子培养基中装液量540ml/1000ml,接种量3%,37℃培养5小时,得到二级种子液。
32.(3)屎肠球菌液体发酵
33.发酵培养基灭菌结束后通冷却水保温至37℃,接入二级种子液,接种量3%,调节ph至6.5,搅拌速度150rpm,发酵开始,设定自动补充氢氧化钠,维持ph6.5。发酵2h后开始流加补料培养基(糖蜜25% 17.5%酵母浸粉),补料培养基的补充体积为2l,发酵12h。
34.实施例2不同二级种子液培养基对屎肠球菌液体发酵活菌数影响
35.屎肠球菌高密度发酵方法同实施例1,其中,二级种子培养基分别选择a:bpy培养基、b:发酵培养基、c:bpy培养基和发酵培养基按1:1比例混匀,分别进行发酵。
36.发酵完成后分别测定活菌数,结果见表1。结果显示,按1:1混匀的种子液发酵水平优于其它两种种子液发酵水平,故选择1:1比例混匀的培养基作为二级种子培养基。
37.表1不同种子液培养基对屎肠球菌液体发酵活菌数影响
38.种子液培养基菌数(cfu/ml)a(bpy培养基)2.4*10
10
b(发酵培养基)2.5*10
10
c(a和b按1:1比例混匀)2.85*10
10
39.实施例3不同发酵培养基对屎肠球菌液体发酵活菌数影响
40.屎肠球菌高密度发酵方法同实施例1,其中,液体发酵培养基分别选择实施例1的发酵培养基和传统mrs培养基,分别进行发酵。
41.传统mrs培养基的主要成分及含量为:蛋白胨10g/l,牛肉粉5g/l,酵母浸粉4g/l,葡萄糖20g/l,三水合乙酸钠5g/l,七水合磷酸氢二钾2g/l,柠檬酸铵2g/l,七水合硫酸镁0.2g/l,四水合硫酸锰0.05g/l,吐温80 1ml/l。
42.发酵结果如图2所示,与传统mrs培养基相比较,选择发酵培养基高密度发酵活菌数是传统mrs培养基发酵活菌数的40倍以上,完全满足屎肠球菌作为饲用乳酸菌的生产要求。
43.实施例4屎肠球菌的种龄生长曲线测定
44.取实验室保存的屎肠球菌cgmcc no.12851平板单菌落,接种于一级种子培养基中,装液量50ml/150ml,37℃培养16小时,之后以3%的比例接种到二级种子培养基中,装液量540ml/1000ml,混匀,37℃培养8小时,从第2h开始,每隔1h进行活菌计数,以时间为横轴,活菌数为纵轴,绘制活菌数随时间变化曲线图,参照附图1。从图1中可以看出,该株屎肠球菌于5h菌数增长迅速,故选取5h为最佳接种龄。
45.实施例5流加不同补料发酵培养基对屎肠球菌液体发酵活菌数影响
46.屎肠球菌高密度发酵方法同实施例1,其中,液体发酵过程中分别流加不同补料培养基a、b,补料a:糖蜜25% 17.5%酵母浸粉、补料b:糖蜜25% 17.5%玉米浆,发酵完成后,分别测定活菌数,结果见表2。结果显示,用玉米浆替代酵母浸粉,对屎肠球菌的发酵水平没有显著影响,但大大降低了成本。
47.表2不同补料培养基对屎肠球菌液体发酵活菌数影响
48.补料培养基菌数(cfu/ml)
补料a(糖蜜25% 酵母浸粉17.5%)2.7*10
10
补料b(糖蜜25% 玉米浆17.5%)2.6*10
10
49.实施例6屎肠球菌液体发酵最佳发酵ph确定
50.屎肠球菌高密度发酵方法同实施例1,其中,液体发酵过程中分别调节ph至5.0、6.0、6.5、7.0、7.5,发酵开始,设定自动补充氢氧化钠维持相应ph。发酵完成后,分别测定活菌数,结果如表3所示,当发酵液ph为6时,发酵液活菌数最高,所述发酵液活菌数为4.0*10
10
cfu/ml。
51.表3不同发酵ph对屎肠球菌液体发酵活菌数影响(cfu/ml)
52.ph菌数(cfu/ml)5.02.15*1096.04.0*10
10
6.53.46*10
10
7.01.95*10
10
7.52.2*10
10
53.对比例1使用不同菌株发酵对比试验
54.所涉及菌种:植物乳杆菌zhang-ll(cgmcc no.6936),罗伊氏乳杆菌ri021(cgmcc no.4650),副干酪乳杆菌kl1(cgmcc no.11533),约氏乳杆菌cgmcc no.4926,酿酒酵母k1(cgmcc no.6560),屎肠球菌cgmcc no.5092。
55.具体方法包括如下步骤:
56.1.一级种子液培养
57.分别取各菌种平板单菌落,接种于一级种子培养基中,装液量50ml/150ml,37℃培养16小时,得到一级种子液。
58.2.二级种子液培养
59.将步骤1培养的一级种子液分别接种于二级种子培养基中,装液量540ml/1000ml,接种量3%,37℃培养5小时,得到二级种子液。
60.3.液体发酵
61.发酵培养基灭菌结束后通冷却水保温至37℃,分别接入步骤2中的二级种子液,接种量3%,调节ph至6.0,搅拌速度150rpm,发酵开始,设定自动补充氢氧化钠维持ph。发酵2h后开始流加补料培养基(糖蜜25% 17.5%玉米浆),补料培养基的补充体积为2l,发酵12h,分别测定活菌数,结果显示,此高密度发酵培养方法对屎肠球菌有显著效果。
62.表4不同菌属高密度发酵活菌数变化(cfu/ml)
63.菌种菌数(cfu/ml)植物乳杆菌zhang-ll(cgmcc no.6936)5.5*109罗伊氏乳杆菌ri021(cgmcc no.4650)1.25*109副干酪乳杆菌kl1(cgmcc no.11533)3.75*109约氏乳杆菌cgmcc no.49268.5*108酿酒酵母k1(cgmcc no.6560)6.75*109屎肠球菌cgmcc no.50921.13*10
10
屎肠球菌cgmcc no.128513.85*10
10
64.最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,但本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
