一种人工改造的
β-半乳糖苷酶galt1及其在水解乳糖中的应用
技术领域
1.本发明涉及生物技术领域,具体涉及一种人工改造的β-半乳糖苷酶galt1及其在水解乳糖中的应用。
背景技术:
2.乳糖是一种二糖,由葡萄糖和半乳糖组成。牛奶中乳糖含量十分丰富。部分人群的小肠黏膜的乳糖酶分泌不足甚至不分泌,导致无法有效水解乳糖,该症状称为乳糖不耐症。目前市场上已出现针对该消费人群的无乳糖奶制品(乳糖含量《0.5%,w/w,卫监督发[2007]300 号)。制备这些无乳糖奶制品的常见方法是利用乳糖酶(即β-半乳糖苷酶,β-galactosidase, ec:3.2.1.23)对牛奶中的乳糖进行降解。
[0003]
β-半乳糖苷酶广泛分布在动物、植物和微生物中。目前,已有两款商品化的β-半乳糖苷酶,但是价格偏贵、水解时间偏长。例如商品化的黑曲霉来源的β-半乳糖苷酶在55℃实现牛奶中乳糖的彻底降解,需要水解12h(rosolen et al 2015);商品化的克鲁维酵母来源的β-半乳糖苷酶在2℃实现牛奶中乳糖的彻底降解需要24h(horner et al 2011)。
[0004]
β-半乳糖苷酶的牛奶乳糖水解分为三种策略。一是低温(10℃以下)长时间水解。往往是把酶作为食品添加剂添加到牛奶中,利用牛奶的储存期进行水解。这对酶的食品源来源有很苛刻的要求;二是中温(37℃左右)水解,该温度是很多微生物的最佳繁殖温度,因此酶解全程必须在严格的无菌条件下进行,成本和工艺要求高;三是高温(55℃以上)短时间水解。该技术可以把固定化酶水解乳糖和巴氏杀菌耦合,工艺二合一,效率也更高;而且酶往往制备为固定化酶,不向牛奶中引入外源蛋白,安全性高。因此,探索高温β-半乳糖苷酶一直是生产无乳糖奶制品研究的热点之一。
[0005]
目前有不少高温β-半乳糖苷酶的报道,但一些高温的β-半乳糖苷酶的热稳定性并不高。例如,sandra w等报道的β-半乳糖苷酶在最适温度50℃下的半衰期仅为10min;arreola等报道的β-半乳糖苷酶在最适温度55℃下的半衰期仅为8min。一些热稳定性较好的高温β-半乳糖苷酶的水解活性却比较低。例如,中国发明专利201210127007.0中的β-半乳糖苷酶在 65-69℃时仅能水解牛奶中80%的乳糖;中国发明专利201510358266.8中的β-半乳糖苷酶在 60℃时仅能水解牛奶中约70%的乳糖。因此,挖掘同时满足热稳定性好和乳糖水解率高的高温β-半乳糖苷酶,对无乳糖奶制品行业的发展具有重要意义。
[0006]
提高酶的热稳定性的方法很多,融合双亲短肽是一种比较好的方法,不容易引起酶催化活性的下降。目前双亲短肽的设计方案多种多样,有不少成功的报道,但是同时也有不少无效甚至更差的报道。例如,中国发明专利201810069643.x中尝试了7条不同的双亲短肽对一个葡萄糖氧化酶的温度稳定性的影响,发现有1条双亲短肽会使酶的稳定性变差,其余对酶的稳定性都有不同程度的提升,但是最高的在60℃仅仅孵育30min。中国发明专利 2109776686a中报道了在一个脂肪酶的n端分别融合2个不同的双亲短肽,略微提高了酶的热稳定性。该脂肪酶本身的热稳定性比较差,半衰期仅25min,双亲肽融合后的酶的半衰期
提高到35和45min。双亲短肽的氨基酸的种类和长度都会影响酶的性质,而且没有一个明显的规律。这就要求在试验中,设计多种双亲短肽,通过试验测试,找到具体某个酶的相对最佳匹配的双亲短肽。
技术实现要素:
[0007]
本发明针对上述现有技术所存在的问题,提供了一种人工改造的β-半乳糖苷酶galt1及其在水解乳糖中的应用。本发明提供的β-半乳糖苷酶galt1相较于野生型的β-半乳糖苷酶 galt0的温度稳定性得到了显著改善,55℃的半衰期提高10倍;此外,β-半乳糖苷酶galt1 的牛奶乳糖降解率也明显提高,55℃、2h内能降解牛奶中95%的乳糖,达到无乳糖奶制品的国家标准。因此,本发明人工改造的β-半乳糖苷酶galt1在长期储存和快速制备无乳糖奶制品方面具有很好的工业应用价值。
[0008]
本发明人工改造的β-半乳糖苷酶galt1,是在来源于t.scotoductus的野生型β-半乳糖苷酶galt0的n端氨基酸序列连接了一个人工改造的双亲短肽序列,所述双亲短肽序列如 seq id no:2所示。
[0009]
进一步地,所述β-半乳糖苷酶galt1的氨基酸序列如seq id no:1所示。
[0010]
本发明还提供了所述β-半乳糖苷酶galt1的编码基因,其核苷酸序列如seq id no:3所示。该序列已经经过序列优化,能在大肠杆菌中有效表达出有酶活力的β-半乳糖苷酶。
[0011]
所述β-半乳糖苷酶galt1基因的表达载体,包括pet22b。
[0012]
含有上述表达载体的宿主菌株,包括大肠杆菌bl21(de3)。
[0013]
本发明还提供用于表达所述β-半乳糖苷酶galt1的重组质粒,该重组质粒至少包含如 seq id no:1所示的氨基酸序列。
[0014]
用于表达所述β-半乳糖苷酶galt1的重组菌株,该重组菌株包含所述重组质粒。
[0015]
本发明β-半乳糖苷酶galt1的比酶活为145u/mg(以乳糖为底物)。该酶在55℃、50mm 的磷酸盐缓冲液(ph 7.0)中存放10h,测残留酶活为74u/mg,即该酶在55℃的半衰期高达10h。
[0016]
本发明β-半乳糖苷酶galt1的应用,是用于水解乳糖,具有较高的热稳定性和乳糖水解率。
[0017]
优化后的水解乳糖条件参数为:天然牛奶(ph约6.7),酶量20u/ml,反应温度55℃,反应时间2h。
[0018]
在55℃下,天然牛奶(ph约6.7,乳糖含量为4.36%,w/w)经过2h酶解,野生型β
‑ꢀ
半乳糖苷酶galt0的乳糖降解率约80%;本发明β-半乳糖苷酶galt1的乳糖降解率为95% (乳糖残留量为0.22%,w/w),比野生型β-半乳糖苷酶galt0的降解率提高了19%,达到无乳糖奶制品的国家标准。
附图说明
[0019]
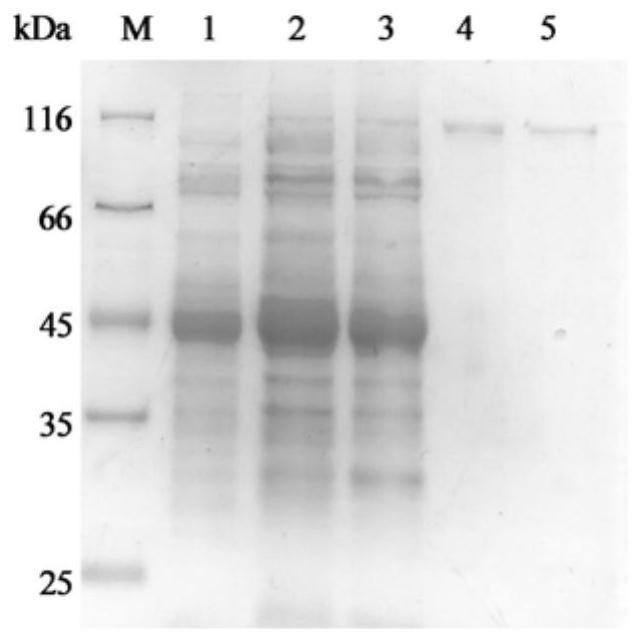
图1表示了本发明的β-半乳糖苷酶蛋白表达及纯化后sds-page电泳图。
[0020]
图2表示了本发明的β-半乳糖苷酶水解反应的最适温度。
[0021]
图3(a)表示了本发明的β-半乳糖苷酶在50℃的温度稳定性;(b)表示了本发明的
β
‑ꢀ
半乳糖苷酶在55℃的温度稳定性。
[0022]
图4表示了本发明的β-半乳糖苷酶对牛奶中乳糖的水解率。
具体实施方式
[0023]
实施例1:人工改造的β-半乳糖苷酶galt1的序列设计和合成
[0024]
(1)双亲短肽设计
[0025]
实验室共设计了8条双亲短肽:
[0026]
①
aeaeakakaeaeakakaeaeakak;
[0027]
②
aeaeakakaeaeakak;
[0028]
③
lelelklklelelklk;
[0029]
④
adadakakadadakaka;
[0030]
⑤
adadararadadarar;
[0031]
⑥
aeaeahahaeaeahah;
[0032]
⑦
hnanararhnanararhnanararhnanarar;
[0033]
⑧
ananararananarar。
[0034]
(2)双亲短肽与来源于t.scotoductus的野生型β-半乳糖苷酶(命名为galt0)的融合。该野生型的β-半乳糖苷酶galt0的氨基酸序列来源于t.scotoductus菌株的全基因组测序,在ncbi 数据库中的编号为wp_015716994.1,被注释为α-淀粉酶(alpha-amylase)。该蛋白的相关研究未见文献报道。委托上海生工生物有限公司把设计好的8条双亲短肽分别融合连接在野生型β-半乳糖苷酶galt0序列的n端,分别命名为galt1、galt2、galt3、galt4、galt5、galt6、 galt7、galt8。新合成的基因序列全部按照大肠杆菌密码子偏好性进行了优化。
[0035]
实施例2:人工改造的β-半乳糖苷酶galt1的重组表达及蛋白纯化
[0036]
1、将融合了不同双亲短肽的β-半乳糖苷酶的基因分别克隆到pet22b上面,然后转入大肠杆菌bl21(de3)菌株中按照分子克隆的标准流程进行诱导表达。获得的菌体细胞,高压均质破碎后,离心后的上清液为粗酶液。
[0037]
2、用阴离子交换层析对粗酶液进行纯化,获得人工改造的β-半乳糖苷酶重组蛋白。利用 sds-page检测蛋白纯度。经过酶的常规活性测试,从8个人工改造的β-半乳糖苷酶中筛选出综合催化能力最佳的galt1。该酶的重组表达及蛋白纯化如图1所示。m为高分子量标准蛋白质,1为包含了pet22b载体的大肠杆菌破碎液的上清;2为包含了pet22b-galt0载体的大肠杆菌破碎液的上清;3为包含了pet22b-galt1载体的大肠杆菌破碎液的上清;4为纯化后的野生型β-半乳糖苷酶galt0;5为纯化后的人工改造的β-半乳糖苷酶galt1。
[0038]
实施例3:人工改造的β-半乳糖苷酶galt1和野生型酶galt0的最适反应温度
[0039]
酶的反应体系为500μl,包括100μl 10mm的onpg,5μl适当稀释的纯酶液,395μl 的50mm的磷酸盐缓冲液(ph7.0)。分别在30-70℃下进行10min反应,反应结束时用同等体积的1m na2co3终止反应,在405nm下测定吸光值。如图2所示,野生型β-半乳糖苷酶galt0 的最适反应温度为50℃,人工改造的β-半乳糖苷酶galt1的最适反应温度提高为55℃。
[0040]
实施例4:人工改造的β-半乳糖苷酶galt1和野生型酶galt0的温度稳定性
[0041]
把纯化的人工改造的β-半乳糖苷酶galt1和野生型酶galt0分别在50与55℃水浴
中孵育 (50mm的磷酸盐缓冲液,ph7.0),每隔一段时间取出一定量的酶,加入底物onpg等,分别在其最适反应温度下检测其残留酶活。将未孵育酶的酶活定义为100%。获得的温度稳定性情况如图3所示,55℃下,野生型galt0的半衰期为1h;人工改造的galt1的半衰期为10h,其热稳定性提高了10倍。
[0042]
实施例5:人工改造的β-半乳糖苷酶galt1和野生型酶galt0降解天然牛奶中乳糖
[0043]
经高效液相色谱(hplc)检测,我们使用的天然牛奶(ph6.7)中乳糖含量为43.6g/l。乳糖降解反应的测试条件为:1ml牛奶,20u/ml酶量,反应温度55℃,反应时间3h。每隔一段时间取出一定量的牛奶,用hplc测试残留的乳糖量,算出乳糖水解率。如图4所示,人工改造的β-半乳糖苷酶galt1仅需要2h,可以水解牛奶中95%的乳糖,达到无乳糖牛奶标准;野生型酶galt0在2h的乳糖水解率仅为80%。
[0044]
乳糖水解率(%)=(牛奶中初始乳糖含量-残留乳糖含量)/牛奶中初始乳糖含量
×
100%seq id no:1
[0045]
maeaeakakaeaeakakggggsggggsggggsmgrilavwvwlslalavpvtfrytpp sglevrsvslrgsfnswgetpmqkedgswavtvdldpgehqykffingqwprdmcndpt fgtpmvdpkaagcvddgfggqnavivvqapvaptppagpvaldfthdpldaqyvshadg klsvrfragegavaaawvevqgkrlpmhlqlsfpgsevwrgtlpggvgayrilvrtqdg keevfgpfnpperpfaevawvgegvgyqifperfyngdssndalaletdeyrfnqvwqrs sgpkphlsrwgdppsplhcchqyfggdlagvlaklpylkalgvsvlylnpifdsgsahgy dthdylkvspkfgdkpllrklldeahrlgmrvifdfvpnhtglgfwafqdvvkrgprspy wnwyfikrwpfvpgdgsayegwwglgslpklntanpgvkrylievtkywvrfgfdgvr vdmpgdvlnphaffkemraelkaikpdaylvaeiwqrdpswlrgdefdslmnyaigrdil lrfakggslalynarraladlarvyalypeavagmgfnlitshdtarlltelgggglkd vpspeararqrlaaamlyalpglpvtfqgdecgftgerpadpphelnrypfqwekchget lafyqelaglrrelaalrsavfrtyfgeghllaffrgepgegevlaafnngveavtlplpp ggwrdplegrtyrkevslpplgfrylvhlgr
[0046]
seq id no:2
[0047]
aeaeakakaeaeakakaeaeakak
[0048]
seq id no:3
[0049]
atggcagaagccgaggcgaaagcgaaagctgaagctgaagcaaaagcaaaaggtggt ggtggttccggtggtggtggttccggtggtggtggtagcggaagaatcctggcggtgt gggtatggcttagcctggccctggcggtcccggtgaccttccgctacacacccccttcg ggcctcgaggtgcgctcggtaagcctccggggctccttcaacagctggggggaaaccc ccatgcagaaggaggacgggtcctgggcggtaaccgtggacctggatccaggggagca ccagtacaagttcttcatcaacggccagtggcccagggacatgtgcaacgatcccacct tcggcacgcccatggtggacccgaaggcggcagggtgtgtggacgatggctttggggg tcagaacgccgtgatcgtggtccaggccccggtagcccccacccctcctgcggggcccg tggccctggacttcacccatgatccgttggacgcccagtatgtgtcccatgccgacggc aagctttccgtgcgcttccgggcaggggagggggcggtggcggccgcctgggtcgagg tgcagggaaagaggctccccatgcacctgcagctgagttttccgggaagcgaggtttg gcgtgggaccttacctggaggcgtgggagcctaccgcatcctggtgcggacccaggat ggcaaggaggaggtgttcggcccctttaaccctcccgaaaggcccttcgccgaggtgg catgggtgggcgagggggtgggttatcagatcttccccgagcgcttctacaacggggat tccagcaacgacgccttggccctggaaaccgacgagtaccgctttaaccaggtgtggc agcgctcctctgggcccaagccccatctttcccgctggggcgatcccccctcgcccctg cactgctgccaccagtacttcgggggggatctt
gccggggtgctggccaagcttcctta cctgaaggccctgggggttagcgtcctctacctgaatcccatctttgattccgggtcggc ccacggctacgacacccacgactacctcaaggtttcccccaagttcggcgacaaacccc tcttgcgcaagctgctggacgaggcccaccgcctcggcatgcgggtgatctttgacttc gtccccaaccacactggcctgggcttttgggcttttcaggatgtggtaaagaggggtcc ccgttccccttactggaactggtacttcatcaagcggtggccctttgtgccgggtgacg gatcggcctacgagggatggtgggggttagggagcctgcccaagctgaacaccgcaaa ccccggggtgaagcgctacctgatcgaggtgaccaagtactgggtacgcttcggctttg acggggtgcgggtggatatgcccggggatgtgctaaatcctcacgctttctttaaggaa atgcgggccgaactgaaggccatcaagcccgacgcctacctggtggcggagatctggc agagggatcctagctggcttcggggggatgagtttgactccctgatgaactacgccatc ggccgggatatcctcctccgctttgctaaggggggaagcctggccctgtacaacgcccg ccgagccttggcggacctagcccgggtttacgccctttacccggaggcggtggccggga tgggcttcaacttgatcacctcccacgatacggcccgcctccttaccgagcttgggggc gggggcctgaaggacgttcccagcccggaagccagggcccggcagcggcttgcggcg gccatgctctacgcccttcccggcctccccgtaaccttccagggggatgagtgcggtttc accggggaaaggccggccgacccccctcacgagctcaaccggtatcccttccagtggg agaaatgccatggggaaaccctagccttttaccaggagctggcggggctgcgccggga gcttgcggccctcaggagcgccgtgttccggacctacttcggagagggccatcttctgg ccttcttccggggtgagccgggagaaggggaggtgcttgccgccttcaataacggggt ggaggccgtcaccttgcccttgcctcctgggggctggcgggatcccctcgaggggcgc acctaccggaaggaagtgagcctgccccccctgggcttccggtacctggtccacctggg gcggcatcatcatcatcatcattag 。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。