一种降解纤维素的真菌融合子rz1及其应用
技术领域
1.本发明属于生物技术领域,尤其涉及一种降解纤维素的青霉-毛霉融合子 rz1及其应用。
背景技术:
2.纤维素(cellulose)在自然界中分布广泛、蕴藏量丰富,也是最廉价的可再生资源。纤维素主要通过纤维素酶进行降解,该酶为复合酶,在其作用下最终将纤维素降解成葡萄糖。纤维素酶降解纤维素的作用机理迄今为止,协同理论最为普遍接受。协同作用一般被认为是内切纤维素酶、外切纤维素酶和β
‑ꢀ
葡萄糖苷酶三者间的协作。
3.目前,纤维素酶生产菌株普遍存在合成的酶类型单一、酶活力较低的问题。纤维素酶生产对菌种培养时间、培养温度、培养基初始ph值等敏感,处理不当易失活。因此,从新的生境筛选纤维降解微生物获得高产纤维素酶菌株,并应用生物技术以提高纤维素降解率变得至关重要。
技术实现要素:
4.本发明的目的在于提供一种高效降解纤维素的青霉-毛霉融合子rz1及其应用,旨在解决现有生产应用中纤维降解相关酶活力低及纤维素降解率不高等问题。
5.本发明是这样实现的,一种降解纤维素的青霉-毛霉融合子rz1,该青霉
‑ꢀ
毛霉融合子rz1于2021年09月13日保藏于中国典型培养物保藏中心,保藏编号为:cctcc m 20211163,保藏地址为:武汉市武昌区珞珈武汉大学保藏中心,邮编为:430072。
6.本发明进一步公开了上述青霉-毛霉融合子rz1在发酵制备降解纤维素的酶的应用。
7.优选地,所述酶包括内切纤维素酶、外切纤维素酶和β-葡萄糖苷酶。
8.本发明进一步公开了一种发酵制备降解纤维素的酶的方法,该方法包括以下步骤:将降解纤维素的青霉-毛霉融合子rz1按接种量1%接种于ph为5~8 的产酶培养基中,于25℃~40℃、120r/min培养48h。
9.优选地,所述产酶培养基的构成为:葡萄糖15g,nh4cl 1g,mgso4·
7h2o0.5g,kh2po
4 1g,蒸馏水1l,ph 8。
10.本发明克服现有技术的不足,提供一种高效降解纤维素的青霉-毛霉融合子 rz1及其应用。本发明以纤维降解为重点,从野生麋鹿粪便中分离筛选得到高效纤维降解的可培养真菌,利用细胞融合技术制备出纤维降解酶种类丰富、酶活较高的融合菌株,拟提高菌株对植物秸秆纤维素的生物降解效率。所得到的菌株命名为青霉-毛霉融合子rz1于2021年09月13日保藏于中国典型培养物保藏中心,保藏编号为:cctcc m 20211163,保藏地址为:武汉市武昌区珞珈武汉大学保藏中心,邮编为:430072。
11.相比于现有技术的缺点和不足,本发明具有以下有益效果:
12.(1)本发明青霉-毛霉融合子rz1与亲本相比,三种纤维素降解关键酶(内切纤维素
酶、外切纤维素酶和β-葡萄糖苷酶)的酶活比值更均衡。在厌氧条件下处理9d时,融合菌rz1对纤维素的降解率达40.78
±
1.48%,降解效果更好;
13.(2)本发明青霉-毛霉融合子rz1的环境耐受性强,在纤维素降解方面具有很好的开发利用价值,可为后续的工业化生产提供可靠的菌种资源支撑;
14.(3)本发明青霉-毛霉融合子rz1的生物安全性高,对水稻和青菜种子萌发及早期幼苗生长有一定的促进作用。
附图说明
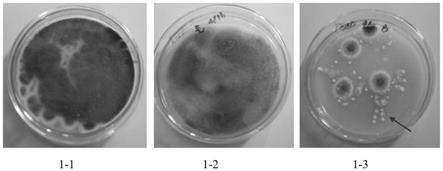
15.图1是本发明青霉-毛霉融合子rz1与亲本(青霉及毛霉)的菌落形态比较;图1-1是青霉的菌落形态,图1-2是毛霉的菌落形态,图1-3是本发明青霉
ꢀ‑
毛霉融合子rz1的菌落形态;
16.图2是本发明融合子rz1纤维素降解酶特性分析;
17.图3是本发明融合子rz1与亲本间的纤维降解率比较结果;
18.图4是本发明融合子rz1的酸碱耐受性分析;
19.图5是本发明融合子rz1的盐度耐受性分析;
20.图6是本发明融合子rz1在不同氧环境下的纤维素降解率结果;
21.图7是本发明融合子rz1对植物秸秆降解的扫描电镜效果;其中,图7-1 是青霉-毛霉融合子rz1处理2d后的秸秆纤维形态,图7-2是青霉-毛霉融合子rz1处理7d后的秸秆纤维形态。
具体实施方式
22.为了使本发明的目的、技术方案及优点更加清楚明白,以下结合附图及实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
23.一、亲本菌株的分离纯化
24.1、菌种出处与筛选方法
25.(1)菌种出处:江苏盐城大丰野生麋鹿粪便。
26.(2)麋鹿肠道产纤维素酶真菌富集、选择性培养基筛选,得到体外易培养、生长稳定、具有较高纤维降解能力的青霉和毛霉,保藏备用。
27.2、菌种活化与传代培养
28.从保藏试管斜面挑取青霉和毛霉的菌丝,分别接种到pda液体培养基中进行活化,28℃摇床中培养3~5d后,接种至察氏培养基中进行传代培养, 28℃摇床中培养3~5d。
29.3、原生质体的制备
30.(1)亲本选取:以pda培养基中培养48h的青霉和毛霉作为亲本。
31.(2)破壁酶的配制:采用1%的蜗牛酶与2%溶菌酶的混合酶液作为破壁酶。
32.(3)稳渗剂:0.6mol/l的蔗糖溶液。
33.(4)酶解作用条件:酶解温度为38℃,酶解时间为2h。
34.(5)原生质体分离操作:取亲本菌液各5ml,7000r/min离心20min,收集菌体,用稳渗剂洗涤两次,取沉淀,悬于稳渗剂中。加入破壁酶各5ml, 38℃酶解2h,7000r/min离心
5min,取上清,用稳渗剂洗涤,7000r/min离心10min,离心后用稳渗剂洗涤,然后将原生质体悬于稳渗剂中待用。
35.二、融合子的制备
36.1、原生质体融合
37.亲本处理:制备得到的青霉和毛霉原生质体用稳渗剂适当稀释后,按照1 ﹕1的比例混合,以7000r/min离心10min,取沉淀。
38.试剂配制:配制40%的聚乙二醇(mw=6000)溶液,现配现用。新生钙液: 54%的kh2po4和29.4%的cacl2·
h2o,分别灭菌后等体积混合,现配现用。
39.融合操作:在亲本沉淀物中加入1.8ml40%的peg溶液和0.2ml新生钙液,混匀,置38℃水浴锅中保温10min后,7000r/min离心5min,取沉淀,用稳渗剂稀释,涂布于yepd高渗培养基上,28℃恒温培养3d。
40.yepd高渗培养基的制备:蛋白胨20g,酵母粉10g,葡萄糖20g,nacl35g,琼脂30g,蒸馏水1l,ph 6.0,115℃灭菌20min。
41.2、融合菌的初筛方法
42.用1ml的移液枪吸取pda液体培养基中青霉和毛霉菌液,稀释涂布法接种于yepd高渗培养基上,28℃培养3d。观察亲本菌落与融合菌菌落的颜色、形态特征,挑取yepd高渗培养基上,明显区别于亲本菌落形态的菌株划线培养至初筛培养基上,28℃恒温培养3d。
43.3、融合菌的复筛方法
44.用刚果红染色法观察初筛培养基上产纤维素酶菌落周围的透明圈。根据透明圈直径(h)与菌落直径(c)的比值(hc)的大小确定复筛菌株。挑选在初筛培养基上的透明圈直径与菌落直径比值较大的纯菌落接种至复筛培养基中,并将复筛得到的融合菌命名为融合菌rz1,28℃摇床培养。
45.刚果红染色法:初筛培养基在培养3d,已有菌落长成,向培养基中加入适量1mg/ml刚果红染液,染色20min,弃去染液后,用1mol/l的nacl溶液脱色3次,每次脱色15min。根据菌落四周透明圈的有无,判断其产纤维素酶能力。
46.三、融合子纤维降解特性分析
47.1、融合菌rz1产酶条件优化
48.(1)不同因素对菌株产酶条件的影响
49.采用正交实验设计,探究培养基初始ph、温度、时间、碳源和氮源等5 因素对菌株产酶能力的影响。
50.将融合菌rz1按接种量1%接种于初始ph值分别为5、6、7、8的100ml 的产酶培养基中,并分别以葡萄糖、蔗糖、cmc-na、淀粉为碳源,以nh4cl、尿素、蛋白胨、nano3为氮源,在25℃、30℃、35℃、40℃,120r/min摇床培养,24h、36h、48h、60h取样,测定滤纸酶活力。
51.(2)融合子rz1与亲本产酶条件优化结果比较
52.采用优化后产酶培养基对融合菌rz1及亲本进行培养,25℃、120r/min 培养48h,测各菌株纤维降解相关酶活力。
53.优化的产酶培养基:葡萄糖15g,nh4cl 1g,mgso4·
7h2o 0.5g,kh2po
4 1g,蒸馏水1l,ph 8。
54.(3)青霉-毛霉融合子rz1对植物纤维素降解率的测定方法
55.尼龙袋法:选择8cm*10cm,孔径300目的尼龙袋,袋的三边以细涤纶线作双道缝合。
56.装样:称取0.5g的样品装入尼龙袋中,贴好标签后,用电子天平称取样品和尼龙袋的总质量,记为m1。
57.降解作用:将每个装好样的尼龙袋投放入优化后的产酶培养基中,并以1%的接种量,在产酶培养基中分别接入融合菌rz1及亲本,每个样品做三个平行。在25℃,120r/min的摇床中培养。
58.取样:于接种后2d和7d后取样,将取出的尼龙袋用蒸馏水清洗,放入60℃的烘箱中烘干,称取样品和尼龙袋的总质量,记为m2。
59.降解率计算:降解率=(m1-m2)/m1*100
60.2、rz1菌株的环境耐受分析
61.(1)融合子rz1的盐耐受性分析
62.配制2500ml的复筛培养基,按1%,3%,5%,7%,8%共5个梯度加入nacl,每组处理设三个重复,空白对照组不添加nacl,121℃灭菌20min,接菌后,30℃恒温震荡培养,培养12h,24h,36h,48h,60h时采集样品,待测。
63.(2)融合子rz1的酸碱耐受性分析
64.设置ph为3、5、8、9四种浓度梯度的复筛培养基,每个处理设三个重复。 30℃恒温震荡箱培养,12h、24h、36h、48h时采集样本,分析rz1在不同酸度下的生长特性。培养48h样品分析该菌的sod酶活特性。
65.(3)融合子rz1的氧耐受性分析
66.以融合子菌株rz1为材料,保持正交优化后的碳源、氮源、温度和ph等其他环境因素,测定其在不同氧环境下的生长特性及纤维降解率。
67.四、融合子rz1的生物安全性评价
68.预处理:将水稻和青菜种子在75%乙醇中浸泡,连续匀速搅拌1min,重复两次。用蒸馏水冲洗3次,无菌水冲洗4次,晒干,备用。
69.浸种:4个稀释梯度菌液和无菌水中分别浸泡水稻100粒种子、青菜100 粒种子。
70.培养:在分别浸种24h、36h、48h后,无菌条件下,用镊子夹取各浓度下的水稻种子和青菜种子各30粒,移至带有湿润滤纸的培养皿中,重复三次。于室温下,自然光照为光源进行培养。青菜种子每隔24h观察记录一次并补充水分,水稻种子每隔48h观察记录一次并补充水分,保持整个体系在培养过程中始终质量守恒。
71.效果实施例
72.本发明以青霉与毛霉作为亲本,通过细胞融合技术,分离筛选出菌落形态与亲本不同的菌株。如图1所示,其中,图1-1是青霉的菌落形态,图1-2是毛霉的菌落形态,图1-3是本发明青霉-毛霉融合子rz1的菌落形态,该菌落培养初期为白色,表面湿润,3d后菌落表面产生皱褶,向中间凸起。
73.本发明中融合子rz1最优产酶条件为:培养基初始ph值8、温度25℃、培养时间48h、以葡萄糖为碳源,以nh4cl为氮源。优化后融合子rz1产纤维素酶能力显著提高。融合菌rz1的4种纤维降解酶(滤纸酶、内切纤维素酶、外切纤维素酶、β-葡萄糖苷酶)活力分别为:121.92
±
7.19u、270.74
±
4.98u、 267.46
±
7.11u、263.09
±
9.44u,均高于亲本(见图2)。
74.本发明采用尼龙袋法测纤维素降解率,降解7d,融合菌rz1纤维素降解率为
19.08%,与亲本青霉相比提高了106.2%,与毛霉相比提高了112.4%(见图3)。
75.本发明中rz1的环境耐受分析研究发现,ph偏酸性条件下,rz1生长受到抑制,ph呈碱性对rz1生长起促进作用。在12h内1%盐浓度对rz1生长影响最小(见图4、图5)。
76.本发明中有氧和厌氧条件下测定真菌融合子rz1的纤维素降解率,纤维素降解率在9d达到峰值,峰值分别为32.19
±
7.06%,40.78
±
1.48%。由多重分析比较可知,厌氧条件下融合子rz1的纤维素降解率高于有氧条件(p《0.05) (见图6)。
77.本发明发现植物秸秆(互花米草)经融合菌rz1降解2d后,秸秆表面产生不同程度的凹陷,纤维束变得疏松,露出排列整齐的纤维束骨架(见图7-1);降解7d后,秸秆表面凹凸程度更加明显,纤维束也发生了不同程度的断裂(见图7-2)。
78.由本发明制备出的融合子rz1菌株对水稻种子和青菜种子发芽率无显著影响(p》0.05),发芽指数却明显提高。其中,以水稻种子为例,浸种36h的种子发芽指数在不同菌液浓度下较空白组(14.71)分别提高了11.91、7.73、9.58 和11.78。rz1的共处理拟可提高水稻和青菜pod酶活力和sod酶活力,其中浸种24h和36h的青菜幼苗中pod酶活力呈不同形式的上升状态。浸种48h 后,水稻幼苗中pod酶活力达最高值786.00u/ml,从而使得水稻和青菜在增产的同时提高抗逆性,有一定的生物安全性。
79.因此,本发明中制备的融合子rz1是一株高效的纤维素降解菌株,其环境耐受性强,在纤维素降解方面具有很好的开发利用价值,可为后续的工业化生产提供可靠的菌种资源支撑。
80.以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。